
AKADEMIA TECHNICZNO–HUMANISTYCZNA
w Bielsku–Białej
Ćwiczenie nr 4
Temat:
Wyznaczanie współczynnika podziału Nernsta
LABORATORIUM CHEMII FIZYCZNEJ

Ćwiczenie nr 4
Str. 2
1. Wstęp teoretyczny
Gdy do układu dwóch praktycznie nie mieszających się cieczy i rozpuszczalników
doda się trzeciej cieczy (lub ciała stałego) rozpuszczonej w dwu pierwszych, wówczas po
ustaleniu się stanu równowagi stosunek stężeń roztworów rozcieńczonych (lub
aktywności w przypadku roztworów bardziej stężonych tego składnika) w obu fazach
ciekłych jest wielkością stałą w danej temperaturze, zwaną współczynnikiem podziału
Nernsta:
K
a
a
D
1
2
=
K
(1)
C
C
D
1
2
=
a
1,2
- aktywności substancji rozpuszczonej w pierwszej i drugiej cieczy,
C
1,2
- stężenie substancji rozpuszczonej w pierwszej i drugiej cieczy,
K
D
- współczynnik podziału Nernsta.
Stałość stosunku stężeń w równowadze podziału zachowana jest wyłącznie
w przypadku spełnienia założenia, że substancja rozpuszczona występuje w obu
rozpuszczalnikach w postaci identycznych cząsteczek, a roztwór jest rozcieńczony.
Jeżeli w jednej z faz ciekłych następuje asocjacja lub dysocjacja cząsteczek
substancji rozpuszczonej, wówczas wartość współczynnika podziału przestaje być stała.
W tym przypadku współczynnik Nernsta można przedstawić następująco:
K
C
D
1
=
C
2
n
(2)
n - stosunek masy cząsteczkowej M
1
substancji rozpuszczonej w pierwszej cieczy
do masy cząsteczkowej M
2
tejże substancji rozpuszczonej w drugiej cieczy.
Istnieją również układy, w których substancja rozpuszczona występuje w postaci
kilku rodzajów cząsteczek. W tym przypadku ustala się równowaga podziału tej
substancji między dwie fazy i równowaga asocjacji (dysocjacji) w danej fazie. Prawo
podziału należy wówczas stosować do każdego rodzaju cząsteczek z osobna.
LABORATORIUM CHEMII FIZYCZNEJ
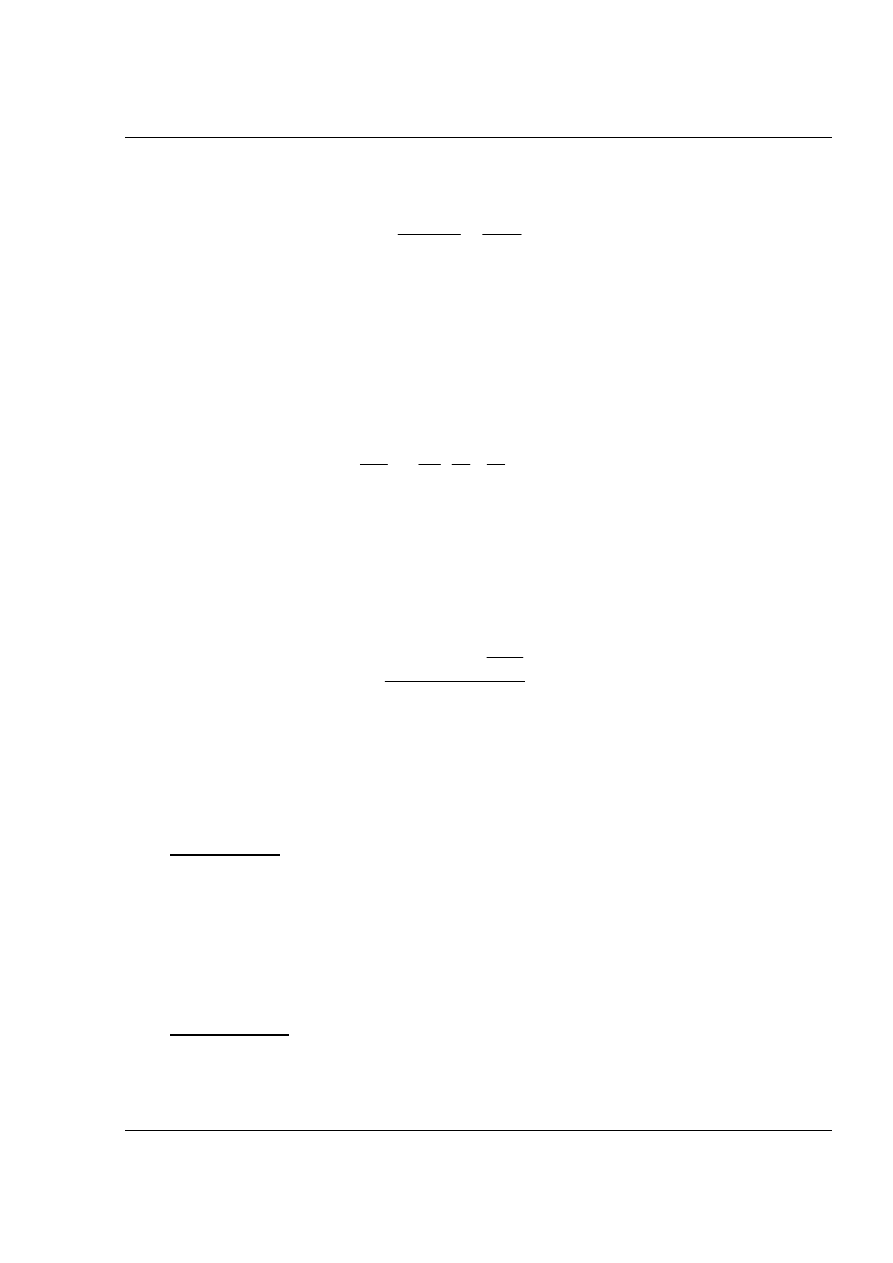
Ćwiczenie nr 4
Str. 3
Zależność współczynnika podziału od temperatury ujmuje wzór izobary
Van`t Hoffa:
d K
dT
H
RT
D
D
ln
=
2
(3)
gdzie: H
D
jest entalpią przejścia 1 mola danej substancji z jednej fazy ciekłej
do drugiej.
Po scałkowaniu powyższej zależności przy założeniu, że H
D
jest niezmienne
w badanym zakresie temperatur, otrzymuje się wyrażenie:
−
−
=
1
2
D
D,2
D,1
T
1
T
1
R
H
K
K
ln
(4)
Wyznaczywszy eksperymentalnie stałą podziału dla różnych, lecz niezbyt
odległych od siebie temperatur, można wyliczyć H
D
w oparciu o wzór:
H
T T R ln
K
K
T
T
D
2
1
D, 1
D, 2
2
1
=
⋅ ⋅ ⋅
−
(5)
2. Sposób wykonania ćwiczenia
a) Aparatura
8 kolb stożkowych, 5 probówek ze szlifem, 1 pipeta na 20 ml, 1 pipeta kalibrowana
na 5 ml, 1 pipeta kalibrowana na 2 ml, 2 butelki ze szlifem, 1 cylinder miarowy na 50 ml,
termostat.
b) Odczynniki
LABORATORIUM CHEMII FIZYCZNEJ

Ćwiczenie nr 4
Str. 4
Woda destylowana, rozpuszczalniki organiczne (benzen, toluen, chloroform,
alkohol amylowy, czterochlorek węgla, dwusiarczek węgla, eter etylowy, anilina), kwas
octowy, kwas solny, kwas mrówkowy.
c) Wykonanie ćwiczenia
Przygotować 5 roztworów wodnych lub anilinowych o określonym stężeniu
substancji badanej (do sporządzenia wodnego roztworu kwasu octowego o danym
stężeniu należy stosować 80 % CH
3
COOH, natomiast do sporządzenia roztworu
anilinowego 100% CH
3
COOH).
Do probówek ze szlifem nalać pipetą 20 ml każdego z przygotowanych roztworów
(wodnych lub anilinowych) o zadanych stężeniach. Następnie do każdej probówki dodać
20 ml rozpuszczalnika organicznego, zakorkować i wstrząsnąć energicznie, a następnie
termostatować w określonej temperaturze przez około 30 min. W czasie termostatowania
wstrząsać zawartość probówki co około 3 min. W tym czasie miareczkować wyjściowe
roztwory wodne lub anilinowe substancji badanej 0,1 N roztworem ługu sodowego
w obecności fenoloftaleiny.
Do miareczkowania brać 2 ml roztworu wodnego ( lub anilinowego) CH
3
COOH
lub HCl. Z trzech miareczkowań każdego roztworu wziąść średnią i zanotować objętość
w ml zużytego odczynnika (oznaczyć przez a
1
). Po określonym czasie wyjąć probówki
z termostatu, nabrać pipetą 2 ml warstwy wodnej lub anilinowej ( w przypadku, gdy
warstwa wodna lub anilinowa jest warstwą dolną, zanurzając pipetę w warstwie
organicznej zakryć jej górny otwór, aby ciecz organiczna nie dostała się do pipety;
następnie pipetą przedmuchać i nabrać określoną objętość roztworu) i miareczkować
analogicznie jak roztwory wyjściowe. Objętość odczynnika miareczkującego oznaczyć
jako b
1
. Pomiary wykonać przy różnych temperaturach.
3. Sposób opracowania wyników
LABORATORIUM CHEMII FIZYCZNEJ
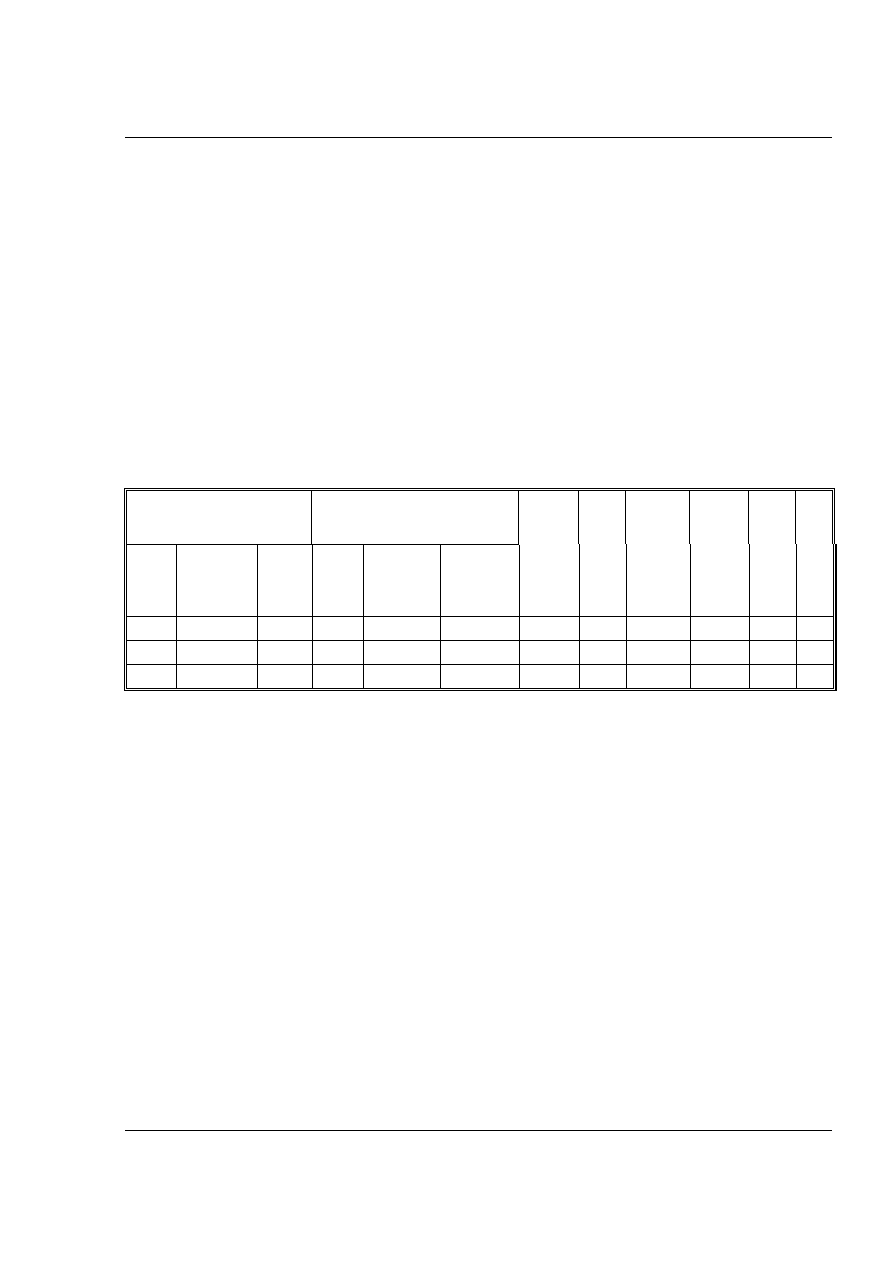
Ćwiczenie nr 4
Str. 5
Wyniki ćwiczenia zestawić w tabeli. Drugą taką tabelę sporządzić dla pomiarów
w drugiej temperaturze.
Na podstawie wyników ćwiczenia wykreślić zależność stężenia substancji badanej
w jednej warstwie c
1
od stężenia tej substancji w warstwie drugiej c
2
. Jeżeli wykres jest
linią prostą, wnioskuje się, że substancja badana nie asocjuje ani nie dysocjuje w żadnym
z rozpuszczalników. Wówczas do obliczania stałej podziału stosuje się równanie (1).
Jeżeli wykres zależności c
1
= f(c
2
) nie jest linią prostą, wówczas należy sporządzić
wykres log c
1
= f(log c
2
). W przypadku, gdy otrzyma się linię prostą, stałą podziału K
oblicza się z równania (2).
Roztwór wyjściowy.
Warstwa wodna (lub anilinowa)
po ustaleniu się równowagi
podziału.
Pomiar Objętość
zużytego
odczynnika
a1 [ml]
Średnie
a1.
Pomiar Objętość
zużytego
odczynnika
b1[ml].
Średnie b1. Stężenie
C1
log C1 a2=a1-b1 Stężenie
C2
log C2 KD
1
1
2
2
3
3
Wartość n oraz K
D
można otrzymać z wykresu log c
1
= f(log c
2
), gdyż po
zlogarytmowaniu równania (2) otrzymuje się:
log c
1
= n log c
2
+ log K
D
gdzie: n - jest współczynnikiem kierunkowym prostej,
log K
D
jest wartością rzędnej dla log c
2
= 0.
W przypadku, gdy wykres zależności log c
1
= f(log c
2
) nie jest linią prostą,
wnioskuje się, że oprócz równowagi podziału ustaliła się także równowaga asocjacji
(dysocjacji) substancji badanej w jednej z warstw. Przy obliczaniu współczynnika
podziału Nernsta w tym przypadku uwzględnić należy stałą równowagi asocjacji
(dysocjacji) cząsteczek substancji badanej.
Otrzymuje się wówczas następujące równanie na stałą podziału:
LABORATORIUM CHEMII FIZYCZNEJ

Ćwiczenie nr 4
Str. 6
K
C C
C C
C C
C
C
1
"
2
'2
1
'
2
"2
2
"
2
'2
2
"2
2
'
=
⋅
−
⋅
⋅
−
⋅
C
1
- stężenie substancji badanej w cieczy 1,
C
2
- stężenie substancji badanej w cieczy 2,
Indeksy "prim" i "bis" oznaczają stężenia substancji po osiągnięciu równowagi przy
dwóch różnych stężeniach wyjściowych roztworów.
Ćwiczenie wykonać w dwóch różnych temperaturach i wyliczyć
KD,1, KD,2 i HD
.
4. Pytania kontrolne
1.Jakie znaczenie ma liczba obecnych w układzie faz?
2.Omówić układ zawierający cząstki pozostające ze sobą w stanie równowagi
chemicznej.
3.Narysować i omówić wykresy fazowe dwuskładnikowych układów ciekłych
rozdzielających się na dwie fazy.
4.Podać najważniejsze sposoby wyrażania stężenia roztworu.
5.Co to jest aktywność substancji rozpuszczonej?
6.Omówić prawo podziału Nernsta.
7.Jak wpływa temperatura na wartość współczynnika podziału Nernsta?
8.Jakie błędy możemy popełnić w trakcie wykonywania ćwiczenia?
5. Literatura
1.Chemia fizyczna K.Gumiński, PWN, 1973, str.527–536.
2.Podstawy Chemii Fizycznej R.Brdicka, PWN, 1970, str.570–574.
3.Ćwiczenia Laboratoryjne z Chemii Fizycznej Praca zbiorowa pod red.A.Dorabialskiej,
PWN, 1955, str.227–229.
4.Chemia Fizyczna W.Tomassi, H.Jankowska, PWN Warszawa, 1973, str.136–138.
5.Ćwiczenia Laboratoryjne z Chemii Fizycznej Praca zbiorowa pod red. J.Podkówki,
skrypt uczelniany, 1977, str.100–102.
LABORATORIUM CHEMII FIZYCZNEJ
Wyszukiwarka
Podobne podstrony:
ei 2005 04 s060 id 154155 Nieznany
7 04 2011 2 id 44696 Nieznany (2)
Zptl 04 przebud id 592770 Nieznany
gk 04 gui id 191748 Nieznany
ei 2005 04 s084 id 154156 Nieznany
7 04 2011 id 44695 Nieznany (2)
6 04 2011 id 43083 Nieznany (2)
ei 2005 04 s086 id 154157 Nieznany
Notatki 04 dystrybucja id 32232 Nieznany
Konspekt 20 04 2013 id 245448 Nieznany
maly terrorysta 01 04 11 id 275 Nieznany
cw 04 formularz id 121367 Nieznany
pkm 04 01 id 359735 Nieznany
ei 2005 04 s060 id 154155 Nieznany
AG 04 id 52754 Nieznany
43 04 id 38675 Nieznany
28 04 2013 cw id 31908 Nieznany
matma dyskretna 04 id 287940 Nieznany
więcej podobnych podstron