
03.02.2009, termin „1”
Egzamin z Chemii Organicznej 2008/2009, Wydział Inżynierii Chemicznej i Procesowej
Zad.1. (9 p.) W jakich warunkach należy wykonać addycję bromowodoru do
2-metylopropenu, aby otrzymany bromek alkilowy mógł w reakcji Corey’a-House’a utworzyć
2,5-dimetylodimetyloheksan? Przedstaw schematy wymienionych reakcji.
Zad. 2. (14 p.) Podaj wzory produktów oznaczonych literami, ogólne nazwy
przeprowadzonych reakcji oraz wskaż produkty każdej z nich.
Zachodzące reakcje to: reakcja alifatycznej substytucji nukleofilowej (produkty B, C, E i F)
oraz reakcja eliminacji (produkty A i D).
Zad. 3. Podaj wzory związków wymienionych z nazwy oraz tych oznaczonych literami.
1. (14 p.)
2. (6 p.)
1
CH
3
CH CH
2
CH
2
CH
CH
3
CH
3
CH
3
2,5-dimetyloheksan
Br CH
2
CH
CH
3
CH
3
reakcja Corey'a-House'a
CH
2
C
CH
3
CH
3
2-metylopropen
1-bromo-2-metylopropan
HBr
(RO)
2
Br CH
2
CH
CH
3
CH
3
Li
Li CH
2
CH
CH
3
CH
3
CuBr
CH
2
CH
CH
3
CH
3
2
CuBr
Br CH
2
CH
CH
3
CH
3
CH
3
CH CH
2
CH
2
CH
CH
3
CH
3
CH
3
CH
3
C
CH
3
CH
3
Br
A
C
2
H
5
ONa
C
2
H
5
OH/H
2
O
A + B + C
Br
CH
CH
3
CH
3
C
2
H
5
ONa
C
2
H
5
OH/H
2
O
D + E
E + F
CH
3
C
CH
3
CH
3
Br
A
C
2
H
5
ONa
C
2
H
5
OH/H
2
O
CH
3
C
CH
3
CH
2
A
CH
3
C
CH
3
CH
2
CH
3
C
CH
3
CH
3
OH
CH
3
C
CH
3
CH
3
OC
2
H
5
+
+
B
C
Br
CH
CH
3
CH
3
C
2
H
5
ONa
C
2
H
5
OH/H
2
O
+
+
CH
CH
2
CH
3
OC
2
H
5
CH
CH
3
CH
3
D
E
OC
2
H
5
CH
CH
3
CH
3
E
OH
CH
CH
3
CH
3
F
A
KOH
EtOH
B HBr
C
KOH
EtOH
D
1) ?
2) ?
aceton + kwas octowy
1) O
3
2) Zn/H
2
O
2-metylopropanal + formaldehyd
NaNH
2
ciekły NH
3
A
acetylen
O
CH
H
2
C
CH
3
B
H
2
O/H
+
C
kw. solny
ZnCl
2
D
(C
5
H
7
Cl)
03.02.2009, termin „1”
1.
2.
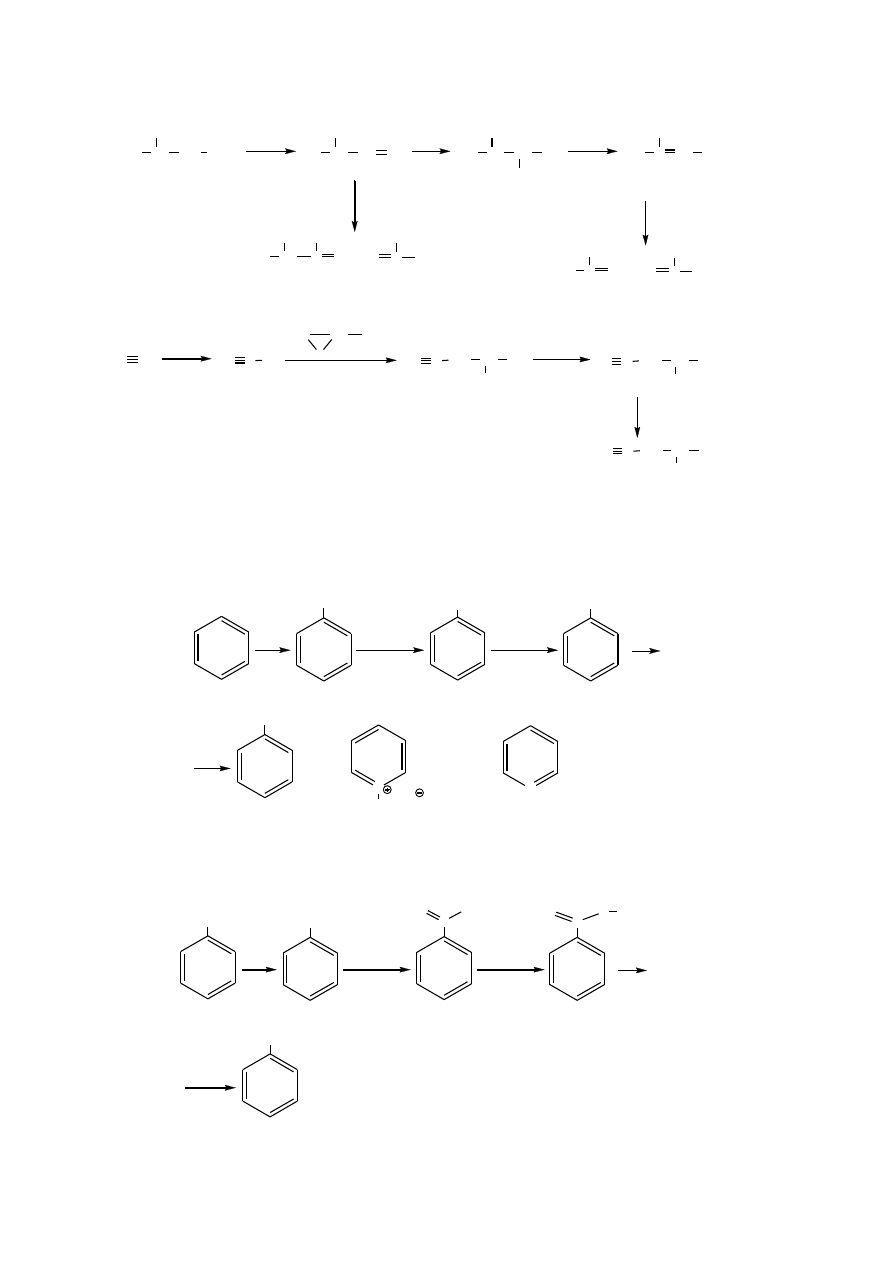
Zad. 4. Przedstaw podane poniżej przekształcenia za pomocą wzorów chemicznych oraz
podaj reagenty i warunki reakcji niezbędne do ich wykonania.
1. (8 p.)
benzen
→
bromobenzen
→
bromek fenylomagnezu
→
alkohol benzylowy
→
benzaldehyd
2. (6 p.)
toluen
→
kwas benzoesowy
→
chlorek benzoilu
→
N-metylobenzamid
→
N-metylobenzyloamina
2
A
KOH
EtOH
B
HBr
C
KOH
EtOH
D
1)KM nO
4
,
∆
T
2) H
2
O/H
+
kwas octowy
1) O
3
2) Zn/H
2
O
formaldehyd
CH
3
CH
C
O
CH
3
H
2-metylopropanal
H
C
O
H
+
CH
3
CH
CH
CH
2
CH
3
CH
3
CH
CH
2
CH
2
Br
CH
3
CH
3
CH
CH
CH
3
CH
3
Br
CH
3
C
CH CH
3
CH
3
CH
3
C
O
CH
3
+
CH
3
C
O
OH
aceton
NaNH
2
c. NH
3
A
acetylen
O
CH
H
2
C
CH
3
B
H
2
O/H
+
C
kw. solny
ZnCl
2
D (C
5
H
7
Cl)
HC
CH
HC
C Na
ONa
CH
CH
2
CH
3
C
HC
OH
CH
CH
2
CH
3
C
HC
Cl
CH
CH
2
CH
3
C
HC
Br
MgBr
CH
2
OH
CHO
Br
2
Fe
Mg
bezwodny
eter
1) HCHO
2) H
2
O/H
+
[O]
[O] =
chlorochromian
pirydyny
N
N
CrO
3
* 2
H CrO
3
Cl
odczynnik
Colinsa
lub
lub
(CH
3
)
2
SO/
ClC(O)-C(O)Cl
CO
2
H
C
C
CH
2
NH-CH
3
[O]
[O] = K
2
Cr
2
O
7
/H
2
SO
4,
∆
T lub 1) KMnO
4
,
∆
T; 2) H
2
O/H
+
CH
3
O
Cl
O
H
N CH
3
SOCl
2
lub PCl
5
CH
3
NH
2
LiAlH
4

03.02.2009, termin „1”
3. (8 p.)
propen
→
1-bromopropan
→
CH
3
−
CH
2
−
CH
2
−
CN
→
kwas masłowy
→
butanian etylu
Zad. 5. (7 p.) W odniesieniu do pokazanych poniżej związków, podaj:
a.
podaj nazwę związku A z uwzględnieniem jego konfiguracji absolutnej
A, kwas (S)-2-bromo-2,3-dimetylobutanowy
b.
konfigurację absolutną związków B i C,
B C
c.
narysuj wzór przestrzenny stereoizomeru związku B,
d.
narysuj wzór krzyżowy Fischera związku C.
Zad. 6. Podaj wzory strukturalne substratów organicznych, z których można otrzymać
poniższe związki we wskazanych reakcjach:
a. (6 p.) 1-fenylo-2-metylopropen (w reakcji Wittiga),
b. (6 p.) trans-1,2,4,5-tetrametylocykloheksen (w reakcji Dielsa-Aldera),
3
COOH
H
3
C
CH(CH
3
)
2
Br
CH
2
CH
CH
3
CH
2
Br
CH
2
CH
3
CH
2
CH
2
CH
3
CO
2
H
CH
2
CH
2
CH
3
CN
CH
2
CH
2
CH
3
C
O
OC
2
H
5
Br
2
(RO)
2
KCN
DM SO
H
2
O/H
+
∆
T
C
2
H
5
OH
H
+
C
6
H
5
(R)
CH
3
H
3
CH
2
C
Cl
CH
2
OCH
3
(S)
CH
3
NC
H
C
6
H
5
H
3
C
CH
2
CH
3
Cl
CH
2
OCH
3
CH
3
CN
H
i
lub
C
C
CH
3
H
CH
3
C
C
CH
3
H
CH
3
O
Ph
3
P
i
C
C
CH
3
H
CH
3
PPh
3
O
CH
3
CH
3
H
3
C
H
3
C
CH
2
CH
2
H
3
C
H
3
C
H
3
C
H
CH
3
H
i
03.02.2009, termin „1”
c. (4 p.) 1,3-difenylo-1-oksoprop-2-en [C
6
H
5
-C(O)-CH=CH-C
6
H
5
, w reakcji kondensacji
aldolowej].
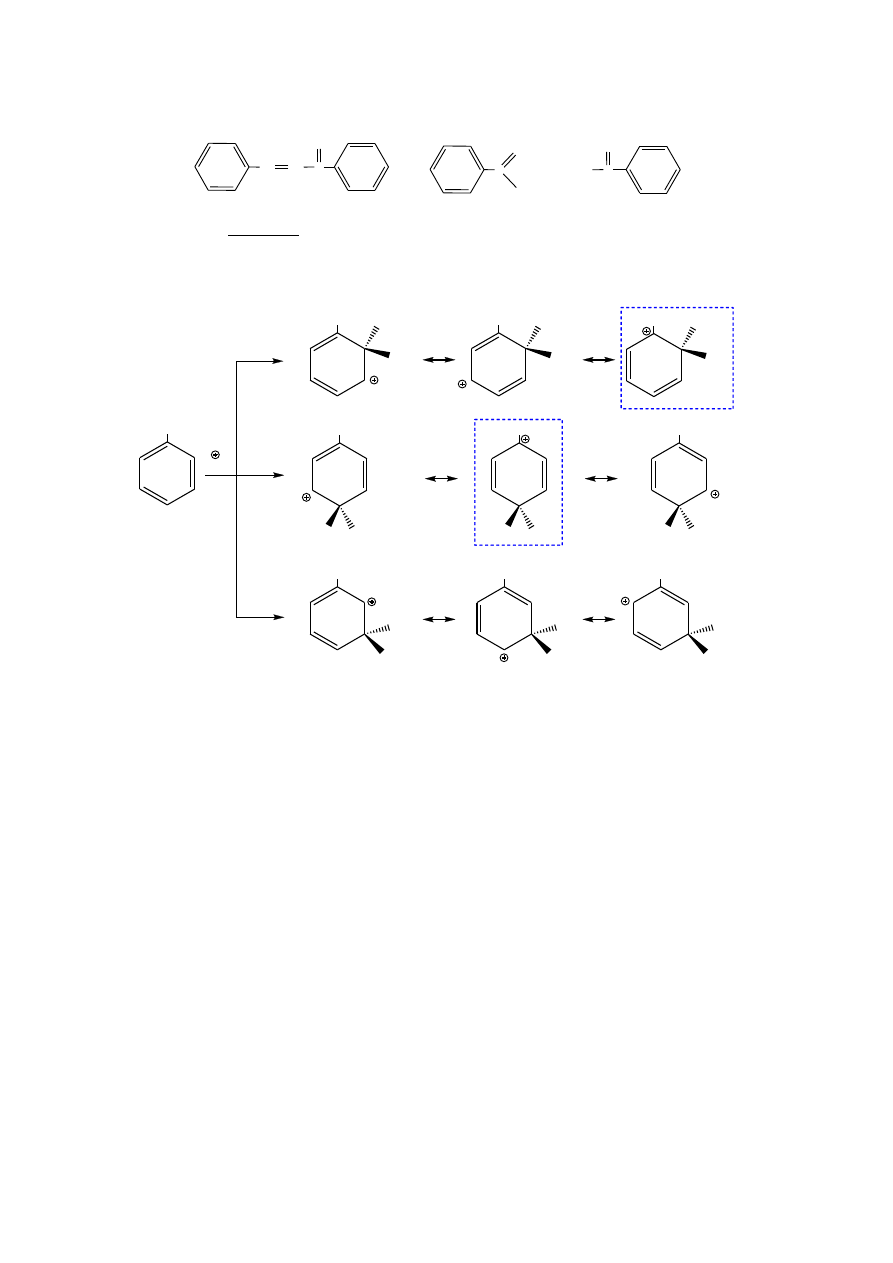
Zad. 7. (12 p.) Wyjaśnij regioselektywność reakcji nitrowania nitrobenzenu na podstawie
porównania budowy odpowiednich kompleksów sigma (narysuj struktury mezomeryczne tych
kompleksów).
Przy podstawieniu elektrofila (kationu nitroniowego, NO
2
+
) w pozycję orto lub para
struktury zaznaczone ramkami są szczególnie nietrwałe, ponieważ ładunek dodatni jest
zlokalizowany na atomie węgla związanym z podstawnikiem posiadającym cząstkowy
ładunek dodatni (podst. elektronoakceptorowym). Przy podstawieniu elektrofila w pozycję
meta w żadnej ze struktur ładunek dodatni nie jest zlokalizowany na atomie węgla związanym
z ww. podstawnikiem; dlatego produktem reakcji jest m-dinitrobenzen.
4
i
C
CH
CH
O
O
C
H
C
CH
3
O
NO
2
NO
2
H
NO
2
NO
2
H
NO
2
NO
2
H
NO
2
NO
2
H
NO
2
NO
2
H
NO
2
NO
2
H
NO
2
NO
2
H
NO
2
NO
2
H
NO
2
NO
2
H
NO
2
orto
p ara
meta
NO
2
Document Outline
Wyszukiwarka
Podobne podstrony:
dyd inz e04
dyd inz n15
dyd inz e05 id 144824 Nieznany
dyd inz e11
dyd inz e02 id 144818 Nieznany
dyd inz n07
dyd inz n12
dyd inz n14
dyd inz d3r 08
dyd inz n11
dyd inz d2r 08
dyd inz d2 09
dyd inz d2r 08
dyd inz d4 09
dyd inz e08 id 144830 Nieznany
dyd inz d3 09
dyd inz n02
dyd inz e07
więcej podobnych podstron