Marta Jolanta Śliwa
06 03.2013
DESTYLACJA Z PARĄ WODNĄ
ochrona środowiska;
grupa C2
A.) CEL ĆWICZENIA:
Celem ćwiczenia było przeprowadzenie destylacji prostej oraz frakcjonowanej mieszaniny metanolu i
1-butanolu.
B.) OPIS CZYNNOŚCI:
Destylacja prosta:
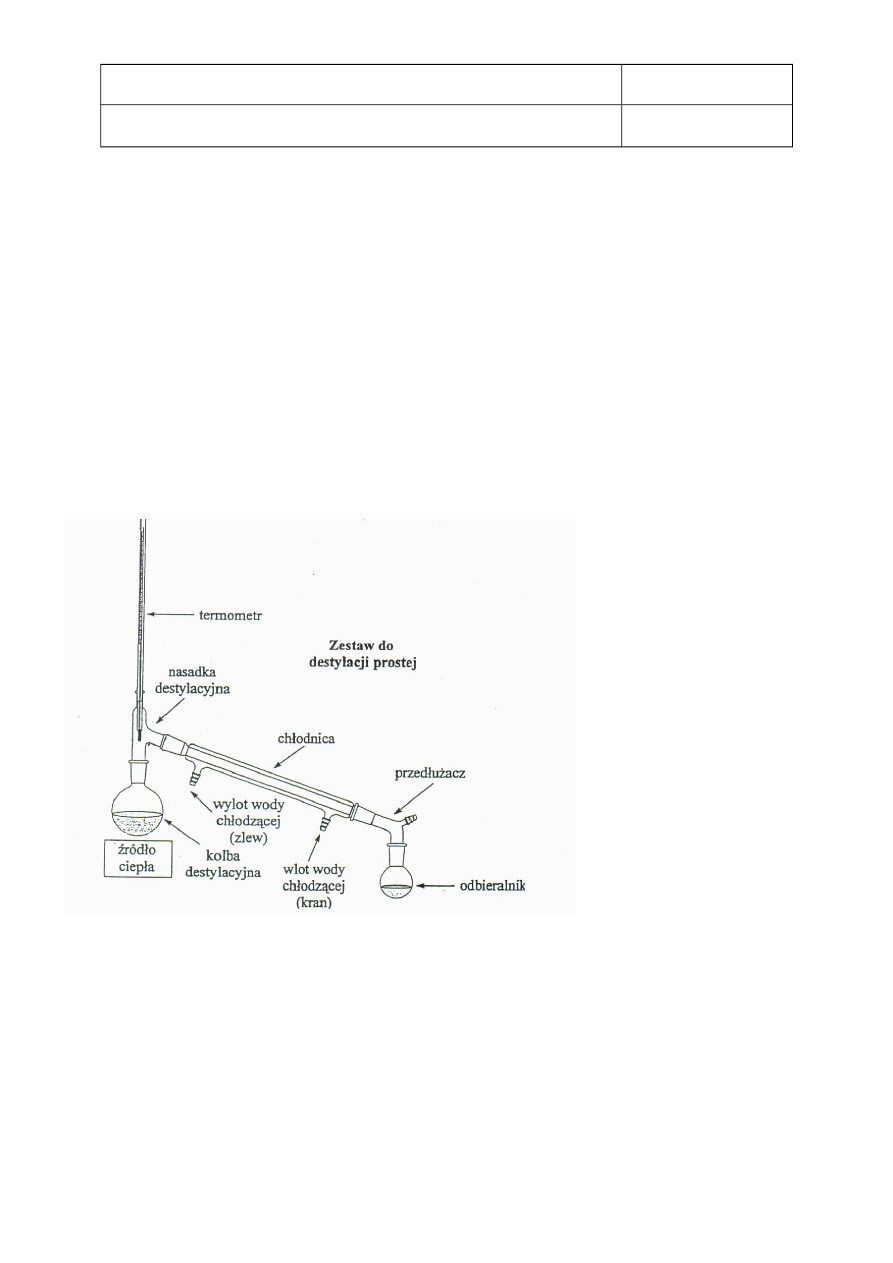
zmontowano aparaturę (schemat zamieszczony na rysunku poniżej);
do kolby destylacyjnej wlano 30cm
3
mieszaniny metanolu i 1-butanolu;
kolbę ogrzano w płaszczu grzejnym i oddestylowano 22cm
3
mieszaniny z szybkością 2cm
3
/minutę;
notowano temperaturę wrzenia na początku i temperaturę wrzeniu po odebraniu każdych 2cm
3
destylatu – na tej podstawie sporządzono wykres zależności temperatury wrzenia od ilości destylatu.
Rys. 1 Schemat zestawu do destylacji prostej
Destylacja frakcjonowana:
zmontowano aparaturę (Rys. 2) – razem z deflegmatorem;
do kolby destylowanej wlano (podobnie jak poprzednio) 30cm
3
mieszaniny metanolu i 1-butanolu;
kolbę ogrzano na płaszczu grzejnym i oddestylowano 26cm
3
mieszaniny z szybkością jak przy
poprzednim doświadczeniu;
notowano temperaturę wrzenia na początku destylacji i po odebraniu każdych 2cm
3
– na tej podstawie
sporządzono wykres, który umieszczono razem z wykresem sporządzonym na podstawie
poprzedniego ćwiczenia.
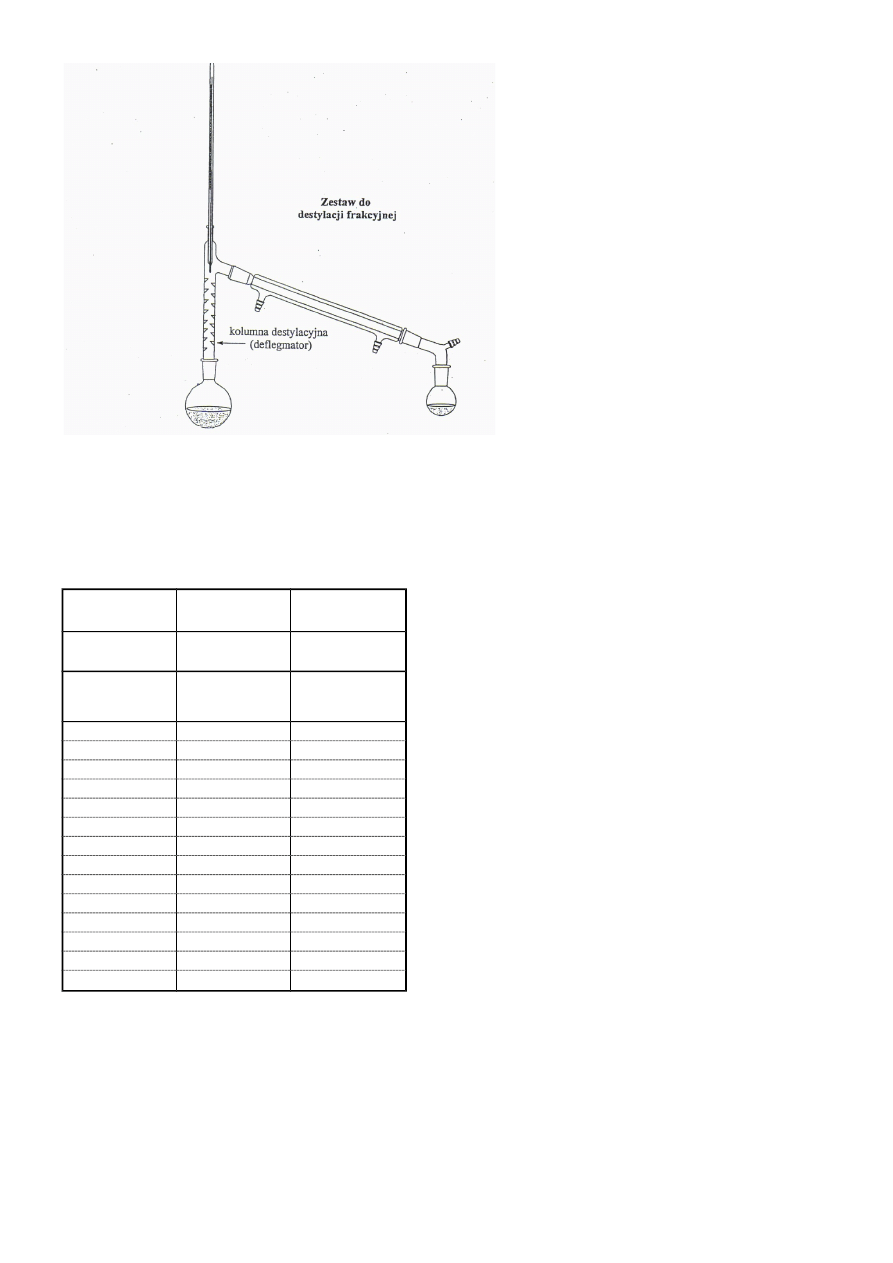
Rys. 2 Schemat zestwu do destylacji frakcyjnej
C.) WYNIKI DESTYLACJI:
Tabela 1 Wynik doświadczenia
destylacja
prosta
destylacja
frakcjonowana
temperatura
wrzenia
64˚C
64˚C
objętość
destylatu [cm
3
]
temperatura
destylacji [˚C]
temperatura
destylacji [˚C]
0
64
63
2
64
64
4
65
66
6
69
67
8
71
69
10
76
70
12
84
73
14
110
76
16
112
80
18
114
85
20
115
98
22
115
107
24
111
26
110
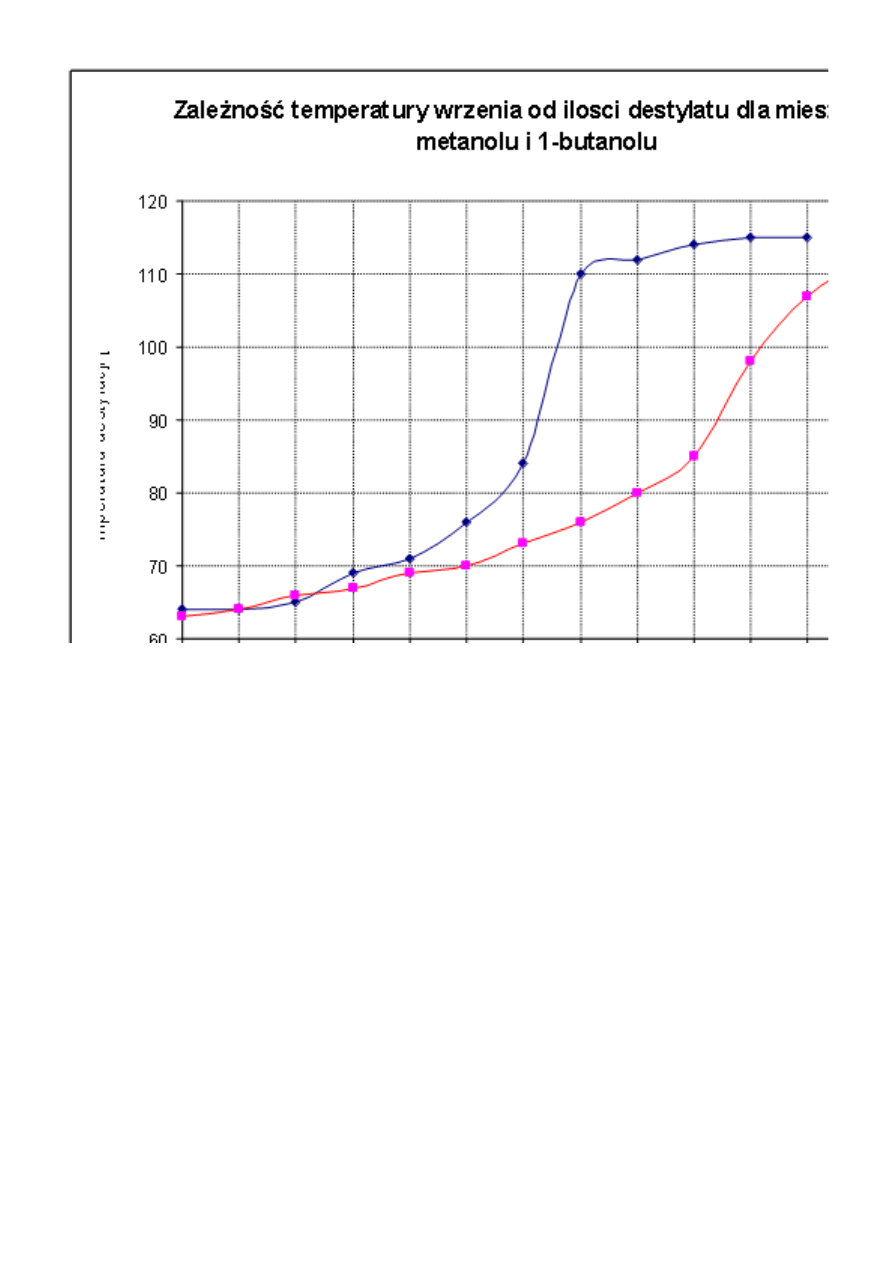
Wykres 1 Wykres przedstawiający zależność temperatury od objętości destylatu.
D.) KOMENTARZ:
Z otrzymanego wykresu wynika, że destylacja frakcjonowana jest bardziej efektywna, prowadzi do
lepszego rozdzielania składników mieszaniny.
Wyszukiwarka
Podobne podstrony:
destylacja sprawozdanie id 1342 Nieznany
Lab10 Sprawozdanie id 259061 Nieznany
Czech sprawozdanie 1 id 128290 Nieznany
Czech sprawozdanie 3 id 128292 Nieznany
L04 sprawozdanie1 id 257051 Nieznany
Lab06 Sprawozdanie id 258833 Nieznany
Lab02 Sprawozdanie id 258779 Nieznany
Lab04 Sprawozdanie id 258808 Nieznany
Lab09 Sprawozdanie id 258852 Nieznany
prostownik sprawozdanie id 4022 Nieznany
Lab03 Sprawozdanie id 258792 Nieznany
Projekt sprawozdanie id 399569 Nieznany
cw 21 sprawozdanie I id 100238 Nieznany
Czech sprawozdanie 6 id 128295 Nieznany
46 SPRAWOZDANIE id 38951 Nieznany (2)
EiE wzor sprawozdania id 154403 Nieznany
Cw 6 sprawozdanie4 id 97476 Nieznany
lab6 sprawozdanie id 604266 Nieznany
więcej podobnych podstron