prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
117
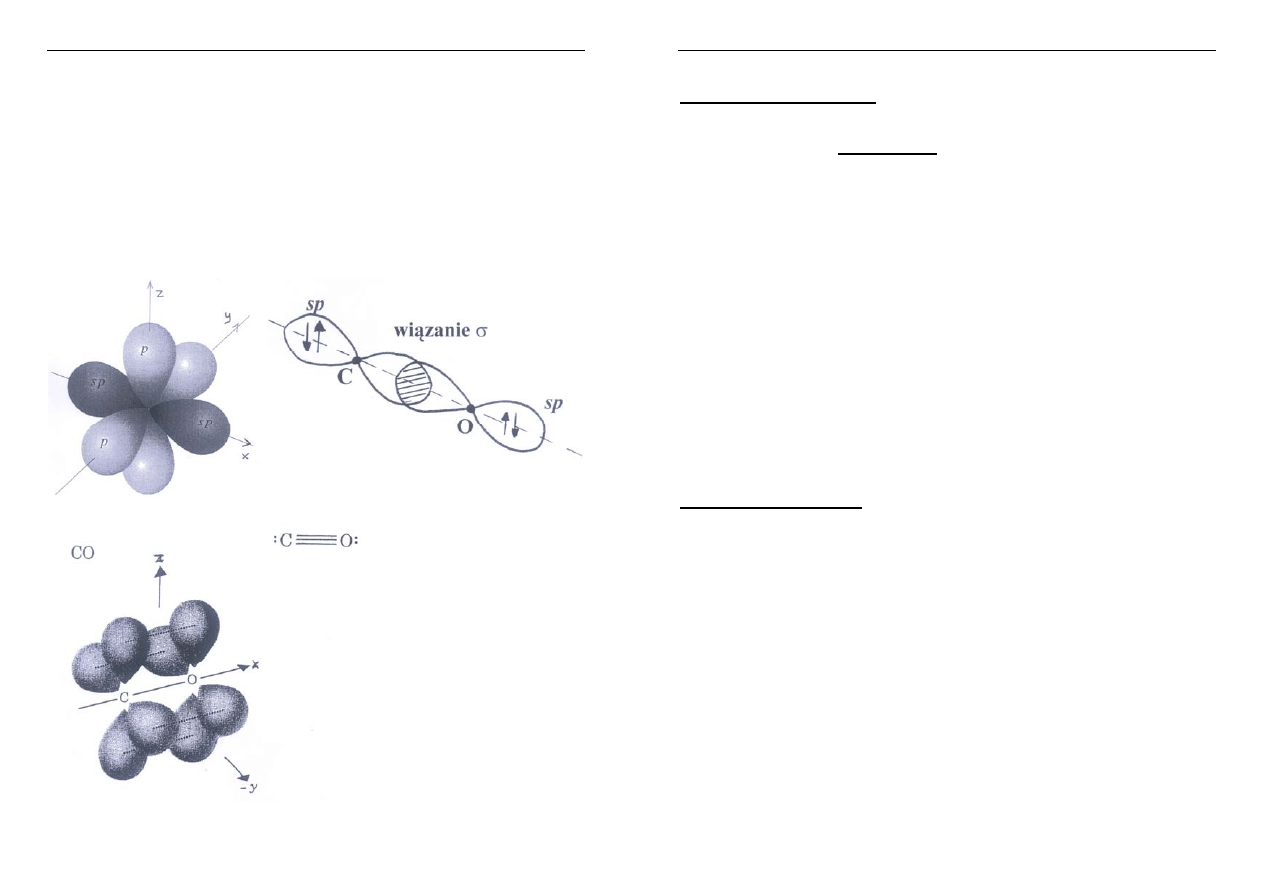
Hybrydyacja sp digonalna (dygonalna)
׃C ≡ O׃
W każdym atomie (C i O) wolna para elektronowa
jest na jednym orbitalu sp
drugi orbital sp uczestniczy w wiązaniu
σ.
Pozostałe orbitale atomowe p tworzą wiązania
π.
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
118
Wiązanie w CO
׃
C
≡
O
׃
Hybrydyzacja digonalna (sp) obu atomów (C i O)
(tzn. z wymieszania się orbitali walencyjnych 2s
i 2p
x
powstają dwa współliniowe orbitale sp)
C: jeden orbital sp zajęty jest przez wolną parę
elektronową
drugi orbital sp uczestniczy w wiązaniu
σ
O: analogicznie jak C
Pozostałe orbitale:
2p
y
(C) i 2p
y
(O) tworzą jedno wiązanie
π
2p
z
(C) i 2p
z
(O) tworzą drugie wiązanie
π
Konfiguracja CO:
KK (n
C
)
2
(n
O
)
2
(
σ
x
)
2
(
π
y
)
2
(
π
z
)
2
n = niewiążące oritale sp
albo : KK (t
C
)
2
(t
O
)
2
(
σ
x
)
2
(
π
y
)
2
(
π
z
)
2
(t= orbital sp)
Rząd wiązania = 3 (jedno typu
σ i dwa typu π)
----------------------------------------------------------------
Wpływ wolnych par elektronowych na orbitalach sp
atomów O i C:
- moment dipolowy CO wynosi jedynie 0,1 D !
- tworzenie wiązań M – CO w karbonylkach metali
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
119
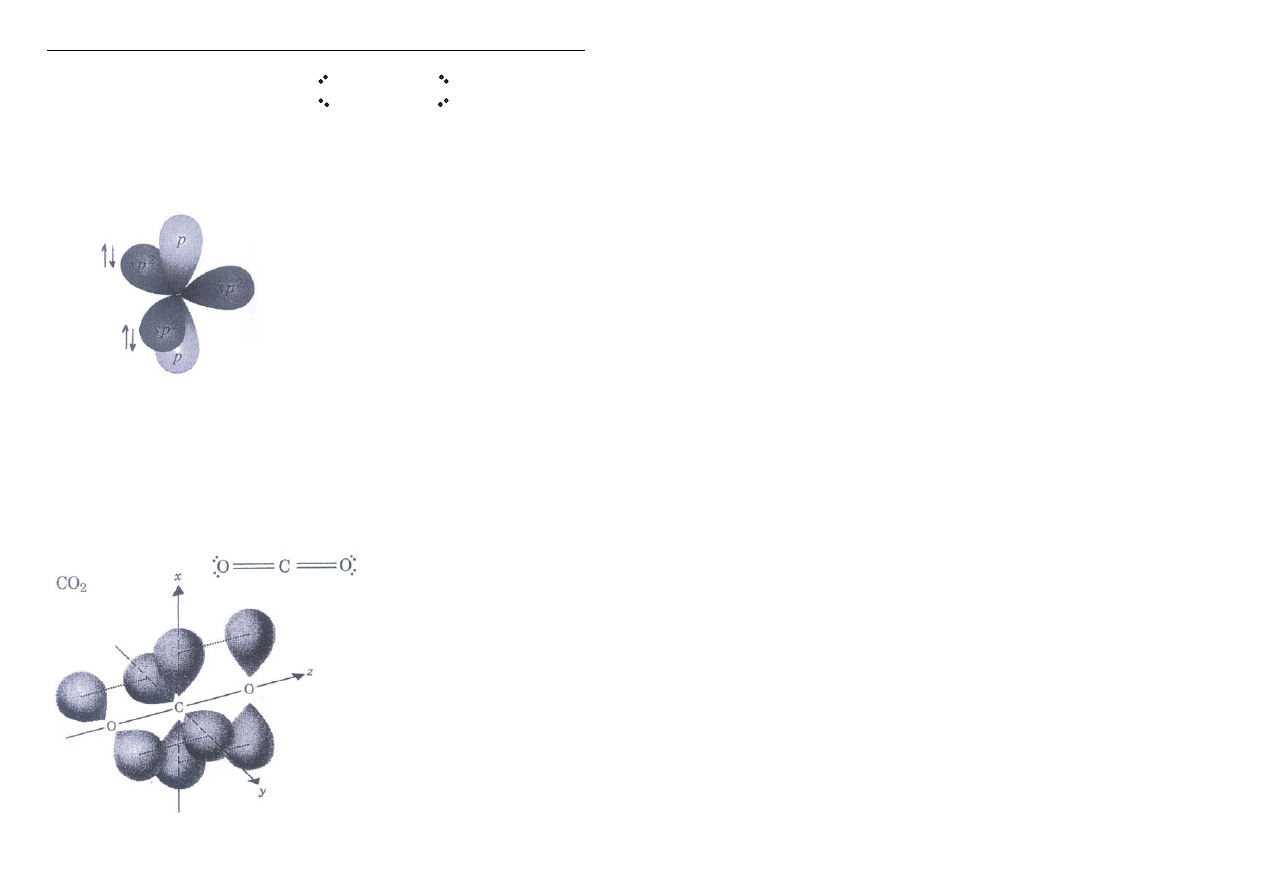
CO
2
ditlenek węgla
O = C = O
Centralny atom węgla ulega hybrydyzacji sp
dlatego cząsteczka jest liniowa.
Atomy tlenu mają hybrydyzację sp
2
W każdym atomie O
dwie wolne pary
elektronowe
zajmują dwa orbitale
sp
2
Trzeci orbital sp
2
atomu tlenu nakłada się na orbital sp
węgla tworząc wiązanie
σ
(powstają w sumie dwa wiązania
σ wzdłuż osi cząsteczki)
Pozostałe orbitale p O i p C nakładają się tworząc
dwa wiązania
π.
Dwa układy wiązań
π są wzajemnie prostopadłe!
Wyszukiwarka
Podobne podstrony:
co co2
co co2
CO O FILTRACH UV POWINNIŚCIE WIEDZIEĆ
Biopreparaty co to
Co to za owoc
IB w5 co
Co powoduje raka1
Klastry turystyczne, pochodzenie nazwy, co to
za co kocham www prezentacje org
Boe co mam czyni
EDoc 6 Co to jest podpis elektroniczny slajdy
co oznacza malzenstwo WWW ALEJAJA PL
Co daje nauce prawoznawstwo porownawcze
(1955) CO PISMO ŚWIĘTE MÓWI O ŻYCIU POZAGROBOWYMid 876
na co nalezy zwrocic uwage przygotowujac uczniow do nowego ustnego egzaminu maturalnego
więcej podobnych podstron