
P
OLITECHNIKA
Ś
LĄSKA
W
YDZIAŁ
C
HEMICZNY
K
ATEDRA
C
HEMII
O
RGANICZNEJ
, B
IOORGANICZNEJ I
B
IOTECHNOLOGII
Instrukcja do ćwiczeń laboratoryjnych
WŁAŚCIWOŚCI KWASOWO-ZASADOWE
ZWIĄZKÓW ORGANICZNYCH;
BADANIE ROZPUSZCZALNOŚCI ZWIĄZKÓW
dla kierunku Biotechnologia
prowadzący: mgr inż. Katarzyna Kajewska
mgr inż. Marta Kurpet

2
Badanie rozpuszczalności związków
Ustalenie rozpuszczalności związku organicznego w wybranych rozpuszczalnikach
dostarcza wstępnych informacji na temat charakteru badanego związku, ponieważ
rozpuszczalność jest ściśle powiązana z budową i obecnością określonych grup funkcyjnych.
Wstępne testy na rozpuszczalność pozwalają uzyskać informacje o kwasowym, zasadowym
lub obojętnym charakterze badanego związku. Stanowią one podstawę do zaliczenia związku
organicznego do odpowiedniej grupy rozpuszczalności, w obrębie której przeprowadzić
można dalsze testy z wykorzystaniem reakcji charakterystycznych dla poszczególnych grup
funkcyjnych.
Do przeprowadzenia prób rozpuszczalności stosuje się następujące rozpuszczalniki,
podane w kolejności ich użycia:
- woda
- eter dietylowym
- 5% wodny roztwór NaOH
- 5% wodny roztwór NaHCO
3
- 5% wodny roztwór HCl
- stężony kwas siarkowy
- 85% kwas fosforowy
Zastosowanie tak wybranych rozpuszczalników ma swoje logiczne uzasadnienie. Woda
ze względu na swą polarność jest dobrym rozpuszczalnikiem związków o wyraźnie polarnym
charakterze cząsteczek, w których udział części niepolarnej (najczęściej węglowodorowej)
nie jest duży. Zła rozpuszczalność związku w eterze świadczy o jego silnej polarności.
Po przeprowadzeniu testu rozpuszczalności w wodzie i eterze sprawdzenie
rozpuszczalności w wodnych roztworach HCl i NaOH pozwala ustalić, czy badana substancja
jest lepiej rozpuszczalna w wodnych roztworach kwasu lub zasady, a tym samym,
czy zawiera grupy funkcyjne kwasowe lub zasadowe (Tabela 3).
Zastosowanie silnego kwasu, jakim jest stężony kwas siarkowy, daje możliwość
rozróżnienia związków będących słabymi zasadami (np. alkohole, etery) bądź ulegającymi
w warunkach przeprowadzonego testu reakcjom chemicznym od związków nie ulegających
w tych warunkach proponowaniu i innym widocznym przemianom (węglowodory
alifatyczne).

3
Proces rozpuszczania w stężonym kwasie siarkowym może być procesem złożonym.
Zewnętrznym przejawem takiej reakcji może być rozgrzewanie się roztworu, wydzielanie
gazów, ściemnienie, zesmolenie próbki.
Dla oceny rozpuszczalności przyjmuje się umownie proporcję pomiędzy substancją
rozpuszczoną a rozpuszczalnikiem. Uznaje się, że związek jest rozpuszczalny w danym
rozpuszczalniku wtedy, gdy tworzy z nim homogeniczną ciecz. Wynik testu jest także
pozytywny, jeżeli badana substancja ulega przemianie w rozpuszczalniku (dotyczy to
zwłaszcza stosowania stężonego kwasu siarkowego) do produktów o odmiennych
własnościach niż związek wyjściowy.
1. Wykonanie prób rozpuszczalności
Do przeprowadzenia prób rozpuszczalności przyjmuje się umownie następujące
proporcje: 0,1 g substancji stałej (sproszkowanej) lub 0,2 cm
3
cieczy oraz 3 cm
3
rozpuszczalnika. Jeżeli badany związek jest ciałem stałym należy go dokładnie rozdrobnić np.
w moździerzu. W przypadku cieczy próbkę odmierza się za pomocą pipety lub kalibrowanego
wkraplacza. Próbki umieszcza się w małych probówkach. Dodaje się odpowiedniego
rozpuszczalnika i po zatkaniu probówki korkiem wstrząsa i obserwuje efekt.
2. Podział związków organicznych na grupy rozpuszczalności
W tabeli 1 podano ogólny podział związków na grupy, w zależności od efektu
rozpuszczenia w podanych rozpuszczalnikach.

4
Tabela 1. Podział związków organicznych na grupy rozpuszczalności
I
Związki
rozpuszczalne
w
eterze
i wodzie
II
Związki
rozpuszczalne
w wodzie,lecz
nierozpuszczal-
ne w eterze
III
Związki
rozpuszczalne
w
5%
roztworze
NaOH
IV
Związki
rozpuszczalne
w
5%
roztworze
kwasu solnego
V
Związki
nie
zawierające N
lub
S
rozpuszczalne
tylko
w
stężonym
H
2
SO
4
VI
Związki
nie
zawierające
N
lub
S
nierozpuszczalne
w stęż. H
2
SO
4
VII
Związki
zawierające
N
lub
S
nie
znajdujące się w
grupach I-IV
Szeregi
homologiczne
(niższe
człony)
1.Alkohole
2.Aldehydy
3.Ketony
4.Kwasy
5.Estry
6.Fenole
7.Bezwodniki
8.Amidy
9.Nitryle
10.Fenole
polihydroksy-
lowe
1.Kwasy
polikarboksy-
lowe i hydro-
ksykwasy
2.Glikole, al-
Kohole
polihydroksy-
lowe,
polihydroksy-
aldehydy
i
ketony (cukry)
3.Niektóre
amdy,
aminokwasy,
związki dwu- i
poliamidowe,
aminoalkohole
4.Kwasy
sulfonowe
5.Sole
1.Kwasy
2.Fenole
3.Imidy
4.Niektóre
pierwszo-
i
drugorzędowe
nitrozwiązki;
oksymy
5.Tiole
i
tiofenole
6.Kwasy
sulfonowe,
kwasy
sulfonowe,
kwasy amino-
sulfonowe
i
sulfonamidy
7.Niektóre
dwuketony i
ß-ketoestry
1.Aminy
pierwszorzę-
dowe
2.Drugorzę-
dowe
aminy
alifatyczne
i
aminy
arylowo-
alkilowe
3.Trzeciorzę-
dowe
aminy
alifatyczne
i
niektóre
trzeciorzędowe
aryloalkilo-
aminy
4.Hydrazyny
1.Węglowodory
nienasycone
2.Niektóre
alkilowane
węglowodory
aromatyczne
3.Alkohole
4.Aldehydy
5.Ketony
6.Estry
7.Bezwodniki
8.Etery i acetale
9.Laktony
10.Chlorki
kwasowe
1.Węglowodory
nasycone.
2.Cykloalkany
3.Węglowodory
aromatyczne
4.Pochodne
chlorowcowe
węglowodorów
1,2 i 3
5.Etery
dwuarylowe
1.Związki
nitrowe
(trzeciorzędo-
we)
2.Amidy
i pochodne
aldehydów
i ketonów
3.Nitryle
4.Aminy
z
podstawnikami
arylowymi
5.Związki
nitrozo,
azo,
hydrazo i inne
pośrednie
redukcji
nitrozwiązków
6.Sulfony,
sulfonamidy,
pochodne amin
drugorzędowych,
siarczki,
siarczany i inne
związki siarki
Kolejność wykonania prób podano w tabeli 2. Próby wykonuje się w kolejności
od lewej kolumny (woda) do prawej (H
3
PO
4
).
Tabela 2. Kolejność wykonywania prób dla ustalenia przynależności do grup rozpuszczalności
Grupa
Woda
Eter
NaOH
NaHCO
3
HCl
H
2
SO
4
H
3
PO
4
I
II
IIIA
IIIB
IV
VA
VB
VI
VII
+
+
-
-
-
-
-
-
-
+
-
+
+
-
-
-
-
-
+
-
+
-
-
-
-
+
+
-
-
+
-
Efekt pozytywny (+) pozwala na zakwalifikowanie związku do danej grupy
rozpuszczalności i dalsze przeprowadzenie testów na grupy funkcyjne. Niekiedy użyteczne
jest sprawdzenie innych rozpuszczalników, zwłaszcza dla pierwszych czterech grup
rozpuszczalności. Przykładowo stwierdzenie wydzielania się CO
2
w reakcji z NaHCO
3
dla związku zaliczonego do pierwszej grupy rozpuszczalności świadczyć może o obecności
5
grupy karboksylowej; związek zaliczony do grupy trzeciej może zawierać także grupy
aminowe i rozpuszczać się w 5% roztworze HCl.
3. Próba rozpuszczalności w wodzie i eterze
Wykonanie próby:
Do 0,1 g substancji stałej i 0,2 cm
3
cieczy umieszczonej w probówce dodaje się 3 cm
3
wody (eteru) porcjami po 1 cm
3
, za każdym razem wstrząsając zawartość probówki i
obserwując efekt. Należy zbadać pH roztworu wodnego.
Omówienie:
GRUPA I – Związki rozpuszczalne w wodzie i eterze
Woda jest rozpuszczalnikiem polarnym i będą się w niej rozpuszczać związki
zawierające polarne grupy funkcyjne i stosunkowo krótkie hydrofobowe fragmenty (łańcuchy
węglowodorowe), przy czym wpływ części polarnej i niepolarnej jest stosunkowo
wyrównany.
Jeżeli związek jest rozpuszczalny w wodzie i eterze to można sądzić, że:
a) jest to związek niejonowy lub jonizuje w niewielkim stopniu
b) posiada do pięciu atomów węgla w cząsteczce
c) zawiera polarna grupę, zdolna do tworzenia wiązań wodorowych
d) zawiera nie więcej niż jedną grupę polarną
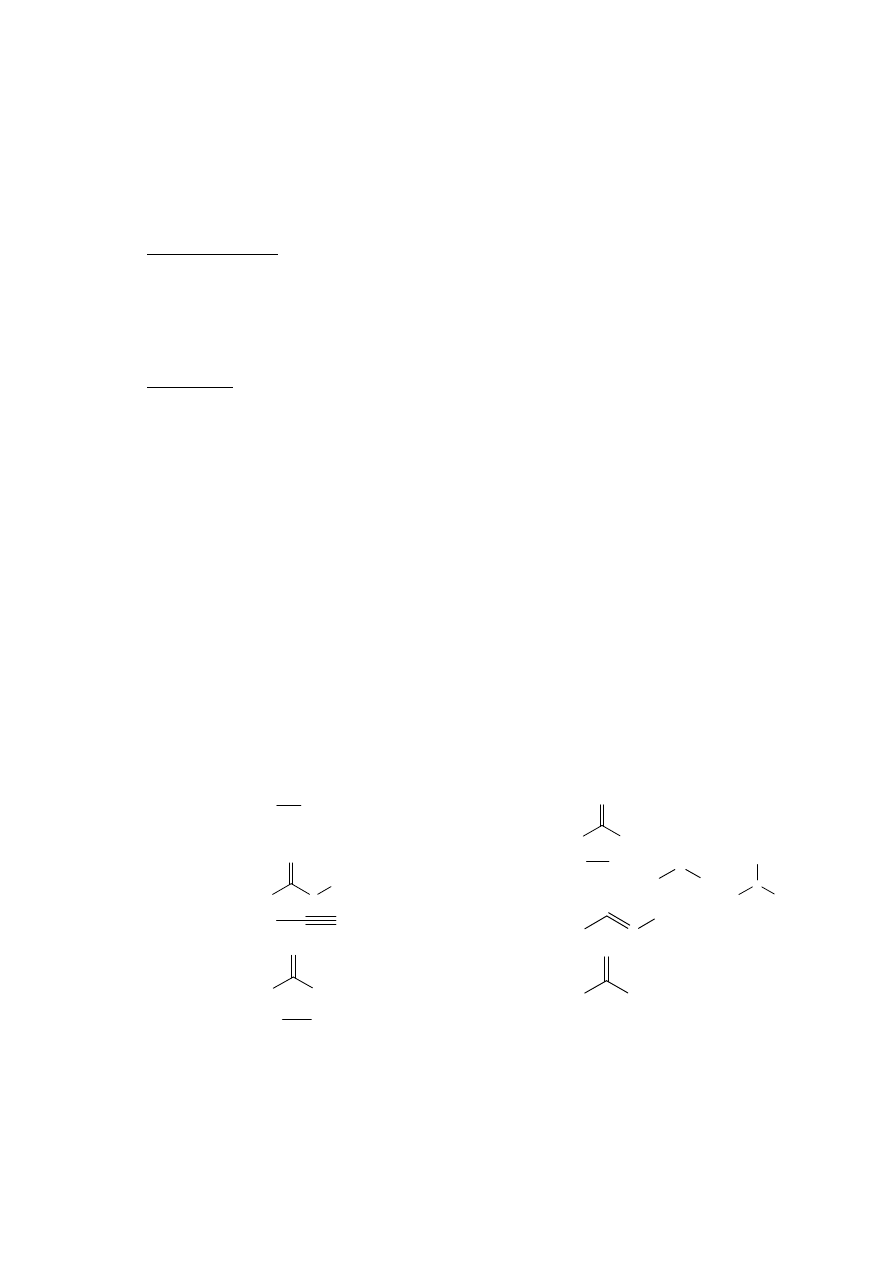
Do związków takich zalicza się zawierające do pięciu atomów w cząsteczce:\
alkohole
R
OH
Amidy
R
NH
2
O
estry
R
O
O
R
1
Aminy
R
NH
2
R
H
N
R
1
R
N
R
1
R
2
nitryle
N
R
Oksymy
R
N
OH
aldehydy
R
H
O
Kwasy
R
OH
O
fenole
Ar
OH
etery pierścieniowe (np. tetrahydrofuran)
fenole polihydroksylowe (np. hydrochinon)
ketonokwasy
gdzie R – alkil, Ar – aryl (np. podstawnik fenylowy)
6
Umownie przyjęta proporcja wody (eteru) i badanej próbki decyduje niejednokrotnie
o przynależności związku do pierwszej lub dalszych grup rozpuszczalności, a granica
podziału nie jest ostra. Często związki tego samego szeregu homologicznego zawierające
przecież te same grupy funkcyjne są klasyfikowane do różnych grup.
3.2 GRUPA II – Związki rozpuszczalne w wodzie, a nierozpuszczalne w eterze
Należą do nich związki o przeważającym wpływie polarnej części cząsteczki,
co, sprzyjając rozpuszczaniu w wodzie, ogranicza rozpuszczalność w eterze. Mogą to być:
a) związki jonowe (sole)
b) związki zawierające więcej niż jedną grupę polarną, przy czym na każdą grupę
polarną wypada nie więcej niż cztery atomy węgla
Z reguły nierozpuszczalne w eterze są związki zawierające niżej wymienione grupy
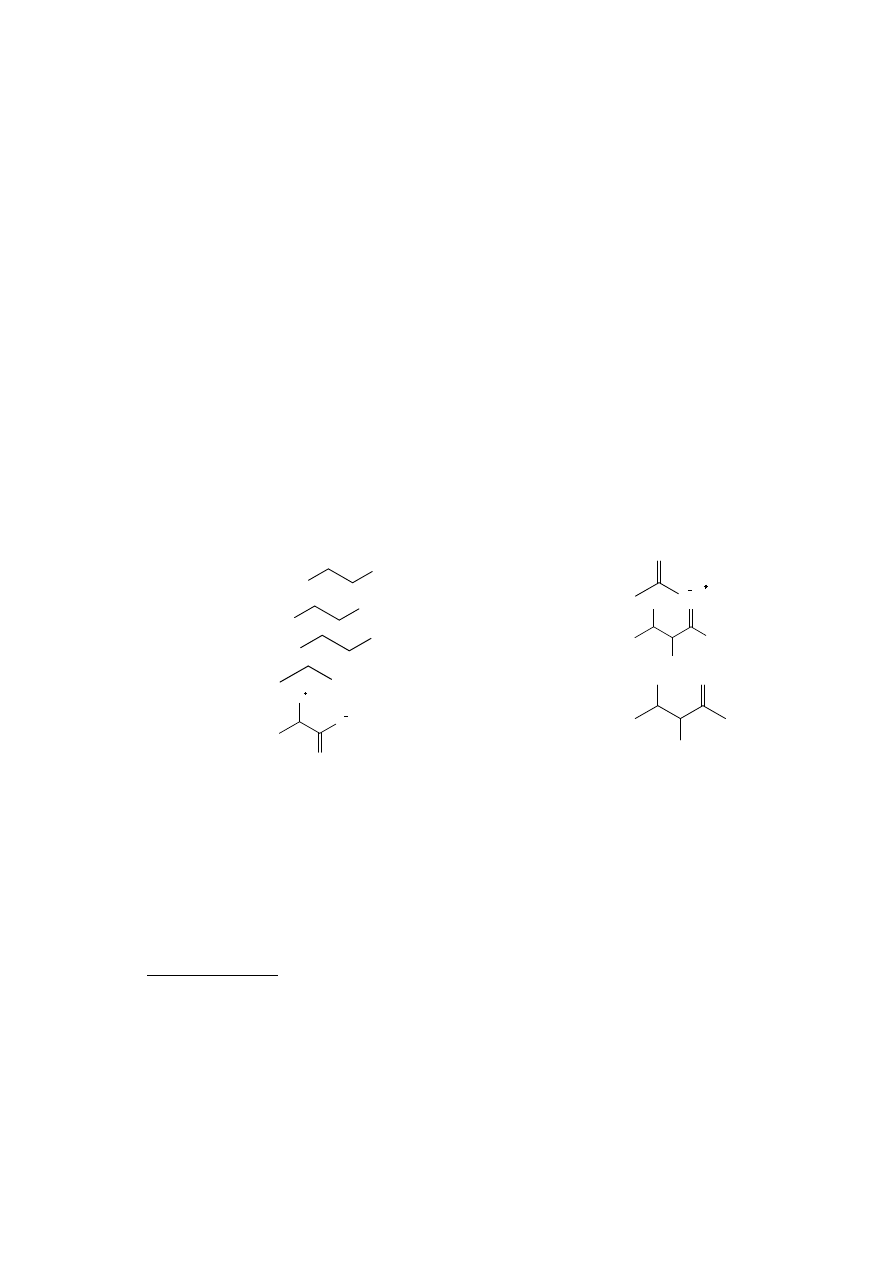
funkcyjne:
kwasy polikarboksylowe
HOOC
COOH
Sole
O
O
Na
Glikole
HO
OH
aminoalkohole
H
2
N
OH
Polihydroksyaldehydy
(aldozy)
OH
OH
O
H
kwasy sulfonowe
SO
3
H
Aminokwasy
NH
3
O
O
Polihydroksyketony
(ketozy)
OH
OH
O
Substancje stałe należące do tej grupy należy zbadać ze względu na zachowanie wobec
wodnego roztworu HCl i NaOH. Hydroliza soli organicznych kwasów lub zasad może
prowadzić do wydzielania osadu.
4. Próba rozpuszczalności w roztworze 5% NaOH i NaHCO
3
Wykonanie próby:
Do probówki wprowadza się 0,1 g badanej substancji stałej lub 0,2 cm
3
cieczy i dodaje
stopniowo 3 cm
3
roztworu NaOH. Jeżeli substancja nie uległa rozpuszczeniu przenosi się
za pomocą pipetki część warstwy wodnej do innej probówki i stopniowo dodaje 5% HCl,
aż do odczynu kwaśnego. Powstanie osadu lub zmętnienie świadczy o obecności związku
o charakterze kwasowym.

7
Podobnie przeprowadza się test na rozpuszczalność w roztworze NaHCO
3
. W tym
wypadku należy zwracać szczególną uwagę na wydzielanie się pęcherzyków CO
2
.
Omówienie:
4.1. GRUPA III – Związki nierozpuszczalne w wodzie, lecz rozpuszczalne w 5%
roztworze NaOH
Do tej grupy należą związki, które posiadają wystarczająco silny charakter kwasowy, by
ulec reakcji z wodnym roztworem NaOH (patrz Tabela 3.)
Część związków rozpuszcza się także w 5% roztworze NaHCO
3
; poniżej wymieniono
typy związków należące do tej grupy, z podziałem na dwie części: grupę IIIA i IIIB.
Pouczające jest porównanie w tabeli 3 stałych pK
a
dla kwasów karboksylowych (4-5),
kwasu węglowego (6,35), fenoli (9-11) i wody (16). Z tych danych oraz reguły, że każdy
kwas reagować będzie z zasadą, która jest w tabeli uszeregowana niżej (wyższa wartość pK
a
)
wynika, iż reakcja:
RCOOH
HCO
3
-
RCOO
-
H
2
CO
3
będzie przesunięta w prawo (z wydzieleniem CO
2
), natomiast reakcja:
ArOH
HCO
3
-
ArO
-
H
2
CO
3
nie jest obserwowana.
4.1.1. GRUPA IIIA – Związki rozpuszczalne w roztworze NaOH i NaHCO
3
Należą do nich:
- kwasy karboksylowe
- kwasy sulfinowe (ArSO
2
H)
- kwasy sulfonowe (ArSO
3
H)
- fenole z grupami elektronoakceptorowymi (2,4-dinitrofenol, 2,4,6-trinitrofenol,
2,4,6-tribromofenol).
8
4.1.2. GRUPA IIIB – Związki rozpuszczalne w roztworze NaOH i nierozpuszczalne
w roztworze NaHCO
3
Do grupy tej należą związki, dla których wartość pK
a
jest wyższa niż kwasu
węglowego, a niższa niż wody. Przykłady związków podano poniżej:
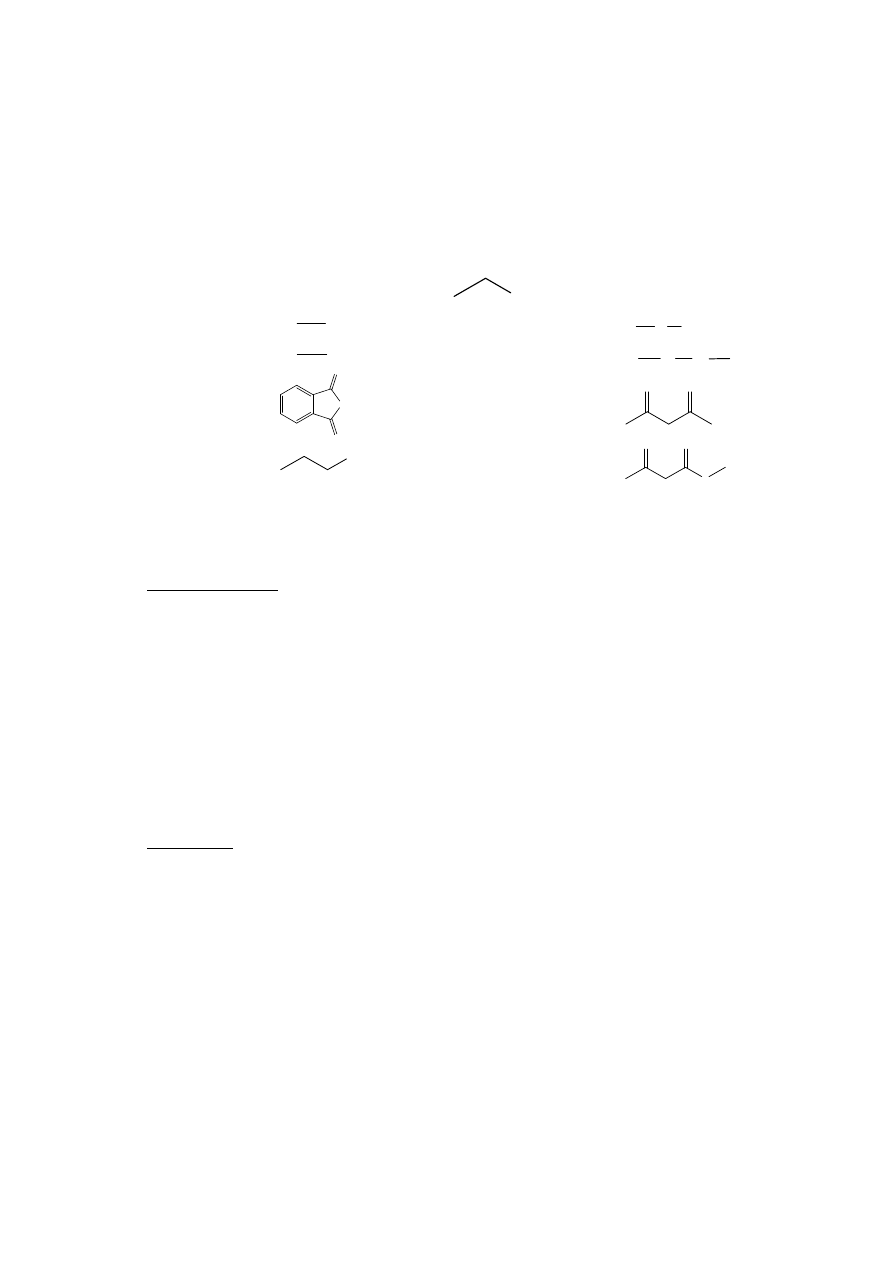
związki nitrowe I- i II-gorzędowe
NO
2
Fenole
Ar
OH
Ar
O
2
S
NH
2
tiofenole
Ar
SH
Sulfonamidy
Ar
O
2
S
NH
R
Imidy
NH
O
O
ß-diketony
O
O
Tiole
SH
ß-ketoestry
O
O
O
5. Próba rozpuszczalności w 5% roztworze HCl
Wykonanie próby:
Do 0,1 g stałej substancji lub 0,2 cm
3
cieczy dodaje się porcjami 3 cm
3
kwasu. Niektóre
zasady organiczne tworzą chlorowodorki rozpuszczalne w wodzie, lecz wytrącające się
wobec nadmiaru kwasu. Rozpuszczenie badanej próbki w którymkolwiek momencie
świadczy o pozytywnym wyniku testu.
Jeżeli próbka nie uległa całkowitemu rozpuszczeniu należy pipetką pobrać część
wodnego roztworu do innej probówki i powoli neutralizować 5% wodnym roztworem NaOH.
Wydzielenie osadu lub emulsji świadczy o pozytywnym wyniku testu.
Omówienie:
GRUPA IV – Związki rozpuszczalne w 5% roztworze HCl
Większość związków rozpuszczalnych w roztworze HCl zawiera w cząsteczce
zasadowy atom azotu (atom posiadający wolną parę elektronową). Są to aminy alifatyczne
wszystkich rzędów, pierwszorzędowe aminy aromatyczne (grupy arylowe zmniejszają
zasadowość azotu), aminy alifatyczno-aromatyczne, aminy alicykliczne. Niektóre związki
zawierające tlen (piron) mogą tworzyć już z 5% roztworem kwasu solnego sole oksoniowe
i są w nim rozpuszczalne. Nierozpuszczalne w wodzie amidy niepodstawionej
9
i jednopodstawione są także nierozpuszczalne. Natomiast niektóre amidy dwupodstawione
mogą ulegać rozpuszczeniu.
Niżej wymieniono niektóre typy związków:
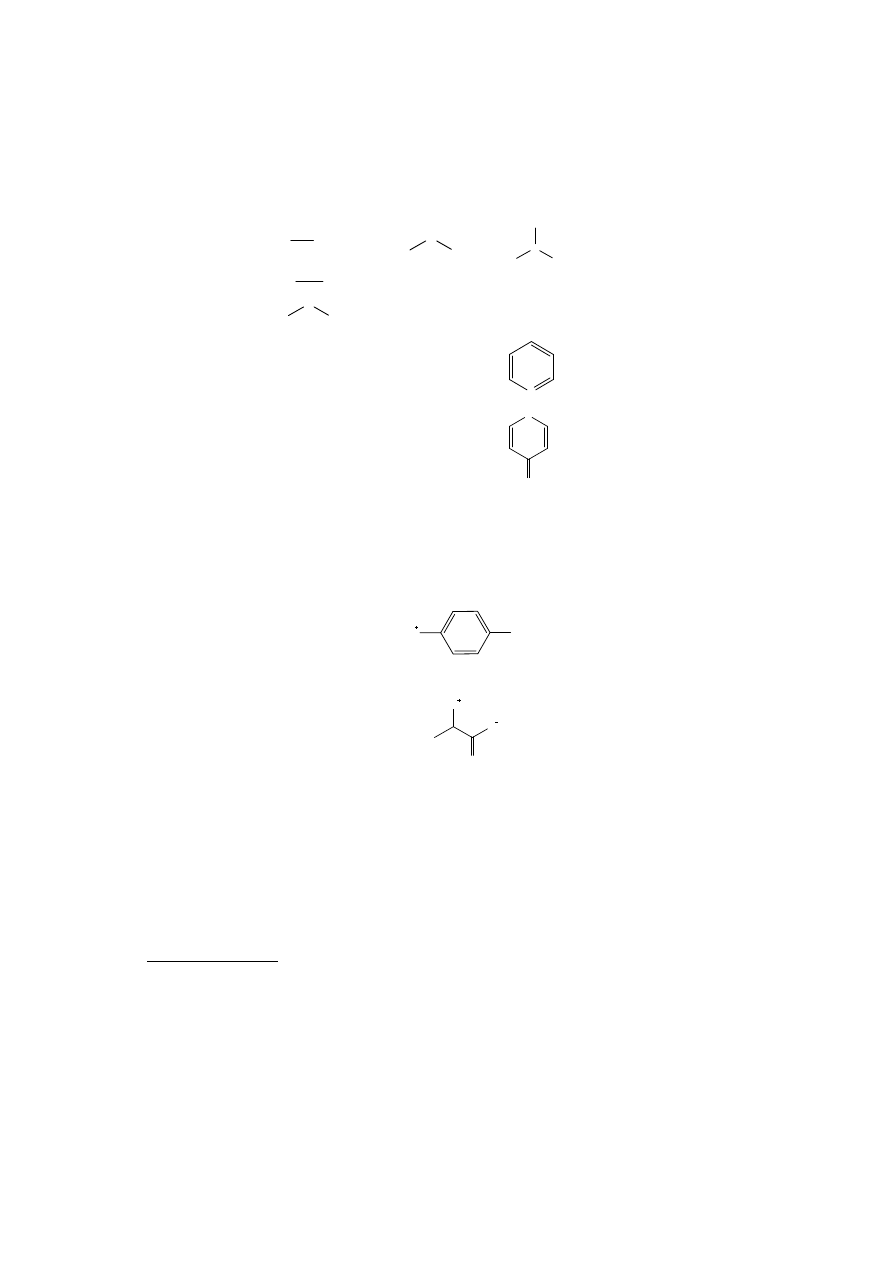
Aminy alifatyczne
R
NH
2
R
H
N
R
1
R
N
R
1
R
2
aminy aromatyczne
Ar
NH
2
hydrazyny
R
H
N
NH
2
niektóre związki heterocykliczne z atomem azotu (pirydyna)
N
niektóre związki heterocykliczne z atomem tlenu (piron)
O
O
Niektóre związki zawierające grupy aminowe nie ulegają rozpuszczeniu w roztworze
HCl,
z
uwagi
na
tworzenie
wewnętrznych
soli.
Przykładem
jest
kwas
p-aminobenzenosulfonowy:
H
3
N
SO
3
-
Podobny typ soli tworzą aminokwasy:
NH
3
O
O
jednakże osłabienie zasadowego charakteru grupy aminowej jest w tym przypadku mniejsze
(aminokwasy rozpuszczają się w roztworze HCl).
6. Próbka rozpuszczalności w stężonym kwasie siarkowym i 85% kwasie
fosforowym
Wykonanie próby:
W suchej probówce umieszcza się 3 cm
3
czystego stężonego kwasu siarkowego i dodaje
0,1 g substancji stałej lub 0,2 cm
3
cieczy. Jeżeli związek nie rozpuszcza się natychmiast
należy delikatnie wstrząsać probówką, obserwując uważnie, czy nie zachodzi zmiana barwy
próbki, zesmolenie, wydzielanie produktów gazowych. Należy wyraźnie rozróżnić
nierozpuszczalność produktu reakcji od rozpuszczalności badanego związku. Dlatego reakcja
10
badanego związku z kwasem siarkowym nawet połączona z wytrąceniem osadu jest podstawą
do uznania związku za rozpuszczalny.
Podobnie wykonuje się próbę rozpuszczalności w kwasie fosforowym, jedynie przy
pozytywnym wyniku rozpuszczenia w stężonym H
2
SO
4
.
Omówienie:
6.1. GRUPA V – Związki nie zawierające azotu i siarki, nierozpuszczalne w wodzie oraz
poszczególnych kwasach alkaliach, rozpuszczalne w kwasie siarkowym
Liczną grupą związków należących do V grupy rozpuszczalności są związki zawierające
tlen. Ich rozpuszczalność spowodowana jest zasadowym charakterem atomów tlenu,
mogących tworzyć jony oksoniowe.
Często rozcieńczenie rozpuszczonej próbki przez ostrożne wprowadzenie jej do wody
powoduje wydzielanie związku w postaci niezmienionej. W wielu wypadkach jony
oksoniowe mogą jednak ulegać dalszym przemianom.
Do V grupy rozpuszczalności należą także węglowodory nienasycone, ulegające
rozpuszczeniu wskutek tworzenia wodorosiarczanów alkilowych oraz węglowodory
polialkiloaromatyczne i etery alkilowo-arylowe, ulegające sulfonowaniu. Do V grupy
rozpuszczalności należy najwięcej klas związków, z tego względu korzystne jest wykonanie
dodatkowego badania rozpuszczalności w 85% kwasie fosforowym.
W kwasie fosforowym rozpuszczają się:
Alkohole
R
OH
aldehydy
R
O
H
ketony alicykliczne
O
metyloketony
R
O
estry (poniżej 9 atomów węgla)
R
O
O
R
1
etery (poniżej 7 atomów węgla)
R
O
R
1
Ponadto do V grupy rozpuszczalności należą związki rozpuszczalne wyłącznie
w stężonym kwasie siarkowym:

11
węglowodory nienasycone
R
R
1
węglowodory polialkiloaromatyczne
chlorki kwasowe
R
O
Cl
etery alkiloarylowe
R
O
Ar
bezwodniki
R
O
O
R
O
Ketony
R
O
R
6.2. GRUPA VI – Związki nie zawierające azotu i siarki , nie odpowiadające warunkom
rozpuszczalności dla grup I-V
Do tej grupy zalicza się:
- węglowodory nasycone (oktan, cykloheksan)
- węglowodory aromatyczne (toluen, naftalen)
- chlorowcopochodne węglowodorów (bromobenzen, 1-chlorobutan)
- etery diarylowe (eter difenylowy)
6.3. GRUPA VII – Związki zawierające azot lub siarkę, nie odpowiadające warunkom
rozpuszczalności grup I-V
Klasy związków zostały wymienione w tabeli 1. Do grupy tej należy szereg związków,
w których występujące atomy azotu lub siarki nie posiadają lub posiadają znacznie
ograniczone właściwości zasadowe.
Proszę DOKŁADNIE zapoznać się z instrukcją oraz:
umieć wyjaśnić pojęcia występujące w instrukcji np. pKa, polarność, rzędowość
znać wzory sumaryczne związków wymienionych w instrukcji
potrafić napisać poprawne reakcje chemiczne opisane w instrukcji
Na zajęcia należy przynieść:
ręcznik / ściereczkę do rąk (najlepiej każdy swoją)
płyn do mycia naczyń (jeden na całą grupę)
rękawiczki lateksowe bądź winylowe (po 2 pary na osobę)
wydrukowaną tabelę (sprawozdanie) 5 egzemplarzy na osobę (zamieszczona poniżej)
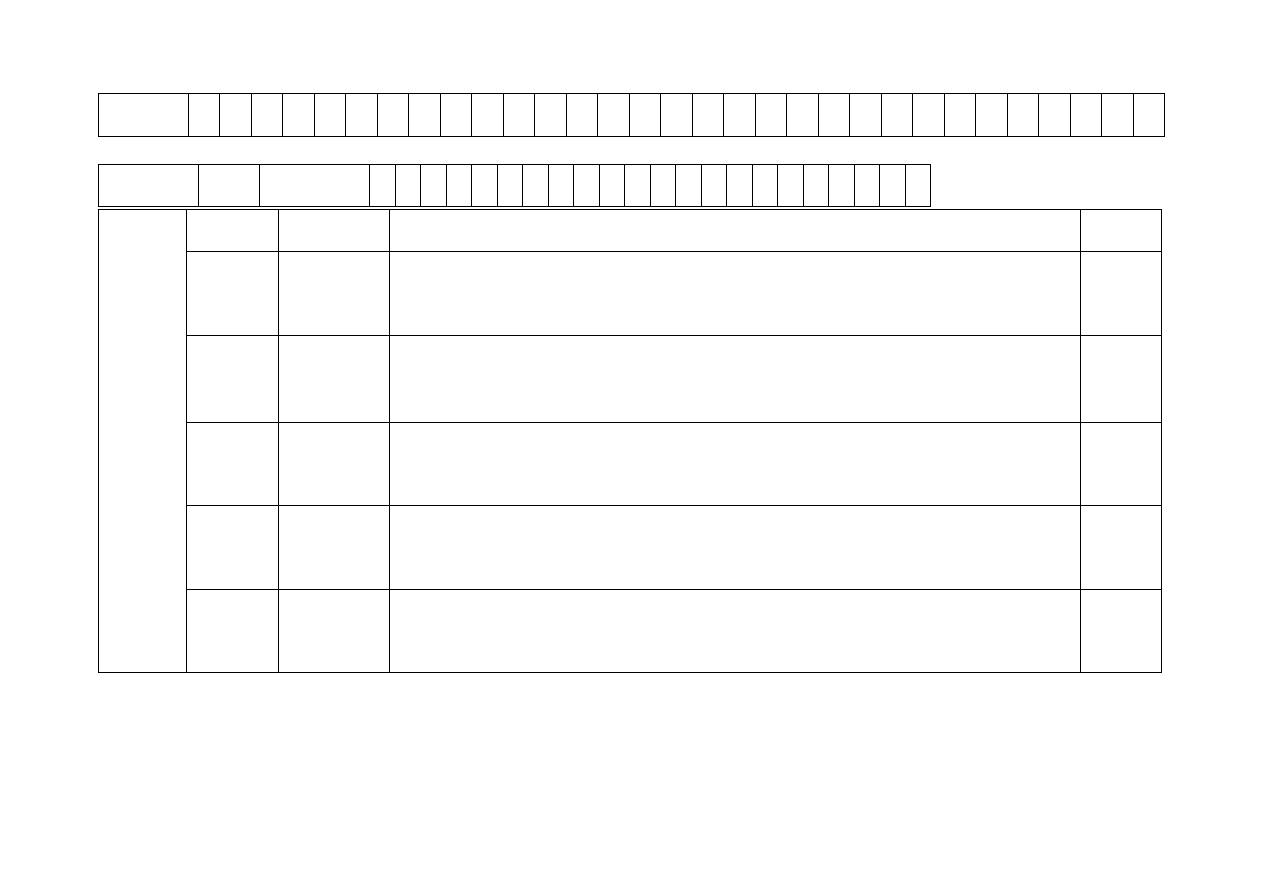
Próba
Wynik
próby *
Opis zachowania próbki
Grupa
rozp. **
Woda
……………
…………………………………………………………………………………………………..
………………………………………………………………………………………………….
………………………………………………………………………………………………….
………………………………………………………………………………………………….
Eter
Dietylowy
……………
…………………………………………………………………………………………………..
………………………………………………………………………………………………….
………………………………………………………………………………………………….
………………………………………………………………………………………………….
5% NaOH
……………
…………………………………………………………………………………………………..
………………………………………………………………………………………………….
………………………………………………………………………………………………….
………………………………………………………………………………………………….
5% HCl
……………
…………………………………………………………………………………………………..
………………………………………………………………………………………………….
………………………………………………………………………………………………….
………………………………………………………………………………………………….
Związek
………..
Skład
atomowy
…………
Stężony
H
2
SO
4
…………….
…………………………………………………………………………………………………..
………………………………………………………………………………………………….
………………………………………………………………………………………………….
………………………………………………………………………………………………….
SUMA PUNKTÓW
*Pozytywny (+); Negatywny (-); nie dotyczy
**Na podstawie wyników z wszystkich prób
Nazwisko
i imię
Grupa lab.
……..
Prowadzący
ćwiczenie
Karta wykonania ćwiczenia
Kwasowość i zasadowość związków organicznych
Wyszukiwarka
Podobne podstrony:
6 grupy rozpuszczalnosci
Podział związków organicznych na grupy rozpuszczalności
Instrukcja Iloczyn rozpuszczalności IB UŁ
Tabela - INSTRUKTAŻ HIGIENY DLA DANEJ GRUPY WIEKOWEJ I Z DANYM SCHORZENIEM, Asystentka stomatologicz
IIedycja final1 klucz , Instrukcja dla grupy I
3-Tabela - INSTRUKTAŻ HIGIENY DLA DANEJ GRUPY WIEKOWEJ I Z DANYM SCHORZENIEM, Asystentka stomatologi
1-Tabela - INSTRUKTAŻ HIGIENY DLA DANEJ GRUPY WIEKOWEJ I Z DANYM SCHORZENIEM, Asystentka stomatologi
Tabela - INSTRUKTAŻ HIGIENY DLA DANEJ GRUPY WIEKOWEJ I Z DANYM SCHORZENIEM, dentystyczne co nieco
4-Tabela - INSTRUKTAŻ HIGIENY DLA DANEJ GRUPY WIEKOWEJ I Z DANYM SCHORZENIEM, Asystentka stomatologi
2-Tabela - INSTRUKTAŻ HIGIENY DLA DANEJ GRUPY WIEKOWEJ I Z DANYM SCHORZENIEM, Asystentka stomatologi
5-Tabela - INSTRUKTAŻ HIGIENY DLA DANEJ GRUPY WIEKOWEJ I Z DANYM SCHORZENIEM, Asystentka stomatologi
instrukcja bhp korzystania z parku linowego przez grupy zorganizowane
Instrukcja dla lidera grupy B
więcej podobnych podstron