1
W
ęglowodany
Węglowodany swoja nazwę zawdzięczają stąd, że związki te na ogół można przedstawić wzorem empirycznym C
x
(H
2
O)
y
, w którym
węgiel przedstawia się jako uwodniony.
Zgodnie z nową definicją w
ęglowodanami nazywamy wielowodorowe aldehydy oraz wielowodorowe ketony, a także związki, z
których takie hydroksyaldehydy lub ketony można otrzymać w wyniku hydrolizy.
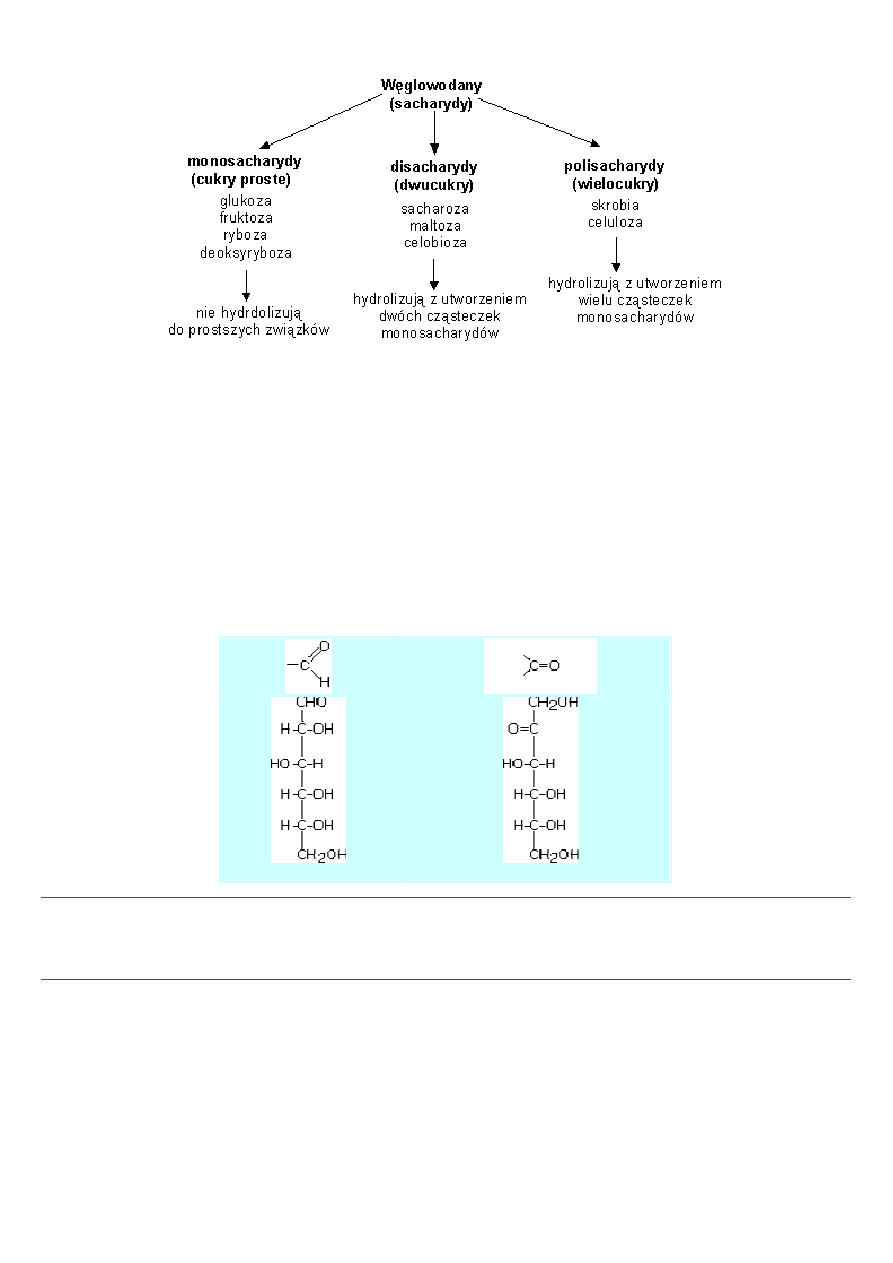
•
węglowodan, który nie ulega hydrolizie do prostszych związków, nosi nazwę monosacharydu (cukru prostego).
•
węglowodan, którego cząsteczka hydrolizuje do dwóch cząsteczek monosacharydu, nazywa się disacharydem (dwucukrem).
•
węglowodan, którego cząsteczka hydrolizuje do wielu cząsteczek monosacharydów, nazywa się polisacharydem
(wielocukrem, cukrem złożonym).
Według innego podziału
•
cukry które zawieraja w cząsteczce grupę aldehydowa nazywane są aldozami,
•
cukry zawierające grupę ketonową noszą ogólna nazwę ketoz.
Aldoza
Ketoza
Monosacharydy (cukry proste)
Monosacharydy, obok licznych grup wodorotlenowych, posiadaj
ą
grup
ę
aldehydow
ą
-CHO albo ketonow
ą
=C=O.
Zgodnie z obecno
ś
ci
ą
tych grup cukry proste dzielimy na aldozy i ketozy
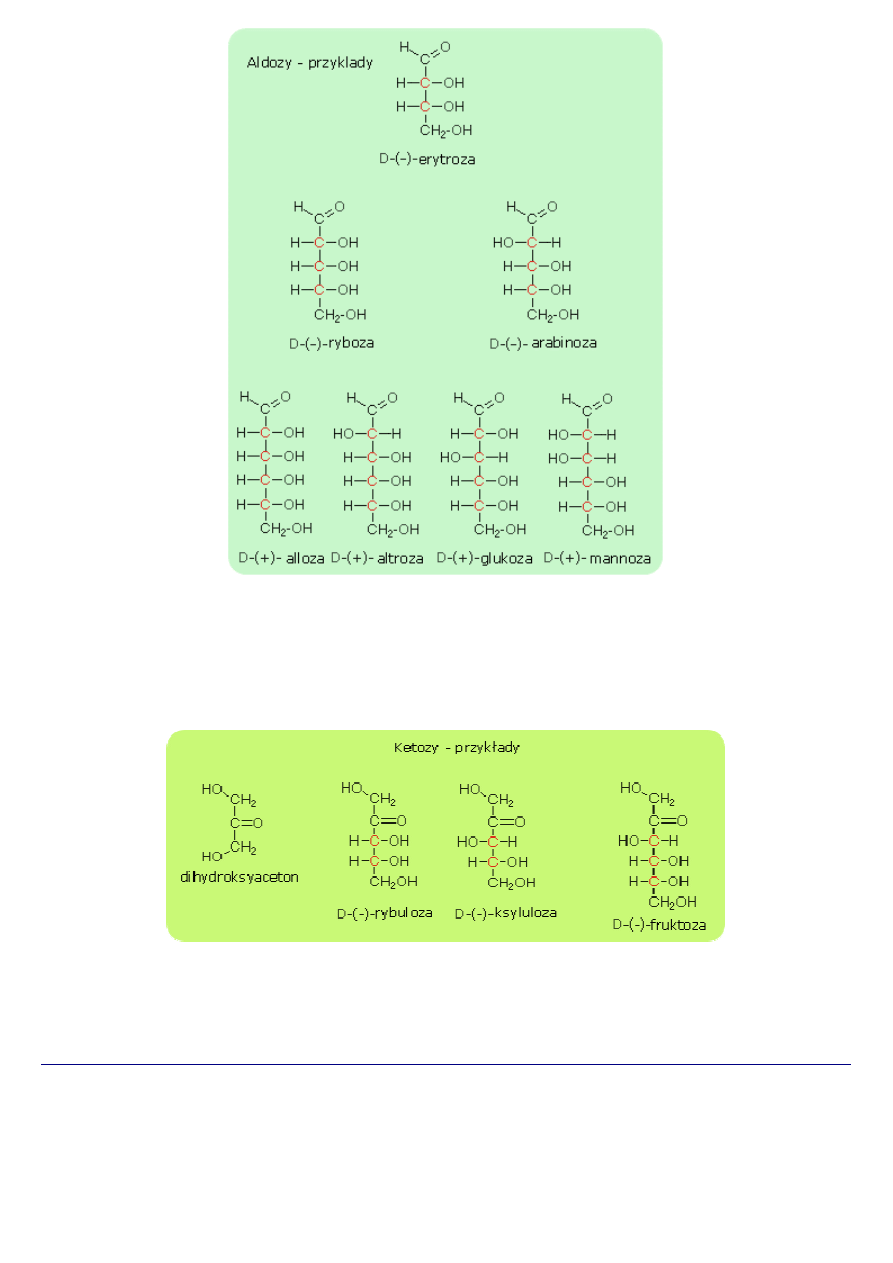
1. Nazewnictwo
W nazwach ogólnych cukrów prostych przyjęto zasadę uwidaczniania ilości atomów węgla albo atomów tlenu w cząsteczce.
Zgodnie z tą zasadą aldozy będą nazywane;
•
najprostszą aldozą jest aldehyd glikolowy CH
2
OH-CHO, który posiada dwa atomy węgla stąd nazwa aldodioza
•
CH
2
OH-CHOH-CHO - aldotrioza (trzy atomy węgla w cząsteczce)
•
CH
2
OH-(CHOH)
2
-CHO - aldotetroza (cztery atomy węgla w cząsteczce)
•
CH
2
OH-(CHOH)
3
-CHO - aldopentoza (pięć atomów węgla w cząsteczce)
•
CH
2
OH-(CHOH)
4
-CHO - aldoheksoza (sześć atomów węgla w cząsteczce)
2
Szereg ketoz, zaczyna się od cukrowca posiadającego trzy atomy węgla:
•
CH
2
OH-CO-CH
2
OH ketotrioza (trzy atomy węgla w cząsteczce)
•
CH
2
OH-CHOH-CO-CH
2
OH ketotetroza (cztery atomy węgla w cząsteczce)
•
CH
2
OH-(CHOH)
2
-CO-CH
2
OH ketopentoza (pięć atomów węgla w cząsteczce)
•
CH
2
OH-(CHOH)
3
-CO-CH
2
OH ketoheksoza (sześć atomów węgla w cząsteczce)
Oprócz nazw ogólnych dla poszczególnych grup cukrów prostych w nazewnictwie cukrów prostych stosuje się;
•
nazwy zwyczajowe
•
nazwy systematyczne
2. Sposoby rysowania wzorów cukrów
Atomy węgla w cząsteczkach cukrów prostych mogą mieć różne ułożenie przestrzenne i tworzyć łańcuchy lub zamknięte pierścienie.
Konfiguracje łańcuchowych form monosacharydów przedstawia się za pomocą wzorów Fischera, a ich przestrzenne struktury
pierścieniowe - za pomocą wzorów Hawortha. We wzorach Fischera atomy węgla łańcucha głównego ułożone są pionowo w ten
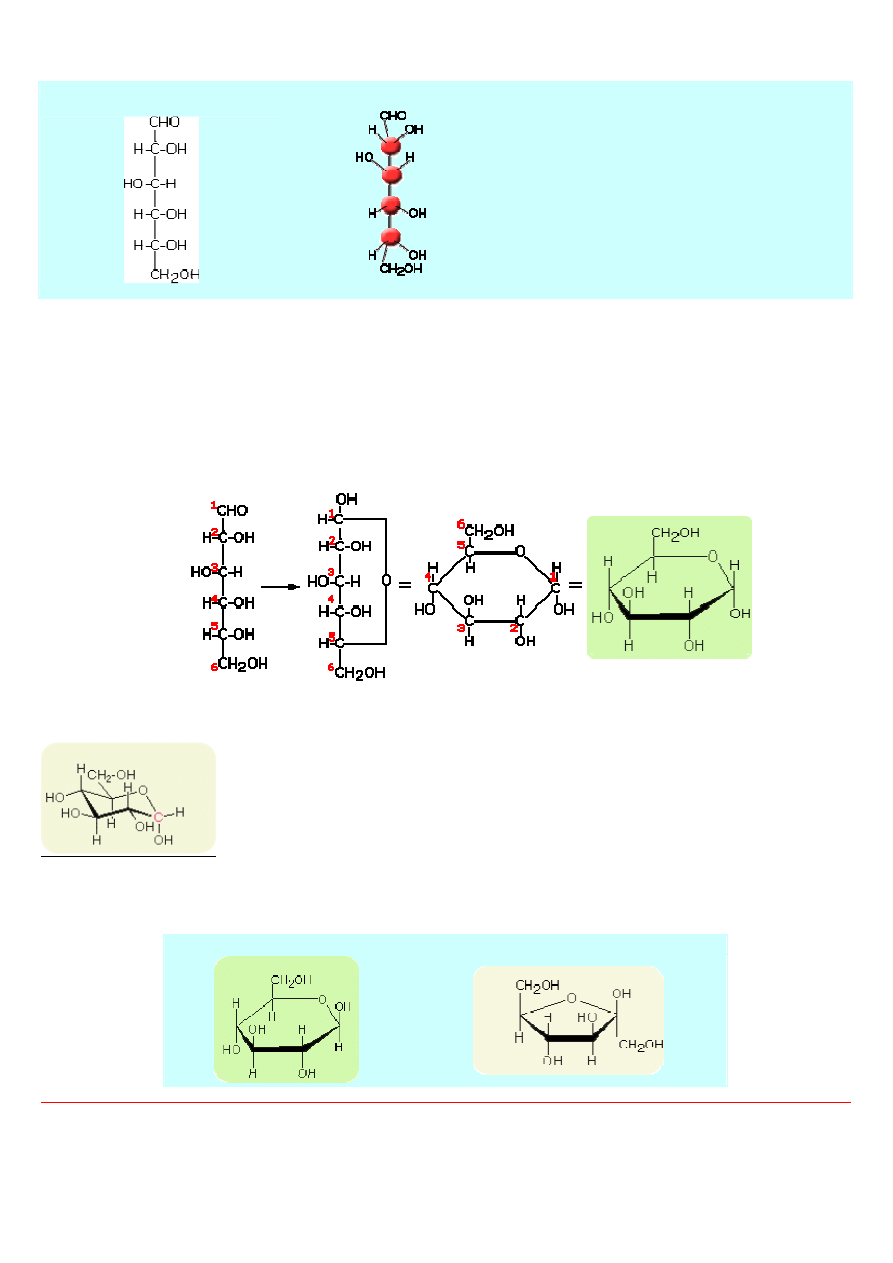
3
sposób, że grupa aldehydowa (lub ketonowa) znajduje się najwyżej. Pozostałe atomy lub grupy atomów zapisujemy po lewej albo po
prawej stronie łańcucha głównego.
Wzór Fischera glukozy
Struktura przestrzenna glukozy
We wzorach tego rodzaju linie poziome oznaczają w
rzeczywistości wiązania "wychodzące" ku nam z
płaszczyzny papieru (ekranu), a linie pionowe -
wiązania "odchodzące" od nas poza płaszczyznę
papieru (ekranu). Wiązania skierowane do tyłu mogą
być przedstawione za pomocą linii przerywanych,
natomiast skierowane do przodu za pomocą strzałek.
Grupa aldehydowa (lub ketonowa) może reagować z grupą hydroksylową związaną z węglem C
4
lub C
5
w cząsteczce monosacharydu.
Wówczas pomiędzy atomem węgla C
1
i najczęściej C
5
w aldoheksosach (lub C
2
i C
5
w ketoheksosach) tworzy się tzw. wiązanie
półacetalowe. Cząsteczka aldoheksozy przyjmuje formę pierścienia sześcioczłonowego, natomiast cząsteczka ketoheksozy - formę
pierścienia pięcioczłonowego.
Monosacharydy tworzą półacetale o budowie pierścieniowej. Półacetale są uprzywilejowaną formš istnienia monosacharydów w
roztworach i jedynš ich formą w stanie krystalicznym. Strukturalne wzory cukrów, określające przestrzenne rozmieszczenie
podstawników, są przedstawiane wzorami Hawortha.
Według Hawortha - glukoza
W perspektywicznie zaznaczonych wzorach Hawortha sześcioczłonowy pierścień przedstawiany jest jako płaski sześciokąt. Nie
odpowiada to jednak rzeczywistości, gdyż w cukrach występuje stale forma krzeselkowa - patrz rysunek niżej
Według wielkości pierścienia, monosacharydy nazywamy furanozami lub piranozami. W tym przypadku przed rdzeniem -furanoza
lub -piranoza umieszcza się przedrostek określający budowę cukru.
Glukopiranoza
Fruktopiranoza
4
Izomeria wsród w
ęglowodanów
Węglowodany posiadają wiele chiralnych atomów wegla, co powoduje, że występują w postaci wielu stereoizomerów. Dlatego do
nazw wprowadza się dodatkowe informacje w postaci przedrostków (α)-, (β)-, D-, L-, znaków (+), (-), które zawierają informacje o
konfiguracji cząsteczki oraz kierunku skręcania płaszczyzny światła spolaryzowanego.
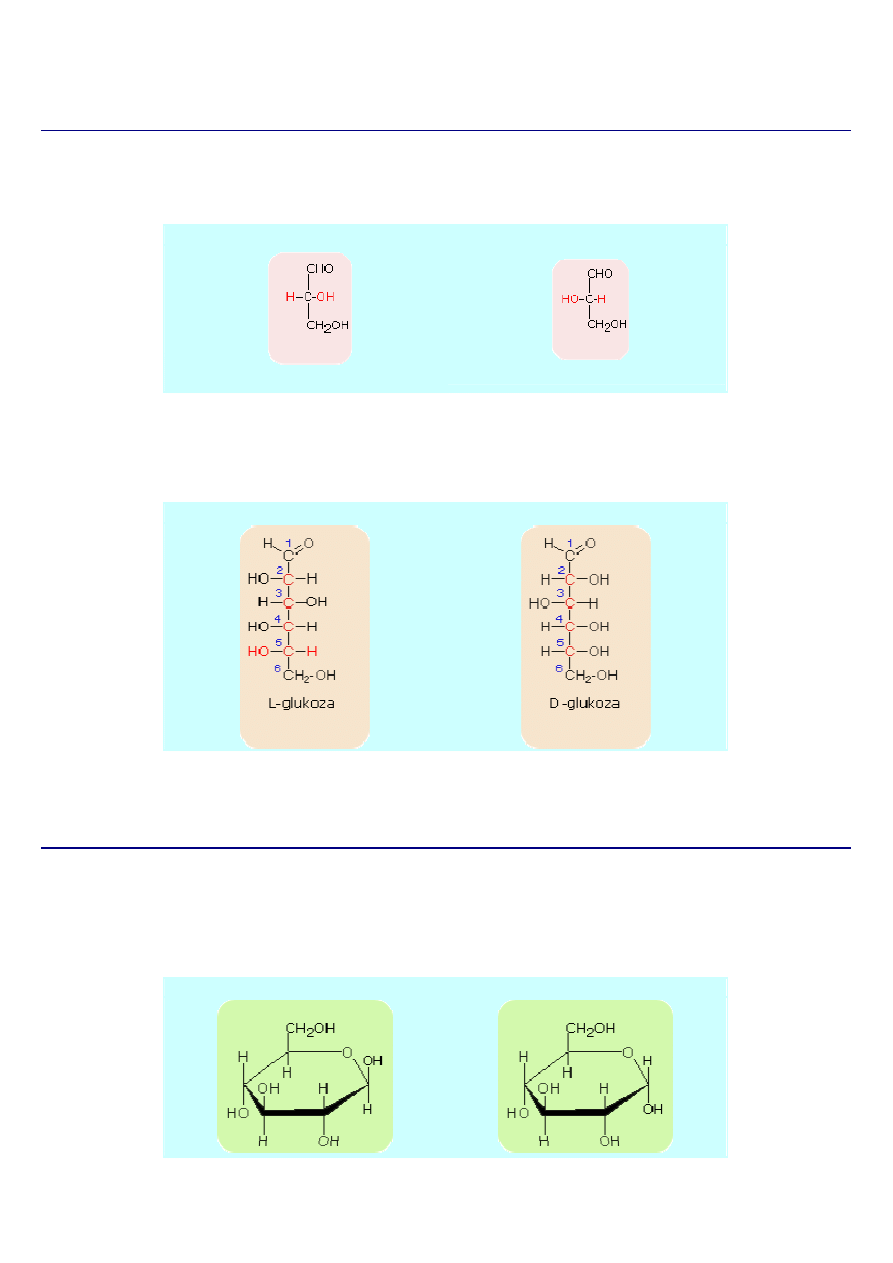
Izomery D- i L-
Punktem odniesienia dla konfoguracji D- i L- jest budowa cząsteczki aldehydu glicerynowego a konkretnie położenie podstawników
H- oraz HO- przy środkowym węglu.
D-aldehyd glicerynowy
L-aldehyd glicerynowy
Jeżeli cząsteczki cukrów prostych swoją budową nawiązuje do D-aldehydu glicerynowego, zaliczane s
ą do szeregu D, natomiast te,
których budowa nawiązuje do L-aldehydu glicerynowego, zaliczane s
ą do szeregu L.
Uporządkowanie na szeregi D i L następuje według konfiguracji podstawników, przy czym bierzemy pod uwagę to centrum
chiralności, które jest najbardziej oddalone od grupy karbonylowej.
L-Glukoza
D-glukoza
Z tego widzimy, że punktem wyjścia dla wyprowadzenia nazwy cukru jest poznanie jego budowy.
Udowodniono że cząsteczki cukrów prostych wykazują formę łańcuchową i pierścieniową, dlatego możemy przedstawiać je różnymi
wzorami chemicznymi, tj. liniowym według Fischera, cyklicznym oraz według Hawortha.
Izomery (
α) i (β)
Przy zamknięciu pierścienia powstaje nowy asymetryczny atom węgla, ponieważ tam, gdzie przedtem wystepowało C=O w
podwójnym wiązaniu, znajdują się teraz cztery różne podstawniki. Wskutek tego możliwe są znowu dwie różne odmiany, które
określa się jako (alfa) i (beta). Przechodzą one łatwo jedna w drugą, prawdopodobnie poprzez formę aldehydową, która jednak w
stanie równowagi występuje w znikomym stężeniu.
α -D(+)-glukoza (glukopiranoza)
β -D(+)-glukoza (glukopiranoza)
5
Izomery (+) i (-)
Znaki (+) i (-) oznaczają kierunek skręcania płaszczyzny światła spolaryzowanego. Związki skręcające płaszczyznę światła w prawo
zaznacza się symbolem (+) przed nazwą związku, skręcające w lewo symbolem
(-). Stąd często nazwy D(+)-glukoza, D(-)-fruktoza, itd.
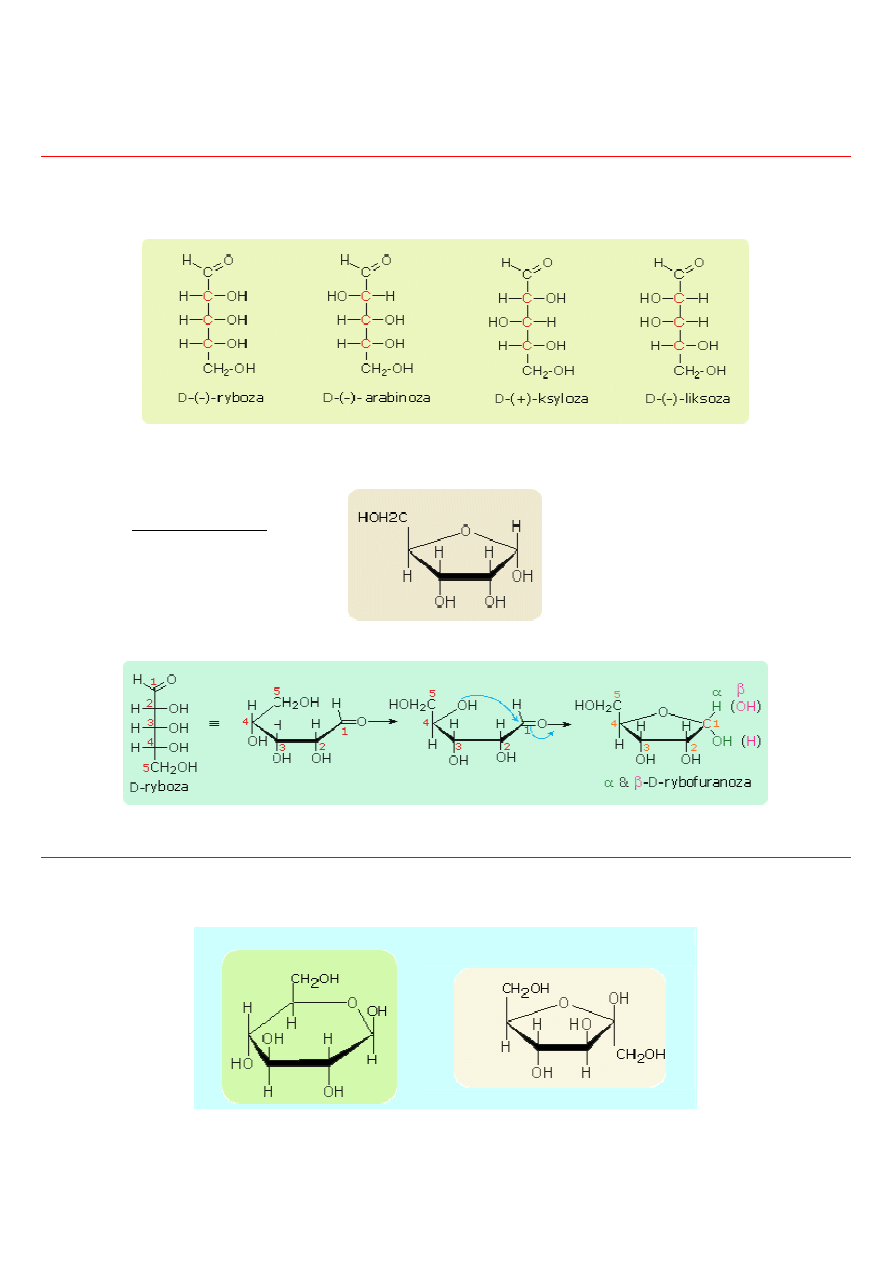
Pentozy
Pentozy C
5
H
10
O
5
Pentozy jako związki chemiczne odgrywają duże znaczenie fizjologiczne. Najważniejsze to:
Z szeregu pentoz najważniejsza jest ryboza, która wchodzi w skład kwasów rybonukleinowych (RNA) i kenzymów nukleotydowych.
Niżej sposób zamykania pierścienia
W kwasach dezoksyrybonukleinowych (DNA) znajduje się ryboza odtleniona (dezoksy) i nie posiadająca tlenu na drugim węglu.
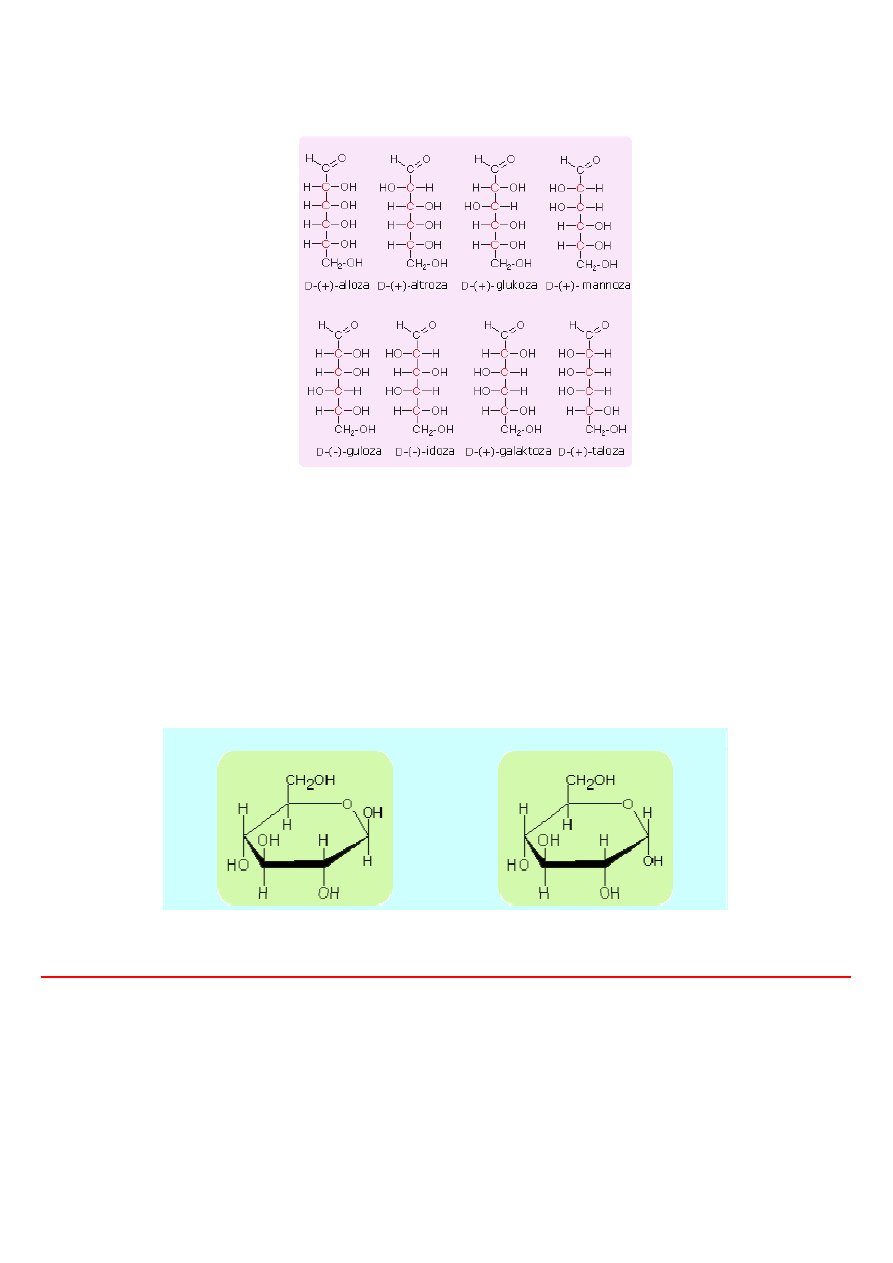
Heksozy
Heksozy C
6
H
12
O
6
. Najbardziej rozpowszechnioną z 16 aldoheksoz jest
D(+)-glukoza (cukier gronowy)
, a z ketoheksoz
D(-)-fruktoza.
D(+)-glukoza (glikopiranoza)
D(-)-fruktoza (fruktopiranoza)
Aldoheksoza należy do grupy cukrów posiadających sześć atomów węgla w cząsteczce, o wzorze sumarycznym C
6
H
12
O
6
, różniących
się jednak strukturalnie, tzn. rozmieszczeniem atomów. Zjawisko to nosi nazwę izomerii.
Wszystkie węgle w cząsteczce cukru, według Fischera, połączone są w łańcuch prosty. Pierwszy węgiel grupy aldehydocukrów, jakim
jest aldoheksoza, tworzy grupę aldehydową -CHO, ostatni, tzn. szósty - grupę alkoholu I-szo rzędowego -CH
2
OH. Pozostałe węgle
ryboza (rybofuranoza)
6
(2,3,4,5) tworzą grupy alkoholowe II-go rzędowe i są zarazem w
ęglami asymetrycznymi.
Obecność w cząsteczce czterech asymetrycznych węgli daje nam zgodnie z regułą N=2
n
, 16 izomerów, gdzie n - liczba
asymetrycznych węgli.
Z tych 16 izomerów aldoheksozy praktycznie znane są obecnie wszystkie. Otrzymano je albo na drodze syntezy laboratoryjnej, albo
przez wydzielenie ze źródeł naturalnych. Stwierdzono, że tylko trzy z tych izomerów: (+)-glukoza, (+)-mannoza i (+)-galaktoza
wyst
ępują w znacznych ilościach.
Wybrane izomery aldoheksoz
Katoheksozy w odróżnieniu od aldoheksoz posiadają 3 asymetryczne atomy węgla. Stąd ilość izomerów w tej grupie cukrów prostych
wynosi 8. Z ketoheksoz najbardziej znanym izomerem jest
D(-)-fruktoza
, która podobnie jak glukoza powszechnie występuje w
owocach a także - w połączeniu z glukozą - w dwucukrze, sacharozie.. Obydwa cukry tj. glukoza i fruktoza występują w świecie
roślinnym obok siebie, przeważnie w słodkich owocach i w miodzie.
D(+)-glukoza jest hemiaacetalem, którego struktura odpowiada strukturze reakcji zachodzącej między grupą aldehydową a grupą
wodorotlenową przy atomie C-5 cząsteczki o otwartym łańcuchu. Ma ona cykliczną strukturę dlatego, że grupa aldehydowa i
alkoholowa są częściami tej samej cząsteczki.
Taka cykliczna struktura ma o jedno centrum chralności więcej niż struktura liniowa, w związku z tym istnieją dwie izomeryczne
odmiany D(+)-glukozy tj.
•
(alfa) α-D(+)-glukoza
•
(beta) β-D(+)-glukoza
rózniącymi się konfiguracją wokół atomu węgla C-1. Takie dwa diastereoizomery nazywają się anomerami
α-D(+)-glukoza
β-D(+)-glukoza
Odmiana α i β łatwo ulegają hydrolizie pod wpływem wody. Każdy z anomerów w roztworze wodnym poprzez formę o otwartym
łańcuchu ulega przekształceniu w mieszaninę pozostającą w stanie równowagi, zawierającą oba izomery o strukturze pierścieniowej.
3. Reakcje cukrów prostych
Cukry proste poddają się następującym reakcjom:
•
reakcji utleniania, gdzie czynnikiem utleniajacym może być odczynnik Fehlinga lub Tollensa, woda bromowa (utlenia aldozy
a nie utlenia ketoz), kwas azotowy, kwas nadjodowy HIO
4
•
tworzenia osazonów (reakcja z fenylohydrazyną i dotyczy tylko aldoz)
•
wydłużania i skracania łańcucha węglowego (dotyczy aldoz)
Odczynnik Fehlinga (roztwór siarczanu(VI)żelaza(II) + roztwr kwasu winowego) to roztwór min. wykorzystywany do wykrywania
substancji o własnościach redukujących a takimi są cukry proste.
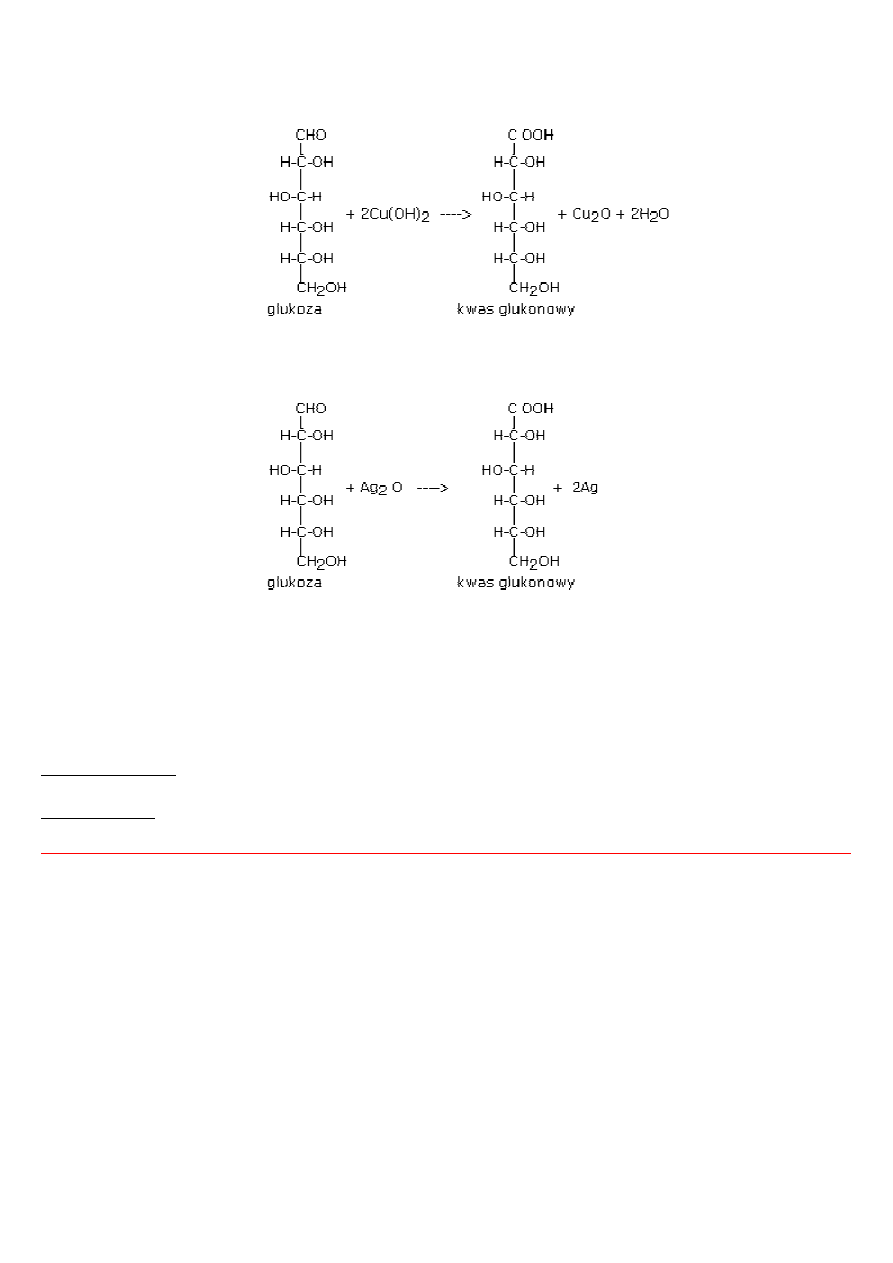
7
Siarczan(VI) miedzi(II) CuSO
4
w środowisku zasadowym (NaOH) tworzy galaretowaty osad Cu(OH)
2
. Ogrzewany Cu(OH)
2
z
roztworem glukozy tworzy czerwonoceglasty osad tlenku miedzi(I) Cu
2
O.
CuSO
4
+ 2NaOH --> Cu(OH)
2
+ Na
2
SO
4
Reakcja z odczynnikiem Tollensa jest nazywana "próbą lustra".W reakcji wydziela się srebro, które tworzy lustrzaną warstwę na
ściankach naczynia (probówki).
Jedną z najwazniejszych przemian, jakiej podlega cukry w organizamch żywych jest glikoliza. Jest to proces przemiany glukozy w
tkankach i komórkach w wyniku czego uwalniana jest energia pokrywająca zapotrzebowanie energetyczne komórek.
Proces glikolizy jest bardzo złożony i bierze w nim udział zespół enzymów , koenzymów i aktywatorów. Schemat glikolizy można
przedstawić następująco:
glukoza --> kwas pirogronowy --> kwas mlekowy
Proces ten może przebiegać w warunkach beztlenowych lub przy dostatecznej ilości tlenu. Sumarycznie procesy te mozemy opisać
równaniami:
Przemiana beztlenowa
C
6
H
12
O
6
--> 2CH
3
CH(OH)COOH + 57kcal
Przemiana tlenowa
C
6
H
12
O
6
+ 6O
2
--> 6CO
2
+ 6H
2
O + 677kcal
Cukry zło
żone
Jeżeli cząsteczki cukrów prostych łączą się ze sobą, tak że jedna cząsteczka cukru prostego łączy się z grupą alkoholową drugiej
cząsteczki cukru, wówczas związki te nazywamy disacharydami (dwucukrami). Gdy więcej cząsteczek cukru łączy się ze sobą,
powstają odpowiednio trójcukrowce, czterocukrowce itd.
Cukry zawierające do ośmiu prostych reszt cukrowych przyjęto nazywać olisacharydami, jeżeli łączy się więcej reszt wówczas
nazywamy je polisacharydami.
Olisacharydy - małocząsteczkowe polisacharydy sa rozpuszczalne w wodzie i zdolne do krystalizacji. Olisacharydy z reguły mają
smak słodki. Podczas hydrolizy rozpadaja się na cząsteczki cukrów prostych. Najważniejszymi olisacharydami są disacharydy
(dwucukrowce), do których zaliczamy;
•
(+)-maltozę
•
(+)-cellobiozę
•
(+)-laktozę
•
(+)-sacharozę
•
(+)-gencjobiozę

8
(+)-Sacharoza
Jest cukrem stołowym otrzymywanym z trzciny cukrowej lub buraków cukrowych. Bardzo słodka, dobrze rozpuszczalna w wodzie i
słabo w etanolu.
Ma wzór sumaryczny C
12
H
22
O
11
a strukturalny następujący
Nie redukuje ona odczynnika Tollensa ani Fehlinga, co wskazuje, że nie posiada własności redukujących (nie zawiera "wolnej" grupy
aldehydowej ani ketonowej).
W wyniku hydrolizy (+)-sacharozy pod wpływem rozcieńczonego, wodnego roztworu kwasu lub enzymu inwertazy powstają równe
ilości D-(+)-glukozy i D-(-)-fruktozy.
C
12
H
22
O
12
+ H
2
O --> C
6
H
12
O
6
(D-glukoza) + C
6
H
12
O
6
(D-fruktoza)
Hydrolizie towarzyszy zmiana znaku skręcalności z dodatniego na ujemny i dlatego proces ten nazywa się często inwersj
ą (+)-
sacharozy a otrzymana lewoskretna mieszanina cukrów nosi nazwę cukru inwertowanego. Z cukrem inwertowanym możemy
spotkac się w miodzie, gdzie inwertazy dostarczają pszczoły.
Polisacharydy - są to wielocukrowce, które nie mają smaku słodkiego, podczas hydrolizy rozpadaja się na kilka cząsteczek
olisacharydów, a te z kolei rozpadają się na cząsteczki cukrów prostych. Do polisacharydów zaliczamy:
•
skrobię
•
glikogen
•
celulozę (błonnik)
Polisacharydy
Powstają one w roślinach z dwutlenku węgla i wody w procesie fotosyntezy. Celuloza jak i skrobia zbudowane są z jednostek D-(+)-
glukozowych.
Skrobia nie jest jednorodna z punktu widzenia chemicznego. Składa się ona z substancji wielkocząsteczkowych amylozy (20%) i
amylopektyny (80%). Zarówno amyloza jak i amylopektyna składają się z jednostek D-(+)-glukozowych, lecz oba różnią się
wielkością i kształtem cząsteczek.
Celuloza jest głónym składnikiem drewna i włókien roślinnych; na przykład bawełna jest prawie czystą celulozą. Nie rozpuszcza się
w wodzie i nie ma smaku oraz nie posiada własności redukujących.
Glikogen nazywany jest cukrem mięśniowym. Jest magazynowany przez organizmy żywe i uwalniany w miarę zapotrzebowania
metabolicznego. Ma strukturę podobną do struktury amylopektyne, z tą różnicą, że jego cząsteczki są znacznie bardziej rozgałęzione i
zawierają krótsze łańcuchy (12-18 jednostek D-glukozowych).
9
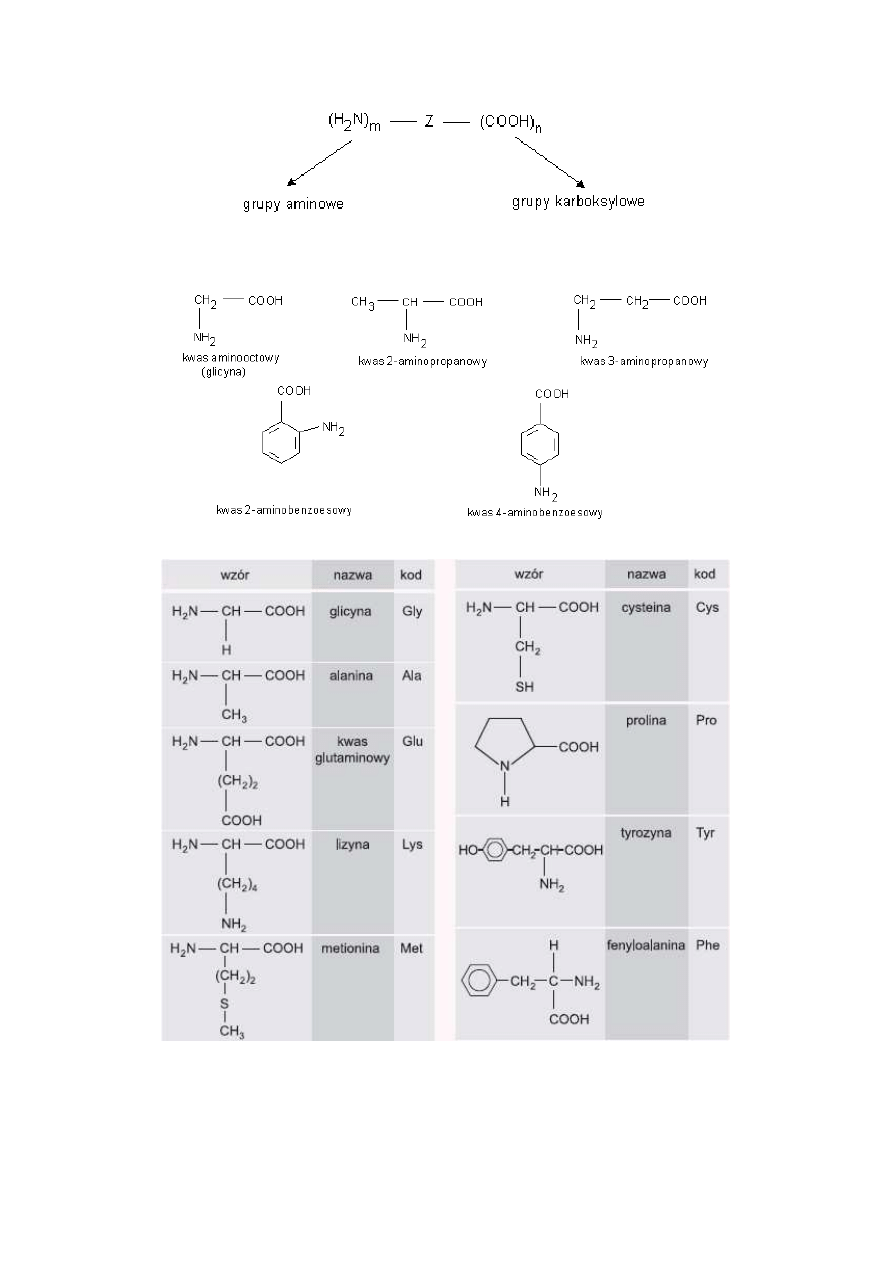
Aminokwasy
Aminokwasy- związki dwufunkcyjne zawierające w swych cząsteczkach grupy karboksylowe i aminowe.
przykłady:
Właściwości fizyczne aminokwasów:
-są związkami krystalicznymi
-rozpuszczają się w rozpuszczalnikach polarnych (woda, alkohol etylowy), nie rozp. się w rozpuszczalnikach niepolarnych (benzen,
eter, heksan)
-mają wysokie temp topnienia
10
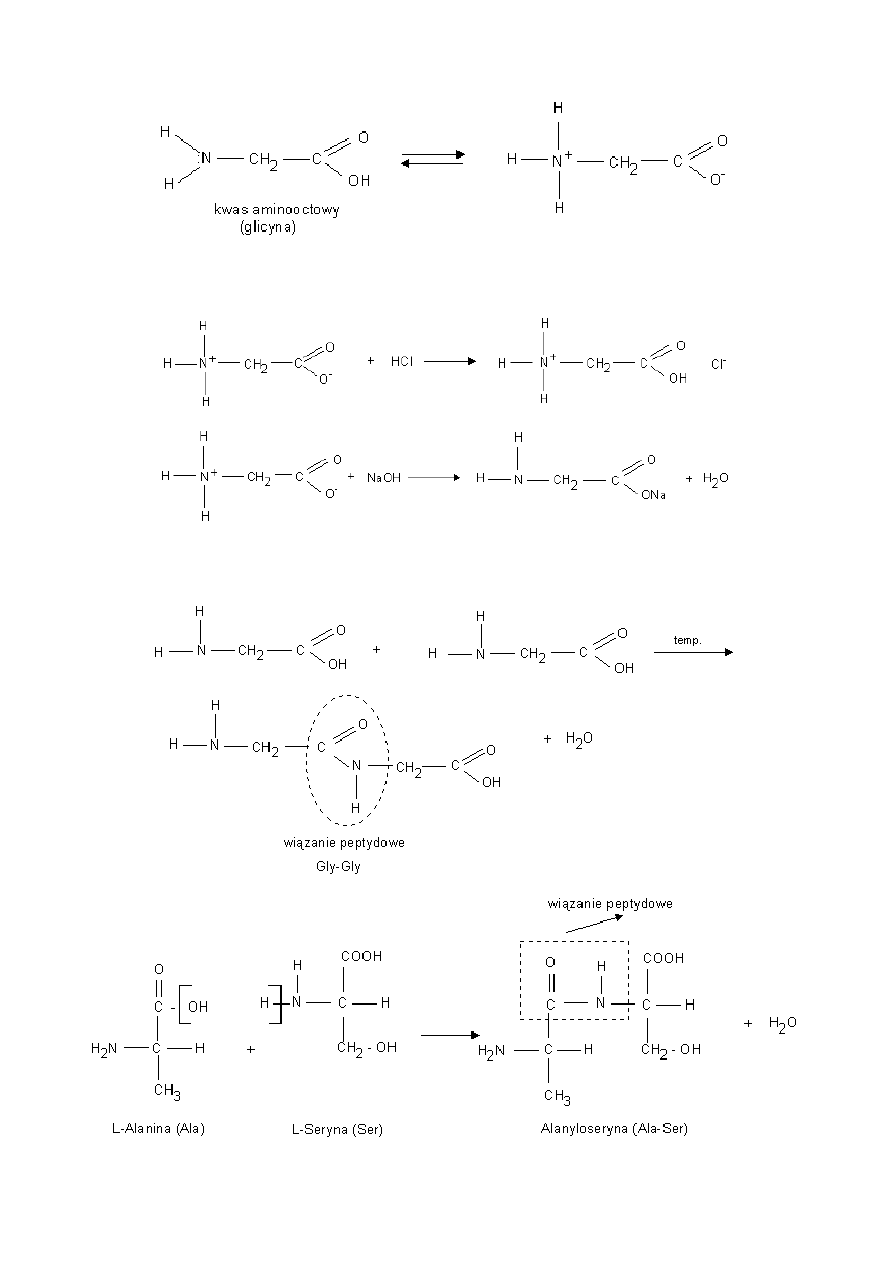
Właściwości chemiczne glicyny:
Roztwór wodny glicyny jest obojętny ponieważ obecne w cząsteczce grupy: karboksylowa i aminowa ulegają wewnętrznemu
zobojętnieniu. Tworzy się sól wewnętrzna w rezultacie przeniesienia jonu H+ od grupy karboksylowej do aminowej.
a) Sól taka może reagować zarówno z kwasami jak i z zasadami.
b) Reakcja kondensacji - zachodzi pomiędzy grupą aminową i karboksylową dwóch aminokwasów.
11
Powstały produkt nadal ma grupę aminową i karboksylową i może reagować dalej w reakcji kondensacji. Związki powstałe w wyniku
kondensacji aminokwasów noszą nazwę peptydów.
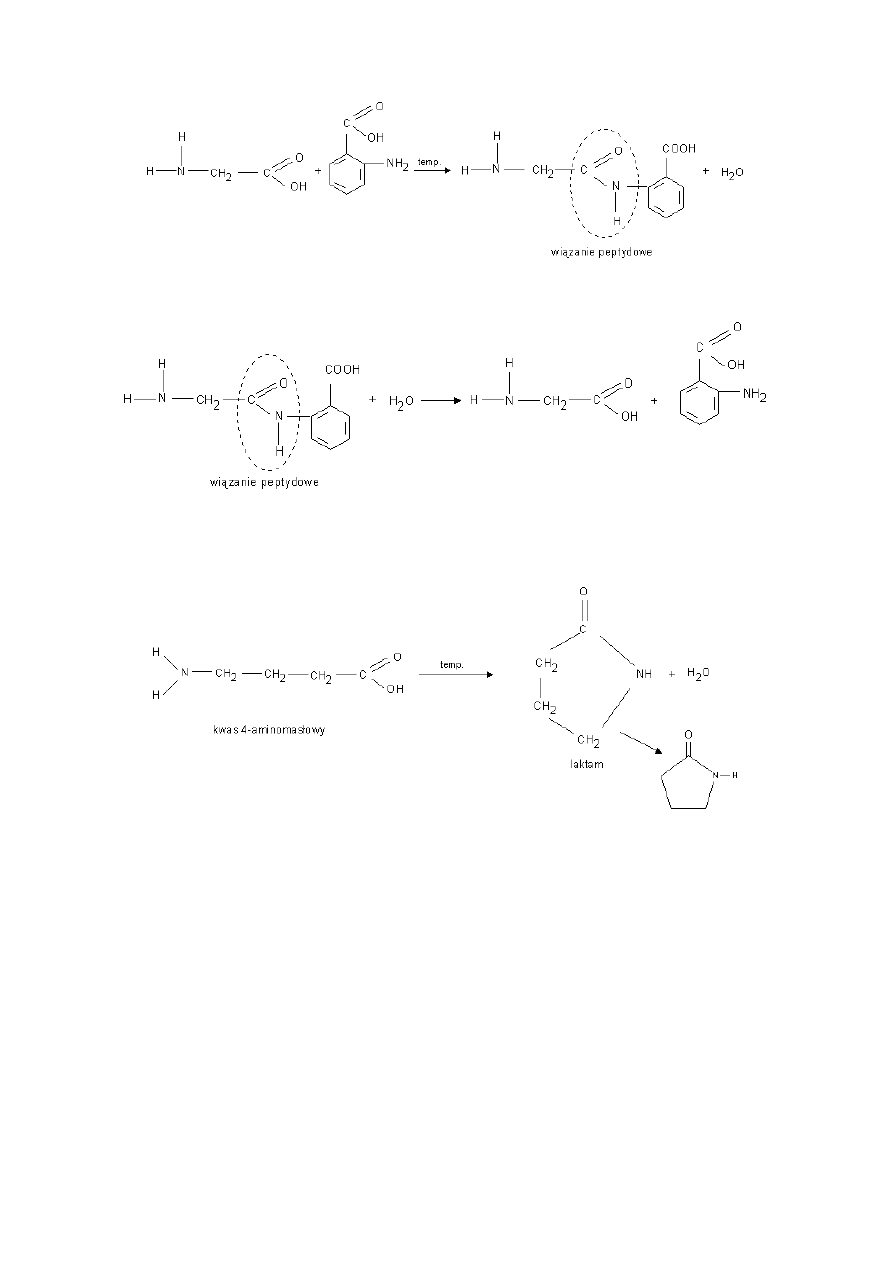
Przykłady innych reakcji kondensacji:
Reakcją odwrotną do redakcji kondensacji jest reakcja hydrolizy.
Za pomocą tej reakcji można ustalić, z jakich aminokwasów składał się peptyd.
c) Reakcja kondensacji - zachodząca pomiędzy grupą aminową i karboksylową tego samego aminokwasu. - wewnątrzcząsteczkowa
reakcja kondensacji.
Pierścienie laktamowe są elementami składowymi penicyliny.
Punkt izoelektryczny (pI) - takie pH środowiska, przy którym cząsteczka aminokwasu w danych warunkach jest obojętna. W punkcie
izoelektrycznym cząsteczka nie ma wędrowania w polu elektrycznym.
Punkt izojonowy - taka wartość pH, przy której liczba protonów związanych z grupami -NH2 jest równa liczbie protonów
odszczepionych przez grupy -COOH. W tym punkcie przeciętny ładunek jest równy zeru. Punkt ten ma wartość stałą i
charakterystyczną dla danego aminokwasu lub białka.
Natomiast punkt izoelektryczny ulega zmianie, bo zależy od środowiska.
W roztworze o Ph większym od punktu izoelektrycznego cząsteczka występuje w postaci anionu, a poniżej pI - w formie kationu. W
punkcie izoelektrycznym jest najsłabiej rozpuszczalna, czyli najłatwiej ją strącić.
Podział aminokwasów:
a) ze względu na ilość grup karboksylowych i aminowych:
obojętne (1 grupa -NH2 1 grupa -COOH)
kwaśne (1 grupa -NH2 2 grupy -COOH)
zasadowe (2 grupy -NH2 1 grupa -COOH)
obojętne z układem cyklicznym
b) ze względu na polarność grup R w sąsiedztwie węgla a.
Wyszukiwarka
Podobne podstrony:
3 ch org zwiazki funkcyjne
3 ch org związki funkcyjne
3 ch org zwiazki funkcyjne
nagrywanie plyt cd i dvd leksyk Nieznany
zcho ch org errata
IX tydzien Zwiazki z kobietami Nieznany
NOP CD (FRANCJA, SZWAJCARIA) i Nieznany
forma rzadu cd id 179477 Nieznany
3 podstawowe operacje cd id 339 Nieznany (2)
W4 ch org 2011 12
Amfotery i Zwiazki Amfoteryczne Nieznany (2)
Jakosc i trwalosc zwiazkow part Nieznany
1 Bazy danych zwiazki normaliza Nieznany
3 Funkcje cd, ciagi, logarytm, Nieznany (2)
3 Formy org prawne wyklad cz3 i Nieznany
zestaw 6 dynamika cd id 588136 Nieznany
więcej podobnych podstron