ĆWICZENIE NR 3
ANALIZA ELEKTROGRAWIMETRYCZNA
Celem ćwiczenia jest zapoznanie się z zastosowaniem metody elektrograwimetrycznej do
ilościowego oznaczania miedzi (analitu) wydzielonej w procesie elektrolizy na platynowej
katodzie i wagowe oznaczenie masy metalu na podstawie przyrostu masy elektrody.
Elektrolizę wyczerpującą roztworu elektrolitu prowadzi się z wykorzystaniem
elektrolizera, którego schemat przedstawia rysunek 1.
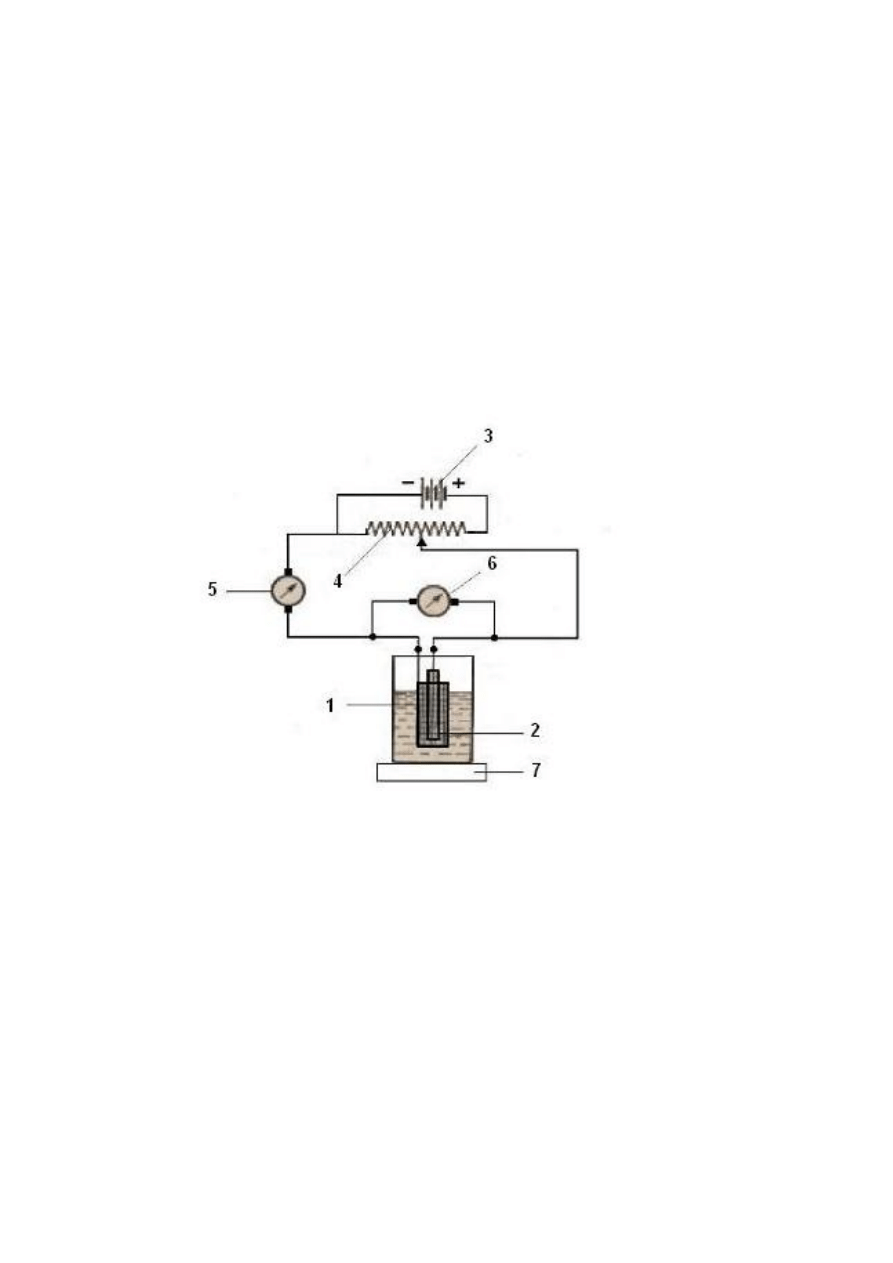
Rys. 1. Schemat obwodu elektrycznego elektrolizera: 1 i 2 - siatkowe elektrody platynowe
(Winklera), 3 – źródło prądu stałego, 4 – opornik suwakowy (potencjometr), 5 -
amperomierz, 6 – woltomierz, 7 – naczynie z mieszadłem elektromagnetycznym najczęściej
z regulacją ogrzewania
Uwaga!
Przed przystąpieniem do pomiarów należy zapoznać się z instrukcją obsługi
elektrolizera laboratoryjnego (EP6 – 1) i przygotować urządzenie do pracy.

2
WYKONANIE OZNACZENIA
1. Do kolby miarowej o pojemności 100 ml przenieść ilościowo otrzymaną do analizy
próbkę miedzi, dodać ok. 2 ml stężonego kwasu siarkowego i 1 – 2 g azotanu
amonowego, roztwór wymieszać i uzupełnić wodą destylowaną do kreski. Do
oznaczenia pobrać pipetą 20 ml roztworu i przenieść go do zlewki w której
prowadzona będzie elektroliza, dodać ok. 100 ml wody destylowanej i włożyć czyste
mieszadło.
2. Platynowe elektrody zanurzyć do stężonego roztworu kwasu azotowego (ok. 1
minuty), dokładnie opłukać, a następnie ponownie zanurzyć do roztworu etanolu.
Elektrody wysuszyć w suszarce.
3. Przygotować i uruchomić elektrolizer zgodnie z instrukcją obsługi. Wprowadzić
elektrody do badanego roztworu. W czasie pomiaru elektrolit należy intensywnie
mieszać. Ustawić parametry elektrolizy zgodnie z p. 7a (Instrukcja obsługi
elektrolizera). Pomiar prowadzić przy stałym natężeniu prądu w granicach od 0,8 do
1 A (napięcie nie powinno przekraczać wartości ok. 4 V). Po upływie 10 – 15 minut
roztwór ulega odbarwieniu w wyniku osadzenia się miedzi na katodzie.
4. Przed zakończeniem pomiaru należy sprawdzić czy miedź całkowicie wydzieliła się
z badanego roztworu. W tym celu pobrać kroplę (nie więcej) roztworu i przenieść ją
na szkiełko zegarkowe, a następnie dodać dwie krople sześciocyjanożelazianu (II)
potasowego, K
4
[Fe(CN)
6
]. Jeżeli pojawi się osad o zabarwieniu różowo-brunatnym
elektrolizę należy prowadzić jeszcze przez około 5 minut, po czym ponownie
sprawdzić obecność jonów miedzi w roztworze.
5. Po doprowadzeniu elektrolizy do końca przerwać elektrolizę (podnieść elektrody).
Pokrętła prądu i potencjału ustawić w pozycji zero (przekręcić je w lewo do oporu)
i wyłączyć
elektrolizer. Elektrody dokładnie opłukać wodą destylowaną
i wymontować je z głowicy elektrolizera.
6. Katodę (z osadzoną miedzią) opłukać w roztworze etanolu i osuszyć w suszarce,
ostudzić, a następnie zważyć na wadze analitycznej (z dokładnością do 0,0001 g).
7. Osadzoną miedź dokładnie usunąć z powierzchni katody, rozpuszczając ją
w stężonym kwasie azotowym. Elektrodę dokładnie wymyć wodą destylowaną,
a następnie opłukać w etanolu, osuszyć w suszarce i ponownie zważyć. Zapisać
wyniki pomiarów.
8. Oznaczenie masy miedzi wykonać trzy razy.

3
OPRACOWANIE WYNIKÓW
1. Napisać reakcje elektrodowe (anodowa i katodowa) przebiegające w trakcie
elektrolizy badanego roztworu.
2. Wyznaczyć masę miedzi otrzymaną do analizy na podstawie wyników ważenia.
Wynik podać w mg jako masę średnią wykonanych pomiarów.
ZAGADNIENIA
1. Zjawisko elektrolizy. Procesy elektrodowe, przykłady równań reakcji elektrolizy.
2. Napięcie rozkładowe. Potencjał wydzielania. Omowy spadek potencjału. Pojęcie
nadnapięcia przyczyny jego występowania i metody ograniczania.
3. Polaryzacja stężeniowa i kinetyczna. Prąd równowagi.
4. Ilościowe ujęcie procesu elektrolizy, prawa Faradaya.
5. Elektroliza bez kontroli potencjału i z kontrolowanym potencjałem katody. Pojęcie
i zastosowanie buforów potencjału.
6. Obwód elektryczny elektrolizera i naczyńka elektrolityczne.
7. Elektroliza na katodzie rtęciowej.
8. Elektroliza wewnętrzna.
9. Czynniki wpływające na strukturę osadu na elektrodzie.
10. Zastosowanie metod elektrograwimetrycznych.
4
INSTRUKCJA OBSŁUGI ELEKTROLIZERA LABORATORYJNEGO
EP6 – 1
Na rysunku 2 przedstawiono elektrolizer z płytą czołową urządzenia.
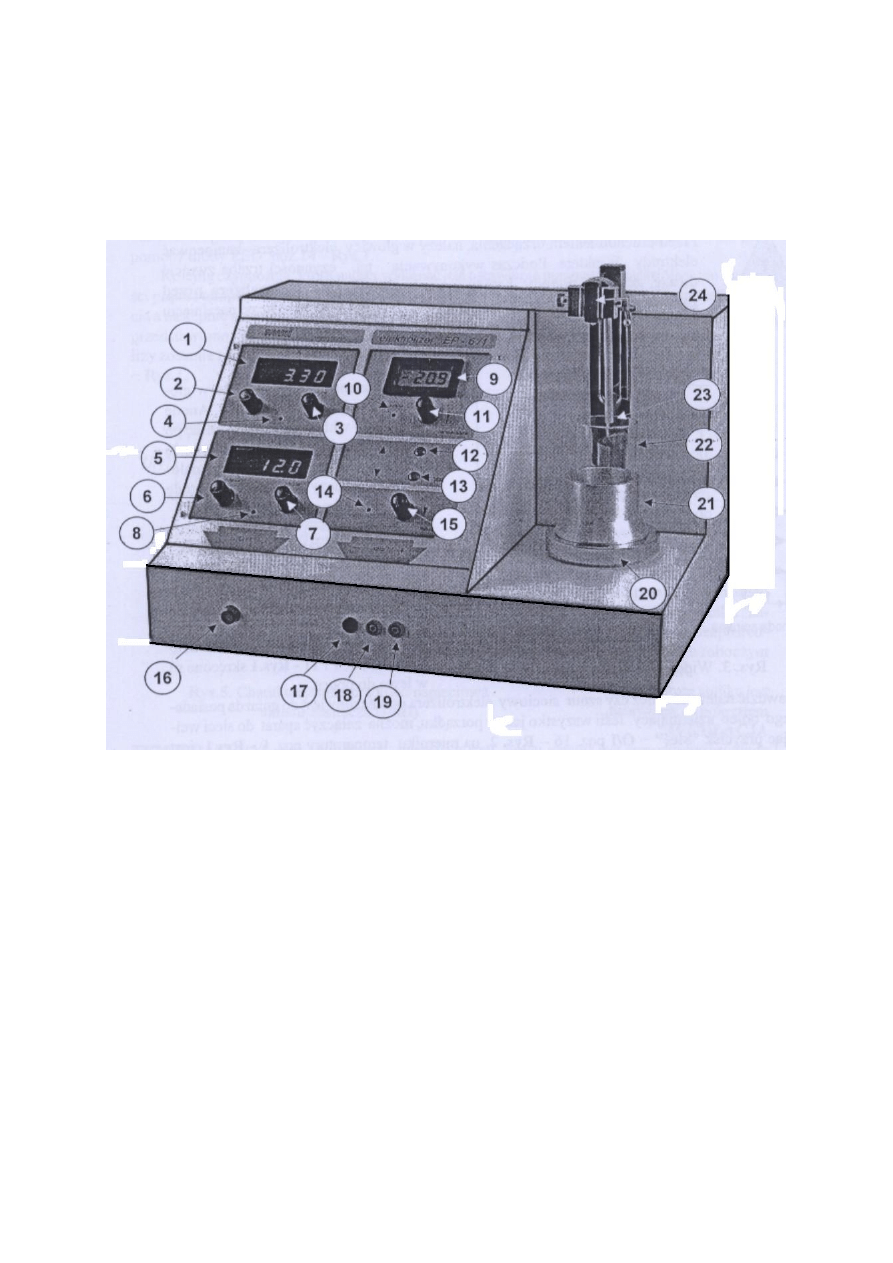
Rys. 2. Elektrolizer EP6 – 1 oraz płyta czołowa: 1 oznacza miernik prądu, 2 – zgrubna, 3
– dokładna regulacja natężenia prądu, 4 – wskaźnik stabilności prądu, 5 – miernik
napięcia, 6 – zgrubna, 7 – dokładna regulacja napięcia, 8 – wskaźnik stabilności napięcia,
9 – miernik temperatury, 10 – wskaźnik (dwukolorowy) grzanie/studzenie, 11 – regulacja
temperatury stolika, 12 i 13 – przyciski służące do przesuwania głowicy z elektrodami
odpowiednio do góry lub w dół, 14 – wskaźnik mieszania, 15 – regulacja szybkości
mieszania, 16 – włącznik sieciowy, 17 – dodatkowy zacisk (-), 18 – zacisk GND
(połączony z bolcem uziemiającym), 19 – dodatkowy zacisk (+), 20 – podgrzewany stolik
z mieszadłem magnetycznym, 21 – tuleja metalowa, 22 – zlewka (poj. 150 ml), 23 –
czujnik temperatury, 24 – głowica elektrolizera
5
Uwaga!
Nie włączać elektrolizera przed zamontowaniem elektrod. Sprawdzić czy pokrętła
regulacji napięcia, natężenia prądu, temperatury i mieszania ustawione są w pozycji
zero, w przeciwnym razie przekręcić je w lewo do oporu.
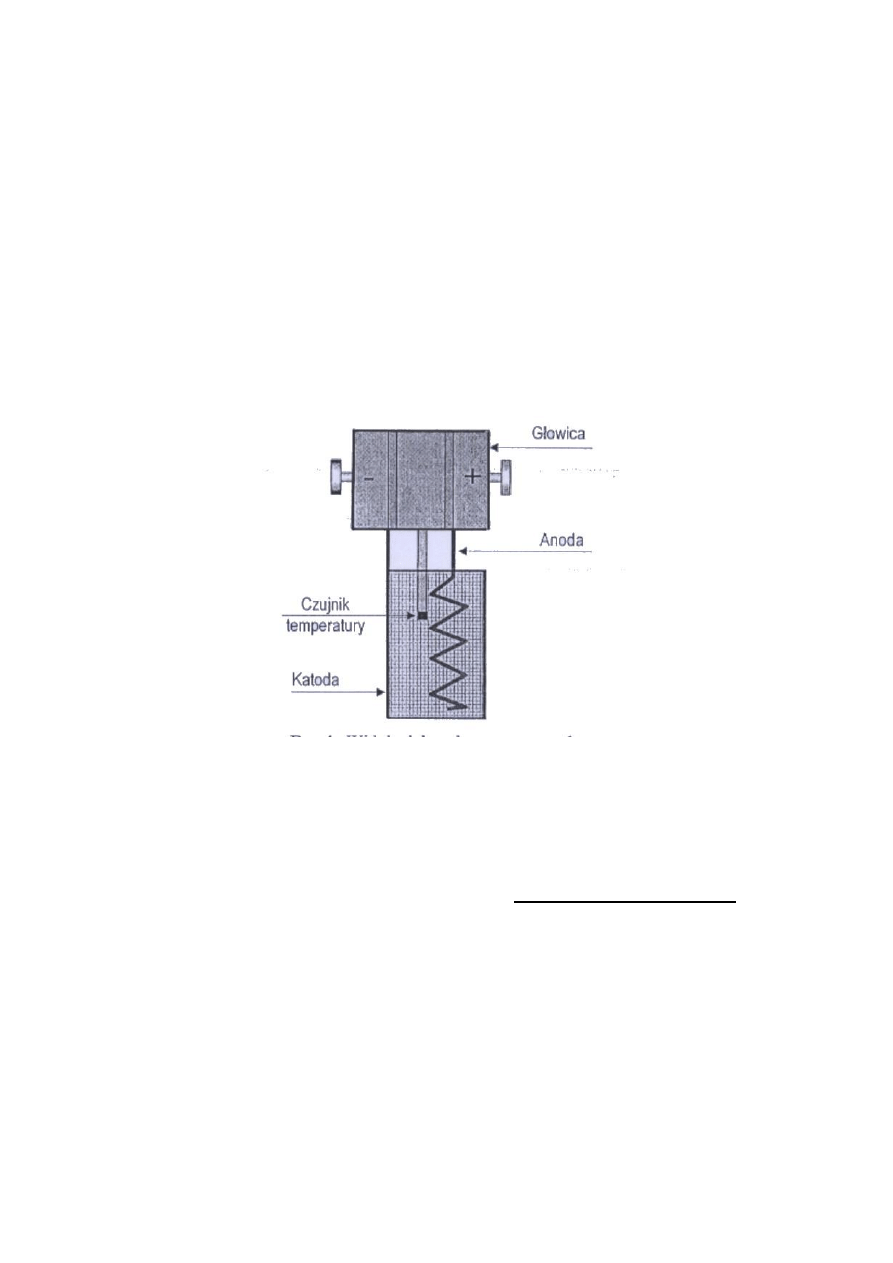
1. Zamocować elektrody Winklera w głowicy elektrolizera 24 wg rysunku 3. Anodę
mocuje się wkładając ją w szczelinę po prawej stronie głowicy i zaciskając ją śrubą
dociskową. Analogicznie należy zamocować katodę z tym, że po lewej stronie
głowicy.
Rys. 3. Głowica elektrolizera z zamontowanymi elektrodami
Zwrócić uwagę, aby nie pomylić miejscami katody i anody. Zamocowane elektrody
muszą być ustawione centrycznie względem siebie i nie mogą się ze sobą zwierać.
2. Włączyć elektrolizer wciskając przycisk 16.
3. Ustawić głowicę 24 w skrajnym górnym położeniu przytrzymując przycisk 12.
4. Na stolik elektrolizera umieścić centralnie zlewkę (150 ml) z badanym roztworem, na
dnie zlewki musi się znajdować mieszadło magnetyczne.
5. Ostrożnie opuścić głowicę (przycisk 13) tak aby elektrody były zanurzone
w roztworze i mieszadło mogło się swobodnie obracać, zapewniając równomierne
mieszanie elektrolitu. Za pomocą pokrętła 15 włączyć mieszanie co sygnalizuje
równomierne świecenie lampki kontrolnej 14.

6
6. W przypadku ogrzewania roztworu należy, za pomocą pokrętła 11 ustawić
odpowiednią temperaturę ogrzewania elektrolitu, która jest stabilizowana poprzez
dwupołożeniowy regulator temperatury. Temperatura roztworu jest podawana na
wyświetlaczu 9. W celu przyśpieszenia ogrzewania (powyżej 40
0
C) należy na zlewkę
nałożyć metalowy pierścień 21.
7. W zależności od sposobu prowadzenia pomiaru, ustawić parametry elektrolizy:
(a) Ze stabilizacją prądu. Potencjometr 6 (napięcie) ustawić w prawym skrajnym
położeniu, następnie ustawić pokrętłem 2 (prąd) żądaną wartość natężenia
prądu, w tym stanie powinna się palić lampka kontrolna 4. Dokładną wartość
natężenia prądu nastawia się przy pomocy pokrętła 3.
(b) Ze stabilizacją napięcia. Potencjometr 2 (prąd) przekręcić maksymalnie
w prawo. Odpowiednią wartość napięcia na elektrodach ustawić pokrętłem 6
(napięcie). Wówczas powinna się palić lampka kontrolna 8. Dokładną wartość
napięcia można ustawić wykorzystując pokrętło 7.
8. Po zakończeniu pomiaru pokrętła prądu i napięcia przekręcić w lewo (na miernikach
powinna się pojawić wartość zero) wyłączyć mieszanie (i ogrzewanie) roztworu
podnieść głowicę z elektrodami, wyłączyć elektrolizer, odstawić zlewkę z roztworem
opłukać i wymontować elektrody.
LITERATURA
1. Douglas A. Skoog i inni, Podstawy chemii analitycznej, tom 2, PWN, Warszawa
2007.
2. W. Szczepaniak, Metody instrumentalne w analizie chemicznej, PWN, Warszawa
2007.
3. J. Minczewski, Z.Marczenko, Chemia analityczna, t. III, PWN, Warszawa 2001.
4. Laboratorium analizy instrumentalnej, red. Z. Brzóska, Wyd. OW PW, Warszawa
1998.
5. A. Cygański, Metody elektroanalityczne, WNT, Warszawa 1995.
6. J. Garaj i inni, Fizyczne i fizykochemiczne metody analizy, WNT, Warszawa 1981.
7. J. Koryta i inni, Elektrochemia, PWN, Warszawa 1980.
8. Galen W. Ewing, Metody instrumentalne w analizie chemicznej, PWN, Warszawa
1980.

7
9. E. Szyszko, Instrumentalne metody analityczne, PZWL, Warszawa 1980.
10. T. H. Gouw, Nowoczesne metody instrumentalne analizy, WNT, Warszawa 1976.
11. J. J. Lingane, Elektroanaliza chemiczna, PWN, Warszawa 1975.
Wyszukiwarka
Podobne podstrony:
Analiza Instrumentalna Wirująca elektroda dyskowa tabelki
Analiza Instrumentalna Analiza elektrograwimetryczna Sprawozdanie 3 kam
Analiza Instrumentalna Wirujaca elektroda dyskowa 5 W (2)
Analiza Instrumentalna Wirująca elektroda dyskowa Wykres 1
Analiza Instrumentalna Wirująca elektroda dyskowa Wykres 2
Analiza Instrumentalna Wirująca elektroda dyskowa Wykres 3
sprawozdanie analiza elektrograwimetryczna
sprawozdanie analiza elektrograwimetryczna
cwiczenie nr 6 analiza elektromechaniczna mems pop
Wynik analizy elektroforetycznej oczyszczonych preparatow zlinearyzowanego i defosforylowanego wekto
Instr. kontr.urz.gaszącego, Instrukcje w wersji elektronicznej
Instr. wciNgarek hydr.- Nocek, Instrukcje w wersji elektronicznej
Instr.spawarki, Instrukcje w wersji elektronicznej
Instrukcja AZ, Instrukcje w wersji elektronicznej
Instrukca obsl ELECTRA(Piłat-korekta 26 09), Instrukcje w wersji elektronicznej
intrukcja obsługi pomp S i OS, Instrukcje w wersji elektronicznej
instrukcja obsługi elektrycznej maszynki do strzyżenia włosów Philips QC 5053, QC 5050, QC 5010 po p
więcej podobnych podstron