1
Chemia Jądrowa
JMSS - PX2512
1
Marek Sikorski
Chemia Jądrowa
Marek Sikorski
2
Terminy wyk
ładów
wtorek 8.00 – 9.30
prof. UAM dr hab.
Marek Sikorski
Termin konsultacji
czwartek 10.30 – 12.00
3
Pracownia Fotochemii Stosowanej
pok. 212
tel. 61 829 1309
e-mail.
Sikorski@amu.edu.pl
Izotopy, Izotony, Izobary,
Izomery
Charakterystyka:
N
X
A
Z
Z liczba atomowa = liczba elektronów (lub protonów)
A liczba masowa = liczba neutronów + protonów
X
A
Z
X
A
JMSS - PX2512
4
Liczba neutronów = A-Z
Liczba protonów = Z
Izotopy – ta sama liczba atomowa, ró
żna liczba masowa
Izotony – ta sama liczba neutronów, ró
żna liczba protonów
Izobary – ta sama masa, ró
żna liczba protonów i neutronów
Izomery – j
ądra atomowe w stanie wabudzonym, (z tau>1 ns)
Marek Sikorski
Izotopy, Izotony, Izobary, Izomery
X
A
Z
Z liczba atomowa = liczba elektronów (lub protonów)
A liczba masowa = liczba neutronów + protonów
m
C
60
JMSS - PX2512
5
Liczba neutronów = A-Z
Liczba protonów = Z
C
14
N
14
Marek Sikorski
C
12
N
13
Izotopy, Izotony, Izobary, Izomery
m
C
60
C
14
N
14
C
12
N
13
Izomer
Izotopy C
Izotopy N
JMSS - PX2512
6
Marek Sikorski
C
14
N
14
C
12
N
13
Izobary (A=14)
Izotony (N=6)
X
A
Z
Z liczba atomowa = liczba elektronów (lub protonów)
A liczba masowa = liczba neutronów + protonów
Liczba neutronów = A-Z
Liczba protonów = Z
2
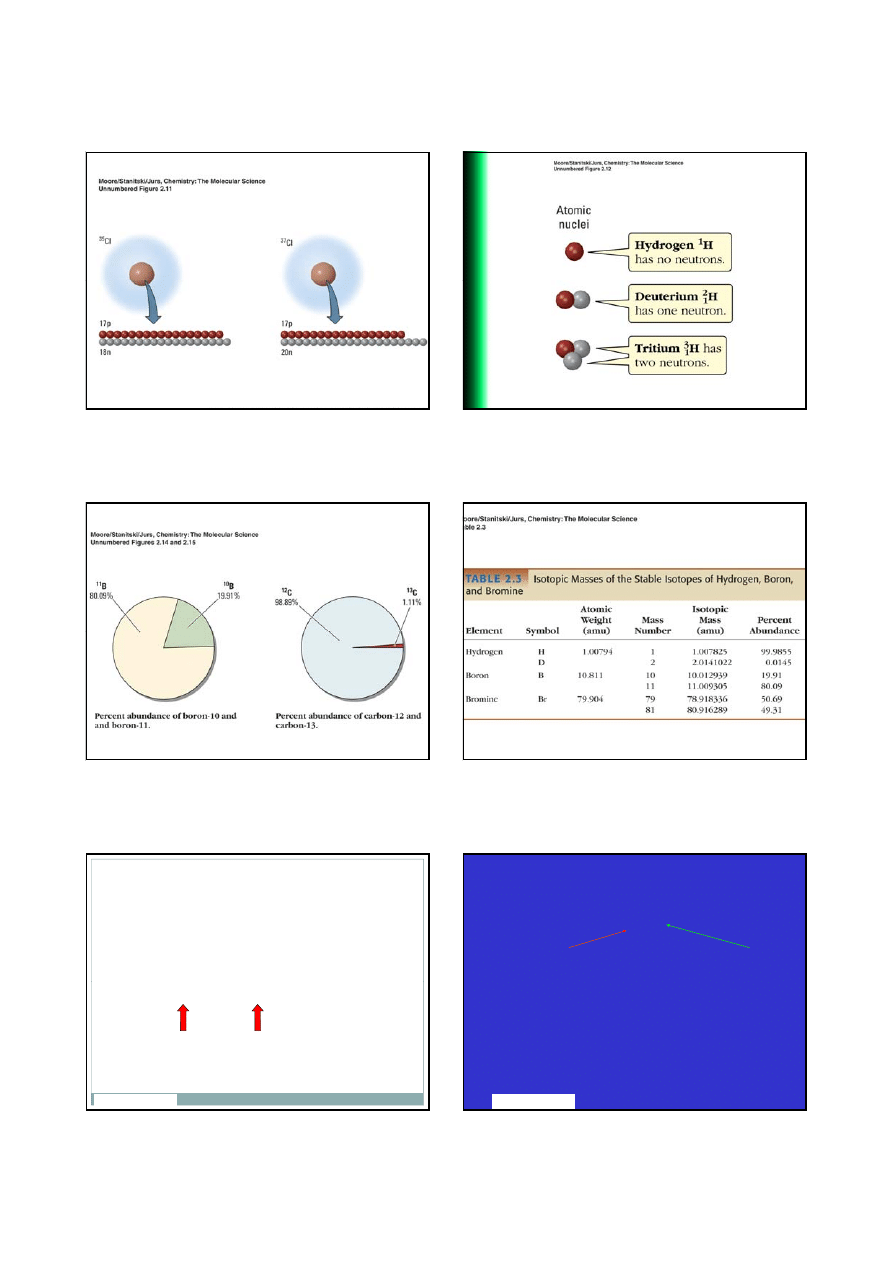
Izotopy Chloru
JMSS - PX2512
7
Izotopy Wodoru
JMSS - PX2512
8
Marek Sikorski
Izotopy a masa atomów
wyst
ępujących naturalnie
JMSS - PX2512
9
JMSS - PX2512
10
Nuklidy i Izotopy
Masa atomowa pierwiastka
jest
średnią mas atomowych i
ilo
ści każdego z naturalnie-występujących izotopów.
N.p. Masa atomowa w
ęgla wynosi 12.01,
co pochodzi z (12 0000x98 89 + 13 00335x1 11)/100
JMSS - PX2512
11
co pochodzi z (12.0000x98.89 + 13.00335x1.11)/100
12
6
C
13
6
C
Masa j
ądra
wzi
ęta z tablic
Masa j
ądra
wyra
żona jest w
skali a.j.m.
(a.m.u).
Marek Sikorski
Masa Ni i O
A =
Z
+
N
Liczba
protonów
Liczba
neutronów
Izotopy mają różną masę ale chemicznie są
JMSS - PX2512
12
identyczne
58
Ni 68.27
16
O
99.762
60
Ni 26.1
17
O
0.038
61
Ni
1.13
18
O
0.2
62
Ni
3.59
64
Ni
0.91
Marek Sikorski
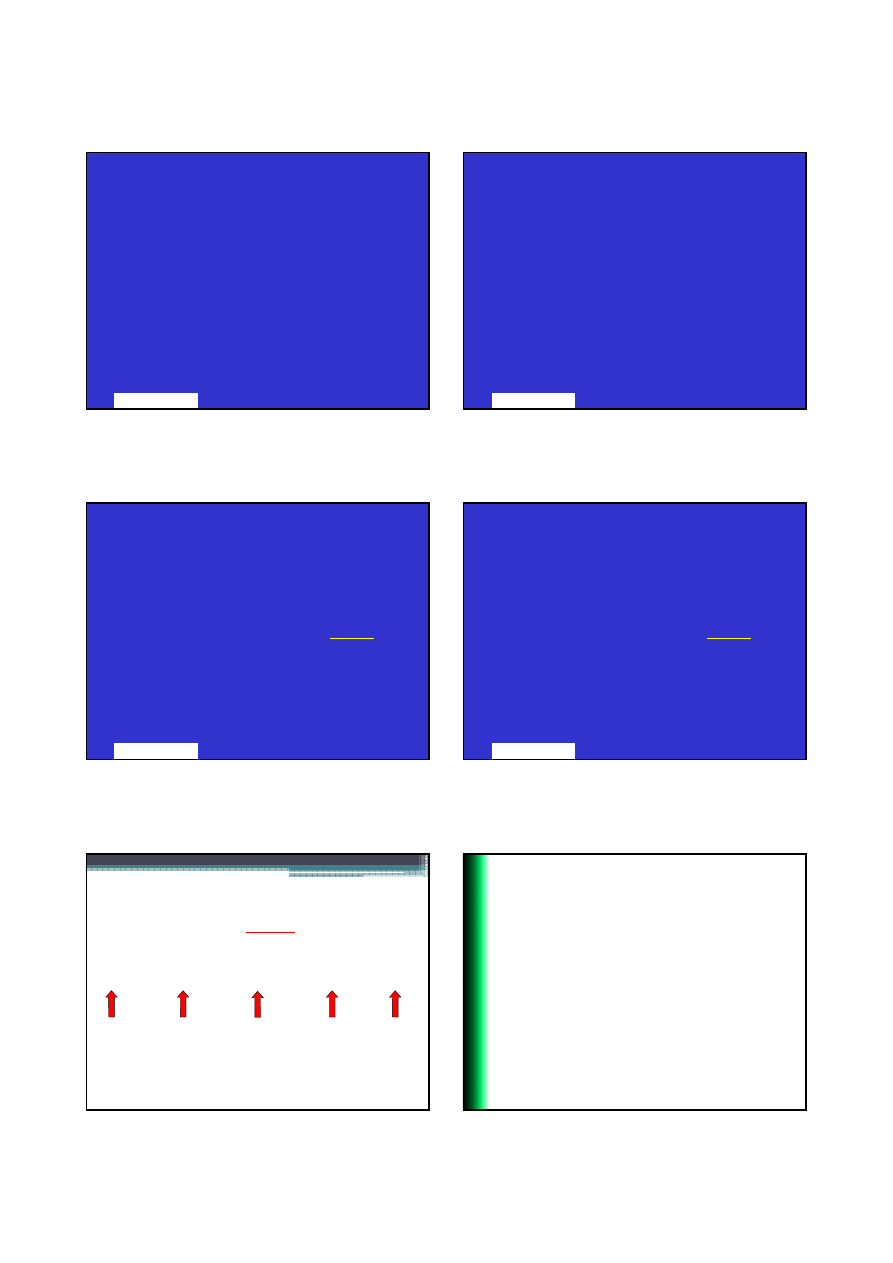
3
Masa atomowa pierwiastka
jest średnią mas
atomowych i ilości każdego z
naturalnie-
występujących izotopów
:
58
Ni 68.27
60
JMSS - PX2512
13
60
Ni 26.1
61
Ni
1.13
62
Ni
3.59
64
Ni
0.91
Marek Sikorski
58
Ni
68.27%
58
x
68.27/100
=
60
Ni
26.1%
60
x
26.1/100
=
61
Ni
1.13%
61
x
1.13/100
=
62
Ni
3.59%
62
x
3.59/100
=
64
Ni
0.91%
64
x
0.91/100
=
JMSS - PX2512
14
Marek Sikorski
58
Ni
68.27%
58
x
68.27/100
= 39.5966
60
Ni
26.1%
60
x
26.1/100
= 15.66
61
Ni
1.13%
61
x
1.13/100
= 0.6893
62
Ni
3.59%
62
x
3.59/100
= 2.2258
64
Ni
0 91%
64
x
0 91/100
= 0 5824
JMSS - PX2512
15
64
Ni
0.91%
64
x
0.91/100
= 0.5824
Marek Sikorski
58
Ni
68.27%
58
x
68.27/100
= 39.5966
60
Ni
26.1%
60
x
26.1/100
= 15.66
61
Ni
1.13%
61
x
1.13/100
= 0.6893
62
Ni
3.59%
62
x
3.59/100
= 2.2258
64
Ni
0 91%
64
x
0 91/100
= 0 5824
JMSS - PX2512
16
64
Ni
0.91%
64
x
0.91/100
= 0.5824
58.7541
Marek Sikorski
17
Izotopy cd...
J
ądra posiadające tę samą liczbę atomową a różniące się
liczb
ą masową nazywane są
izotopami
.
N.p. W
ęgiel może występować w postaci kilku izotopów
11
C
12
C
13
C
14
C
15
C
6
C
6
C
6
C
6
C
Stabilne j
ądro;
wyst
ępujące w
98.89%
naturalnego
w
ęgla.
Stabilne j
ądro;
wyst
ępujące w
1.11%
naturalnego
w
ęgla.
Niestabilne
j
ądro.
Niestabilne
j
ądro;
powstaj
ące w
reakcji
j
ądrowej w
cyklotronie.
6
C
Niestabilne
j
ądro; ilości
śladowe
obecne w
żywej materii.
Marek Sikorski
Radioaktywno
ść Naturalna
Cztery najwa
żniejsze mechanizmy rozpadu radioaktywnego:
1. rozpad
α
n.p.
212
208
4
83
81
2
Bi
Tl
α
⎯⎯
→
+
Cz
ąstkę
α stanowi jądro helu o
masie 4 i
ładunku 2+.
Tak jak we wszystkich reakcjach
JMSS - PX2512
18
2. rozpad
β
n.p.
12
12
0
5
6
1
B
C
e
−
−
⎯⎯
→
+
j
y
j
j
ądrowych, zarówno masa jak i
ładunek są zachowane.
β (lub β
-
) jest elektronem
wyrzuconym z j
ądra
W tej reakcji j
ądrowej jeden neutron
jest zamieniany na proton dla
zachowania
ładunku.
Marek Sikorski
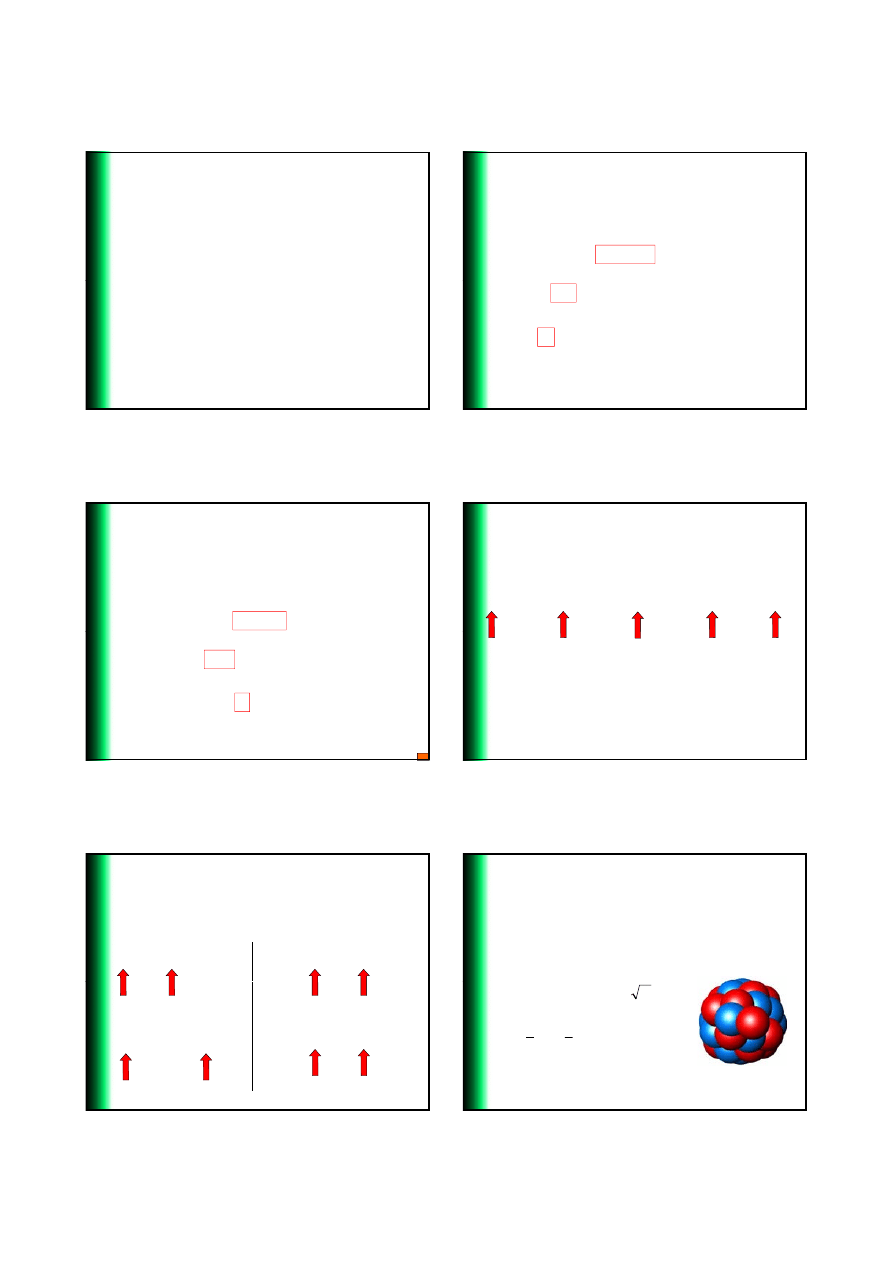
4
Radioaktywno
ść Naturalna
3. Emisja pozytonu (
β
+
)
n.p.
12
12
0
7
6
1
N
C
e
+
⎯⎯
→
+
Gdy pozyton (
β
+
) jest wyrzucany z
j
ądra zwykle bardzo szybko zderza
si
ę z antycząstką (elektronem) w
otaczaj
ącym środowisku:
e
e
γ
+
−
+
→
JMSS - PX2512
19
4. Wychwyt elektronu
n.p.
55
0
55
26
1
25
Fe
e
Mn
−
−
+
⎯⎯
→
Wychwyt elektronu poci
ąga za sobą
emisj
ę promieniowania X jako strumień
elektronów przechodz
ących do niższych
stanów energetycznych w celu
zape
łnienia dziury powstałej po
wychwyconym elektronie.
(promienie X generalnie nie s
ą
zaliczane do radioaktywno
ści, chociaż
mog
ą powodować uszkodzenia o
charakterze promieniotwórczym.)
e
e
γ
+
⎯⎯
→
Marek Sikorski
Radioaktywno
ść Naturalna – przykład do analizy
Zrównowa
ż następujące reakcje rozpadu jądrowego i
zidentyfikuj stosownie emituj
ące cząstki.
1.
234
230
92
90
U
Th
⎯⎯
→
+
4
4
2
2
or
He
α
JMSS - PX2512
20
2.
3.
63
0
28
1
Ni
e
−
−
⎯⎯
→
+
36
36
17
16
Cl
S
+
⎯⎯
→
63
29
Cu
0
1
e
−
Marek Sikorski
Reakcje j
ądrowe – przykład do analizy
Reakcje j
ądrowe zostały zrównoważone w ten sam sposób,
ale mog
ą dotyczyć więcej niż jednego czynnika. Zrównoważ
nast
ępujące reakcje jądrowe i zidentyfikuj brakujące jądra lub
cz
ąstki.
1
14
4
17
7
2
8
N
He
O
+
⎯⎯
→
+
1
1
1
1
or
H
p
JMSS - PX2512
21
1.
2.
3.
239
4
1
94
2
0
Pu
He
n
+
⎯⎯
→
+
28
2
29
14
1
15
Si
H
P
+
⎯⎯
→
+
242
96
Cm
1
0
n
Marek Sikorski
Stabilno
ść jądrowa i mechanizmy rozpadu
Rozwa
żmy pewne znane izotopy węgla z ostatniego wykładu.
11
6
C
12
6
C
13
6
C
14
6
C
15
6
C
JMSS - PX2512
22
Stabilne j
ądro;
N/Z = 1
Stabilne j
ądro;
N/Z = 1.17
Nietrwa
łe
j
ądro;
N/Z = 1.5
zbyt wysokie
Nietrwa
łe
j
ądro
N/Z = 0.83
zbyt niskie
Nietrwa
łe
j
ądro;
N/Z = 1.33
zbyt wysokie
Marek Sikorski
Stabilno
ść jądrowa i mechanizm rozpadu
Ka
żde jądro ulega rozpadowi w kierunku strefy stabilności
poprzez zmian
ę stosunku N/Z przy stałej liczbie masowej.
11
11
0
6
5
1
C
B
e
+
⎯⎯
→
+
14
14
0
6
7
1
C
N
e
−
−
⎯⎯
→
+
N/Z zbyt niskie daje rozpad
β
+
.
N/Z zbyt wysokie daje rozpad
β
-
.
JMSS - PX2512
23
N/Z = 0.83
N/Z = 1.2
N/Z = 1.33
N/Z = 1.0
15
15
0
6
7
1
C
N
e
−
−
⎯⎯
→
+
N/Z = 1.5
N/Z = 1.14
N/Z = 1.11
N/Z = 1.2
lub równowa
żnie przez wychwyt elektronu.
55
0
55
26
1
25
Fe
e
Mn
−
−
+
⎯⎯
→
Marek Sikorski
Wielkość
Wielko
ść atomu Bohra zależy od liczby atomowej
Nukleony = protony + neutrony
= liczba masowa
Obj
ętość jądra atomowego jest proporcionalna do liczby
masowej
JMSS - PX2512
24
3
15
A
m)
10
x
(1.2
r
−
≈
)
(m
A
)
(1.2x10
3
4
r
3
4
V
3
3
15
3
−
=
=
π
π
Marek Sikorski

5
The sizes of atoms and the units
JMSS - PX2512
25
Masa
Spektrofotometr mas
JMSS - PX2512
26
1 atomowa jednostka masy (u.) = 1.6606 x 10
-27
kg =
931.5 MeV
W
ęgiel = 12.00000 u
m
N
= 1.6749 x 10
-27
kg = 1.0087 u
m
P
= 1.6726 x 10
-27
kg = 1.0078 u
Marek Sikorski
Gęstość
)
(m
A
)
(1.2x10
3
4
r
3
4
V
3
3
15
3
−
=
=
π
π
3
3
4
R
A
V
m
π
ρ
=
=
3
3
JMSS - PX2512
27
1 atomowa jednostka masy (u) = 1.6606 x 10
-27
kg
3
mm
ton /
000
200
=
ρ
Marek Sikorski
Wyszukiwarka
Podobne podstrony:
Chemia Jadrowa 07 [tryb zgodnosci]
Chemia Jadrowa 01 [tryb zgodnosci]
Chemia Jadrowa 05 [tryb zgodnosci]
Chemia Jadrowa 06 [tryb zgodnosci]
Chemia Jadrowa 03 [tryb zgodnosci]
Chemia Jadrowa 04 [tryb zgodnosci]
fizyka jadrowa zast [tryb zgodności]
MT st w 02 [tryb zgodno┼Ťci]
Chemia Bionie wyk1 [tryb zgodności]
(18 fizyka jadrowa 2010 [tryb zgodności])
Chemia organiczna wyklad 1 [tryb zgodnosci]
Energetyka jadrowa (cwiczenia 3 rozszczepienia [tryb zgodnosci]
(Fizyka II jądrowa [tryb zgodności])id 1321
Energetyka jądrowa (cwiczenia 1) Kopia [tryb zgodności]
więcej podobnych podstron