
2009-12-31
1
Chemia Bionieorganiczna
• Przedmiotem bada
ń
chemii bionieorganicznej s
ą
pierwiastki nieorganiczne wyst
ę
puj
ą
ce w układach
biologicznych oraz wprowadzanych do tych układów
metali jako sondy i leków.
• W układach biologicznych metale wyst
ę
puj
ą
zwykle jako
naturalne składniki białek.
• Metaloproteiny wykazuj
ą
ce działanie katalityczne
nazywamy metaloenzymami.
• Toksyczne działanie pierwiastków.
• Rola pierwiastków w
ż
ywieniu.
• Transport i magazynowanie metali
Biologiczne funkcje wybranych
metali
A M I N O K W A S Y
Aminokwasy są podstawową jednostką strukturalną : peptydów ( do 100 aa ) i białek ( >100 aa ).
Budowa aminokwasów:
- Centralnie ułożony jest Cα
- Kowalencyjnie związane są z węglem α grupa COOH , grupa NH
2
, atom H oraz charakte-
rystyczna dla aminokwasów grupa R stanowiąca łańcuch boczny aminokwasów.
- Tetraedrycznie ułożone 4 różne podstawniki wokół węgla α nadają aminokwasom charakter
związków optycznie czynnych. C α jest węglem chiralnym - daje izomery optyczne L i D.
Białka zbudowane są wyłącznie z L aminokwasów !!
Wyjątek - GLICYNA - bo nie posiada węgla chiralnego
Wyjątek - THREONINA i IZOLEUCYNA - 2 węgle asymetryczne , 2 centra chiralne
C α jest asymetryczny co powoduje, że aminokwasy są optycznie czynne a więc skręcają
płaszczyznę światła spolaryzowanego.
Jest 20 podstawowych aminokwasów budujących białka. Różnią się one między sobą :
- wielkością cząsteczki
- kształtem
- ładunkiem elektrycznym
- zdolnością do tworzenia wiązań wodorowych
- reaktywnością chemiczną
Podział aminokwasów
1. W zależności od budowy łańcucha bocznego aminokwasu :
- aa z alifatycznym łańcuchem bocznym : Gly , Ala , Val , Leu , Ile
- aa z łańcuchem bocznym zawierającym grupę hydroksylową : Ser , Thr , Tyr
- aa z łańcuchem bocznym zawierającym atom siarki : Cys , Met
- aa z łańcuchem bocznym zawierającym grupy kwaśne lub ich amidy : Asp , Asn , Gln , Glu
- aa z łańcuchem bocznym zawierającym grupy zasadowe : Arg , Lys , His
- aa z łańcuchem bocznym zawierającym pierścień aromatyczny : His , Tyr , Phe , Trp
- iminokwas : Pro
2. W zależności od właściwości łańcucha bocznego :
- łańcuch boczny niepolarny ( hydrofobowy ): Ala , Val , Leu , Pro , Ile , Met , Trp , Phe
- łańcuch boczny polarny , aa obojętne : Gly , Ser , Gln , Asn , Thr , Tyr , Cys
- łańcuch boczny polarny , aa kwaśne ( w pH=7 łańcuch boczny ma ładunek ujemny ) :
aa monoaminodikarboksylowe : Asp , Glu
- łańcuch boczny polarny , aa zasadowe ( w pH=7 łańcuch boczny ma ładunek dodatni ) :
aa diaminomonokarboksylowe : His , Lys , Arg

2009-12-31
2
Cystyna
3. Podział pod względem polarności :
- aa niepolarne ( hydrofobowe - awersja do wody , skłonność do grupowania się - bardzo
ważna cecha slużąca stabilizacji struktury bialka zbudowanego z aa o przeważającym
hydrofobowym charakterze ) : Ala , Val , Leu , Ile , Met , Phe , Trp , Pro
- aa polarne : Gly , Asp , Asn , Glu , Gln , Arg , Lys , His , Cys , Ser , Thr , Tyr
4. Podział pod względem pochodzenia :
- aa egzogenne ( aa NIEZBĘDNE - dostarczane tylko z pokarmem, organizm nie potrafi ich
syntetyzować) : Arg , His - tylko u dzieci !!
Val , Leu , Ile , Lys , Thr , Met , Phe , Trp
- aa endogenne ( aa NIENIEZBĘDNE - syntetyzowane przez organizm): Ala , Gly , Asp , Asn ,
Glu , Gln , Cys , Pro , Ser , Tyr oraz hydroksyprolina i hydroksylizyna
2009-12-31
3
Właściwości chemiczne aminokwasów
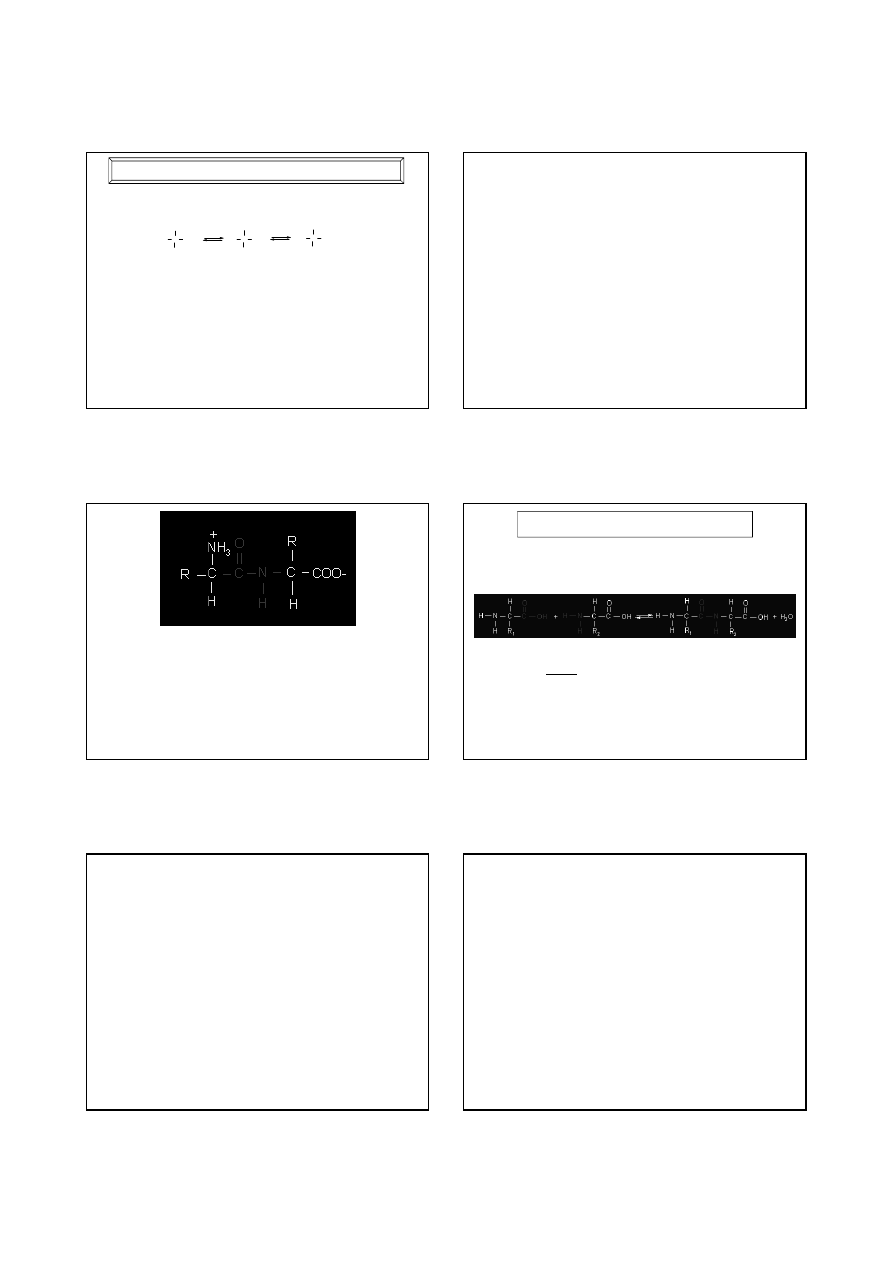
1. Zmiana stanu jonizacji aa w zależności od pH
R
C
NH
3
H
COOH
R
C
NH
3
H
COO-
R
C
NH
2
H
COO-
+
+
pH = 1
pH = 7
pH = 11
Forma przeważająca jon obojnaczy forma przeważająca
jon dwubiegunowy
Równoczesna obecność w cząsteczkach aa grup - COOH i - NH
2
sprawia , że aa są
związkami amfoterycznymi , których charakter uzależniony jest od stężenia jonów H
+
w
roztworze. W roztworze wodnym aa tylko w znikomej ilości ( 0,1% ) występują jako
cząsteczki elektrycznie nienaładowane , w ogromnej większości są jonami. Jony w
zależności od oddziaływania środowiska mogą mieć charakter kwaśny lub zasadowy.
W środowisku kwaśnym aa przyłącza H
+
stając się kationem, w polu elektrycznym
wędruje do katody i zachowuje się jak kwas bo grupa - COOH i NH
3
+
mogą
oddysocjować proton. W środowisku zasadowym aa oddysocjowuje H
+
i staje się
anionem , w polu elektrycznym wędruje do anody i zachowuje się jak zasada bo grupa
- COO
-
i NH
2
może przyjmować proton.
Należy pamiętać , że w przypadku Asp , Glu , Lys , His , Arg , Tyr , Cys jonizacji ulega również
łańcuch boczny aa.
Jon obojnaczy jest amfoteryczny ponieważ może zarówno przyłączyć proton do grupy - COO
-
jak i go oddysocjować od grupy NH
3
+
.
Cząsteczka takiego jonu obojnaczego zachowuje się tak jak gdyby nie była naładowana , a więc
nie wędruje w polu elektrycznym gdyż sumaryczny ładunek takiej cząsteczki jest równy zero.
2/. pH , w którym cząsteczka aa występuje w postaci jonu obojnaczego ( sumaryczny ładunek
cząsteczki = 0 ) nosi nazwę PUNKTU IZOELEKTRYCZNEGO pI
Każdy aa ma charakterystyczny dla siebie pI np. :
- alanina = 6,02
- lizyna = 9,7
- arginina = 10,8
- kwas asparaginowy = 2,98
W przypadku aa ( tylko aa ) pI jest równy punktowi izojonowemu tj takiemu pH , przy którym
cząsteczka ma jednakową liczbe protonów uwolnionych z grupy - COOH i protonów
związanych z grupą - NH
2
.
3/. Aa mają właściwości buforowe
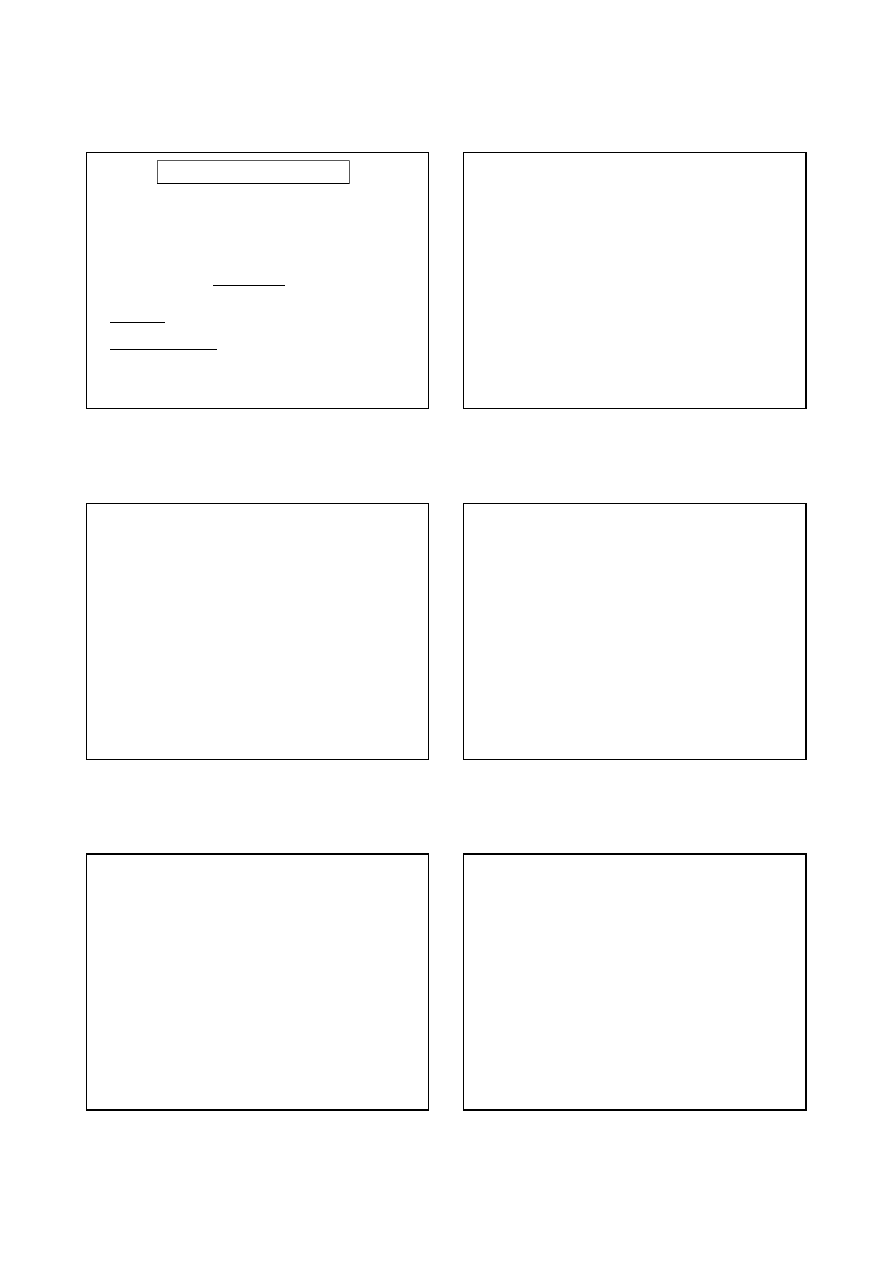
4/. Reakcje jakim ulegają aa :
a) reakcje polimeryzacji : aa + aa < <- ->> dipeptyd + H
2
O
Wiązanie peptydowe , ( zaznaczono kolorem czerwonym ) jest wiązaniem kowalencyjnym
b) Tworzenie kompleksów chelatowych z jonami metali ciężkich np. Cu
2+
, Ni
2+
P E P T Y D Y
- Są związkami złożonymi z 2 lub więcej aa ( do 100 aa ) połączonymi wiązaniami peptydowymi
tworząc łańcuch peptydowy.
- Aa w łańcuchu peptydowym nazywamy resztami aminokwasowymi.
- Wiązanie peptydowe :
d i p e p t y d
Wiązanie amidowe jest wiązaniem sztywnym. Brak jest rotacji wzdłuż wiązania peptydowego gdyż
wiązanie to wykazuje częściowo charakter wiązania podwójnego.
Możliwość rotacji wzdłuż wiązania Cα - C
karboksylowy
i N - Cα .
Wiązanie peptydowe jest częściowo spolaryzowane N
δ+
- C
δ-
Atom H rupy -NH- jest zawsze w pozycji trans w stosunku do atomu O grupy =C=O ( jest to
korzystne energetycznie ).
Nomenklatura peptydów :
- dipeptyd
- tripeptyd
- tetrapeptyd
- oktapeptyd itd..
2 - 10 aa to oligopeptydy
do 100 aa - polipeptydy
> 100 aa - makropeptydy ( białka )
Nomenklatura peptydów polega na podaniu kolejności reszt aa wchodzących w skład peptydu lub
białka ( sekwencji w łańcuchu ) od N końca do C końca.
N - koniec - to ten gdzie występuje reszta aa z wolną grupą -NH
2
- początek łańcucha
C - koniec - to ten gdzie występuje reszta aa z wolną grupą -COOH - koniec łańcucha
Nomenklaturę peptydów tworzy się w ten sposób , że aa , którego grupa -COOH wchodzi w reakcję
z grupą NH
2
kolejnego aa (lub innaczej , którego grupa -COOH tworzy wiązanie peptydowe )
otrzymuje końcówkę -ylo lub -ilo
Przykład:
Gly-Ala
glicyloalanina
Ala-Leu-Tyr
alanyloleucylotyrozyna
Zasada oznaczania reszt aa trzema pierwszymi
literami pochodzącymi od nazwy danego aa
!!! Sekwencja aa w peptydzie lub białku jest zgodna z sekwencją nukleotydów
w DNA kodującym dane białko lub peptyd.
Właściwości peptydów :
- Peptydy mają tylko strukturę I rzędową . Brak struktury II , III czy IV rzędowej - charakterysty-
cznej dla białek.
- Nie ulegają sedymentacji w czasie ultrawirowania.
- Nie występują w postaci koloidów
- Nie dają efektu Tyndala
- Nie ulegają denaturacji bo brak jest struktury II , III czy IV rzędowej
- Nie wywierają ciśnienia osmotycznego
- Nie ulegają wysalaniu i wsalaniu
- Dializują
- Wędrują w polu elektrycznym dzięki cząstkowemu ładunkowi elektrycznemu
- Z powodu obecności wiązania peptydowego, peptydy pochłaniają światło nadfioletowe przy
max λ=230 nm a z powodu obecności Tyr i Trp przy λ=280 nm
- Peptydy są związkami amfoterycznymi
- Każdy peptyd ma charakterystyczny dla siebie punkt izoelektryczny
- mają właściwości buforowe w odpowiednim przedziale pH
Reakcje , którym ulegają peptydy - patrz białka !!
2009-12-31
4
B I A Ł K A
-- To związki organiczne o dużej masie cząsteczkowej , zbudowane głównie z aa połączonych
To związki organiczne o dużej masie cząsteczkowej , zbudowane głównie z aa połączonych
wiązaniami peptydowymi.
wiązaniami peptydowymi.
-- Białka zbudowane są z 1 lub kilku łańcuchów peptydowych :
Białka zbudowane są z 1 lub kilku łańcuchów peptydowych :
-- 1 łańcuch
1 łańcuch
→
→
białko
białko monomeryczne
monomeryczne ( cytochrom C , mioglobina , rybonukleaza )
( cytochrom C , mioglobina , rybonukleaza )
-- kilka łańcuchów
kilka łańcuchów
→
→
białko polimeryczne:
białko polimeryczne:
-- homopolimeryczne
homopolimeryczne ( takie same łańcuchy ) np.
( takie same łańcuchy ) np. heksokinaza
heksokinaza ( α
( α
4
4
))
-- heteropolimeryczne
heteropolimeryczne ( różne łańcuchy ) np.
( różne łańcuchy ) np. Hb
Hb ( α
( α
2
2
β
β
2
2
))
---
--- Podział białek
Podział białek ---
---
1/. Na podstawie kształtu cząsteczki białka (stosunek osiowy
1/. Na podstawie kształtu cząsteczki białka (stosunek osiowy -- czyli stosunek długości do szerokości)
czyli stosunek długości do szerokości)
-- białka globularne
białka globularne -- stosunek osiowy < 10 ( 3
stosunek osiowy < 10 ( 3 -- 4 ), łańcuchy polipeptydowe ściśle pofałdowane i
4 ), łańcuchy polipeptydowe ściśle pofałdowane i
zwinięte np. insulina , albuminy i globuliny osocza , większość enzymów
zwinięte np. insulina , albuminy i globuliny osocza , większość enzymów
-- białka włókienkowe (
białka włókienkowe ( fibrylarne
fibrylarne )) -- stosunek osiowy > 10 , łańcuchy polipeptydowe zwinięte
stosunek osiowy > 10 , łańcuchy polipeptydowe zwinięte
śrubowo lub w helisy , połączone krzyżowo wiązaniami kowalencyjnymi lub wodorowymi np.
śrubowo lub w helisy , połączone krzyżowo wiązaniami kowalencyjnymi lub wodorowymi np.
-- β
β--keratyna
keratyna
-- α
α--keratyna
keratyna
-- kolagen
kolagen
2/.
2/. Klasyfikacja białek na podstawie ich rozpuszczalności
Klasyfikacja białek na podstawie ich rozpuszczalności
-- Albuminy
Albuminy -- R w H
R w H
2
2
O i roztworach soli
O i roztworach soli
-- Globuliny
Globuliny -- słabo R w H
słabo R w H
2
2
O ale dobrze w roztworach soli
O ale dobrze w roztworach soli
-- Prolaminy
Prolaminy -- R w 70
R w 70 -- 80% etanolu. NR w H
80% etanolu. NR w H
2
2
O i etanolu absolutnym. Bogate w
O i etanolu absolutnym. Bogate w Arg
Arg
-- Histony
Histony -- R w roztworach soli i kwasów nieorganicznych
R w roztworach soli i kwasów nieorganicznych
-- Skleroproteiny
Skleroproteiny -- NR w H
NR w H
2
2
O ani w roztworach soli. Bogate w
O ani w roztworach soli. Bogate w Gly
Gly , Ala , Pro
, Ala , Pro
3/.
3/. Klasyfikacja białek na podstawie budowy chemicznej
Klasyfikacja białek na podstawie budowy chemicznej
-- białka proste (
białka proste ( holoproteiny
holoproteiny ) składają się niemal wyłącznie z aa
) składają się niemal wyłącznie z aa
-- białka złożone (
białka złożone (heteroproteiny
heteroproteiny) zawierają integralną część niebiałkową
) zawierają integralną część niebiałkową -- grupę prostetyczną
grupę prostetyczną --
mocniej lub słabiej związaną z częścią białkową np. :
mocniej lub słabiej związaną z częścią białkową np. :
-- glikoproteiny
glikoproteiny -- fibronektyna ,
fibronektyna , IgG
IgG
-- fosfoproteiny
fosfoproteiny -- ufosforylowana
ufosforylowana Ser ,
Ser , Thr
Thr , Tyr
, Tyr -- kazeina , fosforylaza glikogenowa
kazeina , fosforylaza glikogenowa
-- lipoproteiny
lipoproteiny -- LDL , HDL
LDL , HDL
-- nukleoproteiny
nukleoproteiny -- chromosom ,
chromosom , rybosom
rybosom
-- metaloproteiny
metaloproteiny -- ferrytyna ( Fe
ferrytyna ( Fe
3+
3+
) ,
) , transferyna
transferyna ( Fe
( Fe
2+
2+
), dehydrogenaza alkoholowa ( Zn
), dehydrogenaza alkoholowa ( Zn
2+
2+
),
),
oksydaza cytochromowa ( Cu i Fe )
oksydaza cytochromowa ( Cu i Fe )
-- chromoproteiny ( hem )
chromoproteiny ( hem ) -- Hb
Hb , cytochrom C , katalaza , mioglobina
, cytochrom C , katalaza , mioglobina
-- flawoproteiny ( FAD , FMN )
flawoproteiny ( FAD , FMN ) -- dehydrogenaza
dehydrogenaza bursztynianowa
bursztynianowa
4/.
4/. Podział ze względu na rolę białka w organizmie
Podział ze względu na rolę białka w organizmie
5/.
5/. Podział ze względu na pochodzenie białka :
Podział ze względu na pochodzenie białka : roślinne , zwierzęce , bakteryjne , wirusowe
roślinne , zwierzęce , bakteryjne , wirusowe
6/. Podział białek ze względu na wartość odżywczą :
6/. Podział białek ze względu na wartość odżywczą :
-- białko pełnowartościowe
białko pełnowartościowe -- zawiera wszystkie aa niezbędne
zawiera wszystkie aa niezbędne
-- białko niepełnowartościowe
białko niepełnowartościowe -- brak przynajmniej jednego aa niezbędnego
brak przynajmniej jednego aa niezbędnego
W budowie białka wyróżnia się 4 zasadnicze poziomy organizacji łańcucha polipeptydowego:
W budowie białka wyróżnia się 4 zasadnicze poziomy organizacji łańcucha polipeptydowego:
-- struktura I rzędowa
struktura I rzędowa
→
→
sekwencja aa w łańcuchu polipeptydowym.
sekwencja aa w łańcuchu polipeptydowym.
-- struktura II rzędowa
struktura II rzędowa
→
→
przestrzenne ułożenie reszt aa sąsiadujących ze sobą w sekwencji
przestrzenne ułożenie reszt aa sąsiadujących ze sobą w sekwencji
liniowej ( wiązania wodorowe).
liniowej ( wiązania wodorowe).
-- struktura III rzędowa
struktura III rzędowa
→
→
określa powiązania przestrzenne i wzajemne ułożenie reszt aa
określa powiązania przestrzenne i wzajemne ułożenie reszt aa
oddalonych od siebie w sekwencji liniowej oraz lokalizację mostków
oddalonych od siebie w sekwencji liniowej oraz lokalizację mostków
disiarczkowych
disiarczkowych. Określa przestrzenne ułożenie
. Określa przestrzenne ułożenie łancucha
łancucha polipeptydowego.
polipeptydowego.
Wiązania wodorowe , jonowe ,
Wiązania wodorowe , jonowe , disiarczkowe
disiarczkowe , oddziaływania
, oddziaływania
hydrofobowe , wiązania van der
hydrofobowe , wiązania van der Walsa
Walsa , estrowe , O , N
, estrowe , O , N –
– glikozydowe.
glikozydowe.
-- struktura IV rzędowa
struktura IV rzędowa
→
→
w białkach zbudowanych z więcej niż jednego łańcucha
w białkach zbudowanych z więcej niż jednego łańcucha
polipeptydowego. Określa wzajemne ułożenie przestrzenne podjednostek
polipeptydowego. Określa wzajemne ułożenie przestrzenne podjednostek
i rodzaj ich kontaktu (
i rodzaj ich kontaktu ( Hb
Hb , kolagen , wirus polio ,
, kolagen , wirus polio , Rynowirus
Rynowirus 14 ).
14 ).
Rola białek , funkcje :
Rola białek , funkcje :
-- enzymatyczna
enzymatyczna -- prawie wszystkie enzymy są białkami , zwiększają szybkość reakcji o około
prawie wszystkie enzymy są białkami , zwiększają szybkość reakcji o około
1 mln razy . Istnieje kilka tysięcy enzymów, z których każdy katalizuje
1 mln razy . Istnieje kilka tysięcy enzymów, z których każdy katalizuje
swoistą dla siebie reakcję chemiczną np.: trypsyna , pepsyna , rybonukleaza ,
swoistą dla siebie reakcję chemiczną np.: trypsyna , pepsyna , rybonukleaza ,
dehydrogenaza alkoholowa , katalaza ,
dehydrogenaza alkoholowa , katalaza , fosfofruktokinaza
fosfofruktokinaza..
-- budulcowa :
budulcowa :
α
α -- keratyna
keratyna -- włosy , rogi , paznokcie
włosy , rogi , paznokcie
kolagen
kolagen
elastyna
elastyna -- białko tkanki łącznej , odpowiedzialnym za zdolność tkanek do
białko tkanki łącznej , odpowiedzialnym za zdolność tkanek do
rozciągania i powrotu do uprzedniego kształtu. Nie jest tak
rozciągania i powrotu do uprzedniego kształtu. Nie jest tak
rozpowszechniona jak kolagen , ale
rozpowszechniona jak kolagen , ale występujje
występujje w dużych ilościach w
w dużych ilościach w
tkankach , które wymagają takich właściwości fizycznych , a więc np.:
tkankach , które wymagają takich właściwości fizycznych , a więc np.:
w płucach , dużych tętnicach i niektórych więzadłach sprężystych
w płucach , dużych tętnicach i niektórych więzadłach sprężystych
białka błonowe
białka błonowe -- białka strukturalne
białka strukturalne
-- magazynowa :
magazynowa :
ceruloplazmina
ceruloplazmina -- białko magazynujące Cu
białko magazynujące Cu
ferrytyna
ferrytyna -- białko magazynujące Fe
białko magazynujące Fe
3+
3+
-- transportowa :
transportowa :
mioglobina
mioglobina -- transport O
transport O
2
2
w mięśniach
w mięśniach
Hb
Hb -- transport O
transport O
2
2
we krwi
we krwi
transferyna
transferyna -- transport Fe
transport Fe
2+
2+
albumina
albumina -- transport np. leków
transport np. leków
-- regulacyjna :
regulacyjna :
hormony : peptydowe (omówione wcześniej), białkowe np. GH , PRL
hormony : peptydowe (omówione wcześniej), białkowe np. GH , PRL
białka
białka represorowe
represorowe -- hamują transkrypcję genów
hamują transkrypcję genów
-- ochronna :
ochronna :
immunoglobuliny
immunoglobuliny -- układ odpornościowy
układ odpornościowy
trombina , fibrynogen
trombina , fibrynogen -- ochrona przed utratą krwi
ochrona przed utratą krwi
-- ruch :
ruch :
aktyna , miozyna
aktyna , miozyna -- mięśnie
mięśnie
tubulina
tubulina -- białko
białko mikrotubul
mikrotubul biorące udział w podziałach komórkowych
biorące udział w podziałach komórkowych
-- rola buforowa :
rola buforowa :
we krwi
we krwi -- albuminy
albuminy
-- wytwarzanie i przekazywanie impulsów nerwowych :
wytwarzanie i przekazywanie impulsów nerwowych :
białka receptorowe
białka receptorowe -- rodopsyna ( białko
rodopsyna ( białko fotoreceptorowe
fotoreceptorowe występujące w siatkówce oka ).
występujące w siatkówce oka ).
*** Właściwości białek ***
*** Właściwości białek ***
-- mają charakter związków wielkocząsteczkowych, co powoduje , że białka nie dializują , a
mają charakter związków wielkocząsteczkowych, co powoduje , że białka nie dializują , a
roztwory białek wykazują właściwości
roztwory białek wykazują właściwości -- cechy koloidów
cechy koloidów
-- wywierają ciśnienie
wywierają ciśnienie koloido
koloido -- osmotyczne
osmotyczne
-- mają zdolność wiązania jonów
mają zdolność wiązania jonów
-- wędrują w polu elektrycznym dzięki ładunkowi elektrycznemu cząsteczki. Szybkość
wędrują w polu elektrycznym dzięki ładunkowi elektrycznemu cząsteczki. Szybkość
poruszania się w polu elektrycznym zależy od wielkości ładunku elektrycznego , oraz od
poruszania się w polu elektrycznym zależy od wielkości ładunku elektrycznego , oraz od
rozmiarów i kształtu cząsteczki
rozmiarów i kształtu cząsteczki
-- większość białek dobrze rozpuszcza się w H
większość białek dobrze rozpuszcza się w H
2
2
O , niektóre w rozcieńczonych roztworach
O , niektóre w rozcieńczonych roztworach
soli , kwasów i zasad. O rozpuszczalności decyduje przede wszystkim ich zdolność do
soli , kwasów i zasad. O rozpuszczalności decyduje przede wszystkim ich zdolność do
hydratacji , budowa chemiczna , obecność soli w środowisku i
hydratacji , budowa chemiczna , obecność soli w środowisku i pH
pH środowiska
środowiska
-- białka ulegają wysalaniu pod wpływem silnych elektrolitów np. soli Stężenie soli potrzebne
białka ulegają wysalaniu pod wpływem silnych elektrolitów np. soli Stężenie soli potrzebne
do wysolenia zależy od właściwości białka i
do wysolenia zależy od właściwości białka i pH
pH środowiska.
środowiska. Wysalacze
Wysalacze : (NH
: (NH
4
4
))
2
2
SO
SO
4
4
, MgSO
, MgSO
4
4
,,
aceton , etanol ( ale działając krótko ). Wysalanie jest procesem odwracalnym bo nie powoduje
aceton , etanol ( ale działając krótko ). Wysalanie jest procesem odwracalnym bo nie powoduje
denaturacji białka.
denaturacji białka.
-- Wsalanie
Wsalanie jest procesem odwrotnym do wysalania , którego dokonuje się przez stopniowe
jest procesem odwrotnym do wysalania , którego dokonuje się przez stopniowe
rozcieńczanie roztworu białek.
rozcieńczanie roztworu białek.
-- Białka ulegają denaturacji .
Białka ulegają denaturacji .
Zniszczeniu ulega IV , III , lub II rzędowa struktura białka , I rzędowa struktura pozostaje
Zniszczeniu ulega IV , III , lub II rzędowa struktura białka , I rzędowa struktura pozostaje
niezmieniona
niezmieniona -- a więc zmianie ulega konformacja łańcucha polipeptydowego. Białko traci
a więc zmianie ulega konformacja łańcucha polipeptydowego. Białko traci
swoje właściwości. Rozrywane są wiązania wodorowe , jonowe , hydrofobowe ,
swoje właściwości. Rozrywane są wiązania wodorowe , jonowe , hydrofobowe , disiarczkowe
disiarczkowe ,
,
van der
van der Walsa
Walsa..
DENATURACJĘ POWODUJĄ :
DENATURACJĘ POWODUJĄ :
Czynniki fizyczne : ogrzewanie , wysalanie , ultradźwięki , promieniowanie , wstrząsanie
Czynniki fizyczne : ogrzewanie , wysalanie , ultradźwięki , promieniowanie , wstrząsanie
wodnych roztworów białek w atmosferze powietrza.
wodnych roztworów białek w atmosferze powietrza.
Czynniki chemiczne : kwasy , zasady , jony metali ciężkich , chlorowodorek guanidyny ,
Czynniki chemiczne : kwasy , zasady , jony metali ciężkich , chlorowodorek guanidyny ,
mocznik , detergenty , fenol , chloroform , rozpuszczalniki mieszające się
mocznik , detergenty , fenol , chloroform , rozpuszczalniki mieszające się
wodą ( etanol , aceton )
wodą ( etanol , aceton )
-- Skręcają płaszczyznę światła spolaryzowanego w lewo , ponieważ zbudowane są z L
Skręcają płaszczyznę światła spolaryzowanego w lewo , ponieważ zbudowane są z L--aa.
aa.
-- Roztwory białek cechuje duży współczynnik załamania światła , który wzrasta liniowo w
Roztwory białek cechuje duży współczynnik załamania światła , który wzrasta liniowo w
miarę wzrostu stężenia białka w roztworze , co wykorzystuje się do ilościowego oznaczania
miarę wzrostu stężenia białka w roztworze , co wykorzystuje się do ilościowego oznaczania
białka metodą referencyjną
białka metodą referencyjną
2009-12-31
5
-- Z powodu obecności wiązań peptydowych białka pochłaniają światło nadfioletowe z max
Z powodu obecności wiązań peptydowych białka pochłaniają światło nadfioletowe z max
absorbancji
absorbancji przy λ = 230
przy λ = 230 nm
nm, a z powodu obecności Tyr i
, a z powodu obecności Tyr i Trp
Trp przy max λ = 280
przy max λ = 280 nm
nm
-- Masa cząsteczkowa białek waha się od 10.000 do wielokrotności miliona.
Masa cząsteczkowa białek waha się od 10.000 do wielokrotności miliona.
-- Białka są związkami amfoterycznymi.
Białka są związkami amfoterycznymi.
-- Każde białko ma charakterystyczny dla siebie punkt izoelektryczny
Każde białko ma charakterystyczny dla siebie punkt izoelektryczny pI
pI np.:
np.:
-- pepsyna 1.0
pepsyna 1.0
-- kazeina 4.7
kazeina 4.7
-- mioglobina 7.0
mioglobina 7.0
-- trypsyna 10. 5
trypsyna 10. 5
W punkcie izoelektrycznym rozpuszczalność białka jest najmniejsza i najłatwiej jest wtedy
W punkcie izoelektrycznym rozpuszczalność białka jest najmniejsza i najłatwiej jest wtedy
takie białko wytrącić z roztworu bądź wykrystalizować.
takie białko wytrącić z roztworu bądź wykrystalizować.
W punkcie izoelektrycznym białko :
W punkcie izoelektrycznym białko :
-- wykazuje najmniejsze ciśnienie osmotyczne
wykazuje najmniejsze ciśnienie osmotyczne
-- ma najmniejszą lepkość
ma najmniejszą lepkość
-- najsłabiej pęcznieje
najsłabiej pęcznieje
-- nie reaguje z anionami ani z kationami
nie reaguje z anionami ani z kationami
-- wykazuje najmniejszą ruchliwość elektroforetyczną
wykazuje najmniejszą ruchliwość elektroforetyczną
-- Białka mają właściwości buforowe w odpowiednim przedziale
Białka mają właściwości buforowe w odpowiednim przedziale pH
pH
Reakcje chemiczne , którym ulegają białka
Reakcje chemiczne , którym ulegają białka
- Reakcja
Reakcja ninhydrynowa
ninhydrynowa - aa , peptydy , białka , sole amonowe , aminocukry , amoniak
aa , peptydy , białka , sole amonowe , aminocukry , amoniak
-- Reakcja z HNO
Reakcja z HNO
2
2
-- Reakcja biuretowa ( Piotrowskiego )
Reakcja biuretowa ( Piotrowskiego ) -- peptydy i białka.
peptydy i białka. Jest to reakcja na wiązania
Jest to reakcja na wiązania
peptydowe
peptydowe. W środowisku alkalicznym 2 wiązania peptydowe tworzą kompleks z jonami
. W środowisku alkalicznym 2 wiązania peptydowe tworzą kompleks z jonami
Cu
Cu
2+
2+
dając zabarwienie fioletowo
dając zabarwienie fioletowo -- niebieskie. Reakcji tej ulegają więc tylko
niebieskie. Reakcji tej ulegają więc tylko tripeptydy
tripeptydy ,,
tetra
tetra -- ,
, penta
penta -- ....peptydy.
....peptydy. Dipeptydy
Dipeptydy powyższej reakcji nie ulegają. Reakcja służy do
powyższej reakcji nie ulegają. Reakcja służy do
oznaczeń ilościowych i jakościowych.
oznaczeń ilościowych i jakościowych.
-- Metoda
Metoda Lowry’ego
Lowry’ego -- do ilościowego oznaczania peptydów i białek. Metoda wykorzystuje
do ilościowego oznaczania peptydów i białek. Metoda wykorzystuje
czułą reakcję wiązań peptydowych i tyrozyny z odczynnikiem wolframowo
czułą reakcję wiązań peptydowych i tyrozyny z odczynnikiem wolframowo -- molibdenowo
molibdenowo --
fosforowym (
fosforowym ( Folina
Folina -- Ciocalteu
Ciocalteu ). Jest to kombinacja reakcji biuretowej oraz reakcji
). Jest to kombinacja reakcji biuretowej oraz reakcji
między resztami tyrozyny a odczynnikiem
między resztami tyrozyny a odczynnikiem Folina
Folina , w której powstają barwne , niebieskie
, w której powstają barwne , niebieskie
produkty. Metoda pozwala na oznaczenie białka w stężeniu 1µg / ml. Jest zatem ok. 100
produkty. Metoda pozwala na oznaczenie białka w stężeniu 1µg / ml. Jest zatem ok. 100
razy dokładniejsza i czulsza niż biuretowa.
razy dokładniejsza i czulsza niż biuretowa.
-- Metoda oznaczania zawartości białka za pomocą pomiaru
Metoda oznaczania zawartości białka za pomocą pomiaru absorbancji
absorbancji w nadfiolecie
w nadfiolecie --
peptydy i białka. Większość białek ze względu na zawartość reszt Tyr i
peptydy i białka. Większość białek ze względu na zawartość reszt Tyr i Trp
Trp wykazuje
wykazuje
max
max absorbancji
absorbancji przy λ = 280 nm. Związki , które mogą wpływać na
przy λ = 280 nm. Związki , które mogą wpływać na absorbancję
absorbancję to :
to :
kwasy nukleinowe ( wykazujące max
kwasy nukleinowe ( wykazujące max absorbancji
absorbancji przy λ = 260
przy λ = 260 nm
nm ) oraz puryny ,
) oraz puryny ,
pirymidyny i fenole.
pirymidyny i fenole.
-- Metoda
Metoda Bradforda
Bradforda -- peptydy i białka
peptydy i białka -- metoda służy do oznaczeń ilościowych
metoda służy do oznaczeń ilościowych
Z błękitem brylantowym
Z błękitem brylantowym Coomassie’go
Coomassie’go G
G--250 w środowisku kwaśnym białko wiąże się
250 w środowisku kwaśnym białko wiąże się
za pomocą wiązań jonowych i hydrofobowych
za pomocą wiązań jonowych i hydrofobowych Arg
Arg , w mniejszym stopniu His ,
, w mniejszym stopniu His , Lys
Lys , Tyr ,
, Tyr ,
Trp
Trp ,
, Phe
Phe. W wyniku reakcji powstaje brunatne zabarwienie wprost proporcjonalne do
. W wyniku reakcji powstaje brunatne zabarwienie wprost proporcjonalne do
zawartości białka w roztworze.
zawartości białka w roztworze.
-- Metoda
Metoda Kjeldahla
Kjeldahla -- oznaczanie zawartości azotu białkowego
oznaczanie zawartości azotu białkowego -- oznaczanie ilościowe.
oznaczanie ilościowe.
Azot białka oznacza się po rozkładzie białka do NH
Azot białka oznacza się po rozkładzie białka do NH
3
3
. Białko gotuje się ze stężonym
. Białko gotuje się ze stężonym
H
H
2
2
SO
SO
4
4
+ katalizator
+ katalizator
→
→
→
→
→
→
→
→
następuje zniszczenie białka i powstaje (HN
następuje zniszczenie białka i powstaje (HN
4
4
))
2
2
SO
SO
4
4
Następnie
Następnie
dodaje się nadmiar alkaliów , które powodują uwolnienie NH
dodaje się nadmiar alkaliów , które powodują uwolnienie NH
3
3
, który wyłapuje się w
, który wyłapuje się w
płuczce z
płuczce z H
H
2
2
SO
SO
4
4
. Następnie oznaczenie prowadzi się przez miareczkowanie.
. Następnie oznaczenie prowadzi się przez miareczkowanie.
-- Hydroliza wiązania peptydowego.
Hydroliza wiązania peptydowego.
A) hydroliza kwaśna
A) hydroliza kwaśna
6
6 -- 12N
12N HCl
HCl lub 4
lub 4 -- 7N H
7N H
2
2
SO
SO
4
4
w temperaturze 110
w temperaturze 110
°°°°°°°°
C przez 24 , 48 i 72 godziny
C przez 24 , 48 i 72 godziny .
.
Używamy 5
Używamy 5 -- 10 razy więcej kwasu niż białka . Nie wolno używać HNO
10 razy więcej kwasu niż białka . Nie wolno używać HNO
3
3
gdyż powoduje
gdyż powoduje
utlenienie bądź nitrowanie pierścieni .
utlenienie bądź nitrowanie pierścieni .
Wady :
Wady :
niszczy :
niszczy : -- Trp
Trp
-- Powoli aa z grupą
Powoli aa z grupą --OH : Ser ,
OH : Ser , Thr
Thr ( ale mając stężenia tych aa po
( ale mając stężenia tych aa po
czasie 24 , 48 ,72 h można ekstrapolować stężenie wyjściowe )
czasie 24 , 48 ,72 h można ekstrapolować stężenie wyjściowe )
-- Gln
Gln ,
, Asn
Asn w środowisku kwaśnym są nietrwałe
w środowisku kwaśnym są nietrwałe
→
→
→
→
→
→
→
→
Glu
Glu ,
, Asp
Asp + NH
+ NH
3
3
Na podstawie uwolnionego NH
Na podstawie uwolnionego NH
3
3
oznaczamy sumę
oznaczamy sumę Gln
Gln +
+ Asn
Asn i np.
i np.
chromatograficznie sumę
chromatograficznie sumę Asp
Asp +
+ Asn
Asn oraz
oraz Glu
Glu +
+ Gln
Gln
•
• Elektroforeza w gradiencie
Elektroforeza w gradiencie pH
pH -- ogniskowanie izoelektryczne
ogniskowanie izoelektryczne
Białko będzie
Białko będzie wędrowalo
wędrowalo do momentu osiągnięcia pozycji , w której
do momentu osiągnięcia pozycji , w której pH
pH żelu
żelu
zrówna się z
zrówna się z pH
pH białka .
białka .
• HPLC
• HPLC
-- biorąc pod uwagę wielkość cząsteczki i ładunek elektryczny
biorąc pod uwagę wielkość cząsteczki i ładunek elektryczny
•
• Rozdzielanie na podstawie rozpuszczalności .
Rozdzielanie na podstawie rozpuszczalności .
Polega na wysalaniu z roztworu wodnego solami obojętnymi np.: (NH
Polega na wysalaniu z roztworu wodnego solami obojętnymi np.: (NH
4
4
))
2
2
SO
SO
4
4
lub MgSO
lub MgSO
4
4
Do roztworu białek dodaje się wzrastającą ilość soli każdorazowo odwirowując wytrącone
Do roztworu białek dodaje się wzrastającą ilość soli każdorazowo odwirowując wytrącone
białko. Przez zmianę
białko. Przez zmianę pH
pH metodę można udoskonalić. Metoda ta stosowana jest tylko do
metodę można udoskonalić. Metoda ta stosowana jest tylko do
oczyszczania wstępnego .
oczyszczania wstępnego .
Po wyizolowaniu białka w czystej postaci wyżej wymienionymi metodami białko należy
Po wyizolowaniu białka w czystej postaci wyżej wymienionymi metodami białko należy
scharakteryzować pod względem chemicznym :
scharakteryzować pod względem chemicznym :
-- przez wyznaczenie punktu izoelektrycznego
przez wyznaczenie punktu izoelektrycznego
-- przez wyznaczenie względnej masy cząsteczkowej
przez wyznaczenie względnej masy cząsteczkowej
-- przez analityczne oznaczenie całkowitego stężenia białka
przez analityczne oznaczenie całkowitego stężenia białka
-- charakterystyka immunologiczna
charakterystyka immunologiczna
Metody wyznaczania względnej masy cząsteczkowej :
Metody wyznaczania względnej masy cząsteczkowej :
•
• ultrawirowanie
ultrawirowanie przez wyznaczenie stałej sedymentacji Svedberga
przez wyznaczenie stałej sedymentacji Svedberga
• na podstawie składu białka ( oznaczamy ilość O , C , N , S
• na podstawie składu białka ( oznaczamy ilość O , C , N , S
→
→
→
→
→
→
→
→
masa białka )
masa białka )
• na podstawie ciśnienia osmotycznego jakie białko wywiera na błonę półprzepuszczalną
• na podstawie ciśnienia osmotycznego jakie białko wywiera na błonę półprzepuszczalną
w ściśle określonym
w ściśle określonym pH
pH i stężeniu białka w roztworze.
i stężeniu białka w roztworze.
• na podstawie efektu
• na podstawie efektu Tyndala
Tyndala ( rozpraszania światła )
( rozpraszania światła )
• chromatografia na sitach molekularnych
• chromatografia na sitach molekularnych
• Elektroforeza żelowa SDS
• Elektroforeza żelowa SDS
• Metoda wirowania w różnych gradientach stężeń
• Metoda wirowania w różnych gradientach stężeń
60
60 -- 20% roztwór sacharozy
20% roztwór sacharozy
6M roztwór chlorku cezu sam tworzy gradient
6M roztwór chlorku cezu sam tworzy gradient
Są to metody porównawcze naszego białka z białkiem stanowiącym wzorzec standardowy.
Są to metody porównawcze naszego białka z białkiem stanowiącym wzorzec standardowy.
Określenie struktury I rzędowej białka
Określenie struktury I rzędowej białka
1. Jeśli białko jest
1. Jeśli białko jest heteropolimeryczne
heteropolimeryczne tzn
tzn zawiera
zawiera wiecej
wiecej niż jeden łańcuch polipeptydowy
niż jeden łańcuch polipeptydowy
to łańcuchy należy rozdzielić i oczyścić .
to łańcuchy należy rozdzielić i oczyścić .
Rozrywanie wiązań :
Rozrywanie wiązań :
-- wodorowe
wodorowe -- 8M mocznik
8M mocznik
6M chlorowodorek guanidyny
6M chlorowodorek guanidyny
-- diS
diS -- utlenianie kwasem
utlenianie kwasem nadmrówkowym
nadmrówkowym do SO
do SO
3
3
2
2--
-- redukcja za pomocą β
redukcja za pomocą β -- merkaptoetanolu
merkaptoetanolu do
do --SH a następnie należy
SH a następnie należy
podziałać kwasem
podziałać kwasem jodooctowym
jodooctowym lub akrylonitrylem aby zablokować
lub akrylonitrylem aby zablokować
grupę
grupę --SH i zapobiec powstawaniu nowych wiązań
SH i zapobiec powstawaniu nowych wiązań diS
diS
-- hydrofobowe
hydrofobowe -- detergenty
detergenty
-- jonowe
jonowe -- kwasy , zasady
kwasy , zasady
Rozdział i oczyszczanie
Rozdział i oczyszczanie -- podobnie jak białka
podobnie jak białka
Enzymy jako katalizatory
Enzymy s
ą
katalizatorami, które zwi
ę
kszaj
ą
szybko
ść
reakcji
chemicznej,
same
nie
ulegaj
ą
c
zmianie.
W
nieobecno
ś
ci enzymu reakcja mo
ż
e zachodzi
ć
niezwykle
wolno,
natomiast
w
jego
obecno
ś
ci
szybko
ść
reakcji
znacznie wzrasta, nawet do 107 razy. Reakcje katalizowane
przez
enzymy
zazwyczaj
przebiegaj
ą
we
wzgl
ę
dnie
łagodnych warunkach (temperatura poni
ż
ej 100°C, ci
ś
nienie
atmosferyczne i oboj
ę
tne pH) - w porównaniu z warunkami
odpowiednich
niekatalizowanych
reakcji
chemicznych.
Enzymy s
ą
wysoce specyficzne wzgl
ę
dem substratów, na
które
działaj
ą
,
i
produktów,
które
tworz
ą
.
Poza
tym
aktywno
ść
enzymatyczna mo
ż
e by
ć
regulowana, zmieniaj
ą
c
si
ę
w
zale
ż
no
ś
ci
od
st
ęż
enia
substratów
lub
innych
cz
ą
steczek. Prawie wszystkie enzymy s
ą
białkami, chocia
ż
zidentyfikowano
te
ż
kilka
rodzajów
cz
ą
steczek
RNA
aktywnych katalitycznie.
2009-12-31
6
Energia
aktywacji i stan przej
ś
ciowy
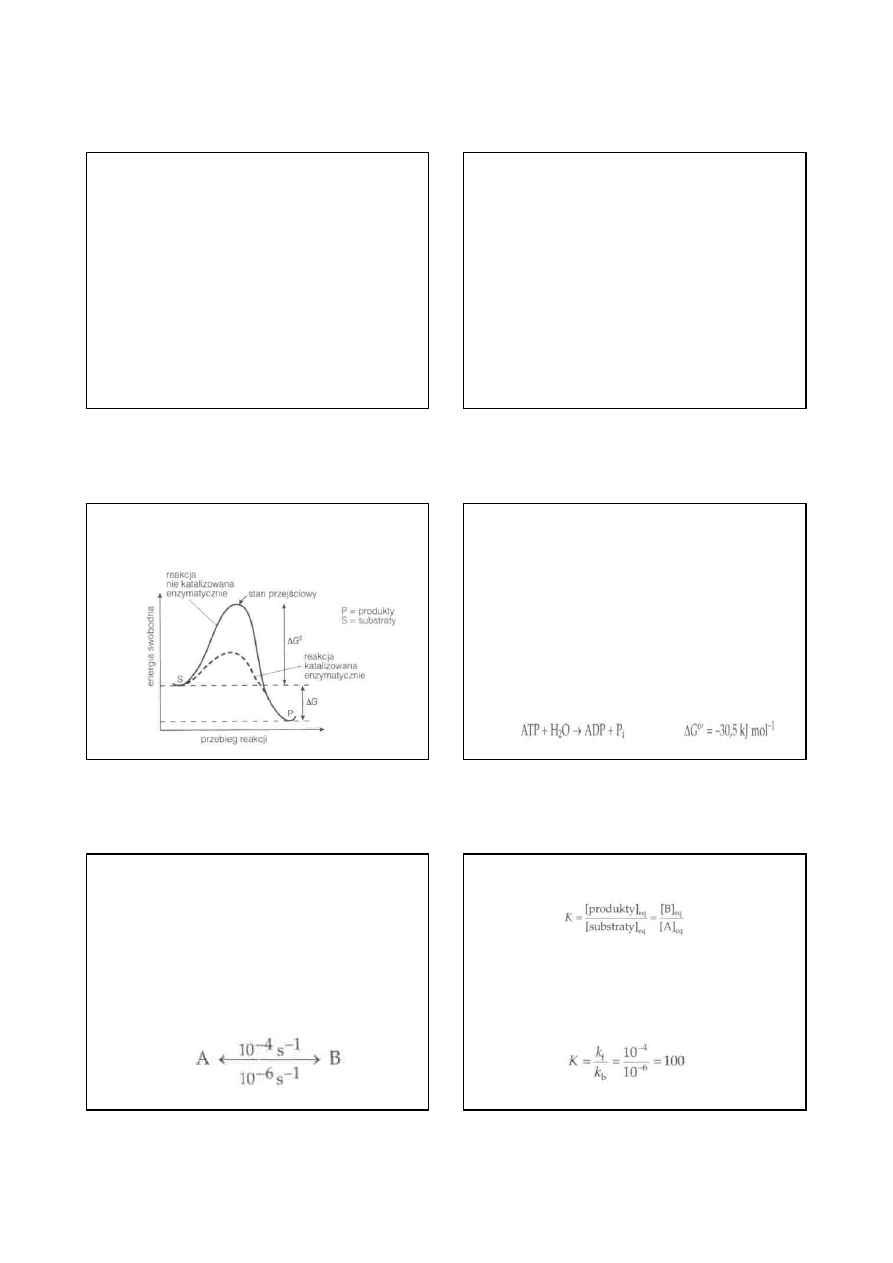
• Zmiany energii zachodzące w przebiegu reakcji biochemicznej
przedstawiono na rysunku. Dla wszystkich reakcji istnieje
bariera energetyczna, którą należy pokonać, aby umożliwić
przebieg
reakcji.
Jest
to
ilość
energii
potrzebna
do
przeprowadzenia cząsteczek substratu w stan przejściowy,
który jest niestabilną formą chemiczną, prowadzącą od
substratów do produktów. Stan przejściowy ma największą
energię swobodną ze wszystkich związków w drodze reakcji.
Energia aktywacji (∆G*) równa jest różnicy w energii
swobodnej między stanem przejściowym a substratem. Enzym
działa w drodze stabilizowania stanu przejściowego reakcji
chemicznej i zmniejsza ∆G*. Enzym nie zmienia poziomu
energii zarówno substratu, jak i produktu. Tak więc enzym
zwiększa szybkość przebiegu reakcji, ale nie wpływa na
ogólną zmianę energii w tej reakcji.
Zmiana energii swobodnej
•
Zmiana energii swobodnej (Gibbsa) decyduje, czy reakcja b
ę
dzie
energetycznie korzystna, czy niekorzystna. Na rysunku
przedstawiono przykład, w którym sumaryczna zmiana energii
reakcji czyni j
ą
energetycznie korzystn
ą
(tzn. produkty maj
ą
ni
ż
szy
poziom energii ni
ż
substraty, a
∆
G ma warto
ść
ujemn
ą
). Nale
ż
y
zaznaczy
ć
,
ż
e
∆
G jest poj
ę
ciem innym ni
ż
∆
G*. Warto
ść
∆
G reakcji
jest niezale
ż
na od drogi reakcji i nie dostarcza
ż
adnej informacji o
szybko
ś
ci reakcji, poniewa
ż
o szybko
ś
ci reakcji decyduje
∆
G*.
Ujemna warto
ść
∆
G wskazuje,
ż
e reakcja jest termodynamicznie
korzystna we wskazanym kierunku (tj. ma du
żą
szans
ę
przebiegu
spontanicznego), natomiast dodatnia warto
ść
∆
G wskazuje,
ż
e
reakcja jest termodynamicznie niekorzystna i wymaga nakładu
energii, aby zaj
ść
we wskazanym kierunku. W układach
biochemicznych ten nakład energii uzyskuje si
ę
cz
ę
sto przez
sprz
ęż
enie reakcji energetycznie niekorzystnej z reakcj
ą
energetycznie korzystn
ą
(reakcje sprz
ęż
one).
Zmiany energii zachodz
ą
ce podczas
przebiegu reakcji biochemicznej
Często jest korzystne odwoływanie się do wartości
∆
G aktualnej dla standardowego zestawu warunków,
jakimi są jednakowe stężenia (1,0 M) zarówno
substratów, jak i produktów reakcji oraz przebieg
reakcji w stałym pH 7,0. W tych warunkach wartość
stwierdzana dla
∆
G jest nieco odmienna niż w
innych warunkach i jest określana jako
∆
G°.
Przykładem reakcji energetycznie korzystnej, o
dużej ujemnej wartości ∆G° i często używanej do
napędzania reakcji energetycznie niekorzystnych
jest hydroliza ATP, tworząca ADP i wolny Pi:
Równowaga reakcji
Reakcja
chemiczna
istnieje
zazwyczaj
w
stanie
równowagi
dynamicznej, w której mimo ustawicznego przekształcania nowych
cząsteczek substratu i tworzenia nowych cząsteczek produktu,
proporcja substratu do produktu pozostaje stała.
Rozważmy następującą reakcję: gdzie szybkość reakcji w kierunku
wprost (od A do B) wynosi 10
-4
na sekundę (s
-1
), a szybkość reakcji
w kierunku odwrotnym wynosi 10
-6
s
-1
. W równowadze stosunek
stężeń substratu i produktu stanowi wartość stałą, znaną jako stała
równowagi (K).
Stałą równowagi dla danej reakcji definiuje się jako:
gdzie prostokątne nawiasy oznaczają stężenie.
Stała równowagi jest określona przez stosunek
szybkości reakcji w kierunku wprost A do B do
szybkości reakcji w kierunku odwrotnym B do
A

2009-12-31
7
Tak więc dla tej reakcji w stanie równowagi istnieje 100 razy
więcej produktu B niż substratu A, niezależnie od tego, czy
enzym jest obecny, czy nie. Dzieje się tak dlatego, że enzymy
nie zmieniają położenia równowagi reakcji, ale przyspieszają
szybkość reakcji w obu kierunkach w tym samym stopniu.
Innymi słowy, enzymy przyspieszają osiągnięcie stanu
równowagi, ale nie przesuwają jego położenia. W przypadku
pokazanej tu hipotetycznej reakcji, w nieobecności enzymu
reakcja może potrzebować więcej niż godzinę do osiągnięcia
stanu równowagi, natomiast w obecności enzymu może
osiągnąć stan równowagi w czasie krótszym niż 1 sekunda.
Miejsce aktywne
•
Miejsce aktywne enzymu jest regionem, który wiąże substrat i
przemienia go w produkt. Zazwyczaj jest to względnie niewielka część
całej cząsteczki enzymu i stanowi określoną trójwymiarową przestrzeń,
utworzoną przez reszty aminokwasów, które w liniowym łańcuchu
polipeptydowym mogą leżeć daleko od siebie. Miejsce aktywne jest często
szczeliną lub zagłębieniem w cząsteczce enzymu, które tworzy środowisko
w znacznym stopniu niepolarne, co ułatwia wiązanie substratu. Substrat(y)
jest wiązany w miejscu aktywnym przez liczne słabe siły (oddziaływania
elektrostatyczne, wiązania wodorowe, siły van der Waalsa, oddziaływania
hydrofobowe), a w pewnych przypadkach przez odwracalne wiązania
kowalencyjne. Po związaniu cząsteczki substratu i utworzeniu kompleksu
enzym-substrat, katalitycznie czynne reszty w obrębie aktywnego miejsca
enzymu działają na cząsteczkę substratu tak, aby przekształcić go
początkowo w stan przejściowy, a następnie w produkt, który zostaje
uwolniony do roztworu. Potem enzym, już wolny, może związać kolejną
cząsteczkę substratu i rozpocząć nowy cykl katalityczny.
• Zaproponowano dwa modele wyjaśniające, jak enzym może
wiązać
swój
substrat.
W
modelu
zamka
i
klucza,
zaproponowanym przez Emila Fischera w 1894 roku, kształt
substratu i aktywnego miejsca enzymu miałyby pasować do siebie
jak klucz do zamka. Oba kształty są uważane za sztywne i
utrwalone oraz pasujące do siebie idealnie po odpowiednim
zestawieniu.
W
modelu
indukowanego
dopasowania,
zaproponowanym w 1958 roku przez Daniela E. Koshlanda,
związanie
substratu
indukuje
zmianę
konformacyjną
w
aktywnym miejscu enzymu. Poza tym enzym może zniekształcić
substrat wymuszając w nim konformację podobną do stanu
przejściowego. Na przykład, związanie glukozy z heksokinazą
indukuje taką konformacyjną zmianę w strukturze enzymu, że
jego miejsce aktywne przyjmuje kształt komplementarny do
substratu (glukozy) tylko po jego związaniu z enzymem. Różne
enzymy wykazują cechy charakterystyczne dla obu modeli, a więc
pewną komplementarność i pewne zmiany konformacji.
Specyficzno
ść
substratowa
• Właściwości i ułożenie przestrzenne reszt aminokwasów
tworzących aktywne miejsce enzymu determinują rodzaj
cząsteczki, która może zostać związana i stać się substratem
dla tego enzymu. O specyficzności substratowej często
decydują zmiany stosunkowo niewielkiej liczby aminokwasów
w miejscu aktywnym. Widać to wyraźnie w trzech enzymach
trawiennych: trypsynie, chymotrypsynie i elastazie. Te trzy
enzymy należą do rodziny enzymów o nazwie proteazy
serynowe
—
„serynowe",
ponieważ
mają
w
miejscu
aktywnym resztę seryny, której udział w katalizie jest
krytyczny, a „proteazy", ponieważ katalizują hydrolizę wiązań
peptydowych w białku. Te trzy enzymy rozszczepiają
wiązania
peptydowe
w
białkowych
substratach
po
karboksylowej stronie pewnych reszt aminokwasów.
Trypsyna
rozszczepia
(tnie)
po
karboksylowej
stronie
dodatnio
naładowanych reszt Lys lub Arg, chymotrypsyna — po karboksylowej
stronie dużych reszt aminokwasów aromatycznych i hydrofobowych, a
elastaza — po karboksylowej stronie reszt o krótkich, nie naładowanych
łańcuchach bocznych. Różna specyficzność tych enzymów jest narzucona
przez charakter grup aminokwasów w miejscach wiązania substratu,
komplementarnych względem substratu, na który działają. Tak więc
trypsyna ma w swym miejscu wiązania substratu ujemnie naładowaną resztę
Asp, która oddziałuje z dodatnimi ładunkami na bocznych łańcuchach Lys i
Arg substratu. Chymotrypsyna ma w miejscu wiązania substratu reszty
aminokwasów o krótkich łańcuchach bocznych, takie jak Gly i Ser, co
umożliwia wejście do tych miejsc dużych łańcuchów bocznych substratu.
Natomiast elastaza ma względnie duże, nie naładowane boczne łańcuchy
aminokwasów Val i Thr, wystające do miejsca wiązania substratu, co
pozwala na wejście do tego miejsca wyłącznie krótkich łańcuchów
bocznych Gly i Ala substratu.
Klasyfikacja enzymów
•
Wiele enzymów ma nazwy utworzone przez dodanie końcówki ,,-aza" do
nazwy substratu. Tak więc ureaza jest enzymem katalizującym hydrolizę
mocznika (ang. urea), a fruktozo-l,6-bisfosfataza hydrolizuje fruktozo-
1,6-bisfosforan. Jednakże pewne enzymy, np. trypsyna i chymotrypsyna,
mają nazwy nie odnoszące się do ich substratów (nazwy zwyczajowe). Są
też enzymy, które mają po kilka różnych nazw. W celu ujednolicenią nazw
enzymów opracowano system nazewnictwa enzymów, uzgodniony
międzynarodowo (Enzyme Commission — EC). System ten dziel
wszystkie enzymy na sześć głównych klas, opartych na typie prowadzonej
reakcji.
Następnie
każdy
enzym
zostaje
zidentyfikowany
prze
czteroliczbowy numer. Tak więc trypsyna ma numer (EC) 3.4.21.4, przy
czym pierwsza liczba (3) oznacza, że jest ona hydrolazą, druga liczba
oznacza, że jest proteazą, która hydrolizuje wiązania peptydowe, trzeci
liczba (21) oznacza, że enzym jest proteazą serynową, mającą w miejsc
aktywnym krytyczną resztę seryny, a czwarta liczba (4) wskazuje, że to
czwarty enzym historycznie przypisany do tej klasy. Dla porównani
chymotrypsyna ma numer EC 3.4.21.1, a elastaza 3.4.21.36.
2009-12-31
8
Koenzymy i grupy prostetyczne
• Wiele enzymów wymaga do swego specyficznego działania
obecności
małych
jednostek
niebiałkowych
o
nazwie
kofaktory. Kofaktorami może być jeden lub więcej jonów
nieorganicznych, np. Zn
2+
lub Fe
2+
, albo złożona cząsteczka
organiczna o nazwie koenzym. Taki metal lub koenzym, który
jest kowalencyjnie związany z enzymem, nazwa się grupą
prostetyczną (np. hem w hemoglobinie). Całość katalitycznie
aktywnego enzymu wraz z jego koenzymem lub jonem metalu
określa się jako holoenzym. Sama białkowa część enzymu bez
jego
kofaktora
jest
nazywana
apoenzymem.
Pewne
koenzymy, takie jak NAD
+
, są wiązane i uwalniane przez
enzym w czasie jego cyklu katalitycznego i dlatego działają
one właściwie jako kosubstraty. Wiele koenzymów jest
pochodnymi prekursorów — witamin, które są często
istotnym składnikiem pożywienia, a których niedostateczny
dopływ wywołuje choroby z niedoboru.
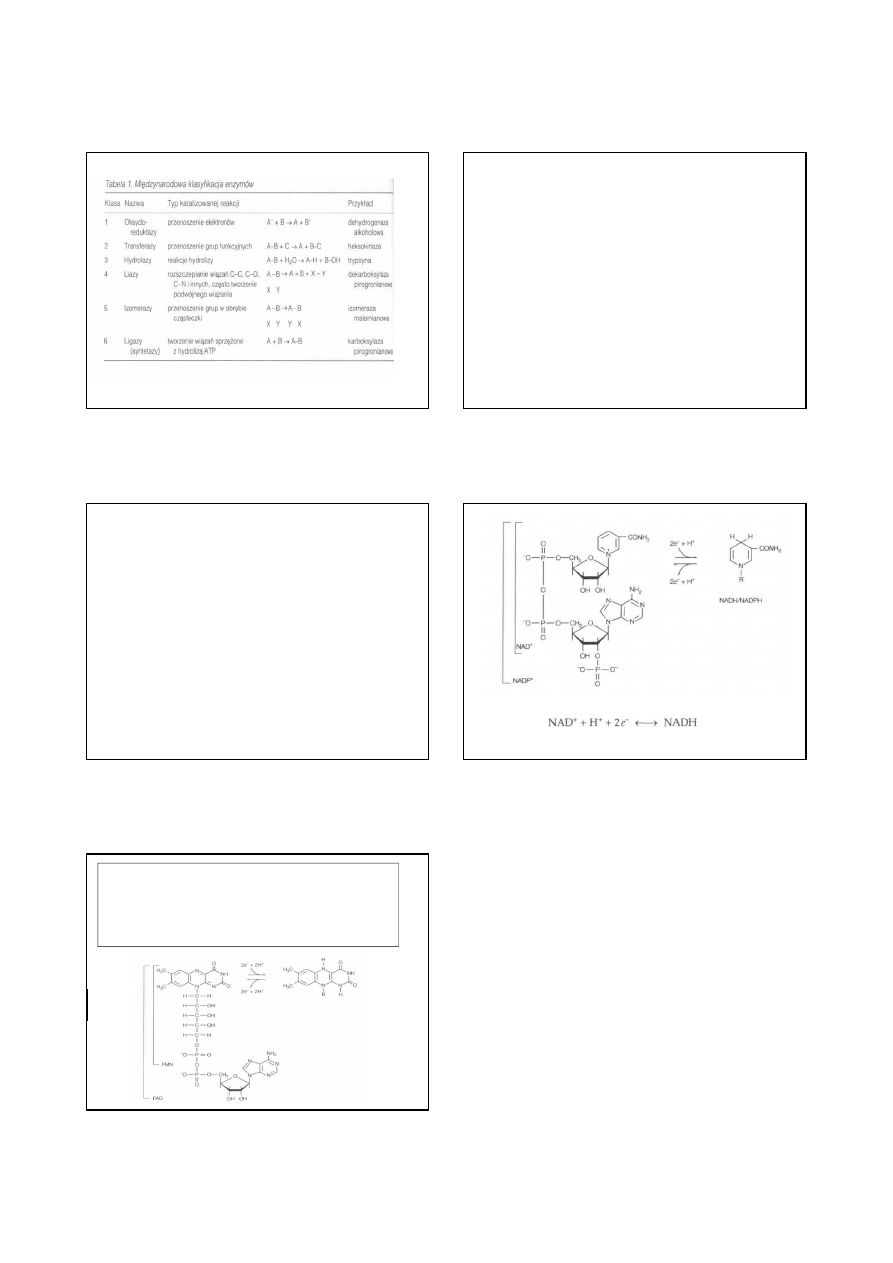
Dinukleotyd
nikotynoamidoadeninowy
(NAD
+
)
oraz
fosforan
dinukleotydu
nikotynoamidoadeninowego
(NADP
+
) są koenzymami mającymi wspólną strukturę opartą
na adeninie, dwóch cząsteczkach rybozy (cukru) powiązanych
grupami fosforanowymi i pierścieniu nikotynoamidowym.
NADP
+
różni się od NAD
+
dodatkową grupą fosforanową
przyłączoną do jednej z cząsteczek rybozy. Oba te koenzymy
pełnią jedną z podstawowych funkcji, jaką jest przenoszenie
elektronów i udział w reakcjach oksydoredukcyjnych.
NAD
+
jest częściej używany w reakcjach katabolicznych
(rozkładu), natomiast NADP
+
jest używany w reakcjach
anabolicznych
(biosyntezy).
Reaktywną
częścią
obu
cząsteczek jest pierścień nikotynoamidowy, który może
występować w formie albo zredukowanej, albo utlenionej, a w
ten sposób działać w reakcji enzymatycznej jako akceptor lub
donor elektronów:
Dinukleotyd flawinoadeninowy (FAD) oraz mononukleotyd flawinowy
(FMN) również są przenośnikami elektronów i mają podobną strukturę
chemiczną. Oba te koenzymy zawierają jednostkę mononukleotydu
flawinowego, która ma miejsce reaktywne. FAD ma dodat-kową grupę
cukrową i zasadę adeninową, powiększające jego strukturę. FAD oraz FMN
reagują z dwoma protonami oraz z dwoma elektronami, oscylując między
stanem utlenionym i zredukowanym:
Wyszukiwarka
Podobne podstrony:
Chemia Bionie wyk1
Chemia Jadrowa 07 [tryb zgodnosci]
Chemia Jadrowa 01 [tryb zgodnosci]
Chemia Jadrowa 05 [tryb zgodnosci]
Chemia Jadrowa 06 [tryb zgodnosci]
Chemia Jadrowa 02 [tryb zgodnosci]
Chemia Jadrowa 03 [tryb zgodnosci]
Chemia Jadrowa 04 [tryb zgodnosci]
Chemia Bionie wyk1
Chemia organiczna wyklad 1 [tryb zgodnosci]
Chemia organiczna wyk�ad 3 [tryb zgodnosci]
Chemia organiczna wyk�ad 8 [tryb zgodnosci]
Chemia organiczna wyk�ad 4 [tryb zgodnosci]
Chemia organiczna wyklad 13 [tryb zgodnosci]
Chemia organiczna wyklad 12 [tryb zgodnosci]
Chemia organiczna wyk�ad 9 [tryb zgodnosci]
Chemia organiczna wyk�ad 2 [tryb zgodnosci]
więcej podobnych podstron