
Katedra i Zakład Chemii Medycznej
UM w Lublinie
str. 1
Ćwiczenie 3: Iloczyn rozpuszczalności
1. Czynniki wpływające na rozpuszczalność osadów.
Zależność rozpuszczalności substancji od temperatury
W 2 probówkach wirówkowych umieścić po 0,5 ml roztworu Pb(CH
3
COO)
2
. Do pierwszej z
nich dodawać kroplami roztworu 2M HCl, a do drugiej K
2
CrO
4
do momentu pojawienia się
osadu (2-5 kropli!!!). Poczekać chwilę, aż wytrącone osady osiądą na dnie probówek, a
następnie je odwirować (5 min). Przesącz zlać znad osadów, a do probówek z osadami wlać
znaczną ilość wody destylowanej, a następnie przenieść ją wraz z osadem do czystych
probówek szklanych. Probówki ogrzewać na wrzącej łaźni wodnej przez ok. 10 minut,
okresowo wstrząsając.
Podać wyniki obserwacji. Przebiegające reakcje zapisać w formie jonowej. Sformułować
wnioski. Co obserwuje się po oziębieniu roztworów?
Zależność rozpuszczalności substancji od pH
W dwóch oddzielnych probówkach strącić osad szczawianu wapnia, używając po 5 kropli
roztworów CaCl
2
i (NH
4
)
2
C
2
O
4
. Do jednej probówki dodać 2 ml 2M HC1, a do drugiej
roztworu CH
3
COOH. Zmierzyć pH roztworów w obu probówkach za pomocą papierka
wskaźnikowego.
Podać wyniki obserwacji. Przebiegające reakcje zapisać w formie jonowej. Sformułować
wnioski.
Zależność rozpuszczalności od stężenia
W trzech jednakowych probówkach umieścić po jednej kropli roztworu Pb(CH
3
COO)
2
. Do
dwóch z nich dodać wody destylowanej - do pierwszej ok. 4 ml, a do drugiej 8 ml. Następnie
do każdej z próbówek dodać po jednej kropli roztworu KI i wymieszać zawartość.
Przebieg zachodzącej reakcji zapisać w formie jonowej. Podać wyniki obserwacji.
Wpływ wspólnego jonu i efekt solny
Do dwóch probówek dodać po 2 ml roztworu CaCl
2
i 0,5 ml roztworu H
2
SO
4
. Probówki
wstrząsać 20 sekund, obserwując powstawanie pierwszych kryształków osadu, następnie do
probówki pierwszej dodać 2 ml roztworu Na
2
SO
4
, a do drugiej roztworu NaCl. Probówki
wstrząsać 1 minutę i porównać ilości powstałych osadów.
Zapisać jonowo przebieg reakcji wytrącania osadu. Opisać wpływ dodanych jonów na
przebieg reakcji. Sformułować wnioski.
2. Badanie kolejności strącania osadów
Przeprowadzić w dwóch probówkach następujące reakcje:
probówka 1: AgNO
3
+ K
2
CrO
4
,
probówka 2: AgNO
3
+ NaCl.
Zanotować kolor i jakość powstających osadów.
Następnie w trzeciej probówce umieścić po 2 krople roztworów NaCl i K
2
CrO
4
. Dolać ok. 4
ml wody destylowanej i wymieszać. Dodawać kroplami roztwór AgNO
3
mieszając dokładnie
po dodaniu każdej kropli. Obserwować kolejność strącania osadów.
Zapisać jonowo przebieg reakcji. Sformułować wnioski.
Katedra i Zakład Chemii Medycznej
UM w Lublinie
str. 2
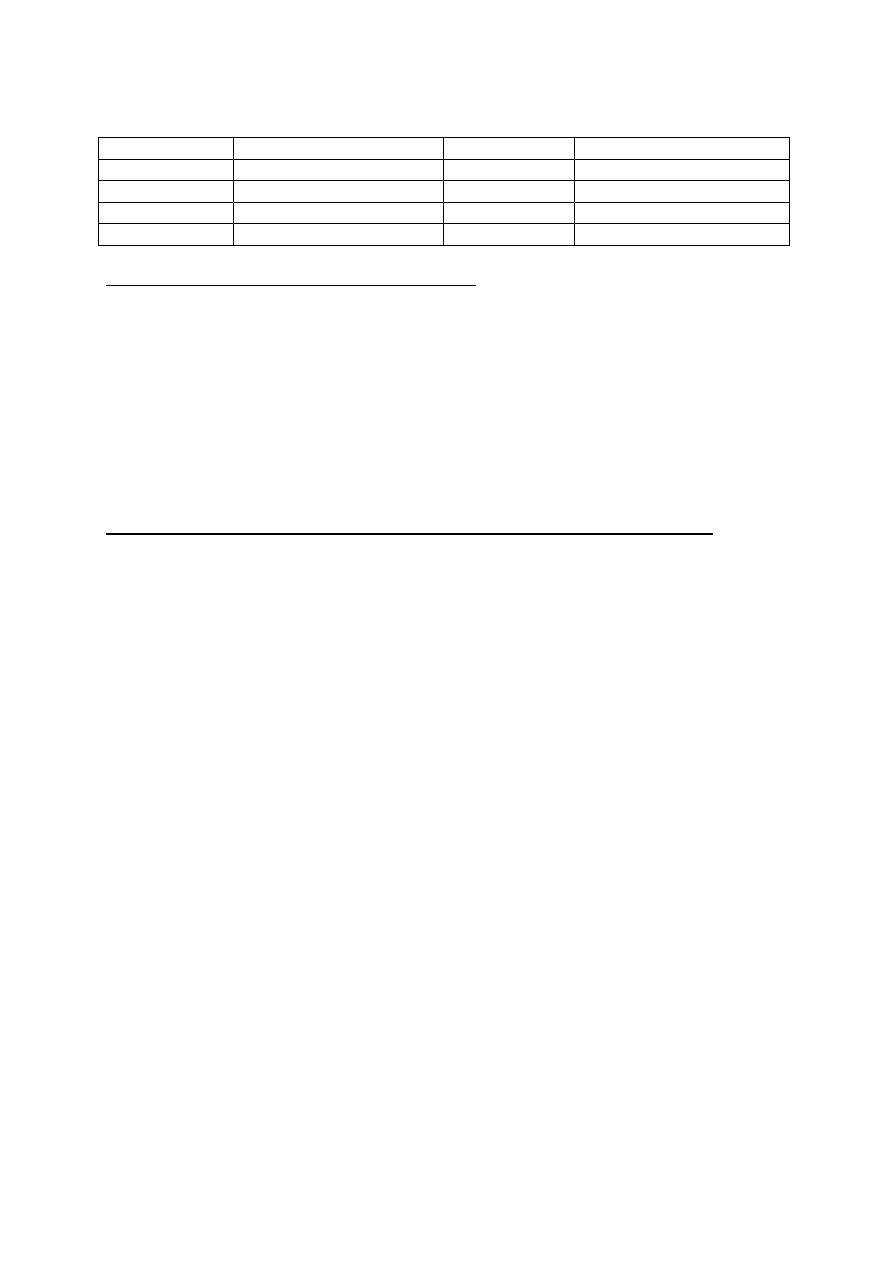
Tabela 1. Wartości iloczynu rozpuszczalności dla soli otrzymywanych w ćwiczeniach 1-2
Związek
Iloczyn rozpuszczalności
Związek
Iloczyn rozpuszczalności
PbCl
2
1,7∙10
-5
CaC
2
O
4
2,6∙10
-9
PbCrO
4
1,8∙10
-14
CaSO
4
6,3∙10
-5
PbI
2
8,7∙10
-9
Ag
2
CrO
4
4,1∙10
-12
AgCl
1,6∙10
-10
3. Rozpuszczalność kwasu moczowego i jego soli
Do trzech probówek dodać niewielką ilość kwasu moczowego, a następnie 1 ml wody
destylowanej i energicznie wytrząsać. Większość kwasu moczowego pozostaje
nierozpuszczone, ponieważ słabo rozpuszcza się w wodzie (25 mg/l w 18°C).
Pierwszą probówkę zostawić jako kontrolę. Następnie do drugiej probówki dodać 1 ml
wodorotlenku sodu, a do trzeciej 1 ml stężonego amoniaku. Porównać rozpuszczalność
powstałych soli. Zawartość drugiej probówki zakwasić dodając kroplami rozcieńczony HCl.
Obserwować wypadanie kwasu moczowego z roztworu.
Sformułować wnioski.
4. Kolorymetryczne oznaczanie stężenia kwasu moczowego w surowicy i moczu
Kwas moczowy jest końcowym produktem katabolizmu nukleotydów purynowych u ssaków.
Kwas moczowy redukuje kwas fosforowolframowy (odczynnik Folina-Denisa) w obecności
węglanu sodowego do tlenku wolframu barwy niebieskiej. Intensywność barwy jest wprost
proporcjonalna do zawartości kwasu moczowego w badanej próbie.
Wykonanie:
Krzywa wzorcowa: Do sześciu czystych szklanych probówek odpipetować kolejno po 3 ml
wody destylowanej do pierwszej probówki, a do probówek 2-6 kolejno roztworu kwasu
moczowego o stężeniach 2,5 mg%, 3 mg%, 4 mg%, 4,5 mg% i 5 mg %. Następnie do każdej
z nich dodać 0,6 ml roztworu Na
2
CO
3
z mocznikiem oraz 0,15 ml odczynnika Folina-Denisa,
wymieszać, pozostawić na 10 minut w temperaturze pokojowej, a następnie odczytać
absorbancję przy długości fali 635 nm. Sporządzić wykres zależności stężenia roztworu
kwasu moczowego od absorbancji.
Przygotowanie próby badanej: Do probówki wirówkowej odpipetować 0,9 ml surowicy, 5 ml
2% roztworu Na
2
WO
3
oraz 3,6 ml roztworu 0,16 N H
2
SO
4
i wymieszać a następnie
odwirować (5 min przy 3000 rpm). Zlać supernatant znad osadu.
Próba badana: Do szklanej probówki odpipetować 3 ml supernatantu (X
1
, X
2
, X
3
), dodać 0,6
ml roztworu Na
2
CO
3
z mocznikiem oraz 0,15 ml odczynnika Folina-Denisa, wymieszać i
pozostawić na 10 minut w temperaturze pokojowej. Następnie odczytać absorbancję próby
badanej przy długości fali 635 nm. Stężenie kwasu moczowego w próbce należy odczytać z
krzywej kalibracyjnej wykonanej dla roztworów kwasu moczowego o znanym stężeniu.
Prawidłowe stężenie kwasu moczowego w surowicy u osób dorosłych wynosi 2,5-7 mg.
Wyszukiwarka
Podobne podstrony:
Bufory krwi układy związków chemicznych rozpuszczobych w osoczu krwi, Biochemia
Związki chemiczne
Związki chemiczne produkty reakcji tlenków z wodą
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
spr cw 11, Technologia chemiczna, semestr 2, Fizyka, Laboratorium, laboratoria fizyka bincia
Cw 8 Utlenianie zwiazkow organicznych
Zasady nomenklatury związków chemicznych, Chemia
Zanieczyszczeniami gleb i gruntów są wszelkie związki chemiczne i pierwiastki promieniotwórczex
gr3, Elektroliza - proces rozkładu związków chemicznych i separacji produktów tego rozkładu pod wpły
Gimznazjum Sprawdziany Chemia Związki chemiczne w życiu codziennym test
Zwiazki chemiczne pierwistakow Nieznany
Pierwiastki i związki chemiczne a zanieczyszczenia środowiska
Barwniki fotosyntetyczne, Barwniki fotosyntetyczne (asymilacyjne) - barwne związki chemiczne odgrywa
Sprawozdanie 1 typy związków chemicznych
Związki chemiczne nazywane feromonami, Studia, 1-stopień, inżynierka, Ochrona Środowiska
materialy ceramiczne cw 3 prasowanie, Technologia chemiczna, Materiały ceramiczne
PIERWIASTKI I ZWIĄZKI CHEMICZNE
biofizyka, błony, Budowa i właściwości struktur biologicznych zależy nie tylko od właściwości związk
więcej podobnych podstron