
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 1356/2005
z dnia 18 sierpnia 2005 r.
zmieniaj
ące załącznik I do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego wspólnotową
procedur
ę określania najwyższego dopuszczalnego poziomu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia zwierzęcego w odniesieniu do
kwasu oksolinowego i morantelu
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzgl
ędniając Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę
okre
ślania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia
zwierz
ęcego (
1
), w szczególno
ści jego art. 2,
uwzgl
ędniając opinię Europejskiej Agencji ds. Oceny Produktów
Leczniczych wydan
ą przez Komitet ds. Weterynaryjnych
Produktów Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje czynne farmakologicznie, które s
ą
stosowane we Wspólnocie w produktach leczniczych
przeznaczonych do podawania zwierz
ętom hodowanym
w celu produkcji
żywności powinny być oceniane
zgodnie z rozporz
ądzeniem (EWG) nr 2377/90.
(2)
Kwas oksolinowy zosta
ł ujęty w załączniku I do rozpo-
rz
ądzenia (EWG) nr 2377/90 w odniesieniu do mięśni,
skóry, t
łuszczu, wątroby i nerek kurczaków i świń oraz
do mi
ęśni i skóry ryb, w naturalnych proporcjach,
z wyj
ątkiem zwierząt, których jaja są przeznaczone do
spo
życia przez ludzi. Wpis ten powinien zostać rozsze-
rzony o wszystkie ssaki hodowane w celu produkcji
żywności, z wyjątkiem zwierząt, których mleko i jaja są
przeznaczone do spo
życia przez ludzi. W przypadku ryb
wpis ten odnosi si
ę jedynie do „mięśni i skóry,
w naturalnych proporcjach
”, a w przypadku świń
i drobiu najwy
ższy dopuszczalny poziom pozostałości
dotycz
ący tłuszczu odnosi się do „skóry i tłuszczu,
w naturalnych proporcjach
”.
(3)
Morantel zosta
ł ujęty w załączniku I do rozporządzenia
(EWG) nr 2377/90 w odniesieniu do mi
ęśni, tłuszczu,
w
ątroby, nerek i mleka bydła i owiec. Wpis ten powinien
obj
ąć wszystkie przeżuwacze.
(4)
Rozporz
ądzenie (EWG) nr 2377/90 powinno zostać
odpowiednio zmienione.
(5)
Aby umo
żliwić wykonanie przepisów niniejszego rozpo-
rz
ądzenia, jego stosowanie należy rozpocząć dopiero po
odpowiednim okresie, co pozwoli Pa
ństwom Członkow-
skim dostosowa
ć zezwolenia na wprowadzenie do
obrotu wydawane zgodnie z dyrektyw
ą 2001/82/WE
Parlamentu Europejskiego i Rady z dnia 6 listopada
2001 r. w sprawie wspólnotowego kodeksu odnosz
ącego
si
ę do weterynaryjnych produktów leczniczych (
2
).
(6)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artykuł 1
W za
łączniku I do rozporządzenia (EWG) nr 2377/90 wpro-
wadza si
ę zmiany zgodnie z Załącznikiem do niniejszego
rozporz
ądzenia.
PL
19.8.2005
Dziennik Urz
ędowy Unii Europejskiej
L 214/3
(
1
) Dz.U. L 224 z 18.8.1990, str. 1. Rozporz
ądzenie ostatnio zmie-
nione rozporz
ądzeniem Komisji (WE) nr 1299/2005 (Dz.U. L 206
z 9.8.2005, str. 4).
(
2
) Dz.U. L 311 z 28.11.2001, str. 1. Dyrektywa ostatnio zmieniona
dyrektyw
ą 2004/28/WE (Dz.U. L 136 z 30.4.2004, str. 58).

Artykuł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po jego opublikowaniu w Dzienniku Urzędowym
Unii Europejskiej.
Niniejsze rozporz
ądzenie stosuje się od dnia 18 października 2005 r.
Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
Pa
ństwach Członkowskich.
Sporz
ądzono w Brukseli, 18 sierpnia 2005 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodniczący
PL
L 214/4
Dziennik Urz
ędowy Unii Europejskiej
19.8.2005
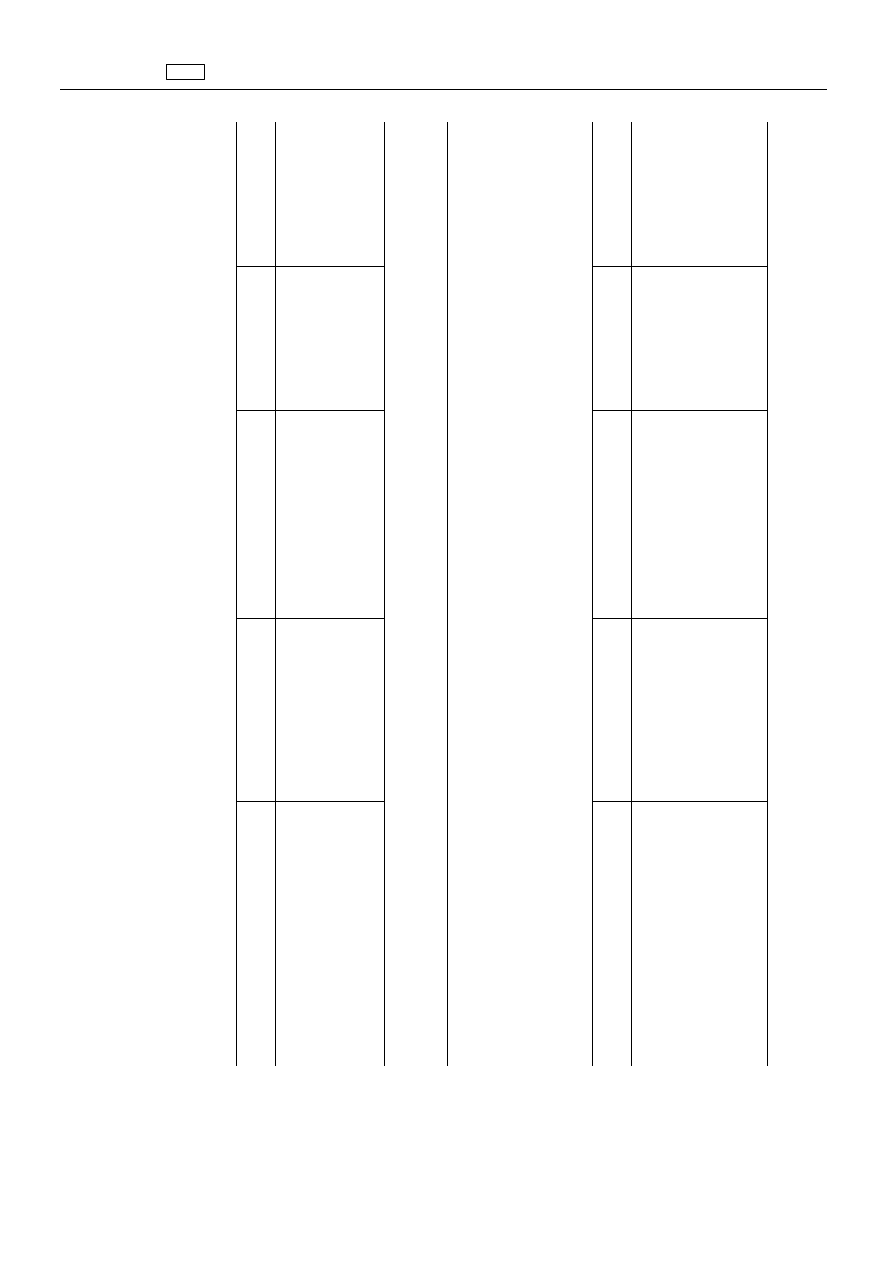
ZA
ŁĄ
CZNIK
A.
Do
za
łą
cznika
I
(Wykaz
substancji
czynnych
farmakologicznie,
dla
których
ustalone
zosta
ły
najwy
ższe
dopuszczalne
limity
pozosta
ło
ści)
wprowadza
się
nast
ępuj
ące
subs
tancje:
1.
Środki
przeciwzaka
źne
1.2.
Antybiotyki
1.2.3.
Chinolony
Substancja
czynna
farmakologicznie
Pozosta
ło
ść
znacznikowa
Gatunek
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
Kwas
oksolinowy
Kwas
oksolinowy
Wszystkie
zwierz
ęta
hodowane
w
celu
produkcji
żywno
ści
(
1
)
100
μg/kg
Mi
ęś
nie
(
2
)
50
μg/kg
Tł
uszcz
(
3
)
150
μg/kg
W
ątroba
150
μg/kg
Nerki
(
1
)
Nie
stosowa
ć
u
zwierz
ąt,
których
mleko
lub
jaja
są
przeznaczone
do
spo
życia
przez
ludzi.
Najwy
ższe
dopuszczalne
poziomy
pozosta
ło
ści
w
odniesieni
u
do
tł
uszczu,
w
ątroby
i
nerek
nie
maj
ą
zastosowania
w
przypadku
ryb.
(
2
)
W
przypadku
ryb
najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
odnosi
si
ę
do
„mi
ęś
ni
i
skóry,
w
naturalnych
proporcjach
”.
(
3
)
W
przypadku
świ
ń
i
drobiu
najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
odnosi
się
do
„skóry
i
tł
uszczu,
w
naturalnych
proporcjach
”.
2.
Środki
przeciwpaso
żytnicze
2.1.
Środki
przeciw
endopaso
żytom
2.1.7.
Tetr
ahydropirymidy
Substancja
czynna
farmakologicznie
Pozosta
ło
ść
znacznikowa
Gatunek
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
Morantel
Suma
pozosta
ło
ści,
które
mog
ą
by
ć
hydrolizowane
do
N-metylo-
1,3-propanodiaminy,
wyra
żona
w
odpowiednikach
morantelu
Wszystkie
prze
żuwacze
100
μg/kg
Mi
ęś
nie
100
μg/kg
Tł
uszcz
800
μg/kg
W
ątroba
200
μg/kg
Nerki
50
μg/kg
Mleko
PL
19.8.2005
Dziennik Urz
ędowy Unii Europejskiej
L 214/5
Wyszukiwarka
Podobne podstrony:
2015 08 20 08 19 24 01
08 19 86
2015 08 20 08 19 11 01
LM 2005 08
2005 08 09 1299
2005 08 Szkoła konstruktorów klasa II
2005 08 Coligun działko magnetyczne
2015 08 20 08 19 34 01
2003 08 19
2005-08-11 Miasto przejmuje pryw nieruchom, materiały, Z PRASY
2005 03 19
2005 08 Najprostszy regulator mocy 220V
25 11 2009 12 08 19 0171 001
2015 08 20 08 19 59 01
2015 08 20 08 19 00 01
08 (19)
AnkietaCSR 2011-08-19, różne
2005 08 Transceiver SSB Antek
więcej podobnych podstron