
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 1299/2005
z dnia 8 sierpnia 2005 r.
zmieniaj
ące załączniki I i III do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego
wspólnotow
ą procedurę określania najwyższego dopuszczalnego poziomu pozostałości
weterynaryjnych produktów leczniczych w
środkach spożywczych pochodzenia zwierzęcego
w odniesieniu do fenoksymetylopenicyliny, foksymu, norgestometu i tiamfenikolu
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
maj
ąc na uwadze Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę
okre
ślania najwyższego dopuszczalnego poziomu pozostałości
weterynaryjnych produktów leczniczych w
środkach spoży-
wczych pochodzenia zwierz
ęcego (
1
), w szczególno
ści jego
art. 2 i art. 4 ust. 3,
uwzgl
ędniając opinie Europejskiej Agencji ds. Oceny Produktów
Leczniczych wydane przez Komitet ds. Weterynaryjnych
Produktów Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje czynne farmakologicznie, które s
ą
stosowane we Wspólnocie w produktach leczniczych
przeznaczonych do podawania zwierz
ętom hodowanym
w celu produkcji
żywności powinny być oceniane
zgodnie z rozporz
ądzeniem (EWG) nr 2377/90.
(2)
Fenoksymetylopenicylina zosta
ła ujęta w załączniku I do
rozporz
ądzenia (EWG) nr 2377/90 w odniesieniu do
mi
ęśni, wątroby i nerek świń. Wpis ten powinien objąć
wymienione tkanki docelowe oraz skór
ę i tłuszcz drobiu,
z wyj
ątkiem zwierząt, których jaja są przeznaczone do
spo
życia przez ludzi.
(3)
Foksym zosta
ł ujęty w załączniku I do rozporządzenia
(EWG) nr 2377/90 w odniesieniu do mi
ęśni, nerek
i t
łuszczu owiec, z wyjątkiem zwierząt, których mleko
jest przeznaczone do spo
życia przez ludzi, a także
w odniesieniu do mi
ęśni, wątroby, nerek, skóry
i t
łuszczu świń. Substancja ta została również ujęta
w za
łączniku III do wspomnianego rozporządzenia
w odniesieniu do kurcz
ąt w oczekiwaniu na zakończenie
bada
ń naukowych. Badania te zostały zakończone
i w zwi
ązku z tym foksym powinien zostać ujęty
w za
łączniku I do wspomnianego rozporządzenia.
(4)
Norgestomet zosta
ł ujęty w załączniku III do rozporzą-
dzenia (EWG) nr 2377/90 w odniesieniu do byd
ła
w oczekiwaniu na zako
ńczenie badań naukowych.
Badania te zosta
ły zakończone i w związku z tym
norgestomet powinien zosta
ć ujęty w załączniku I do
wspomnianego rozporz
ądzenia.
(5)
Substancja tiamfenikol jest uj
ęta w załączniku I do
rozporz
ądzenia (EWG) nr 2377/90 w odniesieniu do
byd
ła i kurcząt, z wyjątkiem zwierząt, których jaja są
przeznaczone do spo
życia przez ludzi. Aby umożliwić
zako
ńczenie badań naukowych mających na celu rozsze-
rzenie z uwzgl
ędnieniem zwierząt z gatunku trzody
chlewnej,
tiamfenikol
powinien
zosta
ć
uj
ęty
w za
łączniku III do wspomnianego rozporządzenia.
(6)
Nale
ży zatem odpowiednio zmienić rozporządzenie
(EWG) nr 2377/90.
(7)
Aby umo
żliwić wykonanie przepisów niniejszego rozpo-
rz
ądzenia, jego stosowanie należy rozpocząć dopiero po
odpowiednim okresie, co pozwoli Pa
ństwom Członkow-
skim dostosowa
ć zezwolenia na wprowadzenie do obrotu
wydawane zgodnie z dyrektyw
ą 2001/82/WE Parlamentu
Europejskiego i Rady z dnia 6 listopada 2001 r. w sprawie
wspólnotowego kodeksu odnosz
ącego się do weterynaryj-
nych produktów leczniczych (
2
).
(8)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artykuł 1
Za
łączniki I i III do rozporządzenia (EWG) nr 2377/90 zmienia
si
ę zgodnie z Załącznikiem do niniejszego rozporządzenia.
PL
L 206/4
Dziennik Urz
ędowy Unii Europejskiej
9.8.2005
(
1
) Dz.U. L 224 z 18.8.1990, str. 1. Rozporz
ądzenie ostatnio zmie-
nione rozporz
ądzeniem Komisji (WE) nr 1148/2005 (Dz.U. L 185
z 16.7.2005, str. 20).
(
2
) Dz.U. L 311 z 28.11.2001, str. 1. Dyrektywa ostatnio zmieniona
dyrektyw
ą 2004/28/WE (Dz.U. L 136 z 30.4.2004, str. 58).

Artykuł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po jego opublikowaniu w Dzienniku Urzędowym
Unii Europejskiej.
Niniejsze rozporz
ądzenie stosuje się od dnia 8 października 2005 r.
Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
Pa
ństwach Członkowskich.
Sporz
ądzono w Brukseli, dnia 8 sierpnia 2005 r.
W imieniu Komisji,
Günter VERHEUGEN
Wiceprzewodniczący
PL
9.8.2005
Dziennik Urz
ędowy Unii Europejskiej
L 206/5
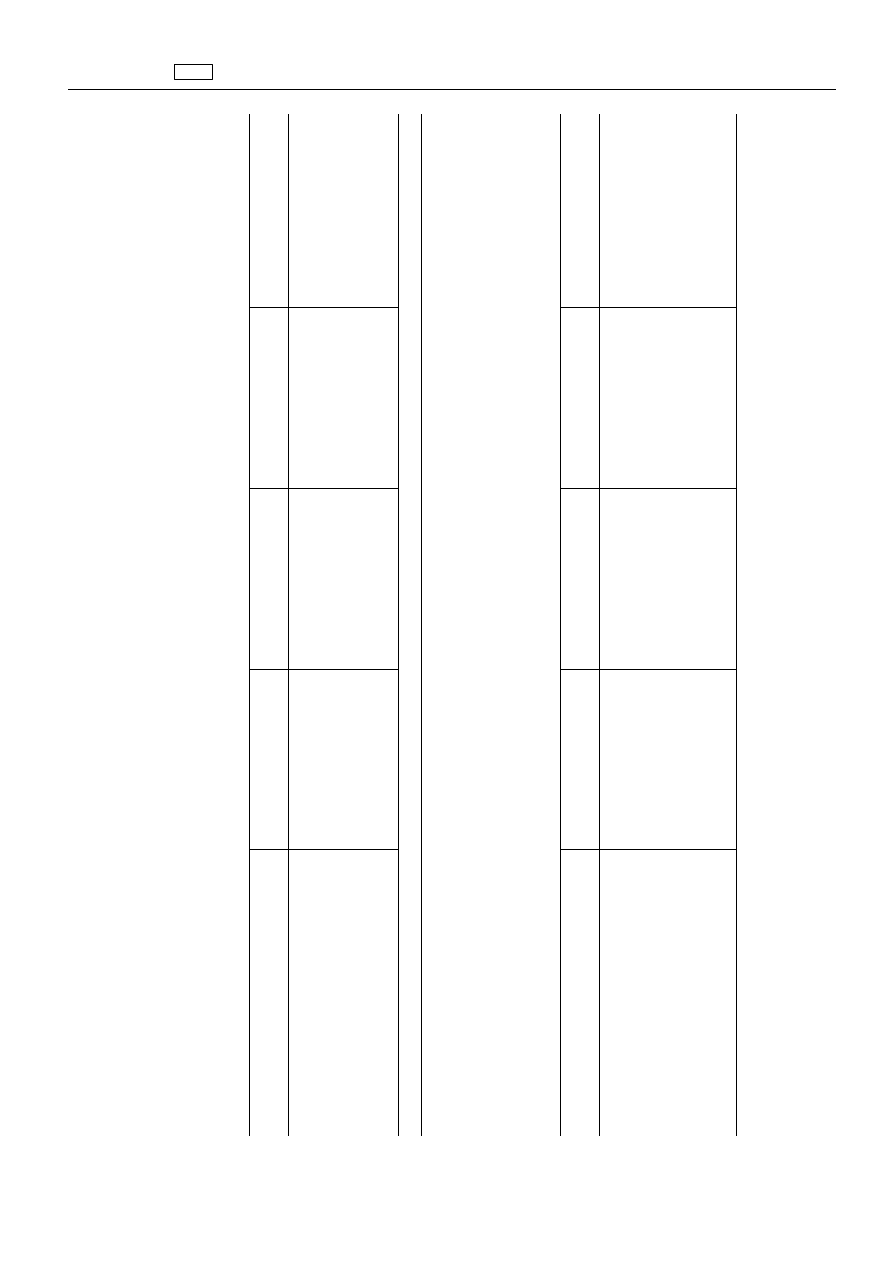
ZA
ŁĄ
CZNIK
A.
Do
za
łą
cznika
I
(Wykaz
substancji
czynnych
farmakologicznie,
dla
których
ustalony
zosta
ł
najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści)
wprowadza
się
nast
ępuj
ące
subs
tancje:
1.
Środki
przeciwzaka
źne
1.2.
Antybiotyki
1.2.1.
Penicyliny
Substancja
czynna
farmakologiczn
ie
Pozosta
ło
ść
znacznikowa
Gatunek
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
„Fenoksymetylopenicylina
Fenoksymetylopenicylina
Drób
(
1
)2
5
μg/kg
Mi
ęś
nie
25
μg/kg
Skóra
+
tł
uszc
z
25
μg/kg
W
ątroba
25
μg/kg
Nerki
(
1
)
Nie
stosowa
ć
u
zwierz
ąt,
których
jaja
przeznaczone
są
do
spo
życia
przez
ludzi.
”
2.
Środki
przeciwpaso
żytnicze
2.2.
Środki
przeciw
ektopaso
żytom
2.2.1.
Zwi
ązki
fosforoorganiczne
Substancja
czynna
farmakologiczn
ie
Pozosta
ło
ść
znacznikowa
Gatunek
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
„Foksym
Foksym
Kurcz
ęta
25
μg/kg
Mi
ęś
nie
550
μg/kg
Skóra
+
tł
uszc
z
50
μg/kg
W
ątroba
30
μg/kg
Nerki
60
μg/kg
Jaja
”
PL
L 206/6
Dziennik Urz
ędowy Unii Europejskiej
9.8.2005
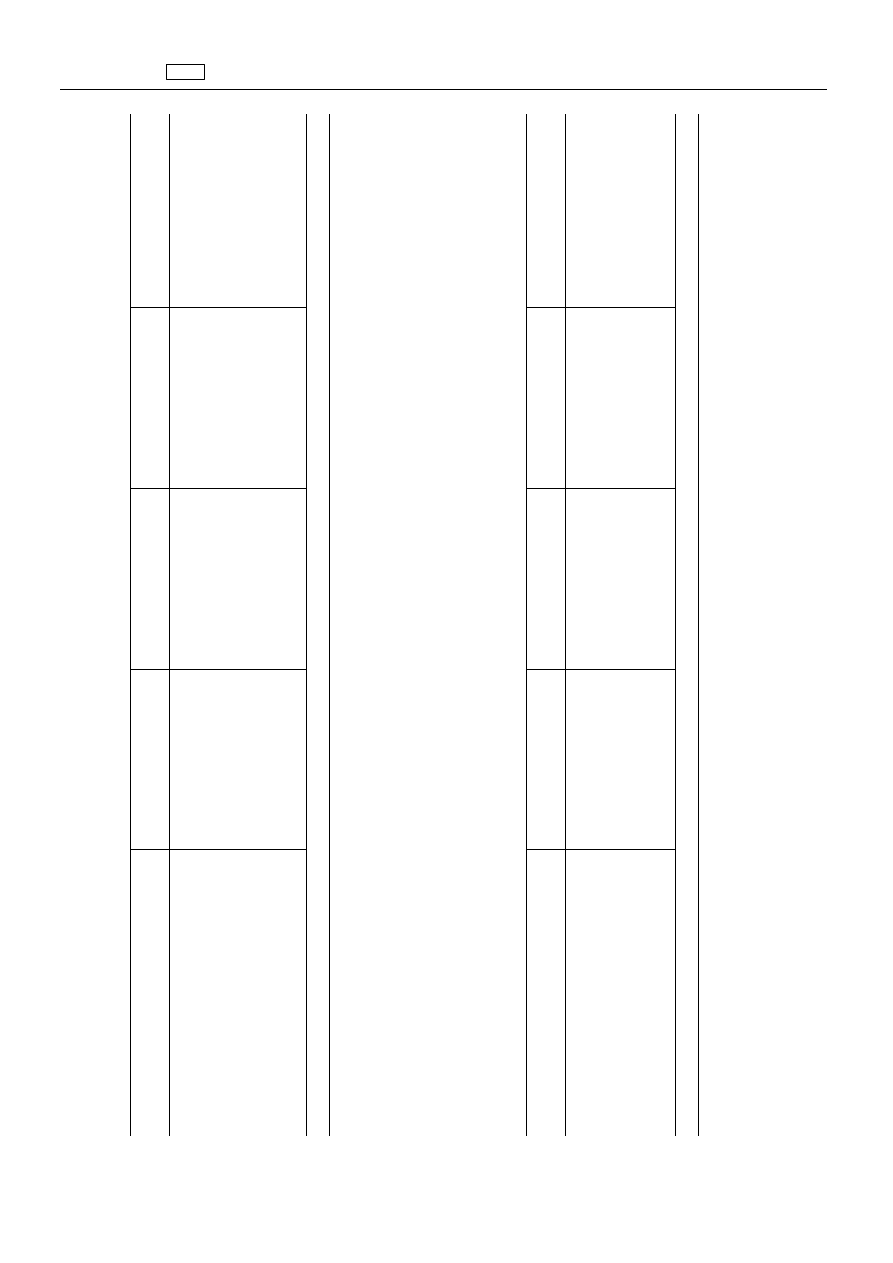
6.
Środki
dzia
łaj
ące
na
system
reprodukcyjny
6.1.
Progestageny
Substancja
czynna
farmakologiczn
ie
Pozosta
ło
ść
znacznikowa
Gatunek
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
„Norgestomet
(
1
)
Norgestomet
Byd
ło
0,2
μg/kg
Mi
ęś
nie
0,2
μg/kg
Tł
uszcz
0,2
μg/kg
W
ątroba
0,2
μg/kg
Nerki
0,12
μg/kg
Mleko
(
1
)
Jedynie
do
celów
terapeutycznyc
h
i
zootechniczny
ch.
”
C.
Do
za
łą
cznika
III
(Wykaz
substancji
czynnych
farmakologicznie
uż
ytych
w
weterynaryjnych
produktach
medycznych,
dla
których
zosta
ł
ustalony
najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści)
wprowadza
się
nast
ępuj
ące
substancje:
1.
Środki
przeciwzaka
źne
1.2.
Antybiotyki
1.2.11.
Florfenikol
i
substancje
pochodne
Substancja
czynna
farmakologiczn
ie
Pozosta
ło
ść
znacznikowa
Gatunek
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
„Tiamfenikol
(
1
)
Tiamfenikol
Trzoda
chlewna
50
μg/kg
Mi
ęś
nie
50
μg/kg
Skóra
+
tł
uszc
z
50
μg/kg
W
ątroba
50
μg/kg
Nerki
(
1
)
Tymczasowe
najwy
ższe
dopuszczalne
poziomy
pozosta
ło
ści
przestaj
ą
obowi
ązywa
ć
od
dnia
1
stycznia
2007
r.”
PL
9.8.2005
Dziennik Urz
ędowy Unii Europejskiej
L 206/7
Wyszukiwarka
Podobne podstrony:
depresja 08 09
PM 08 09 L dz 2 Makrootoczenie
ekonomia 08.09.2010, Notatki lekcyjne ZSEG, Ekonomia
[08-09] Czerniak zlosliwy2, = III ROK =, =Patomorfologia=, =Wykłady=
biologia 2 wl1 08 09
KCh PUREX B POLITECHNIKA 08 09 26
kurier warszawski 08 09 1939
2005 04 09
II D+W Nowy Świat wyk+ćw 08-09, Archeo, ARCHEOLOGIA NOWEGO ŚWIATA
LM 2005 08
IT 6 mgr W PZ WZ 08 09
IMiUE, 9 08 09 zał III
SPEAKING EXAM GENERAL 08, 09 ~$EAKING EXAM GENERAL
javaczeni, 08.09.12 Egzamin Progr sd, Zad
test endokryny 4 rok zima 08 09
więcej podobnych podstron