
Rea
kcje
red
oks
Jedną z najważniejszych reakcji chemicznych w świecie
jest reakcja fotosyntezy:
ditlenek węgla
→ węglowodany
6 CO
2(g)
+ 6 H
2
O
(c)
→ C
6
H
12
O
6(s)
+ 6 O
2(g)
Inną równie istotną z praktycznego punktu widzenia
jest reakcja spalania metanu:
metan
CH
4(g)
+ 2 O
2(g)
→ CO
2(g)
+ 2H
2
O
(c)
re
a
k
cj
e
re
d
o
k
s
W przypadku reakcji kwas - zasada
w przypadku reakcji redoks
kwas zasada + proton
reduktor utleniacz + elektron
2 Mg
(s)
+ O
2 (g)
→ 2 MgO (Mg
2+
; O
2-
)
Reakcje redoks
Przez długi czas termin „utlenianie” dotyczył reakcji z tlenem:
Istotnym etapem reakcji jest przeniesienie elektronów z
jednej substancji na drugą
2 Mg
(s)
+ Cl
2 (g)
→ 2 MgCl
2
(Mg
2+
; 2 Cl
-
)
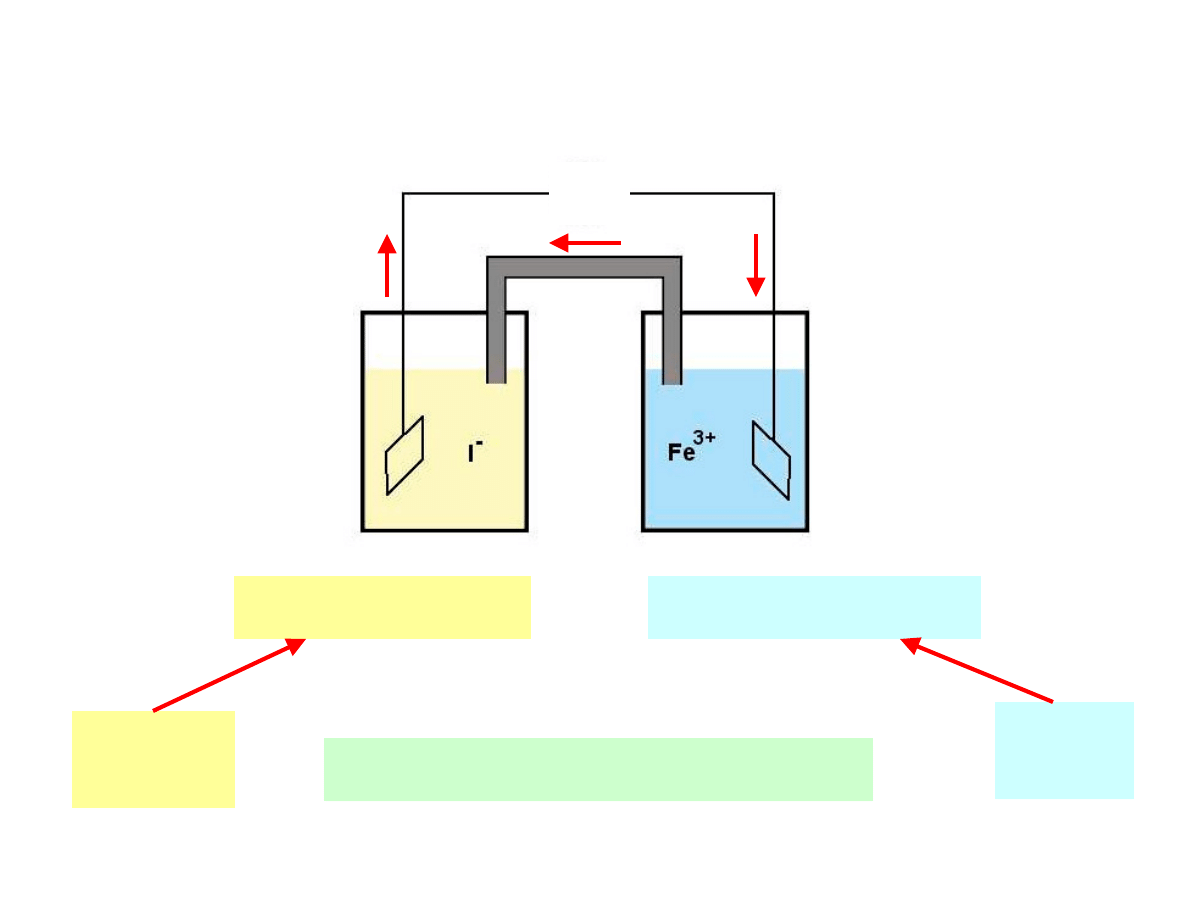
Schemat utleniania I
-
za pomocą Fe
3+
I
-
→
1/2
I
2
+ e
Fe
3+
+ e
→ Fe
2+
w całym układzie zaszła więc reakcja:
Fe
3+
+ I
-
→ Fe
2+
+
1/2
I
2
reakcja
utleniania
reakcja
redukcji
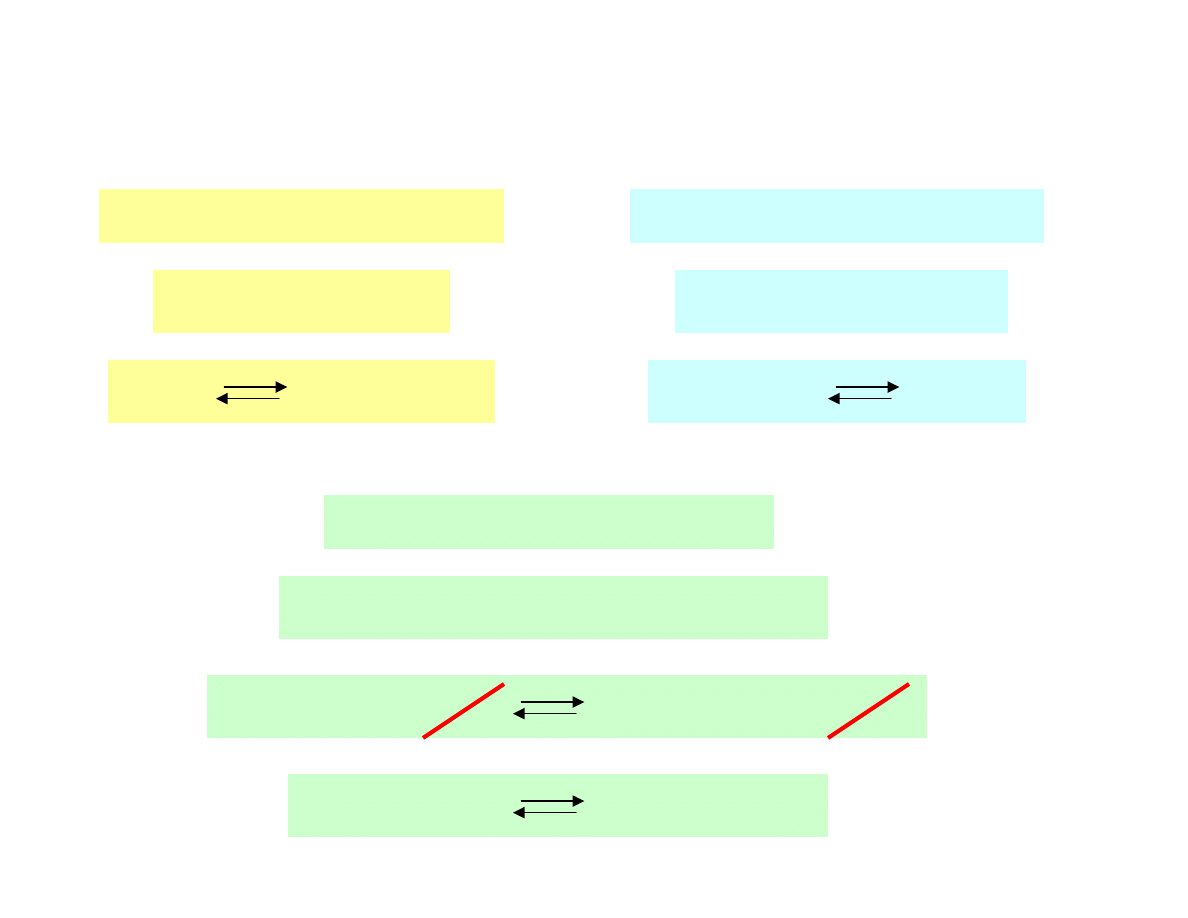
Reakcje redoks
I
-
→
1/2
I
2
+ e
Fe
3+
+ e
→ Fe
2+
Fe
3+
+ I
-
→ Fe
2+
+
1/2
I
2
reakcja utleniania
reakcja redukcji
red
1
utl
1
+ ne
reakcja utleniania-redukcji
utl
2
+ red
1
+ ne red
2
+ utl
1
+ ne
utl
2
+ ne red
2
utl
2
+ red
1
red
2
+ utl
1
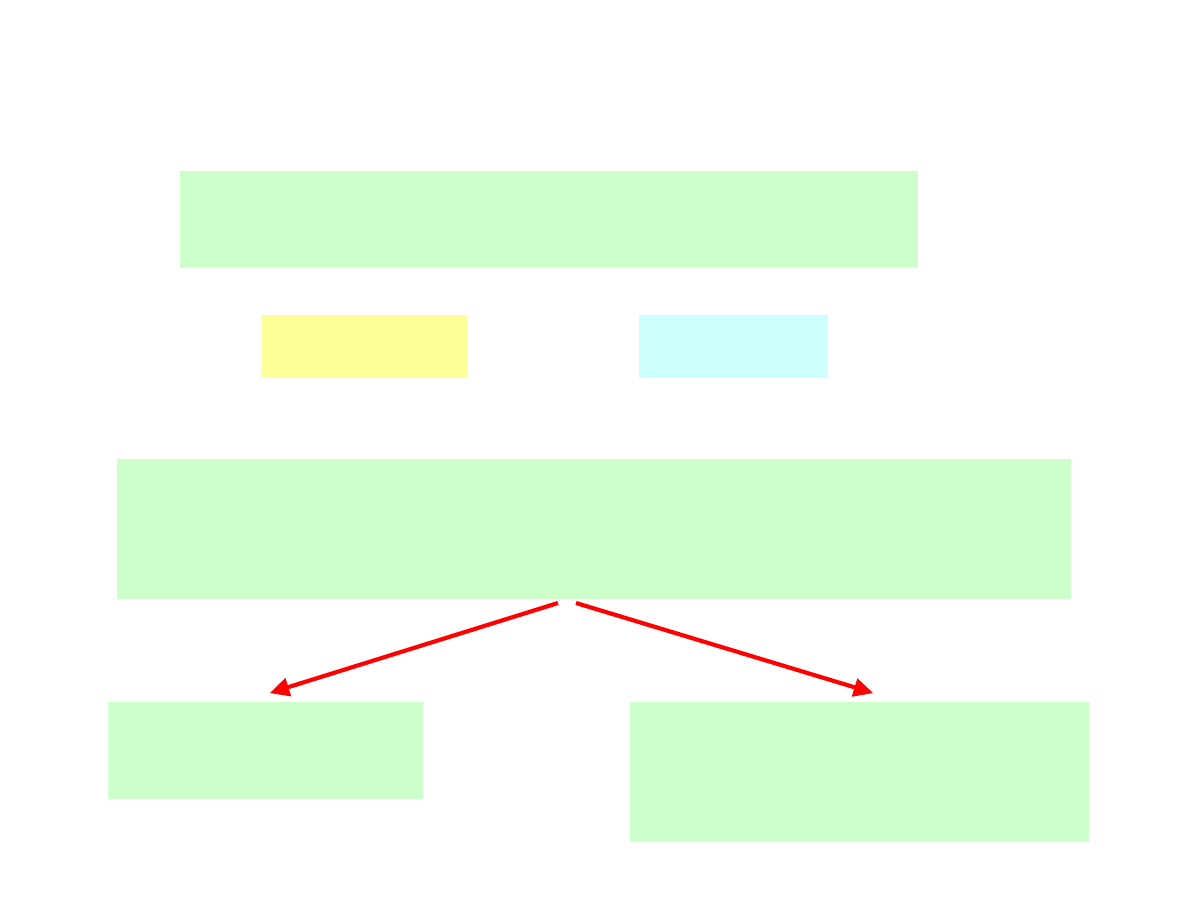
Reakcje redoks
w reakcji utleniania-redukcji uczestniczą zawsze
dwie sprzężone pary redoks
red
1
/ utl
1
utl
2
/ red
2
żadna z tych reakcji oddzielnie nie przebiegnie,
zarówno roztwory jonów Fe
3+
jak i I
-
nie ulegają zmianom,
dopóki są izolowane
zmieszać roztwory
ze sobą
włączenie ich w obwód
zapewniający swobodny
przepływ elektronów
Reakcje redoks
jeżeli każda z reakcji połówkowych przebiega z
wydzieleniem lub pobraniem innej liczby elektronów:
n
2
red
1
+ n
1
utl
2
+ n
1
n
2
e n
2
utl
1
+ n
1
red
2
+ n
2
n
1
e
n
2
red
1
+ n
1
utl
2
n
2
utl
1
+ n
1
red
2
dodając równania stronami trzeba uwzględnić
odpowiednie mnożniki (nww n
1
i n
2
)
red
1
utl
1
+ n
1
e
utl
2
+ n
2
e red
2
n
2
red
1
n
2
utl
1
+ n
2
n
1
e
n
1
utl
2
+ n
1
n
2
e n
1
red
2

Wielkość charakteryzująca dany układ pod względem jego
właściwości redoks to potencjał redoks
Potencjały redoks
można go wyliczyć z wzoru Nernsta
•E
o
- potencjał standardowy danego układu redoks
•R - stała gazowa (8.314 J/(mol· K))
•T - temperatura bezwzględna (K)
•n - liczba elektronów biorąca udział w reakcji
•F - stała Faradaya (96 490 C/mol)
•a
red
- aktywność reduktora w odpowiednim środowisku reakcji
•a
utl
- aktywność utleniacza (sprzężonego z reduktorem)
utl
red
o
a
a
ln
nF
RT
E
E
−
=
!!!
!!!
Potencjały redoks
utl
red
o
a
a
ln
nF
RT
E
E
−
=
utl
red
o
a
a
log
n
0.059
E
E
−
=
podstawiając wartości stałe i zamieniając logarytm naturalny (ln) na
logarytm dziesiętny (log) - w temperaturze 25
o
C otrzymujemy:
w przypadku gdy a
utl
= a
red
utl
red
o
a
a
log
n
0.059
E
E
−
=
0
E = E
o
Potencjały redoks
utl
utl
red
red
o
f
c
f
c
log
n
0.059
E
E
⋅
⋅
−
=
biorąc pod uwagę fakt że:
przy założeniu, że w stosowanych zwykle w analizie układach
można przyjąć że f
utl
= f
red
a = f· c
utl
red
o
c
c
log
n
0.059
E
E
−
=
[utl]
[red]
log
n
0.059
E
E
o
−
=
utl
red
utl
red
o
f
f
log
n
0.059
c
c
log
n
0.059
E
E
−
−
=
Potencjały redoks
]
]
+
+
−
=
4
2
o
II)
Sn(IV)/Sn(
[Sn
[Sn
log
2
0.059
E
E
dla układu Sn(IV)/Sn(II) mamy:
w przypadku układu MnO
4
-
/Mn
2+
dla którego równanie
połówkowe ma następującą postać:
8
]
][
]
+
+
−
=
+
H
[MnO
[Mn
log
5
0.059
E
E
-
4
2
o
/Mn
MnO
2
-
4
MnO
4
-
+ 8H
+
+ 5 e Mn
2+
+ 4H
2
O
Potencjały redoks
podobnie rzecz się ma dla układu CrO
4
2-
/Cr
3+
dla którego
równanie połówkowe ma postać:
]
]
][
2
8
−
−
+
−
=
+
−
4
3
o
/Cr
CrO
[CrO
OH
[Cr
log
3
0.059
E
E
3
2
4
CrO
4
2-
+ 4H
2
O + 3 e Cr
3+
+ 8OH
-
Potencjały redoks
ponieważ nie można obliczyć ani wyznaczyć bezwzględnych
wartości potencjałów ustala się je w odniesieniu do pewnego
potencjału przyjętego jako potencjał zerowy
standardowa elektroda wodorowa
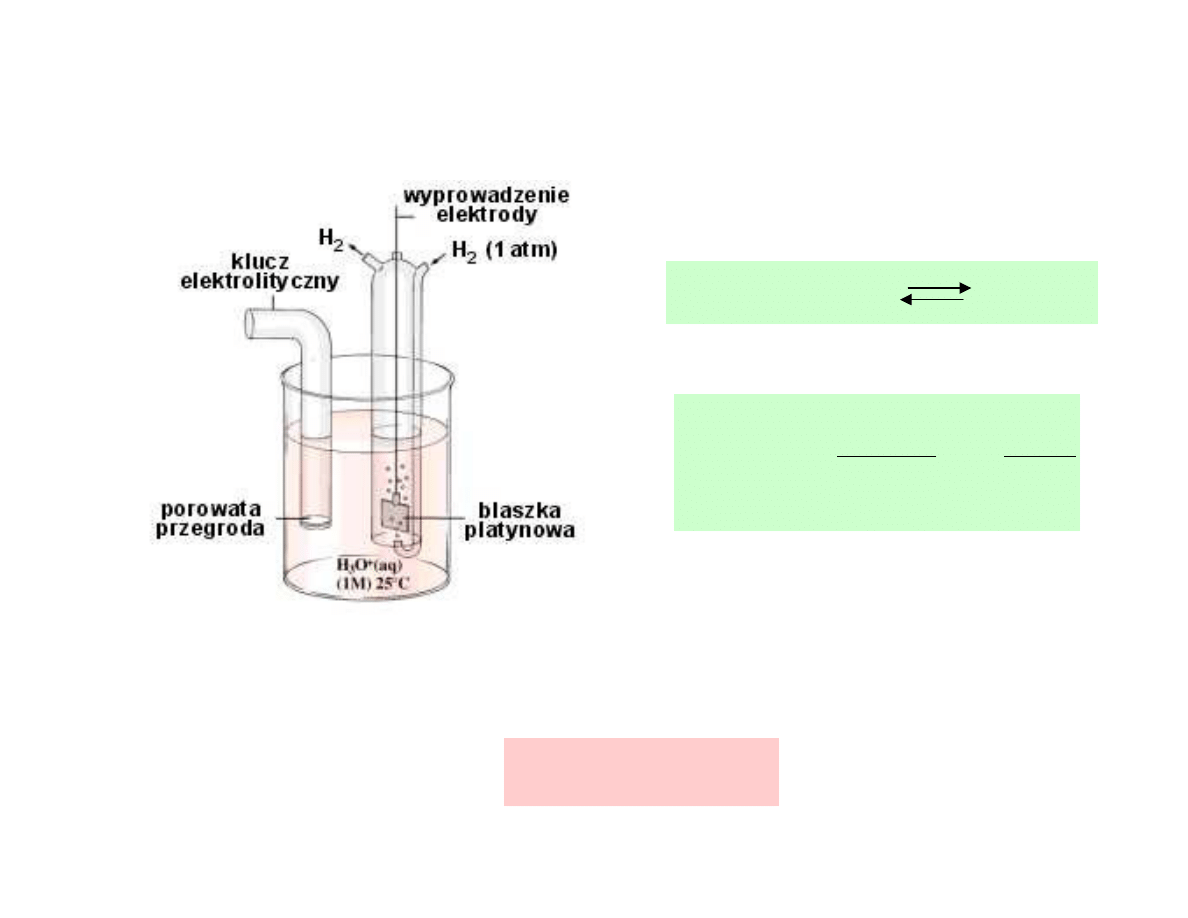
Elektroda wodorowa
2H
+
(aq)
+ 2e H
2(g)
2
H
H
o
a
p
log
2
0.059
E
E
2
+
−
=
w warunkach standardowych a
H+
= 1 oraz p
H2
=1
E = E
o
= 0 V
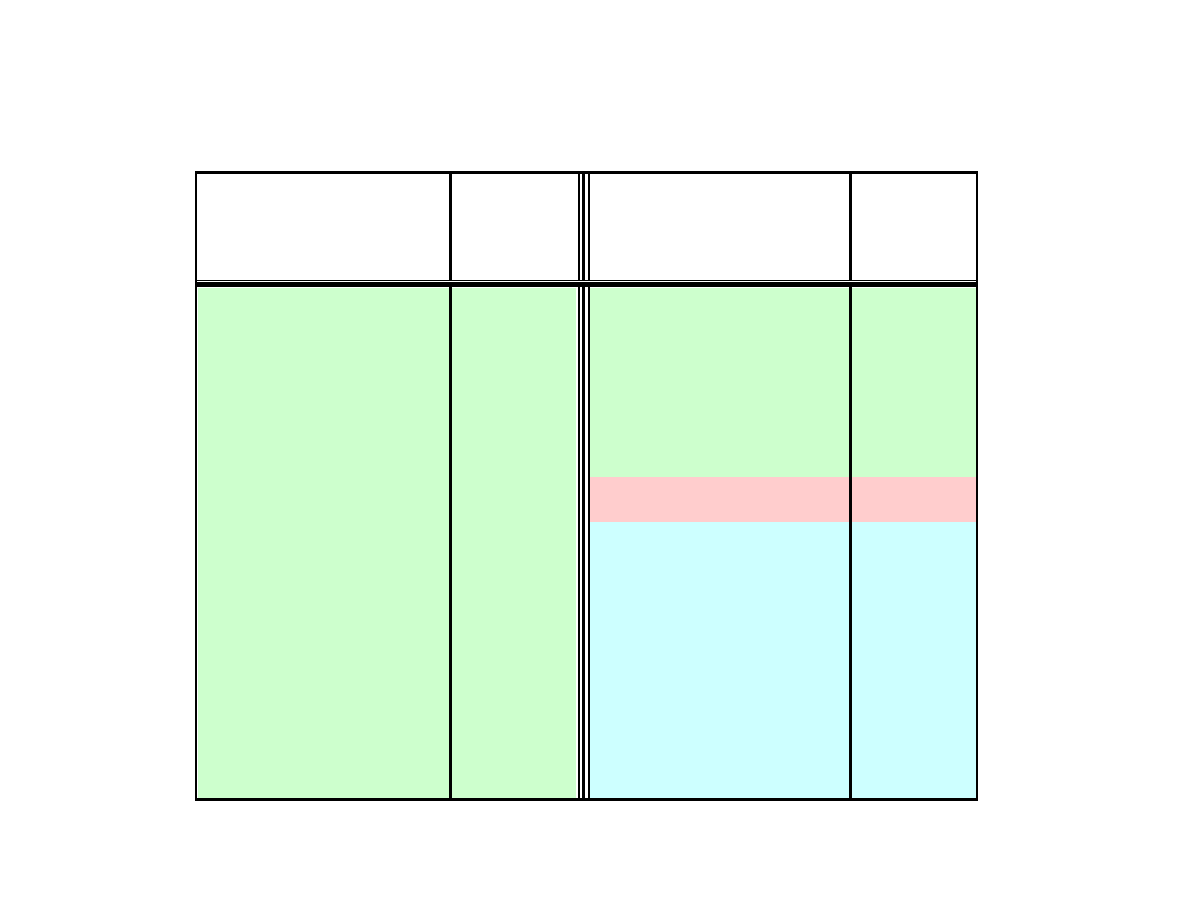
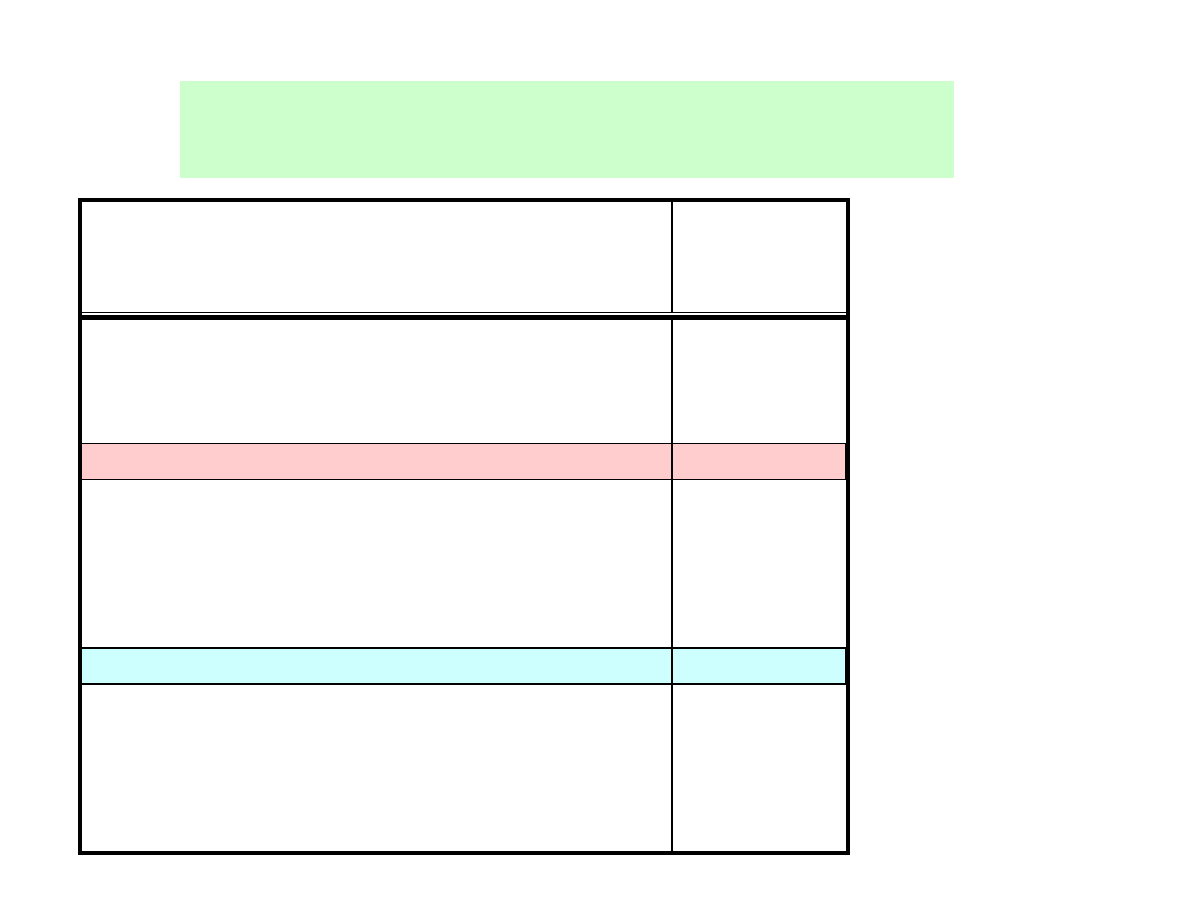
Szereg napięciowy metali
Metal
E
o
, V
Metal
E
o
, V
Li
+
/ Li
-3,04
Cd
2+
/ Cd
-0,40
K
+
/ K
-2,93
Co
2+
/ Co
-0,28
Ba
2+
/ Ba
-2,91
Ni
2+
/ Ni
-0,26
Ca
2+
/ Ca
-2,86
Sn
2+
/ Sn
-0,14
Ce
3+
/ Ce
-2,48
Pb
2+
/ Pb
-0,13
Mg
2+
/ Mg
-2,36
2H
+
/ H
2
0
U
3+
/ U
-1,80
Bi
3+
/ Bi
0,32
Al
3+
/ Al
-1,70
Cu
2+
/ Cu
0,34
Ti
3+
/ Ti
-1,21
Cu
+
/ Cu
0.52
Mn
2+
/ Mn
-1,18
Ag
+
/ Ag
0,80
Zn
2+
/ Zn
-0,76
Hg
2+
/ Hg
0,86
Cr
3+
/ Cr
-0,74
Pt
2+
/ Pt
1,20
Fe
2+
/ Fe
-0,44
Au
3+
/ Au
1,52

Szereg napięciowy metali
• zdolność do wymiany elektronów w układzie metal + jony
innego metalu jest tym większa im dalej od siebie
położone są oba metale w szeregu napięciowym
Znajomość położenia układu redoks w szeregu napięciowym
pozwala nam przewidywać kierunek reakcji
Fe + Cu
2+
→ Cu + Fe
2+
ale
Fe + Zn
2+
→ nie zachodzi
za to można:
Cu + 2Ag
+
→ Cu
2+
+ 2Ag
Szereg napięciowy metali
• litowce i berylowce (początek szeregu napięciowego)
reagują z wodą według schematu:
Znajomość położenia układu redoks w szeregu napięciowym
pozwala nam przewidywać kierunek reakcji
metal + woda
→ wodorotlenek metalu + wodór
• Metale stojące przed wodorem wypierają go z kwasów:
metal + kwas
→ sól + wodór
2Na + 2H
2
O
→ 2NaOH + H
2
(
↑
)
Równowagi reakcji redoks
siła napędowa reakcji redoks
Na podstawie standardowych potencjałów układów
można wyliczyć stałe równowagi reakcji redoks
różnica potencjałów układów
n
2
red
1
+ n
1
utl
2
n
2
utl
1
+ n
1
red
2
1
2
1
2
]
]
]
]
n
n
n
n
2
1
2
1
[utl
[red
[red
[utl
K
=
n
2
red
1
n
2
utl
1
+ n
2
n
1
e
n
1
red
2
n
1
utl
2
+ n
1
n
2
e
2
2
n
1
n
1
2
1
o
1
1
]
[utl
]
[red
log
n
n
0.059
E
E
−
=
1
1
n
2
n
2
2
1
o
2
2
]
[utl
]
[red
log
n
n
0.059
E
E
−
=
Równowagi reakcji redoks
gdy układ osiągnie stan równowagi wówczas:
E
2
=E
1
2
2
1
1
n
1
n
1
2
1
o
1
n
2
n
2
2
1
o
2
]
[utl
]
[red
log
n
n
0.059
E
]
[utl
]
[red
log
n
n
0.059
E
−
=
−
2
2
1
1
n
1
n
1
n
2
n
2
2
1
o
1
o
2
]
[red
]
[utl
]
[utl
]
[red
log
n
n
0.059
E
E
=
−
Równowagi reakcji redoks
stała
równowagi K
można obliczyć stopień
przereagowania utleniacza
czy reduktora jeśli znane są
potencjały standardowe obu
układów redoks
0.059
n
)n
E
(E
logK
2
1
o
1
o
2
−
=
logK
n
n
0.059
E
E
2
1
o
1
o
2
=
−
Potencjały standardowe niektórych układów redoks
w roztworach wodnych
reduktory
silne
utleniacze
układ redoks
E
o
, V
AsO
4
3-
+ H
2
O + 2e = AsO
3
3-
+ 2OH
-
-0.71
Fe(OH)
3
+ e = Fe(OH)
2
+ OH
-
-0.56
CrO
4
2-
+ 4H
2
O + 3e = Cr(OH)
3
+ 5 OH
-
-0.12
2H
+
+ 2e = H
2(g)
0.00
Fe(CN)
6
3-
+ e = Fe(CN)
6
4-
0.36
I
2(s)
= 2e = 2I
-
0.54
MnO
4
-
+ H
2
O
+ 3e = MnO
2
+ 4 OH
-
0.57
NO
3-
+ 4H
+
+ 3e = NO + 2H
2
O
0.96
O
2(g)
+ 4H
+
+ 4e = 2H
2
O
1.23
Cr
2
O
7
2-
+ 14H
+
+ 6e = 2Cr
3+
+ 7H
2
O
1.33
ClO
3
-
+ 6H
+
+ 6e = Cl
-
+ 3H
2
O
1.45
MnO
4
-
+ 8H
+
+ 5e = Mn
2+
+ 4H
2
O
1.52
F
2(g)
+ 2e = 2F
-
2.92
2H
2
O + 2e H
2(g)
+ 2OH
-
2Na + 2H
2
O
→ H
2(g)
+ 2Na
+
+ 2OH
-
woda jako utleniacz
2H
2
O O
2(g)
+ 4H
+
+ 4e
2F
2
+ 2H
2
O
→ O
2(g)
+ 4HF
woda jako reduktor
Potencjały redoks
teoretycznie należałoby oczekiwać, że wszystkie reakcje redoks
dla których wartości:
E
o
< 0 V
(potencjał standardowy wody jako utleniacza)
E
o
> 1.23 V
(potencjał standardowy wody jako reduktora)
oraz
nie będą mogły przebiegać w wodzie
zarówno reakcja redukcji jak i utleniania wody
należą do reakcji zahamowanych
Potencjały redoks
Reakcje zahamowane
Z wartości potencjałów redoks poszczególnych układów można
przypuszczać że H
2(g)
przy pH=0 powinien redukować wszystkie
utleniacze o wyższym potencjale
tak dzieje się jednak rzadko - dlaczego?
wysoki potencjał pierwszego stadium przemiany
zahamowanie procesu rozkładu wody wynika zaś
z wysokiego potencjału wydzielania gazowego wodoru
H
2
H
(g)
+ H
+
+ e
2.1 V
H
+
+ e H
(g)
-2.1 V

Amfoteryczne substancje redoks
związki które w reakcji z silnymi utleniaczami zachowują się
jak reduktory, a w reakcji z silnymi reduktorami reagują jak
utleniacze to
amfoteryczne substancje redoks
.
Typowe przykłady:
Mn(II)
Mn(IV)
Mn(VI)
Mn(VII)
Mn
2+
MnO
2
MnO
4
2
−−−−
MnO
4
−
Br(-I)
Br(0)
Br(V)
Br
−
Br
2
BrO
3
−
O(-II)
O(-I)
O(0)
Η
2
Ο
H
2
O
2
O
2
N(II)
N(III)
N(V)
NO
NO
2
−−−−
NO
3
−
Amfoteryczne substancje redoks
O(-II)
O(-I)
O(0)
Η
2
Ο
H
2
O
2
O
2
H
2
O
2
+ 2H
+
+ 2e 2 H
2
O
2I
−
+ H
2
O
2
+ 2H
+
→ I
2
+ 2 H
2
O
H
2
O
2
jako
utleniacz
H
2
O
2
O
2
+ 2H
+
+ 2e
2MnO
4
−
+ 5H
2
O
2
+ 6H
+
→ 2Mn
2+
+ 5O
2
+ 8 H
2
O
H
2
O
2
jako
reduktor
utl
red
1
1
1
o
1
1
a
a
log
n
0.059
pH
n
m
0.059
E
E
−
⋅
⋅
−
=
Wpływ środowiska na reakcje redoks
Cr(OH)
3
+ 5 OH
−
CrO
4
2
−
+ 4H
2
O + 3e
MnO
4
−
+ 8H
+
+ 5e
Mn
2+
+ 4H
2
O
1
m
H
utl
red
1
o
1
1
a
a
a
log
n
0.059
E
E
+
⋅
−
=
log a
H+
=
−pH
im mniejsze pH tym E
1
większe

Wpływ kwasowości na reakcje redoks
MnO
4
−
+ 8H
+
+ 5e
Mn
2+
+ 4H
2
O
−
+
−
⋅
⋅
−
=
4
2
MnO
Mn
o
1
1
a
a
log
5
0.059
pH
5
8
0.059
E
E
po podstawieniu wartości E
1
o
= 1.52 V, n
1
=5 i m
1
= 8
jeśli założymy, że a
MnO4−
= a
Mn2+
Dla rozpatrywanego układu:
dla pH =
0 E
1
= 1.52
− 0.0 + 0.012 ·log1 = 1.52V
1.24V
1
log
.
5
8
0.059
.
E
3
pH
dla
1
=
⋅
−
⋅
⋅
−
=
=
012
0
3
52
1
.95V
1
log
.
5
8
0.059
.
E
6
pH
dla
1
0
012
0
6
52
1
=
⋅
−
⋅
⋅
−
=
=
Wpływ kwasowości na reakcje redoks
−
−
⋅
−
=
2
4
3
CrO
5
OH
Cr(OH)
o
1
1
a
a
a
log
3
0.059
E
E
Dla drugiego z rozpatrywanych układów:
Cr(OH)
3
+ 5 OH
−
CrO
4
2
−
+ 4H
2
O + 3e
−
−
−
⋅
−
=
2
4
3
CrO
Cr(OH)
OH
o
1
1
a
a
log
3
0.059
a
log
3
5
.
E
E
059
0
−
−
⋅
⋅
+
=
2
4
3
CrO
Cr(OH)
o
1
1
a
a
log
3
0.059
pOH
3
5
.
E
E
059
0
pOH=14-pH
−
−
⋅
⋅
−
⋅
⋅
+
=
2
4
3
CrO
Cr(OH)
o
1
1
a
a
log
3
0.059
pH
3
5
.
3
5
.
E
E
059
0
14
059
0
im > pH
tym <E
1
Wpływ kwasowości na reakcje redoks
po podstawieniu wartości E
1
o
= -0.12 V
jeśli założymy, że a
Cr(OH)3
= a
CrO42−
Dla drugiego z rozpatrywanych układów:
dla pH =
1
E
1
= -0.12 + 1.38 - 0.098 ·
1
= 1.16V
Cr(OH)
3
+ 5 OH
−
CrO
4
2
−
+ 4H
2
O + 3e
1
log
3
0.059
pH
3
5
.
.
E
E
o
1
1
−
⋅
⋅
−
+
=
059
0
38
1
dla pH =
7
E
1
= -0.12 + 1.38 - 0.098 ·
7
= 0.57V
dla pH =
12
E
1
= -0.12 + 1.38 - 0.098 ·
12
= 0.08V
log 1 = 0
]
ML
[
L]
][
[M
log
n
0.059
log
n
0.059
E
]
ML
[
L]
][
[M
log
n
0.059
E
E
n
m
o
n
m
o
+
+
+
+
−
−
=
−
=
β
β
Wpływ kompleksowania na reakcje redoks
Jeżeli w układzie redoks znajdzie się czynnik kompleksujący
postać utlenioną lub zredukowaną albo też obie postacie,
to podstawowa równowaga redoks ulegnie zasadniczej zmianie
M
n+
+ ne M
m+
Mn
n+
+ L ML
n+
o
E
1
]
ML
[
L]
][
[M
log
n
0.059
E
E
n
m
o
+
+
−
=
1
]
M
[
]
[M
log
n
0.059
E
E
n
m
o
+
+
−
=
]
L
][
M
[
]
[ML
n
n
+
+
=
β
β
⋅
=
+
+
]
L
[
]
[ML
]
M
[
n
n
0.5
0.6
0.7
0.8
0.9
1
1.1
1.2
1.3
1.4
0
2
4
6
8
10
12
14
16
18
20
22
24
objętość titranta [ml]
E
[
V
]
0 2 4 6 8 10 12 14 16 18 20 22
0 2 4 6 8 10 12 14 16 18 20
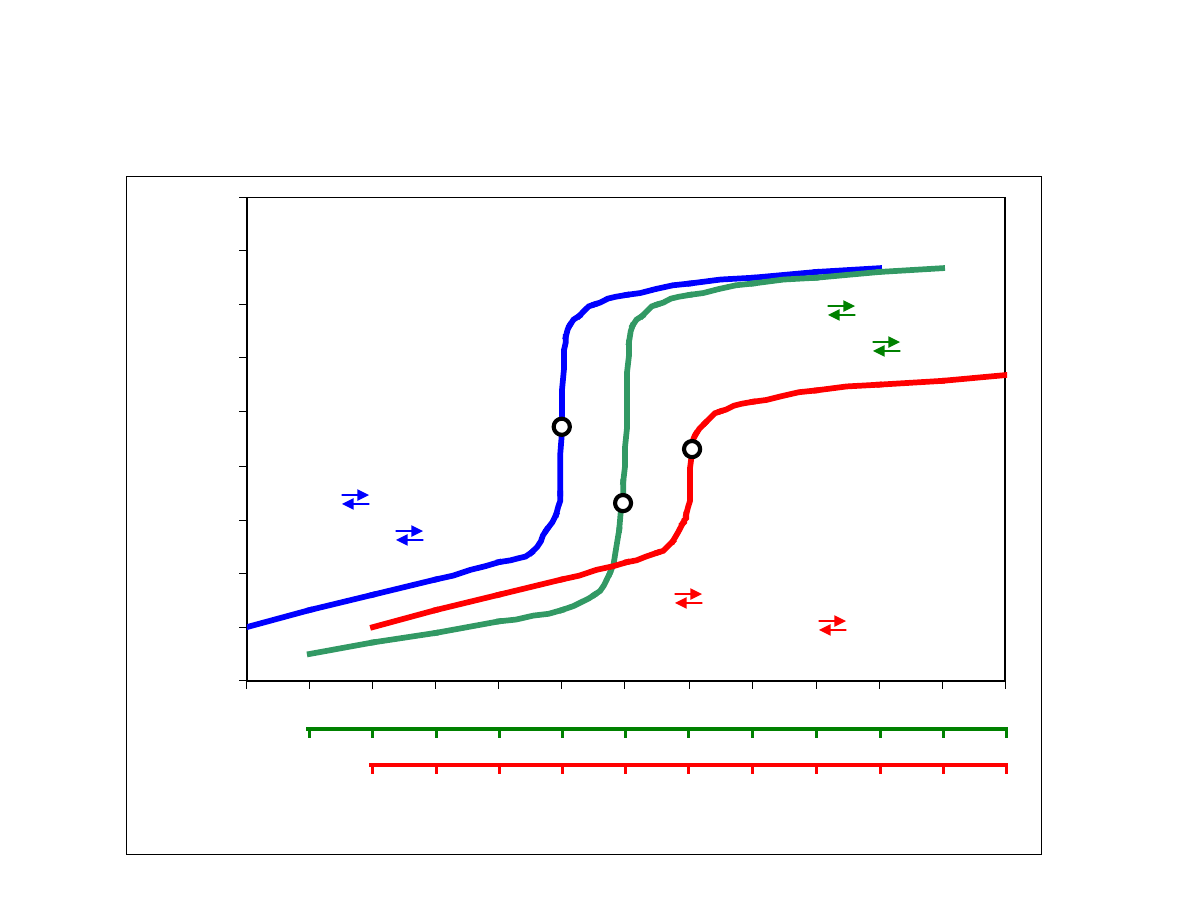
Krzywe miareczkowania redoks
PR
Fe(II) Fe(III) + e
Ce(IV) + e Ce(III)
PR
Fe(II) Fe(III) + e
Cr
2
O
7
2-
+ 6e +14H
+
2Cr
3+
+ 7H
2
O
PR
As(III) As(V) + 2e
Ce(IV) + e Ce(III)
Wskaźniki redoks
PK miareczkowania redoks można wyznaczyć:
potencjometrycznie
(śledząc zmiany potencjału)
wizualnie
(stosując barwne wskaźniki redoks)
odwracalne lub nieodwracalne
sprzężone układy redoks, w których
formy są różnie zabarwione
kryterium doboru wskaźnika -
właściwy potencjał standardowy
lub w konkretnym środowisku
potencjał formalny
układu redoks
Wskaźniki redoks
utl
1
+ red
2
→ red
1
+ utl
2
jeżeli weźmiemy
prostą reakcję redoks:
]
utl
[red
log
n
0.059
E
E
1
1
o
utl
utl
[
]
−
=
to potencjał roztworu
przed PK
jest określony zmianami utleniacza:
zakładając dokładność wskazania PK =
±0.1%:
1
.
0
9
.
99
[
] =
]
utl
[red
1
1
n
0.18
E
0.1
log
n
0.059
E
E
o
utl
o
utl
utl
−
=
−
=
9
.
99
Wskaźniki redoks
utl
1
+ red
2
→ red
1
+ utl
2
jeżeli weźmiemy
prostą reakcję redoks:
potencjał roztworu
po PK
jest określony przez niewielki nadmiar
reduktora (podobne założenie 0.1%):
n
0.18
E
99.9
log
n
0.059
E
E
o
red
o
red
red
+
=
−
=
1
.
0
zatem potencjał wskaźnika E
Ind
musi znajdować się w przedziale:
n
0.18
E
E
n
0.18
E
o
red
Ind
o
utl
+
<
<
−
ciekawe przykłady wskaźników:
• nadmanganian MnO
4
-
(manganometria)
• jod + skrobia
(jodometria)
Wyszukiwarka
Podobne podstrony:
p08 082
BTChwyklad 011
GH 7 082 schemat
BTChwyklad 141a
Admin 312[01] 01 082
GH 7 082
BTChwyklad 062
11 2005 077 082
GH 8 082
BTChwyklad 022
p14 082
P18 082
GM L1 082
P28 082
Admin 312[01] 02 082
BTChwyklad 101
itaMI 082 QE
więcej podobnych podstron