
1
Magiczne pierścienie
-od porfirii do „fotozabijania”
nowotworów
dr Anna Kiersztan,
Zakład Regulacji Metabolizmu
pirol
mostek
metinowy
–HC=
Mg
→
→
→
→
chlorofil
Porfiryny- magiczne pierścienie
Białka zawierające hem u ludzi i zwierząt:
• hemoglobina
→
→
→
→
transport tlenu we krwi
• mioglobina
→
→
→
→
magazynowanie tlenu w mięśniach
• cytochrom P-450
→
→
→
→
detoksyfikacja leków
• katalaza
→
→
→
→
rozkład nadtlenku wodoru
Fe
→
→
→
→
hem
Hemoglobina
Grupa hemowa zawierająca jon żelaza
Porfiryny- magiczne pierścienie

2
Porfiryny- magiczne pierścienie
30 000 : 1
Podwyższony poziom występuje gdy:
1.
produkcja hemu hamowana jest przez ołów (zatrucia ołowiem)
2.
niedoborach żelaza (anemia sierpowata i syderoblastyczna)
3.
przy ekspozycji na wanad
występuje w czerwonych krwinkach i reguluje katabolizm hemu
(jest kompetycyjnym inhibitorem oksygenazy hemowej)
Protoporfiryna
cynkowa (ZPP)
Protoporfiryna + Zn
++
→
protoporfiryna cynkowa (ZPP)
Protoporfiryna + Fe
++
→
protoporfiryna żelazowa (hem)
globina
hemoglobina
ZPP-globina
Porfiryny- magiczne pierścienie
Hans Fischer
1881- 1945
Hemoglobina
Grupa hemowa zawierająca jon żelaza
1930 r. nagroda Nobla
w dziedzinie chemii za
badania dotyczące struktury
hemoglobiny i chlorofilu
grupa chorób w większości uwarunkowanych genetycznie,
w których dochodzi do zaburzeń w szlaku syntezy porfiryn
Porfirie
obniżenia aktywności 1 z enzymów szlaku syntezy hemu,
co prowadzi do nadmiernego wytwarzania, gromadzenia i
wydalania porfiryn i ich prekursorów
3
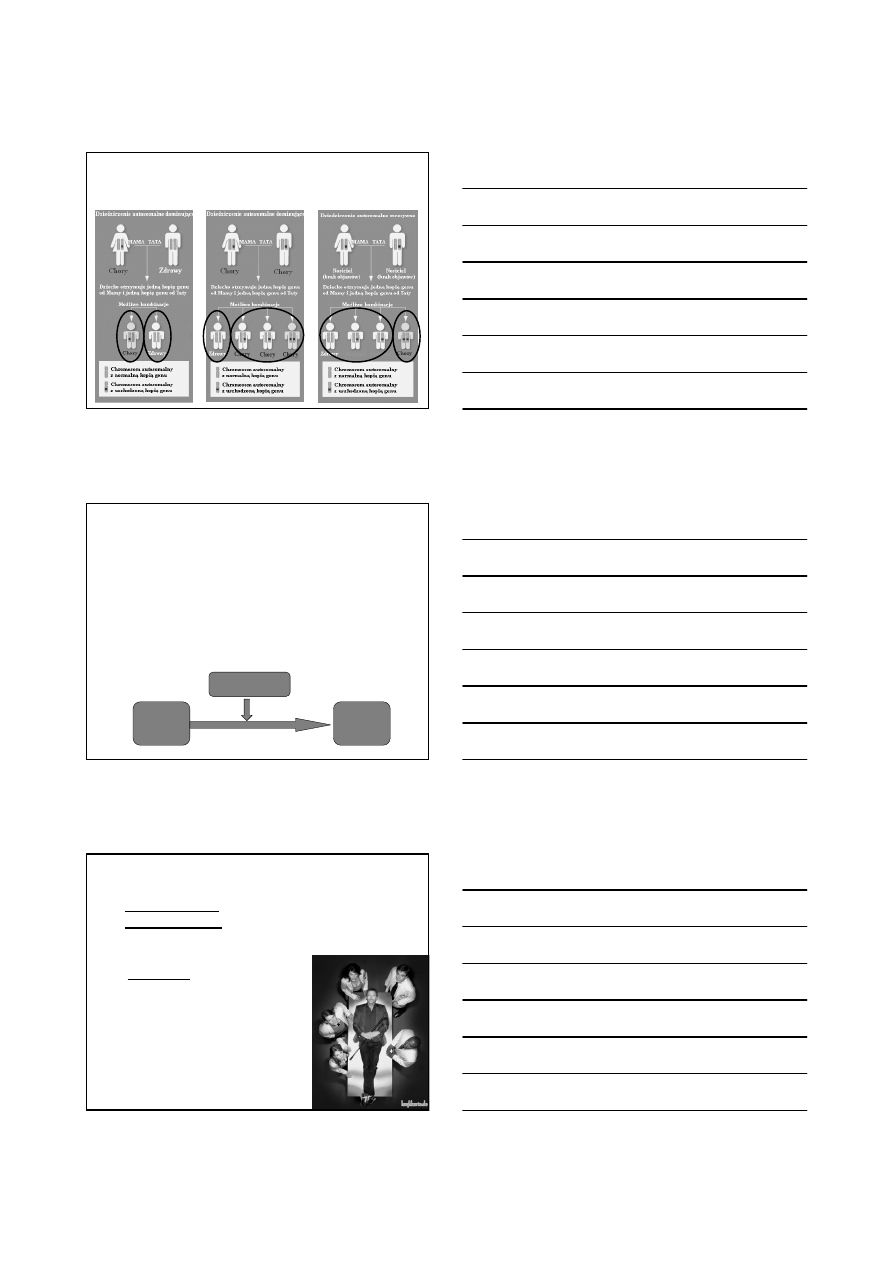
Porfirie - dziedziczenie
dziedziczone autosomalnie dominująco lub autosomalnie recesywnie
- w zależności od typu mogą objawiać się w dzieciństwie,
w okresie dojrzewania lub dorosłości
- poziom enzymu wystarczający do utrzymania normalnego
zapotrzebowania na hem
Porfirie
90 %
utajonych
10 % z objawami
(gł. kobiety w wieku 15-45 lat)
mutacja
czynnik
porfirynogenny
objawy
choroby
- dziedziczone autosomalnie dominująco lub recesywnie
- mało powszechne
(w zależności od populacji
0.5 do 10 osób na 100 000)
klasyczny atak porfirii:
- bóle brzucha, wymioty, biegunka, rzadziej zaparcia;
- zaburzenia psychiczne (zmiana osobowości, lęk, depresja,
pobudzenie, omamy wzrokowe i/lub słuchowe, bezsenność);
- zaburzenia neurologiczne (drętwienie i mrowienie kończyn, bóle
mięśni, zmiany w czuciu, paraliż);
- fotodermatoza, mocz czerwono-brunatny.
Porfirie
4
→
→
→
→
synteza zachodzi w większości komórek
ssaków (z wyjątkiem dojrzałych erytrocytów)
Hem
→
→
→
→
ok. 85 % syntetyzowane jest w szpiku
kostnym (hemoglobina)
→
→
→
→
pozostałe w wątrobie
(
→
→
→
→
cytochromy gł. P 450, hemoproteiny)
Sukcynylo-Co A
Glicyna
ALA
(kwas
δδδδ
-aminolewulinowy)
Fosforan pirydoksalu
Porfobilinogen
Hydroksymetylenobilan (tetrapirol)
Uroporfirynogen III
Koproporfirynogen III
Protoporfirynogen III
Protoporfiryna III
Hem
Hemoproteiny
Syntaza uroporfirynogenowa III
Syntaza uroporfirynogenowa I
Syntaza porfobilinogenowa
Syntaza ALA
Dekarboksylaza uroporfirynogenowa
Oksydaza koproporfirynogenowa
Oksydaza protoporfirynogenowa
Ferrochelataza
(syntaza hemowa)
Fe
2+
białko
C
Y
T
O
Z
O
L
M
I
T
O
C
H
O
N
D
R
I
A
M
I
T
O
C
H
O
N
D
R
I
A
SYNTEZA PORFIRYN (HEM)
Sukcynylo-Co A
Glicyna
ALA
(kwas
δδδδ
-aminolewulinowy)
Fosforan pirydoksalu
Porfobilinogen
Hydroksymetylenobilan
Uroporfirynogen III
Koproporfirynogen III
Protoporfirynogen III
Protoporfiryna III
Hem
Hemoproteiny
Syntaza uroporfirynogenowa III
Syntaza uroporfirynogenowa I
Syntaza porfobilinogenowa
Syntaza ALA
Dekarboksylaza uroporfirynogenowa
Oksydaza koproporfirynogenowa
Oksydaza protoporfirynogenowa
Fe
2+
białko
Ferrochelataza
(syntaza hemowa)
Skutek niedoboru enzymu ze
szlaku biosyntezy hemu
podobny jest do robót
drogowych na autostradzie
SYNTEZA PORFIRYN (HEM)
5
Sukcynylo-Co A
Glicyna
ALA
(kwas
δδδδ
-aminolewulinowy)
Fosforan pirydoksalu
Porfobilinogen
Hydroksymetylenobilan
Uroporfirynogen III
Koproporfirynogen III
Protoporfirynogen III
Protoporfiryna III
Hem
Hemoproteiny
Syntaza uroporfirynogenowa III
Syntaza uroporfirynogenowa I
Syntaza porfobilinogenowa
Syntaza ALA
Dekarboksylaza uroporfirynogenowa
Oksydaza koproporfirynogenowa
Oksydaza protoporfirynogenowa
Fe
2+
białko
Bardzo rzadka
Ferrochelataza
(syntaza hemowa)
Porfiria ostra
przerywana (AIP)
Wrodzona porfiria
erytropoetyczna (CEP)
Porfiria skórna poźna
(PCT)
Koproporfiria
wrodzona (HCP)
Porfiria mieszana
(VP)
→
→
→
→
1: 400 !!!!!
Protoporfiria (EPP)
SYNTEZA PORFIRYN (HEM)
W zależności od
miejsca syntezy
Klasyfikacja porfirii
wątrobowe
erytropoetyczne
klinicznie
ostre
nieostre
Skórna ??
Sukcynylo-Co A
Glicyna
ALA
(kwas
δδδδ
-aminolewulinowy)
Fosforan pirydoksalu
Porfobilinogen
Hydroksymetylenobilan
Uroporfirynogen III
Koproporfirynogen III
Protoporfirynogen III
Protoporfiryna III
Hem
Hemoproteiny
Syntaza uroporfirynogenowa III
Syntaza uroporfirynogenowa I
Syntaza porfobilinogenowa
Syntaza ALA
Dekarboksylaza uroporfirynogenowa
Oksydaza koproporfirynogenowa
Oksydaza protoporfirynogenowa
Fe
2+
białko
Bardzo rzadka
Porfiria ostra
przerywana (AIP)
Wrodzona porfiria
erytropoetyczna (CEP)
Porfiria skórna poźna
(PCT)
Koproporfiria
wrodzona (HCP)
Porfiria mieszana
(VP)
Protoporfiria (EPP)
Ostre ataki
SYNTEZA PORFIRYN (HEM)
Ferrochelataza
(syntaza hemowa)
6
Warunki normalne
Warunki zwiększonego
zapotrzebowania na hem
Czynniki wywołujące ostre ataki
hem
hem
hem
• hormony i niektóre leki
Czynniki wywołujące ostre ataki
Bromobenzen
Chloramfenikol
Chlorpropamid (2 typ cukrzycy)
Chlorochina (malaria)
Fenylobutazon
Karbamazepina
Ketamina
Metyldopa
Mepiwakaina
Metronidazol
Pentazocyna
Prymidon; Diclofenac
Ryfampicyna; Verapamil
Sukcynimid; Tolbutamid
Androgeny
Estrogeny
Progesteron
Etanol
Gryzeofulwin (antybiotyk)
Barbiturany
Sulfonamidy
Prawdopodobnie
Potwierdzone
Związki niebezpieczne w porfirii
• hormony i niektóre leki
Czynniki wywołujące ostre ataki
• dieta niskowęglowodanowa /odchudzanie
7
PGC-1
α
• kontroluje biogenezę mitochondriów
i metabolizm tlenowy w wielu tkankach
(tłuszczowa, mięśniowa, serce, wątroba)
• aktywowany przez głodzenie
głodzenie
Syntaza
ALA
aktywacja syntezy
hemu
nagromadzanie się
pośredników syntezy hemu
ostry atak porfirii
Głodzenie a ostry atak porfirii
• dieta niskowęglowodanowa /odchudzanie
• hormony i niektóre leki
• nadmiar żelaza lub ołowiu w organizmie
Czynniki wywołujące ostre ataki
• stres
• infekcje (wirusowe zapalenie wątroby
typu C, HIV)
• ostre światło słoneczne
Sukcynylo-Co A
Glicyna
ALA
(kwas
δδδδ
-aminolewulinowy)
Fosforan pirydoksalu
Porfobilinogen
Hydroksymetylenobilan
Uroporfirynogen III
Koproporfirynogen III
Protoporfirynogen III
Protoporfiryna III
Hem
Hemoproteiny
Syntaza uroporfirynogenowa III
Syntaza uroporfirynogenowa I
Syntaza porfobilinogenowa
Syntaza ALA
Dekarboksylaza uroporfirynogenowa
Oksydaza koproporfirynogenowa
Oksydaza protoporfirynogenowa
Fe
2+
białko
SYNTEZA PORFIRYN (HEM)
Bardzo rzadka
Porfiria ostra
przerywana (AIP)
Wrodzona porfiria
erytropoetyczna (CEP)
Porfiria skórna poźna
(PCT)
Koproporfiria
wrodzona (HCP)
Porfiria mieszana
(VP)
Protoporfiria (EPP)
Zaburzenia
neurologiczne i
psychiczne
Ferrochelataza
(syntaza hemowa)
8
ALA
PBG
Bóle brzucha i objawy neuropsychiczne
charakterystyczne dla porfirii
Mechanizm działania ALA i PBG
Sukcynylo-Co A
Glicyna
ALA
(kwas
δδδδ
-aminolewulinowy)
Fosforan pirydoksalu
Porfobilinogen
Uroporfirynogen III
Koproporfirynogen III
Protoporfirynogen III
Protoporfiryna III
Hem
Hemoproteiny
Syntaza uroporfirynogenowa III
Syntaza uroporfirynogenowa I
Syntaza porfobilinogenowa
Syntaza ALA
Dekarboksylaza uroporfirynogenowa
Oksydaza koproporfirynogenowa
Oksydaza protoporfirynogenowa
Fe
2+
białko
Bardzo rzadka
Ferrochelataza
(syntaza hemowa)
Porfiria ostra
przerywana (AIP)
Wrodzona porfiria
erytropoetyczna (CEP)
Porfiria skórna poźna
(PCT)
Koproporfiria
wrodzona (HCP)
Porfiria mieszana
(VP)
Protoporfiria (EPP)
Światłowrażliwość
Hydroksymetylenobilan (tetrapirol)
SYNTEZA PORFIRYN (HEM)
Sukcynylo-Co A
Glicyna
ALA
(kwas
δδδδ
-aminolewulinowy)
Fosforan pirydoksalu
Porfobilinogen
Hydroksymetylenobilan (tetrapirol)
Uroporfirynogen III
Koproporfirynogen III
Protoporfirynogen III
Protoporfiryna III
Hem
Hemoproteiny
Syntaza uroporfirynogenowa III
Syntaza uroporfirynogenowa I
Syntaza porfobilinogenowa
Syntaza ALA
Dekarboksylaza uroporfirynogenowa
Oksydaza koproporfirynogenowa
Oksydaza protoporfirynogenowa
Ferrochelataza
(syntaza hemowa)
Fe
2+
białko
samorzutnie
Uroporfirynogen I
Koproporfirynogen I
światło
światło
światło
Uroporfiryna I
Koproporfiryna I
Protoporfiryna III
SYNTEZA PORFIRYN (HEM)

9
Rozpoznanie i przebieg choroby
→
→
→
→
czerwony kolor moczu
→
→
→
→
pomiar stężenia porfiryn i ich prekursorów we krwi,
moczu i kale
→
→
→
→
badania genetyczne i wywiad rodzinny
• przeciwbólowe, przeciwwymiotne, glukoza, hem dożylnie
Leczenie porfirii
• właściwy tryb życia:
Działanie hemu
hem
hem
podanie
hemu

10
PGC-1
α
głodzenie
Syntaza
ALA
aktywacja syntezy
hemu
nagromadzanie się
pośredników syntezy hemu
ostry atak porfirii
glukoza
insulina
glukagon
Znaczenie glukozy w leczeniu porfirii
• przeciwbólowe, przeciwwymiotne, glukoza, hem dożylnie
Leczenie porfirii
• właściwy tryb życia:
• upuszczanie krwi (2,5 –3 l -
↓
żelazo), niskie dawki chlorochiny (2 x
125 mg/tydzień) lub hydroksychlorochiny
• transfuzje krwi; usunięcie śledziony;
transplantacje szpiku
• beta-karoten, żywica cholestyraminowa
→
obniża poziom porfiryn
Król Anglii
Jerzy III
→
porfiria mieszana
Sławni porfirycy
→
wg. notatek jego
lekarza miał objawy
typowe dla ostrego
ataku porfiri czyli:
zaparcia, wysypka,
stan splątania
/dezorientacji, słabość
kończyn, czerwony
mocz i łatwo wpadał
w furię.
→
porfiria genetyczna czy nabyta ???
OŁÓW
– jako
konserwant
do wina
→
styl życia, cechy psychiczne, a głównie informacje zawarte w
listach do brata
Vincent van Gogh
TUJON
?
10 mg/l
11
Mitochondria
Cytozol
Glicyna
Bursztynylo
CoA
ALA
ALA
PBG
HMB
Uro-P
Kopro-P
Kopro-P
Proto-P
protoporfiryna
Hem
Pb
Pb
Pb
Hamowanie syntezy hemu przez ołów
Król Bawarii
Ludwik II
Sławni porfirycy
- wielokrotnie zmieniał
daty swojego ślubu
- nie spał po nocach
- odseparował się od świata i nie opuszczał swojego pałacu
Porfiria może być nabyta
„Epidemia” porfirii skórnej późnej (PCT) w Turcji
(1956- 1961)
w 1956 r. około 5000 osób z objawami
przypominającymi PCT
Porfirie nabyte
1954 r. nasiona pszenicy traktowane fungicydem
– zaw. 10 % sześciochlorobenzen (HBC)
Jedno z dzieci
z objawami porfirii

12
Porfirie –ile prawdy jest w legendach o wampirach ?
David Dolphin –biochemik
z Uniwersytetu British Columbia
w Kanadzie
następstwem choroby jest niezwykle
wysoka swiatłowrażliwość skóry
na twarzy i innych odkrytych częściach ciała powstają
ropiejące pęcherze
→
owrzodzenia
→
blizny
→
zgrubienia (przypominające zmiany martwicze
występujące w trądzie)
na ciele niekiedy pojawia się
nienaturalne owłosienie
picie krwi jako jedyne dostępne lekarstwo,
aby złagodzić odczuwane cierpienia
wkrótce potem następuje zanik kości
palców, a korzenie i dziąsła chorego,
na skutek odkładania się uroporfiryny,
przybierają kolor brunatno-czerwony
Porfirie –ile prawdy jest w legendach o wampirach ?
Druga twarz światłowrażliwości
„fotozabijanie nowotworów”
i nie tylko….

13
Terapia fotodynamiczna
w kosmetyce i dermatologii
Uzdrawiająca siła światła
W starożytnym Egipcie chorym na bielactwo
zalecano spożywanie pewnych roślin, a
następnie opalanie się, co prowadziło do
repigmentacji białych obszarów skóry
PSORALEN –powoduje, że skóra staje się
bardzo wrażliwa na światło UV
1860- 1904
Twórca nowoczesnej fototerapii
1903 r. – nagroda Nobla w dziedzinie medycyny za wkład
w leczenie chorób przy użyciu wiązki światła
słonecznego i sztucznego (skonstruował on
pierwsze urządzenie emitujące fale podobne do fal
ś
wiatła słonecznego)
1911 r. – odkryto fotouczulajace właściwości hematoporfiryn

14
Porfiryny jako fotouczulacze
Dr Fredrich Meyer-Betz
W 1913 roku zastosował u siebie dożylnie
200 mg hematoporfiryny
W miejscach poddanych działaniu światła
pojawiła się bolesna opuchlizna
1860- 1904
Twórca nowoczesnej fototerapii
1975 r. pierwszy udany przypadek wyleczenia nowotworu
skóry u myszy
Od 1978 r. – pierwsze zastosowania kliniczne
1903 r. – nagroda Nobla w dziedzinie medycyny za wkład
w leczenie chorób przy użyciu wiązki światła
słonecznego i sztucznego (skonstruował on
pierwsze urządzenie emitujące fale podobne do fal
ś
wiatła słonecznego)
1911 r. – odkryto fotouczulajace właściwości hematoporfiryn
Terapia fotodynamiczna wymaga
3 czynników
Fotouczulacz
Światło
(o określonej
długości fali)
Tlen
(rozpuszczony w tkance)
stężenie tlenu w tkankach biologicznych jest najistotniejsze w PDT,
gdy jest mniejsze niż 50 %, to takie tkanki źle odpowiadają na PDT
15
Na czym polega terapia fotodynamiczna ?
2. Fotouczulacz selektywnie gromadzi
się w komórkach nowotworowych
3. Nowotwór naświetlany jest światłem
o ściśle określonej (aktywującej
fotouczulacz) długości fali
4. Światło aktywując fotouczulacz
doprowadza do wytworzenia wolnych
rodników i reaktywnych form tlenu,
które są toksyczne dla komórek
nowotworowych
1. Ogólnoustrojowe lub miejscowe
podanie fotouczulacza (pochodna
porfiryn)
Schemat reakcji fotochemicznej w PDT
Fotouczulacz pod wpływem pochłoniętego światła przechodzi
ze stanu podstawowego (1) w singletowy stan wzbudzony (2)
Wzbudzony fotouczulacz (2) może oddać energię w postaci
fluorescencji (3) lub drgań oscylacyjnych
Fotouczulacz ze stanu singletowego (2) może przejść w
tripletowy stan wzbudzony (5) tzw. przejście
interkombinacyjne (4)
Fotouczulacz (5) może oddać energię na tlen cząsteczkowy i
powstanie bardzo reaktywny tlen singletowy (6)
Stężenie tlenu a reakcje fotouczulacza
3
F*
1
F
reakcje utleniania
ŚMIERĆ KOMÓREK
Transfer wodoru lub
elektronu na inny substrat
Transfer energii na tlen
3
O
2
→
1
O
2
Wysokie stężenie tlenu
Niskie stężenie tlenu
1
F
Rodniki
3
O
2
ROS

16
Tlen singletowy- fenomen PDT
roztwór wodny
tkanka
1
O
2
1
O
2
ok. 125 nm
4 mikrosekundy
10-20 nm
10 -40 nanosekundy
1 nm = 0,001
µ
m =0,000 001 mm = 0,000 000 001 m =
10
−9
m
1 ns = 0,001
µ
s = 0,000 001 ms = 0,000 000 001 s =
10
-9
s
ŚMIERĆ
.....i inne reaktywne formy tlenu
H
2
O
2
;
•
OH; O
2
• –
zmiana właściwości
fizyko-chemicznych błon
i zaburzenie:
-
transportu przez błony
- przewodzenia sygnałów
- aktywności łańcucha
oddechowego
i wytwarzania energii
zmiana właściwości
(aktywności) białek:
- enzymów, nośników
- białek łańcucha oddechowego
- czynników transkrypcyjnych
- histonów, białek cytoszkieletu
przyśpieszenie tempa
mutacji i wzrost
prawdopodobieństwa
transformacji
nowotworowej
DRASTYCZNE ZABURZENIE METABOLIZMU KOMÓRKI
UTLENIANIE ZASAD
AZOTOWYCH W DNA
PEROKSYDACJA
LIPIDÓW
UTLENIANIE
GRUP SH BIAŁEK
Molekularny mechanizm PDT
Na przeciwnowotworowe działanie PDT składa się:
1. zabicie komórek nowotworowych
2. uszkodzenie układu naczyniowego (hipoksja i niedożywienie)
3. aktywacja niespecyficznej odpowiedzi immunologicznej

17
Castano et al. Nature Reviews Cancer 6, 535–545 (July 2006)
Molekularny mechanizm PDT cd.
aktywacja odpowiedzi immunologicznej
Dlaczego PDT zabija tylko nowotwór ?
Fotouczulacz intensywniej gromadzi się
w tkankach nowotworowych niż w zdrowych
DLACZEGO ?
• komórki nowotworowe intensywnie się dzielą
• mają słaby przepływ limfatyczny
• mają wysoką ekspresję receptorów dla LDL
(wiele PS wiąże się do LDL)
• niskie pH zewnątrzkomórkowe
(ułatwia
pobieranie)
• zwiększoną przepuszczalność naczyń
• nieprawidłową strukturę tkanki (duże przestrzenie śródmiąższowe i
zwiększona synteza kolagenu, który wiąże PS)
• naciek tk. nowotworowej makrofagami
Robaczek świętojański
Nie tylko terapia….
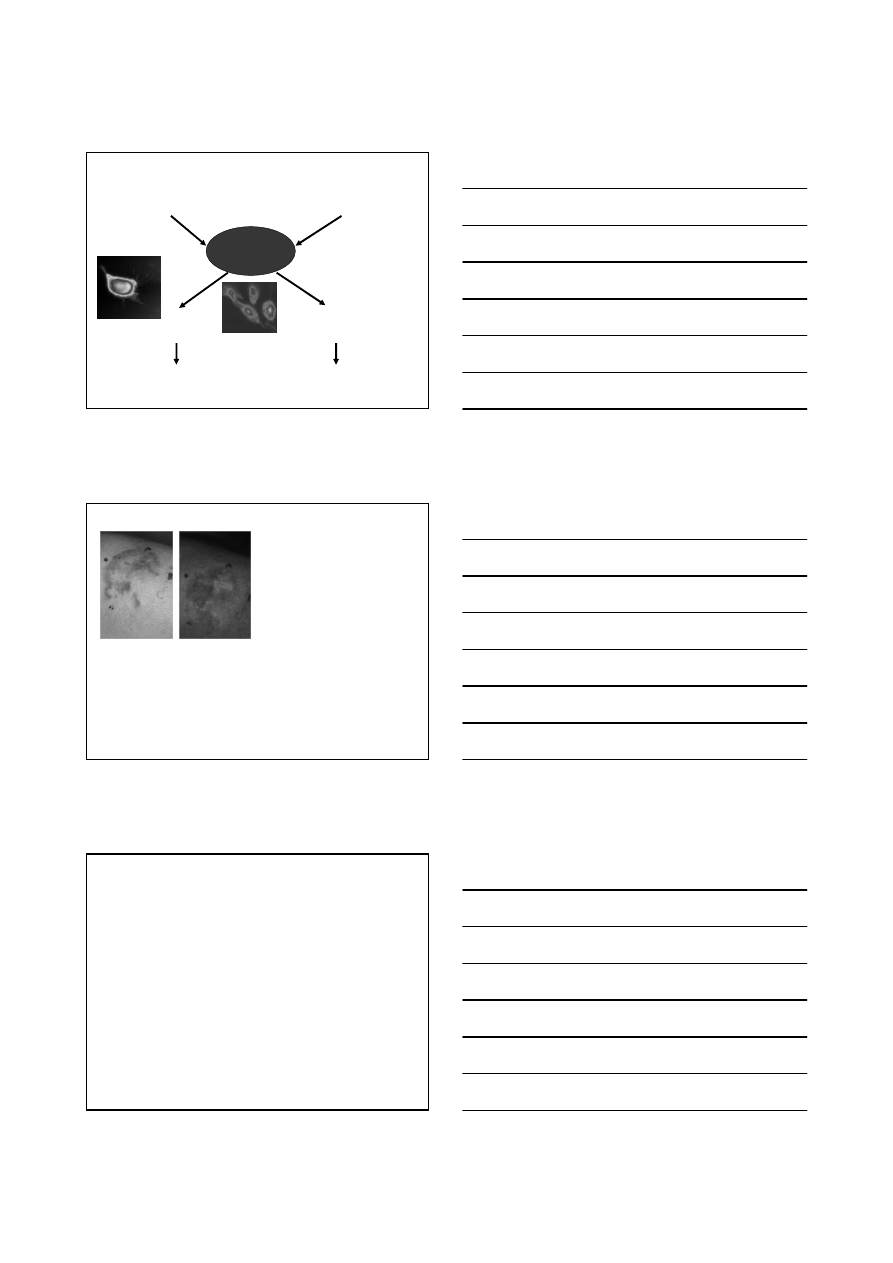
18
Fotouczulacz
400 nm
600- 700 nm
Diagnostyka (PDD)
wielkości i położenia
nowotworu
generowanie wolnych
rodników w tkance
nowotworowej
śmierć komórek
nowotworowych
Leczenie (PDT)
tkanka
nowotworowa
świeci na czerwono
nowotworowa
zdrowa
Diagnostyka fotodynamiczna
poważne, ale zarazem przykre estetycznie schorzenie
(usta, powieki, uszy, policzki, nos, kark)
Nieczerniakowe nowotwory skóry
Badania skriningowe w Japonii
20 000 osób należących do grupy szczególnego ryzyka
(palacze oraz pracownicy przemysłu hutniczego)
u 860 osób wykryto nowotwory, które nie dawały jeszcze
żadnych objawów klinicznych
(jamy ustnej, przełyku, płuc, żołądka i pęcherza)
95 % chorych wyleczono w ciągu 3- 6 tygodni za pomocą
terapii fotodynamicznej
5 % z zaawansowanymi nowotworami leczono znacznie
dłużej, ale równie skutecznie

19
Skuteczność PDT
100 % we wczesnym etapie choroby (szybko i z minimalnym
skutkiem ubocznym)
W stanach zaawansowanych znacznie poprawia jakość życia
Skutki uboczne PDT
znikome (nadwrażliwość skóry na światło, swędzenie, pieczenie)
Nowotwory: jelita grubego, wątroby, trzustki, sutka, skóry, narządów
płciowych, płuc, przełyku, żołądka …
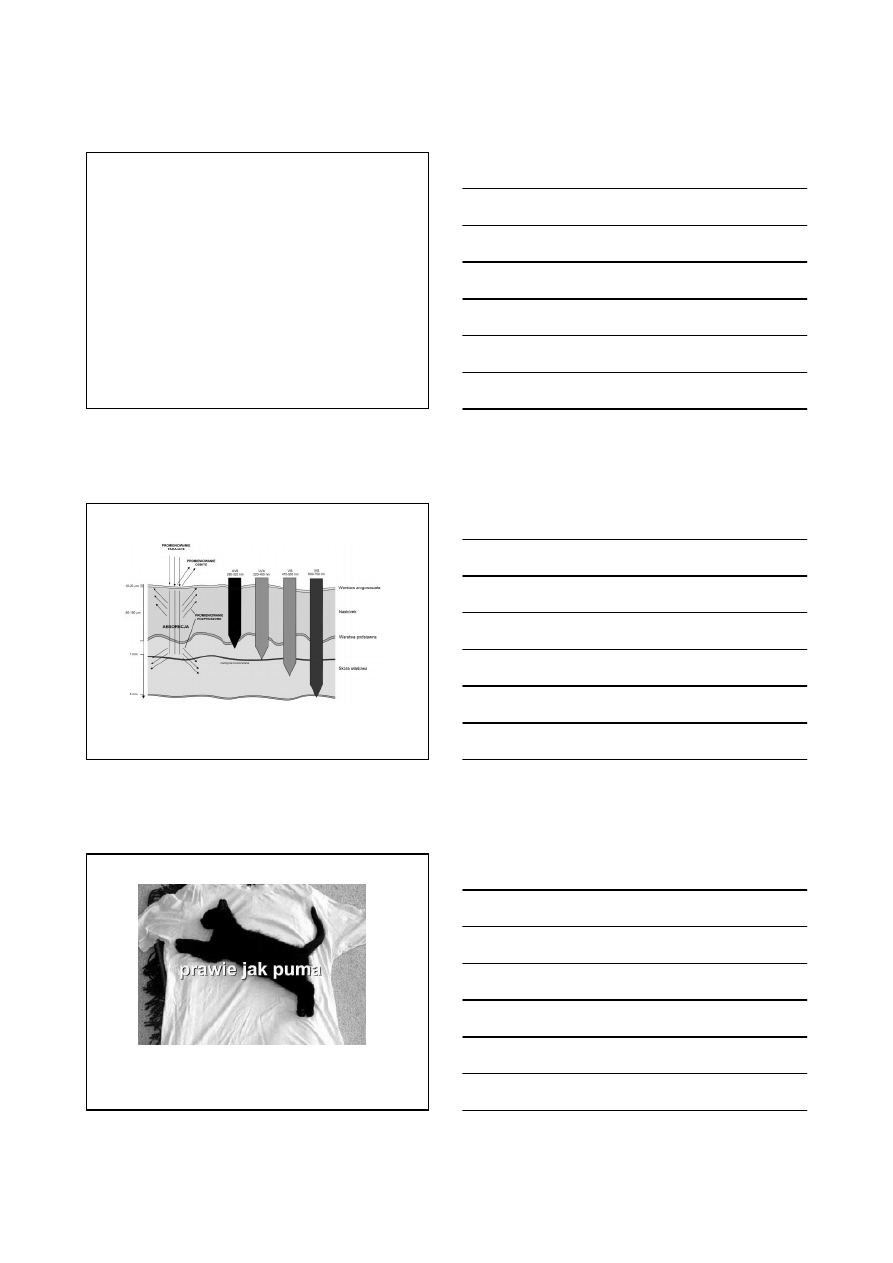
Rak podstawnokomórkowy: diagnostyka fotodynamiczna i stan
po terapii fotodynamicznej.
Nieczerniakowe nowotwory skóry
dotąd chory narażony był na okaleczającą niejednokrotnie operację
poważne, ale zarazem przykre estetycznie schorzenie
(usta, powieki, uszy, policzki, nos, kark)
Polskie fotouczulacze górą ???
tańsze (Fotofryn II – jednorazowa dawka ok. 2500 $)
rozpuszczalne w wodzie
(krócej przebywa w organizmie ok. 4-6 dni,
a Fotofryn II rozpuszczalny w tłuszczach ok. 4-8 tygodni)
20
Właściwości idealnego fotouczulacza
1. Cytotoksyczność wyłącznie w obecności światła
2. Selektywne gromadzenie się w komórkach nowotworowych
3. W krótkim czasie od podania osiąganie maksymalnego
stężenia w tkance docelowej
4. Szybkie wydalanie z organizmu
5. Wysoka wydajność tworzenia tlenu singletowego lub form
rodnikowych
6. Wysoki współczynniki absorbancji w zakresie 600- 800 nm
(takie światło głęboko wnika w tkanki)
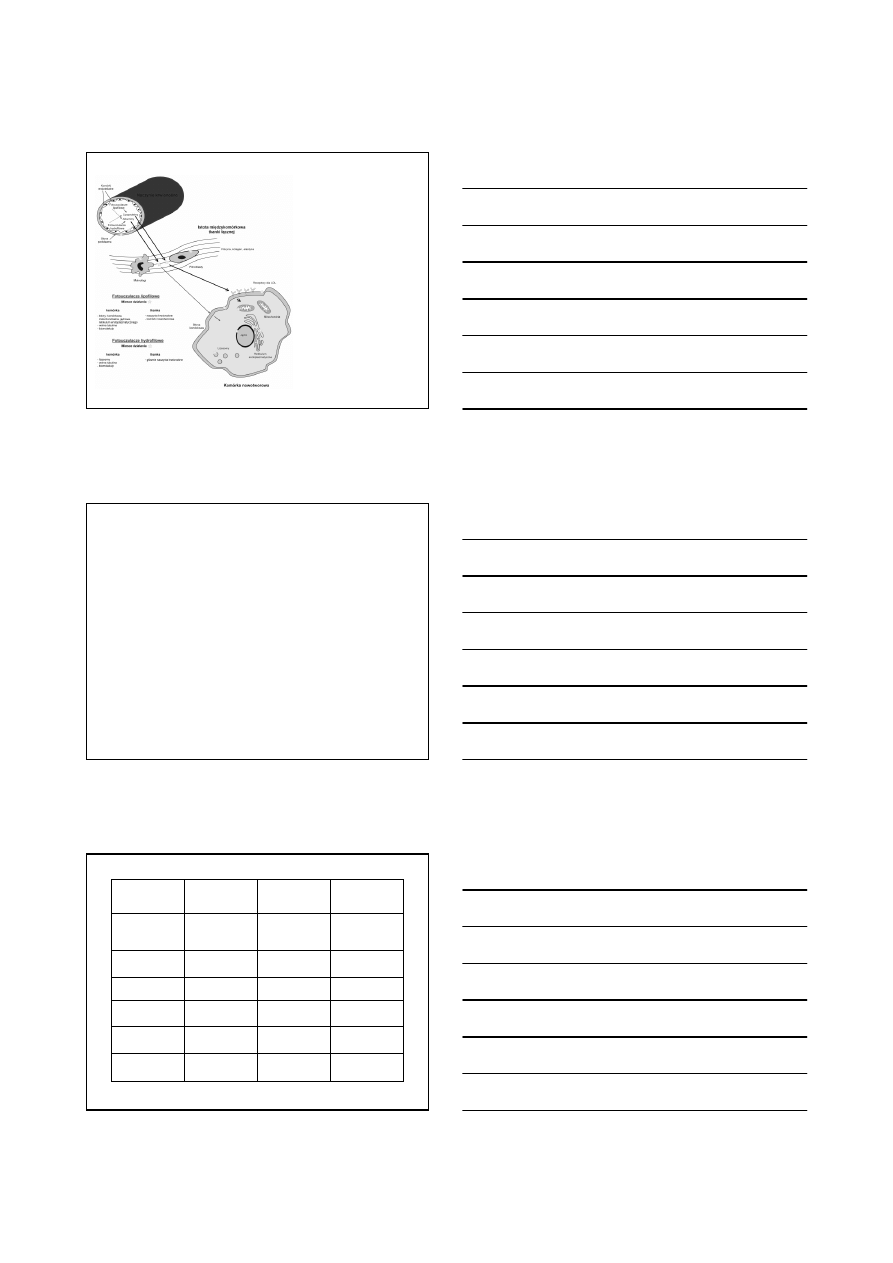
Rozchodzenie się światła w skórze (na podstawie: Juzenas, 2002;
Peng i in., 2008).
Głębokość penetracji światła
dla różnych długości fali
Związki hydrofobowe mające tendencję do agregacji
(spada wydajność generowania tlenu singletowego, utrudnia
podawanie, może utrudniać i fałszować wyniki badań in vitro)
Porfiryny - prawie idealne fotouczulacze
21
Transport i lokalizacja fotouczulaczy
Hydrofilowe
transportowane przez białka
osocza, gromadzą się
głównie w zrębie naczyń
krwionośnych guza,
dominują efekty naczyniowe
Lipofilowe
tworzą kompleksy z
lipoproteinami, gromadzą się
głównie w komórkach tkanki
łącznej oraz komórkach
nowotworu,
dominuje bezpośredni
mechanizm śmierci komórek
(na podstawie: Ma, 1996; Nyman i Hynninen, 2004; Peng i Nesland, 2004)
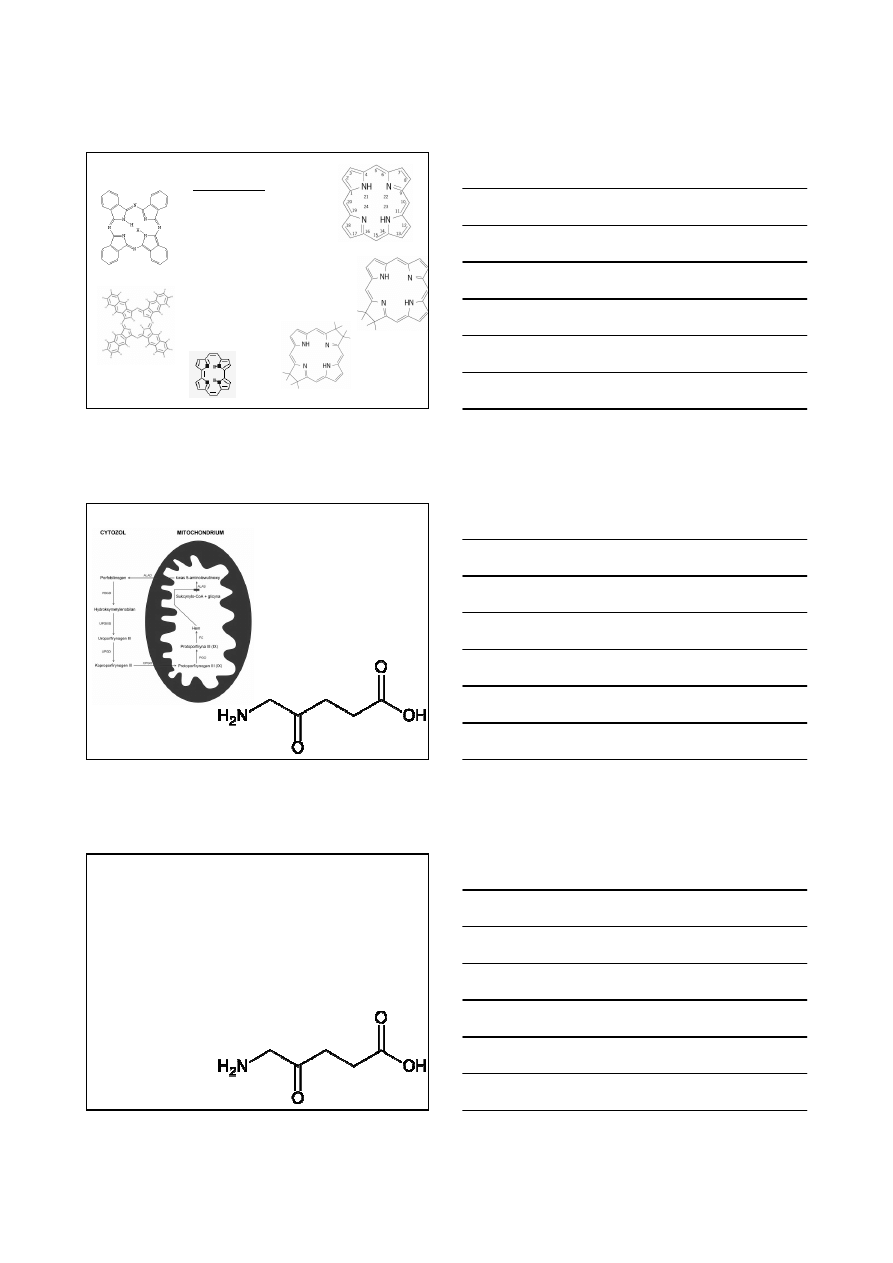
Wady obecnie stosowanych fotouczulaczy
1. Przedłużająca się wrażliwość skóry na działanie światła
2. Ograniczona selektywność
3. Zbyt wysoka lub zbyt niska efektywność
łuszczyca
n. skóry
24 h
595 nm
Hypercin
Choroba
Bowena
4 - 12 h
635 nm
Metvix
n. pęcherza
zmiany skórne
4 – 12 h
635 nm
Levulan
n. jamy ustnej
72 – 96 h
652 nm
Foscan
zmiany
naczyniowe
1 – 2,5 h
690 -692 nm
Visudyne
n. płuc
n. pęcherza
n. przełyku
24 - 48 h
630 nm
Photofrin
Zastosowanie
Czas przed
naświetleniem
Długość fali
do PDT
Fotouczulacz
(nazwa handlowa)
Wybrane fotouczulacze
22
Nie tylko porfiryny….
Fotouczulacze:
- porfiryny
- prekursory porfiryn
(ALA i jego estry)
- chloryny
- bakteriochloryny
- ftalocyjaniny
- naftalocyjaniny
- porficyny
Porfiryny (~ 630 nm)
Chloryny (660 -690 nm)
Bakteriochloryny (740 -800 nm)
Ftalocyjaniny
Naftalocyjaniny
Porficyny
Kwas 5 - aminolewulinowy (ALA) i jego estry
Hem ogranicza powstawanie ALA
Podanie egzogennego ALA
umożliwia ominięcie etapu
limitującego syntezę hemu
jednocześnie ograniczona
wydajność FC prowadzi do
gromadzenia porfiryn
Kwas 5- aminolewulinowy (ALA) i jego estry
Zalety:
- naturalnie występuje w organizmie,
- niska toksyczność bez światła,
- miejscowe podawanie,
- nagromadzająca się protoporfiryna usuwana jest w ciągu 24-48 h
- maksymalne stężenie w tkankach docelowych w ciągu 1-8 h od
momentu podania
23
Gdzie stosuje się PDT ?
PDT
USA
Kanada
Japonia
Kraje Europy
Zachodniej
Polska
(II faza badań klinicznych)
Perspektywy w PDT
Perspektywy w PDT
Aparatura endoskopowa dostarczająca
ś
wiatło o określonej długości fali do
nowotworów położonych wewnątrz ciała

24
DZIĘKUJĘ
Wyszukiwarka
Podobne podstrony:
Krzyze i monogramy
Polar PDT 839
Focke Wulf Fw 190 A F G cz 2 (AJ PRESS Monografie Lotnicze 018)
Kataliza Monograficzny gr1 wyniki
monografia rodziny praca zaliczeniowa
Wykład monograficzny 9 10 2012
17 Porfiryni i pochodne
monografia2 doc
Monografia3, Pedagogika, Monografia
Monografia liczby 5
monografia, Dla nauczycieli przedszkola
Egzamin poprawkowy Wyklad Monograficzny
Polar PDT 619
monografia liczby 7(1), Monografia liczby
Aktualne Problemy Informacji i Dokumentacji - monografia, Informacja naukowa i bibliotekoznastwo 2 s
wykład monograficzny, antyk, egzamin
więcej podobnych podstron