
POLITECHNIKA GDAŃSKA
WYDZIAŁ CHEMICZNY
KATEDRA TECHNOLOGII CHEMICZNEJ
Technologia Chemiczna, VII sem.
Technologia Organiczna
Tytuł ćwiczenia: Produkcja związków powierzchniowo czynnych
Opracowała: mgr. inż. Agnieszka Pazik, p. 406 ChB
Gdańsk 2012

1
.
Wiadomości ogólne
Związki powierzchniowo czynne (surfaktanty) obecne są w życiu człowieka już od ponad 2000 lat. Początkowo znane
i stosowane były tylko mydła. Dopiero po II wojnie światowej gwałtowny rozwój przemysłu petrochemicznego
dostarczył surowców, które były i są nadal podstawą dla dzisiejszego przemysłu związków powierzchniowych, o
rocznej produkcji sięgającej już 11 mln ton. Podstawowe źródła surowcowe do produkcji surfaktantów stanowią oleje
roślinne i tłuszcze zwierzęce oraz ropa naftowa. Związki powierzchniowo czynne to związki chemiczne, które
gromadzą się na powierzchniach podziału faz i mogą w znacznym stopniu (nawet przy bardzo niskich stężeniach)
zmieniać własności powierzchniowe cieczy, w której są rozpuszczone. Cząsteczki związków powierzchniowo
czynnych są asymetryczne, składają się z dwóch części o różnych własnościach: niepolarnej lub słabo polarnej
(pochodzenia węglowodorowego) oraz silnie polarnej (jonotwtórczej lub niejonotwórczej). Część niepolarna
(hydrofobowa) jest nierozpuszczalna w wodzie i w cieczach silnie polarnych, natomiast łatwo rozpuszczalna w
olejach (lipofilowa) i w cieczach niepolarnych. Część polarna jest hydrofilowa, a więc lipofobowa. Z uwagi na ich
budowę, odmienne zachowanie się w stosunku różnych faz, środki powierzchniowe czynne gromadzą się na granicy
podziału faz. Tworząca się warstwa absorpcyjna służy, jako łącznik między fazami nierozpuszczalnymi (np. woda-
olej) oraz przyczynia się do zmniejszenia napięcia powierzchniowego lub międzyfazowego.
Środki powierzchniowo czynne różnią się od innych substancji tym, iż tworzą roztwory koloidalne specjalnego typu,
w których cząsteczki i jony aglomerują się w postaci charakterystycznych ugrupowań, zwanych micelami.
Grupa hydrofobowa utworzona jest w większości przypadków z rodnika alifatycznego, zawierającego na ogół od 8
do 18 atomów węgla. W przypadku kwasów tłuszczowych i tłuszczów naturalnych oraz ich pochodnych łańcuchy
węglowodorowe są nierozgałęzione, natomiast w przypadku reszt węglowodorowych pochodzenia naftowego lub
syntetycznego łańcuchy te są rozgałęzione. Znaczna ilość środków powierzchniowo czynnych zawiera resztę
hydrofobową utworzoną z węglowodoru aromatycznego alkilowanego (np. alkilobenzen, alkilotoluen, alkilofenole).
Budowa reszty hydrofobowej ma decydujący wpływ na własności produktów otrzymywanych syntetycznie.
Grupa hydrofilowa składa się najczęściej z grupy kwasowej lub zasadowej o dużej energii potencjalnej. Działanie
rozpuszczające grupy oparte jest głównie na tworzeniu soli. Najważniejszymi grupami kwasowymi są: grupa
karboksylowa, siarczanowa, sulfonowa i grupa fosforanowa. Do grupy zasadowej zaliczyć można: grupę aminową
pierwszorzędową, drugo, trzecio i czwartorzędową oraz grupę pirydynową. Na aktywność powierzchniową środków
wpływa rodzaj grupy hydrofilowej, a także jej położenie w cząsteczce. W przypadku obecności w cząsteczce takiej
samej grupy węglowodorowej, grupa nadająca jej rozpuszczalność znajdująca się bliżej końca reszty hydrofobowej
nadaje jej mniejszą rozpuszczalność, niż w przypadku gdy jest położona bliżej środka łańcucha.
Związki zawierające grupę hydrofilową kwasową ich czynną częścią cząsteczki jest anion, natomiast w przypadku
grupy zasadowej jest kation. Substancje powierzchniowe, których grupy hydrofilowe nie są zdolne do tworzenia soli
nazywane są niejonowymi.
2. Klasyfikacja związków powierzchniowo czynnych
Biorą pod uwagę wielką ilość produktów o działaniu powierzchniowym, produkowanych przez przemysł na świecie
oraz ich szerokie zastosowanie w przemyśle, rolnictwie oraz artykułach użytku powszechnego, konieczne jest
przyjęcie jakiejś klasyfikacji. Najstarsza i najbardziej logiczna klasyfikacja oparta jest na budowie chemicznej i
wyróżnia pięć podstawowych klas związków powierzchniowo czynnych.

1.
Związki anionowe
A. Kwasy karboksylowe
•
Grupa karboksylowa przyłączona wprost do grupy hydrofobowej
•
Grupa karboksylowa przyłączona poprzez wiązanie pośrednie
B. Siarczany
•
Grupa siarczanowa przyłączona wprost do hydrofobowej
•
Grupa siarczanowa przyłączona poprzez wiązanie pośrednie
C. Alifatyczne kwasy sulfonowe
•
Grupa sulfonowa związana bezpośrednio z grupą hydrofobową
•
Grupa sulfonowa związana poprzez wiązania pośrednie
D. Alkiloaromatyczne kwasy sulfonowe
•
Grupa hydrofobowa połączona wprost ze sulfonowanym pierścieniem aromatycznym
•
Grupa hydrofobowa połączona z pierścieniem aromatycznym poprzez wiązania pośrednie
E. Mieszane hydrofilowe grupy anionowe
•
Fosforany i kwasy fosforanowe
•
Nadsiarczany, tiosiarczany
•
Sulfonamidy
•
Kwasy amidosulfonowe
2. Związki kationowe
A. Sole amin (I, II, III-rzędowych)
•
Grupa aminowa połączona bezpośrednio z grupą hydrofobową
•
Grupa aminowa połączona z hydrofobową w sposób pośredni
B. Czwartorzędowe związki amoniowe
•
Atom azotu połączony bezpośrednio z grupą hydrofobową
•
Atom azotu połączony poprzez wiązanie pośrednie
C. Inne zasady azotowe
•
Zasady nieczwartorzędowe
•
Zasady czwartorzędowe
D. Zasady nieazotowe
•
Związki fosfoniowe
•
Związki sulfoniowe
3. Związki niejonowe
A. Etery z grupami zwiększającymi rozpuszczalność
B. Estry
C. Amidy
D. Inne
E. Pochodne zawierające kilka grup funkcyjnych
4. Związki amfolityczne
A. Związki zawierające grupy aminowe i karboksylowe

•
Nieczwartorzędowe
•
Czwartorzędowe
B. Związki zawierające grupy aminowe i siarczanowe
•
Nieczwartorzędowe
•
Czwartorzędowe
C. Związki zawierające grupy aminowe i alkilowe kwasy sulfonowe
D. Związki zawierające grupy aminowe i aromatyczne kwasy sulfonowe
E. Związki zawierające inne kombinacje grup kwasowych i zasadowych
5. Emulgatory nierozpuszczalne w wodzie
A. Związki zawierające jonowe grupy hydrofilowe
B. Związki zawierające niejonowe grupy hydrofilowe
Inny sposób klasyfikacji związków powierzchniowo czynnych oparty jest na ich biologicznej degradowalności, w
której wyróżniamy trzy grupy:
1.
Łatwo ulegająca biodegradacji (tzw. miękkie surfaktanty):
•
alkohole siarczanowane,
•
n-alkanosulfoniany,
•
n-alkenosulfoniany,
•
pochodne etoksylowe siarczanowych produktów addycji alkoholi i kwasów tłuszczowych,
•
pochodne polipeptydów i polisacharydów związanych z podstawnikami n-alkilowymi.
2.
Średnio biodegradowalne:
•
n-alkilobenzenosulfoniany,
•
addukty tlenku etylenu i wyższych kwasów tłuszczowych oraz amin.
3.
Trudno ulegające biodegradacj (tzw. twarde surfaktanty):
•
alkilobenzenosulfoniany o rozgałęzionych podstawnikach alkilowych,
•
alkilonaftalenosulfoniany o rozgałęzionych podstawnikach alkilowych,
•
wysokocząsteczkowe addukty tlenku etylenu i alkilofenoli.
•
3. Podstawowe procesy jednostkowe realizowane w przemyśle związków powierzchniowo czynnych
3.1.
Sulfonowanie
Sulfonowanie to proces polegający na wprowadzeniu do cząsteczki związku organicznego w miejsce atomów wodoru
jednej lub kilku grup sulfonowych –SO
3
H w reakcji podstawienia. Grupa sulfonowa bezpośrednio połączona jest z
atomem węgla -C-SO
3
H. Do procesu sulfonowania zalicza się również tzw. chlorosulfonowanie, które polega na
wprowadzeniu do cząsteczki związku organicznego grupy –SO
2
Cl.
Po wprowadzeniu grupy –SO
3
H do cząsteczki związku organicznego otrzymuje się produkty o właściwościach
kwasów (pK
a
< 1), tworzące z zasadami sole. Sulfonowanie związków organicznych przeprowadza się w celu
przekształcenia nierozpuszczalnych w wodzie związków chemicznych w związki rozpuszczalne, nadania im
właściwości hydrofilowych i zwiększenia powinowactwa do wody. Ma to duże znaczenie przemysłowe, szczególnie
podczas produkcji środków powierzchniowo czynnych, barwników i garbników. Związki aromatyczne są
najważniejszymi substratami wykorzystywanymi w przemysłowych procesach sulfonowania. W przemyśle
organicznym sulfonowaniu poddaje się: benzen, toluen, fenol, anilinę i ich pochodne, n-alkilobenzeny, naftalen i jego
C
12
H
25
SO
3
C
12
H
25
HO
3
S
pochodne. Grupę sulfonowa często wprowadza się do związku aromatycznego na okres przejściowy, aby następnie
zastąpić ją pożądaną grupą funkcyjną, którą innym sposobem byłoby trudno wprowadzić w zamierzone położenie (np.
-OH, -NH
2
, -NO
2
).
Do sulfonowania związków aromatycznych wykorzystuje się tzw. czynniki sulfonujące, do których zalicza się:
•
kwas siarkowy o stężeniu 65-100% (H
2
SO
4
),
•
oleum o stężeniu 18-20% i 60-65% (SO
3
.
H
2
SO
4
),
•
tritlenek siarki (SO
3
),
•
kwas chlorosulfonowy ClSO
3
H (SO
3
.
HCl),
•
kompleksy tritlenku siarki z substancjami organicznymi (SO
3
.
pirydyna, SO
3
.
dioksan).
Przebieg reakcji sulfonowania zależy od rodzaju stosowanego czynnika sulfonującego i jego stężenia oraz stosunku
ilościowego względem związku sulfonującego. Ważnym również czynnikiem wywierającym wpływ na przebieg
reakcji sulfonowania jest temperatura reakcji. Podwyższenie temperatury zwiększa szybkość reakcji, lecz należy
przestrzegać ustalonych granic temperaturowych ze względu na możliwość powstania produktów ubocznych. W
przypadku sulfonowania pierścienia benzenowego podwyższenie temperatury powoduje bardzo często zmianę
kierunku sulfonowania i zwiększenie wydajności niepożądanego izomeru. W przemyśle reakcje sulfonowania
przeprowadza się w temperaturach o zakresie od 0 do 180 ºC, pod normalnym lub nieznacznie podwyższonym
ciśnieniem. Reakcje sulfonowania mają charakter egzotermiczny. Sulfonowe pochodne naftalenu i antrachinonu
otrzymuje się za pomocą metody okresowej. Reakcje w tej metodzie prowadzone są w stalowych lub żeliwnych
sulfonatorach zaopatrzonych w wykładziny odporne na działanie czynników sulfonujących. Zaopatrzone są one w
mieszadła oraz płaszcze do ogrzewania oraz chłodzenia. Metodą ciągła w półkowych wieżach sulfonacyjnych
przeprowadza się reakcje z lotnymi węglowodorami aromatycznymi, np. benzen oraz n-alkilobenzeny.
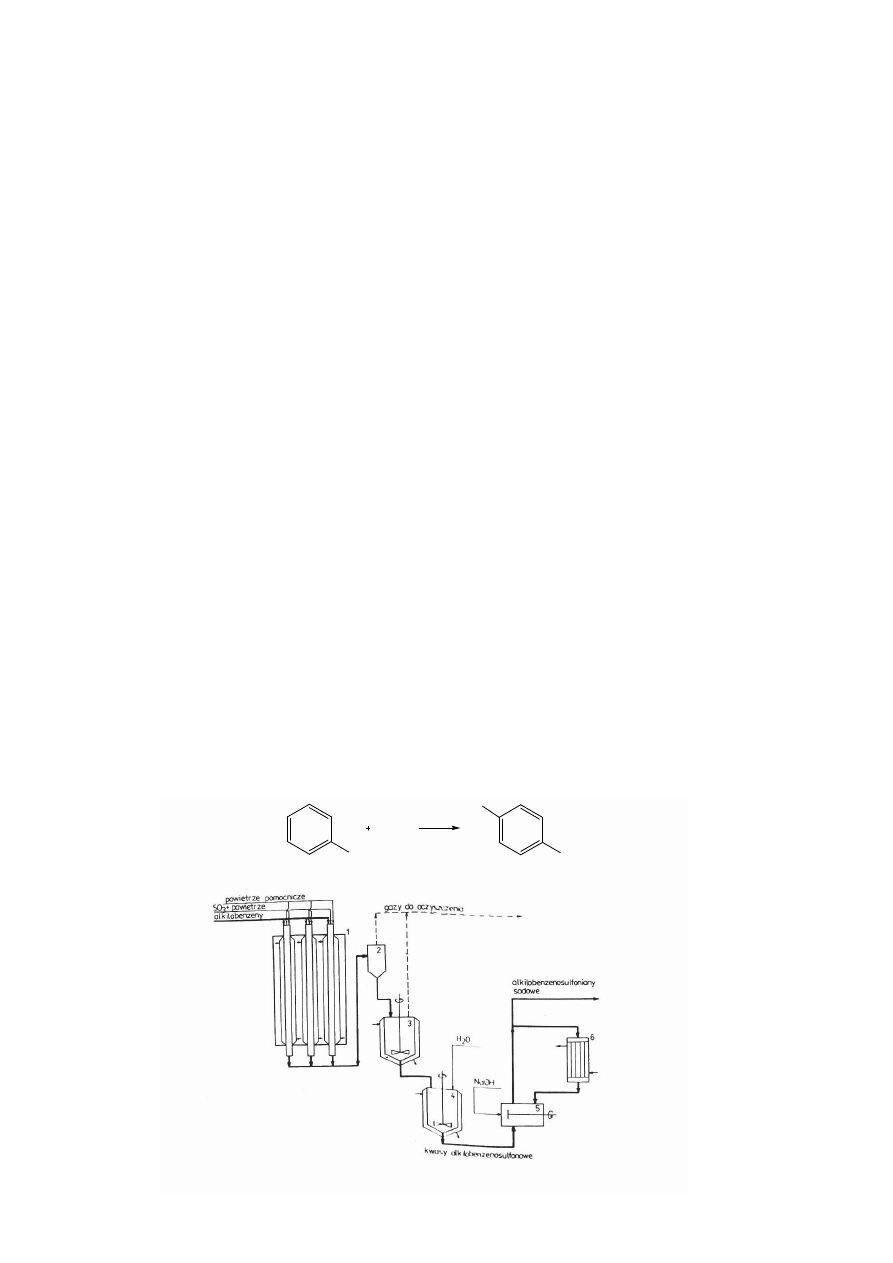
Przykład procesu przemysłowego sulfonowania n-alkilobenzenów za pomocą SO
3
Surowcem w procesie jest mieszanina monoalkilobenzenów o prostych łańcuchach alifatycznych zawierających od 10
do 14 atomów węgla. Alkilobenzeny otrzymuje się poprzez alkilowanie benzenu odpowiednimi alkenami lub
monochloroalkanami. Czynnikiem sulfonującym jest gazowy SO
3
podawany do reakcji w mieszaninie z powietrzem.
Schemat instalacji do otrzymywania n-alkilobenzenosulfonianów sodu
lit.

R-CH
2
OH
SO
3
R-CH
2
OSO
3
H
R-CH
2
OSO
3
H
NaOH
R-CH
2
OSO
3
Na
H
2
O
R-CH=CH
2
H
2
SO
4
R
H
C
CH
3
OSO
3
H
Proces prowadzi się w sposób ciągły, w temperaturze 35 – 50 ºC, pod ciśnieniem 0,1 - 0,2 MPa w reaktorze filmowym
(1). Reaktor zbudowany jest z wiązki rur połączonych dnami sitowymi, do których w prowadzane są substraty. Po
przejściu przez reaktor mieszanina gazowo ciekła wprowadzana jest do rozdzielacza (2). Ciekła pozostałość
przenoszona jest dalej do mieszalnika (3) gdzie następuje tzw. dojrzewanie. Surowy produkt poddawany jest
oczyszczaniu za pomocą hydrolizy wodą (4), a mieszaninę poreakcyjną zadaje się roztworem wodorotlenku sodu (5)
do pH = 7. Uzyskuje się w ten sposób produkt końcowy w postaci soli sodowych kwasów alkilobenzenosulfonowych
o konsystencji pasty.
3.2.
Siarczanowanie
Siarczanowanie (O-sulfonowanie) jest procesem najczęściej wykorzystywanym w produkcji środków powierzchniowo
czynnych. Siarczanowaniu poddaje się alkohole C
10
-C
18
, alkeny C
10
-C
18
oraz oleje i tłuszcze. Istotne znaczenie
przemysłowe ma siarczanowanie alkoholi tłuszczowych pierwszorzędowych i ich polioksyetylenowych pochodnych.
Czynnikiem siarczanującym może być kwas siarkowy o stężeniu 98 – 100 % oraz tritlenek siarki. Produkty
siarczanowania poddaje się neutralizacji uzyskując sole sodowe siarczanów alkilowych.
Drugorzędowe siarczany alkilowe wykazują nieco gorsze właściwości powierzchniowo czynne w porównaniu do
pierwszorzędowych pochodnych. Otrzymuje się głównie przez siarczanowanie alkoholi tłuszczowych
drugorzędowych lub przez siarczanowanie alkenów C
10
-C
18
za pomocą stężonego kwasu siarkowego. W analogiczny
sposób przerabia się na środki powierzchniowe oleje i tłuszcze. Następuje addycja kwasu siarkowego do wiązania
nienasyconego w resztach kwasowych glicerydów.
3.3.
Alkilowanie
Alkilowanie jest to proces polegający na wprowadzeniu grupy alkilowej do cząsteczki związku chemicznego za
pomocą reakcji przyłączenia lub podstawienia. W procesie alkilowania rodnik alkilowy może się połączyć z atomem
węgla w łańcuchu alifatycznym lub w pierścieniu aromatycznym, z atomem azotu, z atomem tlenu oraz z atomem
siarki.
W przemysłowych procesach alkilowania stosuje się jako czynniki alkilujące:
•
małocząsteczkowe olefiny (etylen, propylen, n-buten),
•
prostołańcuchowe olefiny C
10-
C
14,
•
niższe halogenki alkilowe, np. chlorki, bromki, jodki metylu i etylu,
•
monochloropochodne prostołańcuchowych alkanów C
10
-C
14,
•
halogenki alkiloarylowe, np. chlorek benzylu,
•
niższe alkohole, np. metanol, etanol,
•
siarczany alkilowe, np. siarczan dimetylu, siarczan dietylu.
Alkilowanie węgla jest procesem katalitycznym i jako katalizatory wykorzystuje się kwasy mineralne (H
2
SO
4
, H
3
PO
4
,
HF) oraz kwasy Lewisa (AlCl
3
, AlF
3
, BF
3
).
Reakcje w obecności katalizatorów kwasowych przebiegają wg mechanizmu jonowego z pośrednim utworzeniem
karbokationu, który atakuje cząsteczkę alkilowaną. W przemyśle organicznym największe znaczenie ma alkilowanie

C
3
H
5
(COOR)
3
3 NaOH
3 RCOONa
C
3
H
5
(OH)
3
2 RCOOH
Na
2
CO
3
2 ROONa
CO
2
H
2
O
H
2
O
RCOOH
NaOH
RCOONa
węglowodorów parafinowych i aromatycznych alkenami. Procesy te prowadzone są w fazie ciekłej lub gazowej. W
procesach prowadzonych w fazie gazowej, jako katalizator stosuje się najczęściej tzw. stały kwas fosforowy.
Katalizator ten otrzymuje się przez nasycenie porowatego nośnika (np. ziemi okrzemkowej) wodnym roztworem
kwasu fosforowego, z którego następnie usuwa się wodę.
Alkilowanie w fazie gazowej przeprowadza się w temp. 250 – 350 °C, pod ciśnieniem 2-5 MPa.
Alkilowe pochodne benzenu zawierające prostołańcuchowe grupy alkilowe C
10
-C
14
stanowią substraty do produkcji
alkilobenzenosulfonianów sodowych, wykorzystywanych jako detergenty. Otrzymywanie wyższych alkilobenzenów
opiera się na reakcji alkilowania benzenu za pomocą dwóch czynników alkilujących:
- alkeny C
10
-C
14
zawierające prawie wyłącznie podwójne wiązanie przy pierwszym atomie węgla,
- monochlorowane alkany C
10
-C
14.
W przemyśle proces alkilowania benzenu chloroalkanami przeprowadza się w sposób ciągły, w fazie ciekłej w temp.
40 – 80 °C, pod normalnym ciśnieniem. W przypadku alkilowania benzenu alkenami reakcje prowadzi się w fazie
ciekłej w sposób ciągły, przy zastosowaniu takich parametrów:
- AlCl
3
w temp. 30 – 40 °C, pod ciśnieniem normalnym
- H
2
SO
4
(96 – 98 %) w temp. 10-20 °C, pod ciśnieniem normalnym
- HF (85 – 9 5%) w temp. 0 – 5 °C, pod ciśnieniem 0,5 – 1 MPa.
4. Otrzymywanie środków powierzchniowo czynnych w skali przemysłowej
4.1. Środki anionowe
W światowej produkcji związkow powierzchniowo czynnych największy udział stanowią środki anionowe.
Cząsteczki tych związków w roztworach wodnych ulegają dysocjacji, dając kation oraz anion o dużej cząsteczce.
Najważniejszymi grupami polarnymi wchodzącymi w skład anionu są: -COO
-
(w mydłach), -SO
3
-
(w sulfonianach) i –
OSO
3
-
(w siarczanach).
4.1.1. Środki anionowe z grupami karboksylowymi (mydła)
Są to związki, w których grupą hydrofilową jest grupa karboksylowa, a grupą hydrofobową są reszty kwasów
tłuszczowych zawierające od 8 do 20 atomów węgla. Środki anionowe są najstarszymi i najlepiej poznanymi
środkami powierzchniowo czynnymi, dzielą się one na mydła alkaliczne (z kationem Na, K lub NH
4
), mydła
metaliczne (Ca, Zn, Mg, Al, Mn, Cr) i mydła aminowe (kationem jest zasada ograniczona typu aminoalkoholu).
Mydła alkaliczne otrzymuje się w następujący sposób:
•
z tłuszczów obojętnych przez działanie wodorotlenkami alkalicznymi,
•
przez zobojętnienie kwasów tłuszczowych, żywicznych lub naftenowych węglanami alkalicznymi,
•
przez zobojętnianie kwasów tłuszczowych, żywicznych lub naftenowych wodorotlenkiem potasowców.
W trakcie procesu otrzymywania mydła dodaje się roztworów elektrolitów w takiej ilości, by roztwór mydła tracił swą
jednorodność i następowało wysolenie. Dzięki temu tworzą się dwie warstwy: górna o dużej lepkości (zawierająca 60
H
2
O
2 RCOOH
MeO
Me(COOR)
2
2 NaX
2 RCOONa
MeX
2
Me(COOR)
2
RCH
2
CH
OH
COOH
HOSO
3
H
RCH
2
CH
COOH
OSO
3
H
H
2
O
HOSO
3
H
RCH=CH
COOH
COOH
RCH-CH
2
OSO
3
H
– 63 % kwasów tłuszczowych) oraz dolna zawierająca roztwór elektrolitu o bardzo małej zawartości mydła i dużej
zanieczyszczeń pochodzących z użytego surowca. Minimalne stężenie elektrolitu potrzebne do wysolenia mydła nosi
nazwę „ługu granicznego” i zależne jest od rodzaju elektrolitu jak i kwasów tłuszczowych. Reakcja zmydlania składa
się z trzech etapów:
•
faza emulsji, w której następuje kontakt między reagentami na powierzchni styku faz,
•
faza szybkiego zmydlania,
•
faza zmydlania końcowego.
Mydła metaliczne można otrzymać dwiema metodami:
•
Metodą suchą, polegającą na ogrzewaniu odpowiedniego kwasu z tlenkiem lub wodorotlenkiem metalu w
temperaturze 150-300°C,
•
Metodą mokrą, która polega na reakcji podwójnej wymiany (temp. 70-80° 15% roztworu wodnego mydła
sodowego i odpowiednio rozpuszczonej w wodzie soli.
Mydła aminowe otrzymuje się przez bezpośrednią reakcję kwasu organicznego i zasady w temperaturze nieznacznie
wyższej od temperatury topnienia kwasu.
4.1.2. Oleje i tłuszcze siarczanowane
Surowcami do produkcji tłuszczów siarczanowych są estry gliceryny i kwasów tłuszczowych, zawierające
przynajmniej jedną resztę kwasu nienasyconego. Reakcje powstawania siarczanów tri glicerydów lub kwasów
tłuszczowych przebiegają dwiema drogami. W pierwszej reakcji kwas siarkowy reaguje z kwasem
hydroksytłuszczowym lub jego estrem z gliceryną. Wodę powstającą w reakcji pochłania kwas siarkowy, używany w
nadmiarze w stosunku do ilości stechiometrycznych.
Do olejów o dużym stopniu siarczanowania konieczne jest użycie czynnika silniejszego, jak kwas chlorosulfonowy
lub SO
3
.
Drugą reakcją tworzenia się siarczanów jest przyłączenie kwasu siarkowego do wiązania podwójnego C=C.
W reakcji nie powstaje woda, a zastosowanie mocniejszego reagenta powoduje tworzenie się kwasów
hydroksysulfonowych. Obecność w cząsteczce zarówno wiązania nienasyconego, jak i grupy hydroksylowej
powoduje, że reakcja może przebiegać według różnych schematów w zależności od warunków procesu.
Znane są dwie główne metody produkcji olejów siarczanowych, różniące się w zasadniczy sposób warunkami. Jedna z
nich to tzw. proces powolny w trakcie, którego kwas siarkowy dodaje się do olejów z bardzo małą szybkością w
temperaturze nieprzekraczającej 35°C. Proces szybki pozwala podnieść temperaturę w reaktorze do 50°C. Proces
technologiczny obejmuje trzy fazy: siarczanowanie, przemywanie oraz zobojętnianie i wykończanie.
CH
3
CH
2
CHCH
2
CH
3
OSO
3
H
H
2
SO
4
RCH=CH
2
(RCH
+
-CH
3
)HSO
4
-
ROH
HOSO
3
H
ROSO
3
H
H
2
O
ROH
ROSO
3
H
SO
3
ROH
ROSO
3
NH
4
NH
2
SO
3
H
HC
CO
HC
CO
O
2ROH
HC
HC
COOR
COOR
H
2
C
COOR
HC
COOR
SO
3
Na
+ NaHSO
3
4.1.3. Pochodne kwasów dikarboksylowych
Pochodne kwasów dikarboksylowych, a w szczególności kwasu bursztynowego i ftalowego, o zablokowanej przez
aminowanie lub estryfikację grupie karboksylowej dają przez sulfonowanie lub siarczanowanie środki
powierzchniowo czynne o dobrych właściwościach zwilżających.
Zwykła metoda otrzymywania sulfobursztynianów sodowych polega na estryfikacji kwasu lub bezwodnika
maleinowego alkoholami o 2 – 20 atomach węgla, natomiast grupę sulfonową wprowadza się przez reakcję
wodorosiarczynu sodu z podwójnym wiązaniem utworzonego estru.
Bardziej skomplikowane pochodne można otrzymać przez reakcję sulfonowych amidów kwasu bursztynowego z
kwasem maleinowym, z estrami i ich pochodnymi oraz przez syntezę dienową między bezwodnikiem lub estrem
kwasu maleinowego i sulfonowanie produktu reakcji.
W podobny sposób otrzymuje się pochodne kwasu ftalowego, mają one jednak znacznie mniejsze zastosowanie.
4.1.4. Siarczany alkilowe pierwszorzędowe
Siarczany alkilowe pierwszorzędowe, czyli alkohole pierwszorzędowe siarczanowane są jedną z podstawowych grup
środków powierzchniowo czynnych. Pochodne alkoholi wyższych niż 6 atomów węgla posiadają własności piorące i
emulgujące. Siarczanowane alkohole tłuszczowe lub siarczany alkilowe są estrami alkoholi tłuszczowych i kwasu
siarkowego.
Konieczne jest usuwanie wody powstającej w trakcie reakcji, dlatego stosowany jest duży nadmiar stężonego kwasu
siarkowego. Jednakże nadmiar kwasu prowadzi do powstawania produktów ubocznych, toteż zastępowany jest bardzo
często kwasem chlorosulfonowym lub jego mieszaniną z azotynem sodu, formaldehydem lub sześciometafosforanem.
Innym środkiem siarczanującym jest bezwodnik kwasu siarkowego, kwas amino sulfonowy oraz kwas
pirydynosulfonowy (otrzymywany przez działanie SO
3
na pirydynę).
4.1.5. Siarczany alkilowe drugorzędowe
Siarczany alkilowe drugorzędowe:
Drugorzędowe siarczany alkilowe można otrzymać dwiema metodami: przez siarczanowanie alkoholi
drugorzędowych oraz przez bezpośrednie siarczanowanie alkenów. Otrzymywanie pierwszym sposobem nie przyjęło
się w skali przemysłowej ze względów technicznych i ekonomicznych, dlatego otrzymuje je się głównie z alkenów
pochodzenia petrochemicznego. Związki te posiadają bardzo dobrą rozpuszczalność oraz własności piorące,
zwilżające i deflokulacyjne. Znane są pod nazwą handlową TEEPOL. Do syntezy używane są najczęściej α-alkenów
tak, aby grupa hydrofilowa znajdowała się możliwie najbliżej końca łańcucha węglowego. Reakcja przebiega wg
poniższej reakcji:
RSH
1,5 O
2
RSO
3
H
RBr
RSO
3
Na
Na
2
SO
3
NaBr
R
1
R
2
CH
2
SO
2
Cl
2
hv
R
1
R
2
CH
SO
2
Cl
HCl
R
1
R
2
CH
SO
2
Cl
2 NaOH
R
1
R
2
CH
SO
3
Na
NaCl
H
2
O
RH
SO
2
1/2 O
2
hv lub
nadtlenek
RSO
3
H
Stabilizację powstałego kompleksu zapewnia solwatacja, dlatego w reakcji stosuje się 3 lub 4 krotny nadmiar kwasu w
stosunku do alkenu. Reakcja prowadzona jest w niskiej temperaturze ok. 20 °C w czasie kilku minut. Nadmiar kwasu
zmniejszany jest proporcjonalnie do długości łańcucha alkenu. Przemysłowe Teepol otrzymuje się metodą ciągłą z
frakcji alkenów o temperaturze wrzenia 150 – 300 °C oraz kwasu siarkowego 92-96%, przy stosunku molowym kwas:
alken równym 1:2. Temperaturę reakcji osiąga się stosując wymienniki ciepła z ciekłym propanem, zaś produkt
siarczanowania zobojętnia się 20 % NaOH oraz poddaje się go hydrolizie w celu usunięcia produktów ubocznych.
Kolejnym etapem reakcji jest odsalanie np. dodatkiem alkoholu izopropylowego oraz oddestylowanie
rozpuszczalników. Zagęszczony produkt o pH ok. 8 odbarwia się ziemią okrzemkową.
4.1.6. Alkanosulfoniany
Alkanosulfoniany (sulfonowane parafiny) posiadają bardzo dobre własności piorące, myjące, zwilżające i emulgujące.
Hydrofilowym fragmentem ich cząsteczki jest grupa –SO
3
H związana z drugorzędowym atomem węgla. Stosowane
są najczęściej w postaci soli sodowych. Dobre efekty zwilżania osiągają produkty zawierające od 15 do 16 atomów
węgla w łańcuchu węglowodorowym.
Alkany i cykloalkany nie dają się sulfonować w sposób bezpośredni, natomiast alkeny jedynie w specjalnych
warunkach dają pożądane kwasy sulfonowe. W reakcji alkenów z SO
3
w rozcieńczonym dioksanie lub powietrzu
otrzymuje się cykliczne estry kwasów β-sulfonowych i dopiero ich hydroliza daje kwasy sulfonowe. Natomiast
nadmiar odczynnika sulfonującego prowadzi do powstania cyklicznych bezwodników siarczanowo-sulfonowych.
Metody otrzymywania kwasów alkanosulfonowych:
•
Reakcja utleniania merkaptanów i polisiarczków gdzie, jako utleniacz stosuje się nadtlenki, halogenki lub
dwuchromiany.
•
Reakcja podstawienia bromu w bromkach alifatycznych za pomocą siarczynu sodu
•
Telomeryzacja, w której etylen i wodorosiarczyn sodu ogrzewane są w obecności CCl
4
w temperaturze 115 –
125 °C pod ciśnieniem 700 – 1000 at. Powstający produkt jest mieszaniną połączeń o ogólnym wzorze H(CH
2
-CH
2
)
n
-
SO
3
H, gdzie n zmienia się w zakresie od 4 do 12.
•
Sulfochlorowanie alkanów w obecności światła prowadzi do sulfochlorków alkilowych, a ich hydroliza do
odpowiednich sulfonianów.
Warunki reakcji: frakcja alkanów o temperaturze wrzenia 250 – 350 °C, światło o długości fali 300- 400 nm. Reakcja
biegnie zgonie z mechanizmem rodnikowym.
•
Sulfoutlenianie przebiega wg schematu:
W wyniku reakcji dodatkowo powstaje kwas alkilonadsulfonowy, który redukowany jest ditlenkiem siarki do kwasu
alkanosulfonowego w obecności wody i światła lub przez działanie bezwodnikiem octowym.

RArH
HOSO
3
H
RArSO
3
H
H
2
O
4.1.7. Alkiloarylosulfoniany
Kwasy sulfonowe zawierające w swojej cząsteczce grupę – SO
3
H i pierścień aromatyczny nie wykazują właściwości
powierzchniowych. Obecność w pierścieniu podstawników alkilowych znacznie wpływa na czynności
powierzchniowe, które rosną wraz z długością łańcucha alkilowego – poczynając już od C
8
.
Otrzymywanie alkilobenzenosulfonianów przebiega zwykle w dwóch etapach i polega na alkilowaniu pierścienia
aromatycznego, a następnie sulfonowaniu produktu. Zgodnie z metodą Friedla-Craftsa benzen alkiluje się
halogenkiem alkilowym lub alkenem w obecności katalizatora, którym najczęściej jest AlCl
3
. Reakcje katalityczne
alkilowania w przemyśle prowadzi się pod ciśnieniem od atmosferycznego do 60 atmosfer w temperaturze od 0 do
300 °C. Zwykle alkiluje się benzen frakcją alkenową zawierającą alkeny od 10-14 atomów węgla, przy czym stosuje
się 3-4 krotny nadmiar molowy benzenu. Sulfonowanie alkilobenzenów wykonuje się bezpośrednio, stosując stężony
kwas siarkowy, oleum o różnych stężeniach oraz SO
3
czysty lub rozcieńczony gazem obojętnym bądź powietrzem.
Reakcja przebiega zgodnie z mechanizmem substytucji elektrofilowej, w wysokich temperaturach i przy dużych
stężeniach kwasu siarkowego tworzy się kwas arylomonosulfonowy, który może działać, jako środek sulfonujący i
dzięki czemu powstają produkty uboczne – sulfony. Odpowiedni dobór temperatury jest bardzo istotny na przebieg i
jakość reakcji. Zbyt niska nie zapewnia właściwej wydajności, natomiast w za wysokiej zachodzą reakcje uboczne
oraz inne podstawienie grupy sulfonowej.
Reakcje sulfonowania powinny być intensywnie mieszane i jednocześnie wydajnie chłodzone, ze względu na brak
mieszania się poszczególnych reagentów. Produkt reakcji powinien mieć kolor biały lub słabo żółty i być bez
jakiegokolwiek zapachu.
4.2. Środki kationowe
Środki kationowe ulegają w środowisku wodnym dysocjacji na dodatnio naładowany jon, wykazujący aktywność
powierzchniową. Zawierają zwykle w swojej budowie trzeciorzędowy lub czwartorzędowy atom azotu. Środki
kationowe nie zawierające azotu w cząsteczce stanowią niewielką grupę zarówno pod względem ilości produktów, jak
i ich zastosowania praktycznego.
4.2.1. Aminy
W alkiloaminach i ich pochodnych grupę hydrofobową stanowią nasycone lub nienasycone łańcuchy węglowe
zawierające 8 – 22 atomów węgla. Reaktywność grup aminowych daje możliwość syntezy wielu pochodnych amin,
należących do kationowych lub niejonowych środków powierzchniowo czynnych. Alkiloaminy otrzymywane są z
kwasów tłuszczowych poprzez syntezę amidów i ich redukcję lub degradację. Amidy, jako produkty pośrednie
otrzymuje się m. in. poprzez przepuszczanie gazowego amoniaku przez warstwę stopionych kwasów w temperaturze
190 – 210 °C w ciągu 12 godzin. Zalecany jest jednak dwustopniowy proces bez wyodrębniania amidów, w którym
odparowuje się kwasy w atmosferze gorącego amoniaku (280 – 330 °C), a następnie pary reagentów wprowadza się
do reaktora z Al
2
O
3
(280 °C). Wydajność procesu sięga 99 %.
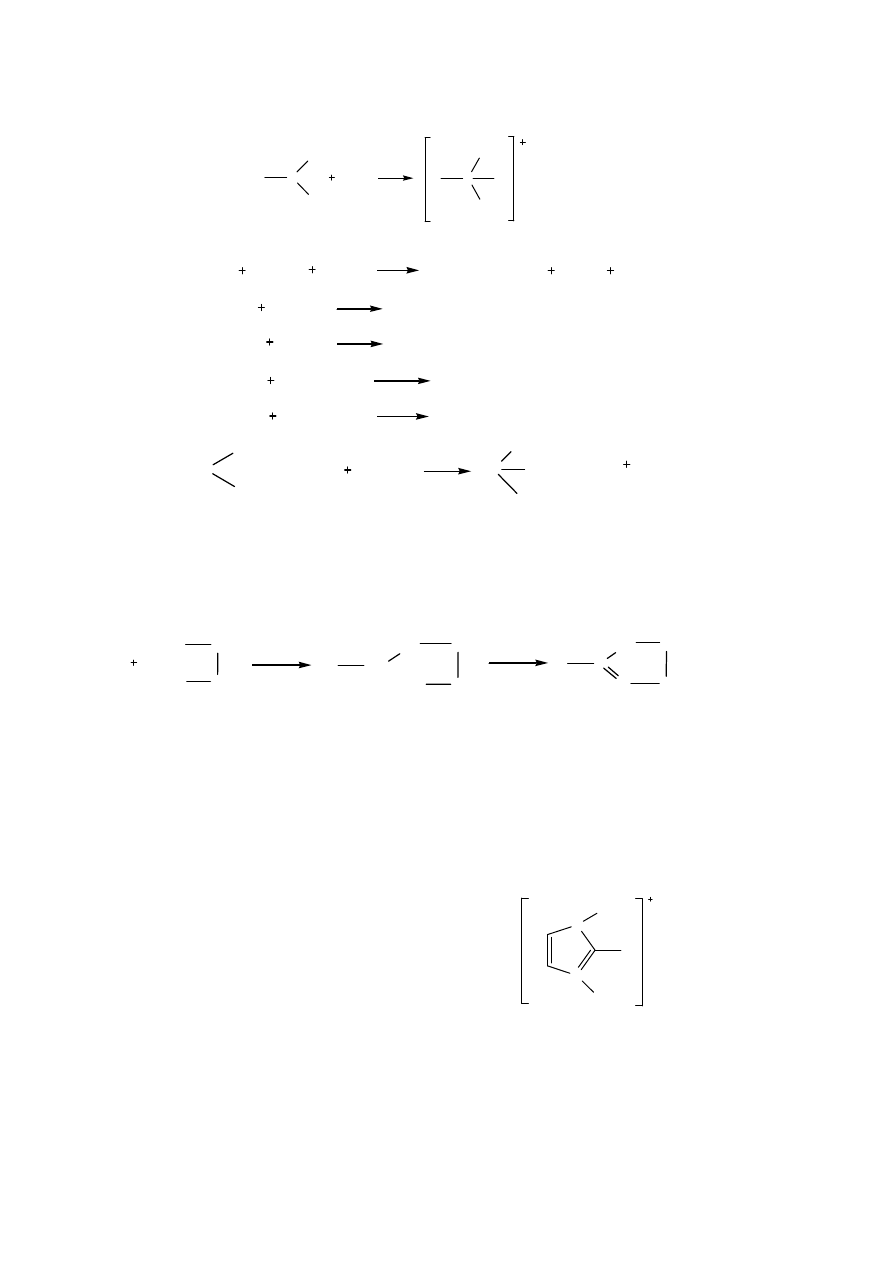
RCOOH
H
2
N
H
2
N
CH
2
CH
2
- H
2
O
HN
H
2
N
CH
2
CH
2
OC
R
- H
2
O
HN
N
CH
2
CH
2
C
R
N
N
R
R
2
R
1
X
-
R
N
R'
R'
R"Cl
R
N
R'
R"
R'
Cl
-
R
2
NH
CH
3
Cl
NaOH
R
2
NCH
3
CH
3
Cl
[R
2
N(CH
3
)
2
]
+
Cl
-
NaCl
H
2
O
RN(CH
3
)
2
CH
3
Cl
[RN(CH
3
)
3
]
+
Cl
-
RN(CH
3
)
2
C
6
H
5
CH
2
Cl
RN(CH
3
)
2
(CH
3
)
2
SO
4
[RN(CH
3
)
2
CH
2
C
6
H
5
]
+
Cl
-
[RN(CH
3
)
3
]
+
CH
3
SO
4
-
RN
(CH
2
CH
2
O)xH
(CH
2
CH
2
O)xH
CH
3
Cl
RN
+
(CH
2
CH
2
O)xH
(CH
2
CH
2
O)xH
CH
3
Cl
-
[R
2
N(CH
3
)
2
]
+
Cl
-
4.2.2. Sole i zasady czwartorzędowe
Najpowszechniejszym procesem otrzymywania czwartorzędowych soli amoniowych lub pirydyniowych jest metoda
polegająca na reakcji amin trzeciorzędowych z halogenkami lub siarczanami alkilowymi o krótkim rodniku
alkilowym.
Najważniejsze typy soli amoniowych przedstawiono poniżej:
4.2.3. Związki imidazolinowe
Kwasy tłuszczowe w reakcji z poliamidami tworzą środki kationowe typu imidazolin. Przedstawicielem tej grupy są
Sapaminy, otrzymywane z kwasu stearynowgo lub oleinowego w reakcji z etylenodiaminą.
Reakcję prowadzi się w temperaturze 250 °C pod zmniejszonym ciśnieniem lub w obecności środka odwadniającego.
Przez zastąpienie etylenodwuaminy jej pochodną lub inną dwuaminą można otrzymać różne rodzaje Sapaminy.
Produkty te zakwaszane są kwasem solnym, siarkowym lub kwasami sulfonowymi w celu zwiększenia ich
rozpuszczalności. Taki sam efekt można otrzymać przez przeprowadzenie ich w czwartorzędowe
sole. Przez siarczanowanie środków kationowych tego typu uzyskuje się produkty o charakterze anionowym
(Ultravon).
Również do kategorii imidazolin należą produkty o wzorze:
gdzie: R – rodnik alifatyczny C
1
-C
7
R
1
– rodnik alifatyczny C
7
-C
18
R
2
– rodnik benzylowy
X – anion
4.3. Środki amfoteryczne
Surowcem do syntezy środków amfoterycznych (amfolity i betainy) są alkiloaminy. Cechują się one obecnością w
tym samym łańcuch grup funkcyjnych zarówno dodatnich jak i ujemnych. W roztworach wodnych amfoterycznych
surfaktantów występuje jon obojnaczy, jednak odczyn roztworu nie jest obojętny, co wiąże się z wielkością stałych
dysocjacji grup kwasowych i zasadowych.
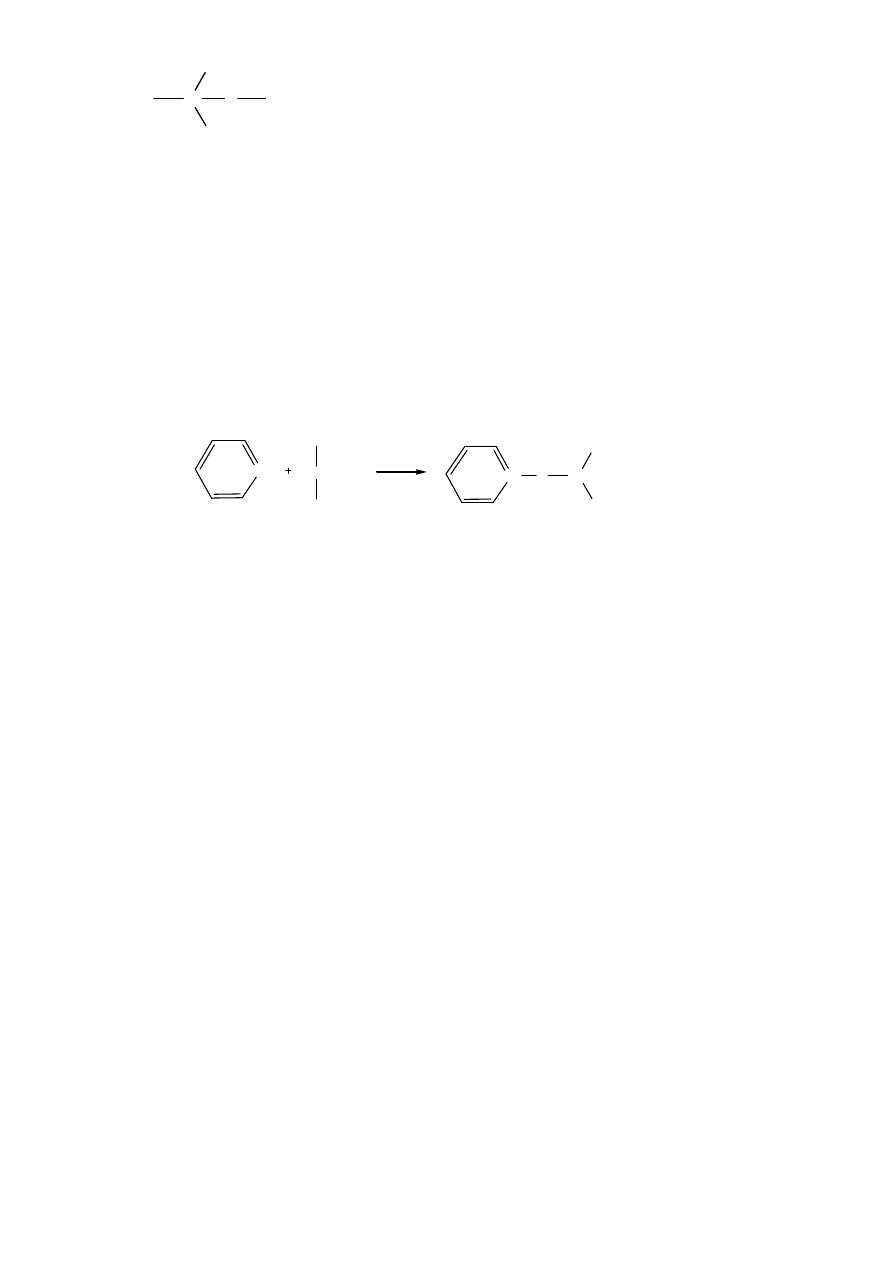
R
1
N
+
R
2
R
3
Y
Z
-
N
CHOH
CH
2
Cl
CH
2
SO
3
H
- HCl
N
+
H
2
C
CH
OH
CH
2
SO
3
-
gdzie: R
1
– grupa alkilowa C
8
-C
22
R
2
,R
3
– grupy alkilowe lub hydroksyalkilowe
Y – grupa alkilowa lub hydroksyalkilowe
Z – grupa hydrofilowa (COO
-
, SO
3
-
, OSO
3
-
)
Betainy najczęściej otrzymuje się w reakcji amin trzeciorzędowych z kwasem chlorooctowym. Zastosowanie estrów
chlorowcokwasów dikarboksylowych o krótkim łańcuch zamiast chlorowcokwasów daje produkty o własnościach
zwilżających. Długość mostka węglowego łączącego grupę kationową i anionową oraz rodzaj grupy anionowej
wpływają na rozpuszczalność w wodzie, aktywność powierzchniową oraz aktywność biobójczą (betainy i
czwartorzędowe sole amoniowe).
Sulfobetainy są to związki, które w swojej strukurze w miejscu grupy karboksylowej posiadają reszty kwasu
sulfonowego i dlatego posiadają lepsze właściwości powierzchniowe niż betainy. Otrzymuje się je w reakcji aminy
trzeciorzędowej z epichlorohydryną i siarczynem sodu. W grupie sulfobetain znane są m. in. pochodne zawierające
pierścień pirydynowy, otrzymywane w reakcji pirydyny z kwasem 1-chloro-2-hydroksypropanosulfonowym.
4.4. Środki niejonowe
Środki powierzchniowo czynne niejonowe nie ulegają w roztworach wodnych dysocjacji. Dzięki obecności grup
polarnych są one silnie solwatowane przez wodę i mogą się w niej rozpuszczać. Ze względu na zachowanie się w
roztworach wodnych środki powierzchniowe niejonowe można podzielić na trzy podgrupy:
1.
Rozpuszczalne dające w wodzie roztwory przeźroczyste lub opalizujące
2.
Ulegające dyspersji w wodzie dzięki własnościom hydrofilowym
3.
Nierozpuszczalne w wodzie, lecz rozpuszczalne w tłuszczach.
W przyrodzie występują substancje będące naturalnymi niejonowymi surfaktantami. Są to saponiny, glikozydy
złożone z cukrowców i swapogenin zawierające dużą ilość grup OH i dzięki temu rozpuszczalne są w wodzie.
Dodatkowo występują fosfolipidy i sterole (np. lecytyna).
5. Zastosowanie środków powierzchniowo czynnych
Związki powierzchniowo czynne wykorzystywane są w wielu różnych dziedzinach. Granice przemysłowego ich
stosowania są trudne do dokładnego sprecyzowania. Przykładami przemysłowych zastosowań surfaktantów jest
polimeryzacja emulsyjna lub zawiesinowa w produkcji polimerów termoplastycznych, poliuretanów lub włókien
syntetycznych, produkcja środków ochrony roślin, spienianie betonu w budownictwie, ekstrakcja przemysłowa,
usuwanie wycieków ropy naftowej, zastosowania w przemyśle papierniczym, tekstylnym i skórzanym, mycie i
czyszczenie urządzeń i obiektów przemysłowych, flotacja rud, obróbka metali, przemysł farb i lakierów, przemysł
drukarski(produkcja atramentu) i wiele innych. Największą część zużycia związków powierzchniowo czynnych
stanowi przemysł spożywczy, kosmetyczny i farmaceutyczny.
HOSO
3
H
H
2
O
NaCl
HCl
CH
C
10
H
20
CH
3
(CH
2
)
7
CH
3
katalizator
CH
CH
3
(CH
2
)
7
CH
3
CH
CH
3
(CH
2
)
7
CH
3
HO
3
S
CH
CH
3
(CH
2
)
7
CH
3
HO
3
S
CH
CH
3
(CH
2
)
7
CH
3
+
Na
-
O
3
S
Część doświadczalna
Ćwiczenie 1
Otrzymywanie decylobenzenosulfonianu sodu
Reagenty:
40 mmol (3,55 ml) benzenu
8 mmol (1,52 ml) 1-deken
8 mmol (0,43 ml) stężony kwas siarkowy
chlorek sodu
Reakcję wykonuje się w kolbie trójszyjnej zaopatrzonej w mieszadło, termometr, wkraplacz i chłodnicę zwrotną
zakończoną rurką z chlorkiem wapniowym, której wylot ma doprowadzenie bezpośrednio do przewodu wyciągu. W
kolbie umieszcza się 40 mmol osuszonego benzenu oraz 8 mmol stężonego kwasu siarkowego. Do zawartości kolby
wkrapla się, mieszając 8 mmol 1-dekenu. Najpierw wkrapla się kilka kropel bez chłodzenia i czeka się aż do
zapoczątkowania reakcji. Następnie dodaje się pozostałą część środka alkilującego, chłodząc kolbę wodą z lodem tak,
aby temperatura mieszaniny reagującej nie przekroczyła 20 °C. Zawartość kolby miesza się intensywnie przez 1,5
godziny. Po usunięciu wkraplacza do kolby dodaje się, mieszając, małymi porcjami drobno zmielonego lodu, a
następnie zimnej wody. Mieszaninę dobrze się wytrząsa i przenosi do rozdzielacza i oddziela dolną warstwę wodną.
Warstwę górną przemywa się kolejno wodą, wodorotlenkiem sodu i wodą. Rozpuszczalnik odparowuje się pod
zmniejszonym ciśnieniem, natomiast surowy produkt pozostawia się do zakrzepnięcia. Kolejnym etapem procesu jest
NH
2
NH
2
C
17
H
35
COOH
- H
2
O
N
N
H
C
17
H
35
+ H
2
SO
4
-H
2
O
N
N
H
C
17
H
35
HO
3
S
N
N
H
C
17
H
35
+
Na
-
O
3
S
NaCl
sulfonowanie otrzymanego alkilobenzenu. W tym celu w kolbie trójszyjnej zaopatrzonej w mieszadło i chłodnicę
zwrotną, umieszczamy reagent, a następnie powoli wkraplamy stężonego kwasu siarkowego (stosunek 1:1). W czasie
dodawania kwasu należy kontrolować temperaturę tak, aby nie przekraczała 30 – 50 °C, chłodząc kolbę w razie
potrzeby w naczyniu z zimną wodą. Po przereagowaniu reagentów pozostawia się mieszaninę reakcyjną do
ostygnięcia, po czym mieszając wylewa się do 100 ml zimnej wody i sączy od ewentualnie wytrąconego osadu.
Kwaśny roztwór zobojętnia się częściowo dodając ostrożnie, małymi porcjami wodorowęglanu sodu. Następnie
roztwór ogrzewa się do wrzenia, wysyca chlorkiem sodu i sączy na gorąco przez lejek Buchnera. Gorący przesącz
przelewa się do zlewki i mieszając chłodzi w lodzie. Student zobowiązany jest do zaproponowania dalszego
oczyszczania tego typu związków.
.
Ćwiczenie 2
Otrzymywanie sulfonianu sodowego 2-heptadecylobenzimidazolu
Reagenty:
5 mmol (0,54 g) o-fenylenodiaminy
5 mmol (1,42 g) kwasu stearynowego
10 % roztwór KOH
stężony kwas siarkowy
chlorek sodu
5 mmol (0,5 g) o-fenylodiaminy i 5 mmol kwasu stearynowego umieszczamy w reaktorze mikrofalowym lub reakcje
wykonujemy tradycyjnie w kolbie kulistej. Roztwór ogrzewamy w reaktorze w temperaturze 80 – 90 °C przez 80 s,
stosując moc reaktora 20 W. Natomiast tradycyjnie ogrzewamy reagenty do wrzenia przez 30 minut. Następnie do
mieszaniny dodajemy alkoholu i ogrzewamy mieszaninę do całkowitego rozpuszczenia reagentów. Później dodajemy
powoli roztwór KOH, aż do otrzymania alkalicznego odczynu, pH roztworu sprawdzamy papierkiem lakmusowym.
Surowy produkt podajemy dalszemu sulfonowaniu stężonym kwasem siarkowym. W kolbie trójszyjnej zaopatrzonej
w mieszadło i chłodnicę zwrotną, umieszczamy 2-heptadecylobenzimidazol a następnie powoli wkraplamy stężonego
kwasu siarkowego (stosunek 1:1). W czasie dodawania kwasu należy kontrolować temperaturę tak, aby nie
przekraczała 30 – 50 °C, chłodząc kolbę w razie potrzeby w naczyniu z zimną wodą. Po przereagowaniu reagentów
pozostawia się mieszaninę reakcyjną do ostygnięcia, po czym mieszając wylewa się do 100 ml zimnej wody i sączy
od ewentualnie wytrąconego osadu. Kwaśny roztwór zobojętnia się częściowo dodając ostrożnie, małymi porcjami
wodorowęglanu sodu. Następnie roztwór ogrzewa się do wrzenia, wysyca chlorkiem sodu i sączy na gorąco przez
lejek Buchnera. Gorący przesącz przelewa się do zlewki i mieszając chłodzi w lodzie. Krystaliczny osad odsącza się
pod zmniejszonym ciśnieniem. Po przeprowadzonym ćwiczeniu należy wyliczyć wydajność otrzymanego produktu.

C
12
H
25
-NH
2
HCOH
2. HCl 6N
3. HCOCOH
N
N
C
12
H
25
C
12
H
25
Cl
-
3 H
2
O
1. C
12
H
25
NH
2
/ toluen
Ćwiczenie 3
Otrzymywanie chlorku 1,3-bisdodecyloimidazoliowego
Reagenty:
10 mmol (1,85 g) dodecyloaminy
5 mmol (0,3 g) paraformaldehydu
5 mmol (1,6 ml) 6N kwas solny
5 mmol (1,12 ml) 40 % wodny roztwór glioksalu
10 ml toluenu
W kolbie kulistej trójszyjnej umieszczamy 5 mmol paraformaldehydu w 10 ml toluenu, a następnie powoli wkraplamy
5 mmol aminy, kontrolując temperaturę mieszaniny tak, aby nie osiągnęła 40 °C. Po 10 minutach mieszania, roztwór
ochładzamy do temperatury 3 °C i wkraplamy bardzo powoli drugą porcję aminy (5 mmol) oraz 5 mmol 6N wodnego
roztworu HCl, tak by temperatura nie przekroczyła 20 °C. Następnie mieszaninę ogrzewamy do temperatury 25 °C i
dodajemy 5 mmol 40% wodnego roztworu glioksalu. Po godzinnym mieszaniu w temperaturze pokojowej z roztworu
usuwamy toluen i wodę. Otrzymaną sól oczyszczałam poprzez ekstrakcję z acetonem. Po reakcji należy wyliczyć
wydajność uzyskanego produktu.
Ćwiczenie 4
Produkcja oleju siarczanowanego
W kolbie kulistej z mieszadłem umieszczamy 10 g naważonego oleju, a następnie w wkraplaczu umieszczamy 25 %
wagowych stężonego kwasu siarkowego w stosunku do oleju. Kwasu dodaje się do oleju z bardzo mała szybkością,
tak, aby temperatura nie przekroczyła około 25 °C. W razie potrzeby należy zastosować chłodzenie kolby mieszaniną
wody i lodu. Przez 2 godziny po dodaniu mieszamy układ w celu odreagowania. Koniec reakcji stwierdza się
wykonując próbę na rozpuszczalność w wodzie bez dodatku alkaliów. Produkt siarczanowanie przemywa się 20 %
roztworem NaCl.
Ćwiczenie 5
Produkcja siarczanów alkilowych
W kolbie kulistej umieszczamy 20 mmol (3,8 ml) 1-dekenu, montujemy wkraplacz i mieszadło. Do wkraplacza
umieszczamy obliczoną ilość stężonego kwasu siarkowego (alken: kwas, 1:2). Kwas wkraplamy powoli tak, aby
temperatura nie przekroczyła 10-20 °C, a w razie przekroczenia tej temperatury chłodzimy układ mieszaniną wody i
lodu. Reakcje należy zakończyć, gdy mieszanina reakcyjna jest rozpuszczalna w ciepłej wodzie. Produkt
siarczanowania zobojętniamy 20% roztworem NaOH a następnie prowadzimy hydrolizę w temperaturze 90-100 °C.
Następnie prowadzimy odsalanie surowego produktu, czyli dodajemy 10 ml alkoholu izopropylowego. Fazę wodną
usuwamy, a fazę organiczną zadajemy eterem naftowym. Fazę organiczną przenosimy do kolbki i odparowujemy pod
zmniejszonym ciśnieniem. Produkt końcowy o pH 8-8,5 odbarwia się ziemią okrzemkową.
Ćwiczenie 6

Właściwości ekstrakcyjne związków powierzchniowo-czynnych.
1.
Ćwiczenie rozpoczyna się od przygotowania roztworu barwnika – błękitu metylenowego o stężeniu 10
-2
M.
2.
Do 10 próbek o pojemności 20 ml odmierzamy pipetą 0.1, 0.2, 0.4, 0.8, 1.2, 1.6, 2.0, 5.0, 7.0, 10 ml roztworu
barwnika i uzupełniamy do pełna wodą destylowaną. Obliczyć stężenia przygotowanych roztworów.
3.
Zarejestrować widmo jednego z roztworów błękitu metylenowego. Widmo należy zarejestrować w zakresie
550-750 nm i na podstawie jego przebiegu wybrać długość fali do pomiarów absorbancji. Następnie
mierzymy absorbancję dla badanych roztworów dla wybranej długości fali. Po pomiarze każdy roztwór należy
z powrotem wlać do odpowiedniej probówki i sporządzamy krzywą kalibracyjną.
4.
Próbki badanych roztworów umieszczamy w rozdzielaczu wraz z równoważną ilością chloroformu i stałym
stężeniem zw. pow-czynnego ABS.
5.
Po ekstrakcji 3 ml warstwy organicznej umieszcza się w kuwetach do spektrofotometru UV i wykonuje się
pomiary absorbancji dla wybranej długości fali.
6.
Na podstawie pomiarów wyznaczamy stężenie barwnika w próbkach organicznych oraz należy wyciągnąć
wnioski wynikające z otrzymanych wyników.
Ćwiczenie 6
Badanie podstawowych właściwości środków powierzchniowo czynnych na dostępnych komercyjnie produktach:
•
Surforokanol L225/1
•
Kwas ABS
Określanie stopnia przydatności środków powierzchniowo czynnych
Wskazania, co do stopnia przydatności środków powierzchniowo czynnych otrzymuje się przez oznaczanie
podstawowych własności powierzchniowo czynnych, przez bezpośrednią ocenę własności potrzebnych w określonym
celu a także przez naznaczenie odporności chemicznej w warunkach, które zaistnieją w praktyce ich użytkowania.
1.
Wstępna ocena organoleptyczna związku powierzchniowo czynnego polega na sprawdzeniu wyglądu,
zapachu oraz barwy produktu.
2.
Pomiar pH związku powierzchniowo czynnego. Do kolby miarowej o pojemności 100 cm
3
odważyć 1 g
badanego środka i uzupełnić do kreski wodą destylowaną, po czym zawartość kolby dokładnie wymieszać.
Przygotowany w ten sposób 1% roztwór przenieść do kolby stożkowej. Przed przystąpieniem do pomiaru
każdorazowo sprawdzić działanie pehametru i wyskalować stosując bufor o pH najbardziej zbliżonym do
przewidywanego pH roztworu badanego. Elektrodę przemyć wodą destylowaną, po czym zanurzyć w badanym
roztworze. Odczytać na skali pehametru wartość pH roztworu. Dokonać kolejnego pomiaru, powtarzając czynności.
Wynik końcowy należy podać jako średnią arytmetyczną dwóch pomiarów, których różnica nie może być większa niż
0,1 jednostki pH.
3.
Oznaczanie własności pianotwórczych
•
Zdolność pianotwórcza – własność środka powierzchniowo czynnego określona objętością wytworzonej piany
[cm
3
] mierzonej po upływie określonego czasu
•
Wskaźnik trwałości piany – wielkość obliczona, jako stosunek objętości piany mierzonej po upływie 10 min
do objętości tejże piany zmierzonej po upływie 1 min licząc od chwili jej wytworzenia.
Wykonanie oznaczenia: Z ilości około 300 cm
3
roztworu badanego środka powierzchniowo czynnego pobrać 50 cm
3
i
wlać do cylindra pomiarowego po ściance tak, aby nie powstała piana. Po 10 min z pozostałej części roztworu pobrać
200 cm
3
roztworu i wprowadzić do rozdzielacza w taki sposób żeby nie powstała piana. Rozdzielacz z roztworem
umieścić nad cylindrem i sprawdzić czy otwór wylotowy rozdzielacza znajduje się w centralnym punkcie cylindra w
odległości 900 mm nad poziomem cieczy w cylindrze. Następnie otwieramy kran rozdzielacza. Po wypłynięciu całej
objętości roztworu z rozdzielacza włączyć sekundomierz i po upływie 1min oraz 10 min odczytać na skali cylindra
wysokość słupa powstałej piany.
Obliczenie wyników:
Zdolność pianotwórczą (X) obliczamy w cm
3
wg wzoru:
h
d
X
⋅
⋅
=
4
2
π
gdzie: d - średnica wewnętrzna cylindra pomiarowego [cm]
h - odczytana wysokość słupa piany [cm]
Wskaźnik trwałości piany (X
1
) obliczamy w procentach wg wzoru:
100
1
2
1
⋅
=
V
V
X
gdzie: V
1
- objętość piany zmierzona po upływie 1 min [cm
3
]
V
2
- objętość piany zmierzona po upływie 10 min [cm
3
]
Skrócona instrukcja obsługi reaktora mikrofalowego PLAZMATRONIKA
Po umieszczeniu naczynia reakcyjnego wraz z chłodnicą w reaktorze, należy:
1.
Włączyć napięcie zasilające (czerwony włącznik z prawej strony)
2.
Uruchomić mieszadło oraz ustawić pożądaną szybkość mieszania
3.
Wcisnąć przycisk TIME – wpisać 1 i wcisnąć ENTER
4.
Wprowadzić zadany czas grzania (HEAT) i wcisnąć ENTER
5.
Wprowadzić czas chłodzenia (COOL) i wcisnąć ENTER
6.
Wprowadzić zadaną moc (%P) i wcisnąć ENTER
7.
Wprowadzić minimalną temperaturę grzania (TEMP MIN), wcisnąć ENTER
8.
Wprowadzić maksymalną temperaturę grzania (TEMP MAX), wcisnąć ENTER
9.
Wprowadzić zadany czas oczekiwania (SET WAIT TIME), wcisną ENTER
Jeśli parametry zostały wprowadzone poprawnie wcisnąć przycisk START STOP
Literatura:
1.
J. Ogonowski, A. Tomaszkiewicz-Potępa „Związki powierzchniowo czynne”, Politechnika Krakowska,
Kraków 1999.
2.
S. Anastasiu, E. Jelescu „Środki powierzchniowo czynne”, Wydawnictwo Naukowo-Techniczne, Warszawa
1973.
3.
A. I. Vogel „Preparatyka Organiczna”, Wydawnictwo Naukowo-Techniczne, Warszawa 1984.

4.
E. Białowąs, W. Hreczuk, J. Szymanowski „Przemysł Chemiczny”, 80/10 (2001).
5.
R. Bogoczek, E. Kociołek-Balawejder „Technologia chemiczna: surowce i półprodukty”, Akademia
Ekonomiczna, 1992.
W sprawozdaniu musi być zawarty:
1.
Przebieg wykonywanego ćwiczenia, wydajność produktu i poszczególnych etapów syntezy.
2.
Krótki opis zsyntetyzowanego związku, jego stopnia przydatności, jako środka powierzchniowo czynnego i
zastosowanie.
3.
W przypadku wykonywania ćwiczenia 2 podać inne przykładowe zastosowania reaktora mikrofalowego w
przemyśle (3 przykłady).
4.
Poniżej zamieszczony jest wzór pierwszej strony sprawozdania. Sprawozdanie wysyłamy elektronicznie do
prowadzącego ćwiczenie laboratoryjne przed wykonywanym drugim ćwiczeniem.

POLITECHNIKA GDAŃSKA
WYDZIAŁ CHEMICZNY
KATEDRA TECHNOLOGII CHEMICZNEJ
SPRAWOZDANIE Z ĆWICZEŃ LABORATORYJNYCH
PRODUKCJA ZWIĄZKÓW POWIERZCHNIOWO CZYNNYCH
PROWADZĄCY:
NAZWISKA OSÓB WYKONUJĄCYCH ĆWICZENIE:
1.
2.
3.
4.
5.
KIERUNEK STUDIÓW:
GRUPA:
DATA WYKONANIA ĆWICZENIA:
DATA ODDANIA SPRAWOZDANIA:
GDAŃSK 2012
Wyszukiwarka
Podobne podstrony:
produkcja zwiazkow powierzchniowo czynnych sprawko
Związki powierzchniowo czynne; tenzydy
Oznaczanie w ściekach substancji powierzchniowo – czynnych, Ochrona Środowiska, semestr IV, sprawka
Zwiazki powierzchniowo czynne i Nieznany
Wyznaczanie potencjału desorpcji związków powierzchniowo akt, Studia, Politechnika
Zwilżalnośc Równanie Washburna Związki powierzchniowo czynne
wyznaczanie izoterm adsorbcji substancji powierzchniowo czynnych, Chemia fizyczna, laboratorium, Che
Czerwone i brązowe algi morskie w walce ze szkodliwym działaniem środków powierzchniowo czynnychx
Niejonowe związki powierzchniowo czynne
Związki powierzchniowo czynne; tenzydy
Związki chemiczne produkty reakcji tlenków z wodą
gr3, Elektroliza - proces rozkładu związków chemicznych i separacji produktów tego rozkładu pod wpły
Ściągi mikro, Ściąga wykład 9, Teoria produkcji- zajmuje się rzeczową stroną procesów wytwórczych, a
Napięcie powierzchniowe, Bioinżynieria Produkcji żywności, Fizyka
PODSTAWOWE ZWIĄZKI DO PRODUKCJI KOSMETYKÓW, Kosmetologia, Prace kontrolne, CHEMIA KOSMETYCZNA
Charakterystyka technologiczna produkcji wielkotonażowych związków organicznych w UE
więcej podobnych podstron