
1
Ć
WICZENIA Z GOSPODARKI ENERGETYCZNEJ, WODNEJ I ŚCIEKOWEJ
CZĘŚĆ MIKROBIOLOGICZNA
Ć
wiczenie 4-5
Mikrobiologiczne kryteria oceny sanitarnej wody
Część teoretyczna:
1. Kryteria jakości sanitarnej wody przeznaczonej do spożycia przez ludzi.
2. Charakterystyka mikroorganizmów wskaźnikowych.
3. Drobnoustroje chorobotwórcze przenoszone drogą wodną. Bakterie chorobotwórcze i
potencjalnie chorobotwórcze występujące w wodach powierzchniowych.
Część praktyczna:
I. Oznaczanie liczby bakterii psychro- i mezofilnych
Jest to metoda hodowlana, w której zakłada się, że każda kolonia rozwija się z
pojedynczej komórki bakteryjnej, pozwala więc na określenie liczby żywych, zdolnych do
rozmnażania komórek bakterii znajdujących się w badanym materiale. Oznaczenie
wykonuje się metodą płytkową Kocha, stosując posiew głębinowy na podłoże z agarem
odżywczym.
Materiał: woda wodociągowa, rzeczna
Odczynniki i aparatura:
•
podłoże – agar odżywczy;
•
jałowe płytki Petriego;
•
probówki z płynem do rozcieńczeń (po 9ml);
•
jałowe pipety mikrobiologiczne (1ml).
Wykonanie:
1. Posiewu bakterii na agar odżywczy dokonuje się w dwóch równoległych
powtórzeniach. Wodę wodociągową należy posiewać bezpośrednio, pobierając 1
ml wody i przenosząc na jałową płytkę Petriego. Dodatkowo posiewu dokonuje
się z rozcieńczenia 10
-1
.
Wodę powierzchniową posiewa się z rozcieńczeń 10
-3
i/lub 10
-5
.
2. Płytki z zawiesiną bakterii (1ml) zalać upłynnionym na łaźni wodnej i ostudzonym
do 45°C podłożem i po dokładnym wymieszaniu pozostawić do zastygnięcia.
3. Płytki odwrócić do góry dnem i jedną z nich wstawić do cieplarki o temperaturze
22°C (oznaczenie bakterii psychrofilnych), drugą do cieplarki o temperaturze
37°C (oznaczenie bakterii mezofilnych).
4. Po okresie inkubacji (72 h dla bakterii psychrofilnych i 24 h dla bakterii
mezofilnych) policzyć wyrosłe kolonie. W razie stosowania rozcieńczeń próbki,
liczbę koloni należy pomnożyć przez odwrotność rozcieńczenia.
5. Wynik badań wpisać do tabeli 1. Wynik oznaczenia podać jako liczbę bakterii
psychrofilnych oraz liczbę bakterii mezofilnych w 1 cm
3
wody.
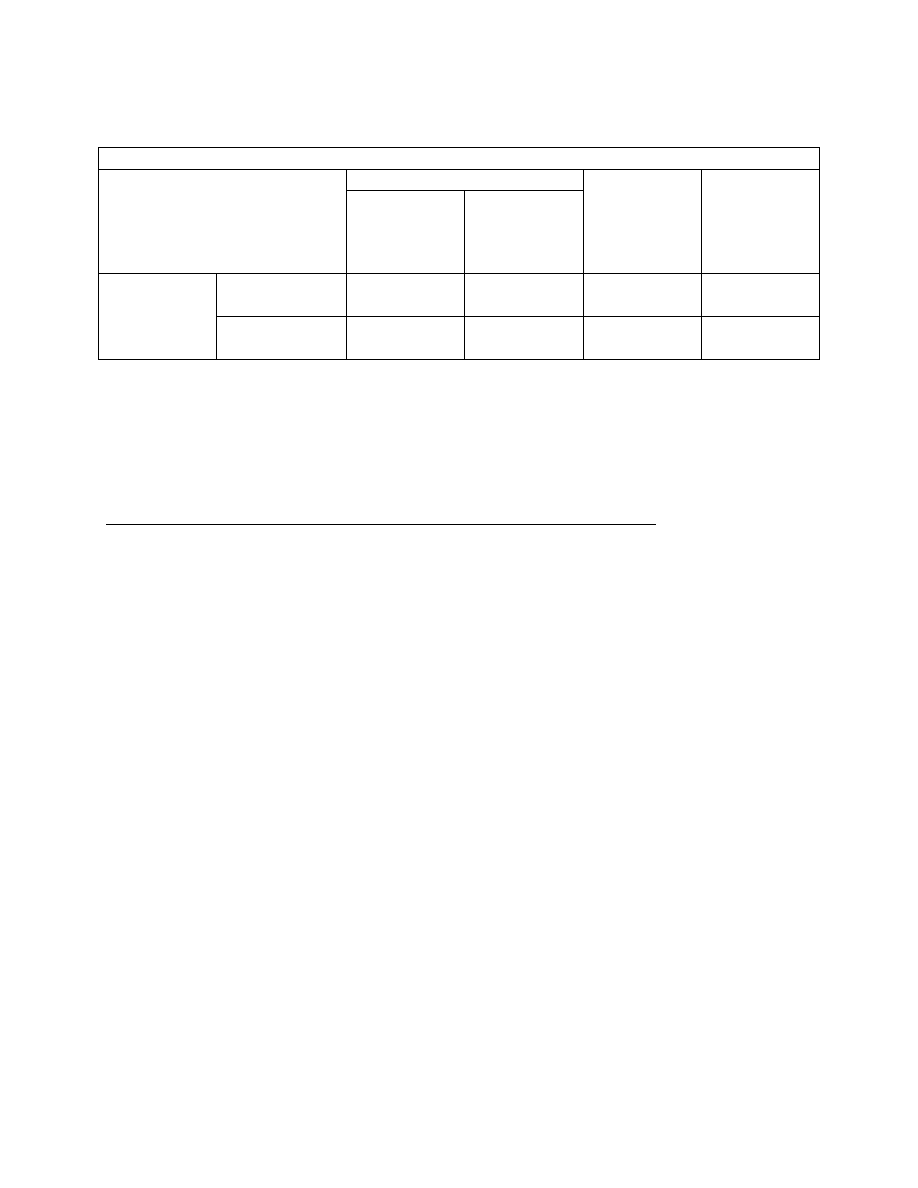
2
Tabela 1. Zestawienie wyników analizy bakteriologicznej wody do celów sanitarnych −
liczba bakterii psychrofilnych i mezofilnych.
BADANA PRÓBA: …………
Warunki hodowli
Oznaczenie
podłoże
temperatura
i czas
hodowli
Liczba
kolonii w
ilości
badanej
próby
Liczba
bakterii w
1 cm
3
wody
psychrofilnych
Ogólna
liczba
bakterii
mezofilnych
Wnioski:
………………………………………………………………………………………………………
………………………………………………………………………………………………………
……………………………………………………………………………………………………..
II. Oznaczanie bakterii grupy coli metodą filtrów membranowych
Metoda filtrów membranowych zalecana jest do badania wody zawierającej małe
ilości poszukiwanych bakterii, a więc wody przeznaczonej do picia i potrzeb
gospodarskich, może być również wykorzystana w badaniu wód zanieczyszczonych i
ś
cieków po uprzednim rozcieńczeniu tych próbek.
Wykrywanie bakterii grupy coli metodą filtrów membranowych polega na
przesączeniu określonej objętości wody lub ścieków przez jałowy filtr i inkubacji na
określonym podłożu. Bakterie w trakcie sączenia zostają zatrzymane na filtrze, który
umieszcza się na pożywce wybiórczej, rozwijając się w czasie inkubacji tworzą na
powierzchni filtra kolonie o typowym wyglądzie.
Materiał: woda wodociągowa, rzeczna
Odczynniki i aparatura:
•
zestaw do filtracji membranowej;
•
płytki Petriego z podłożem Endo.
Wykonanie:
1. Przed użyciem aparat filtracyjny wysterylizować w autoklawie w temperaturze
120°C przez 15 minut.
2. Zmontować aparat filtracyjny (lejek umieścić w kolbie ssawkowej, połączonej z
pompą próżniową, jałową pęsetą nałożyć na porowatą płytkę filtr membranowy).
3. Wlać odpowiednią ilość badanej wody do lejka (dla wody kranowej 100 ml, dla
wód powierzchniowych 1 ml z dodatkiem 30 ml roztworu soli fizjologicznej).
4. Po przefiltrowaniu ściany lejka spłukać dokładnie ok. 20 ml jałowego roztworu soli
fizjologicznej.

3
5. Zamknąć kranik i wyjałowioną pęsetą przenieść filtr membranowy na płytkę
Petriego z podłożem Endo (powierzchnią z bakteriami ku górze), tak aby nie było
pęcherzyków powietrza pomiędzy filtrem i podłożem.
6. Płytki Petriego z filtrami umieścić w cieplarce dnem ku górze i inkubować 24 h w
37°C.
7. Po okresie inkubacji policzyć wyrosłe kolonie, tj. ciemnoczerwone z metalicznym
połyskiem (tzw. połysk fuksynowy). Jeżeli nie stwierdza się obecności typowych
kolonii, należy przeprowadzić badania potwierdzające.
III. Oznaczanie bakterii grupy coli metodą fermentacyjno-probówkową (FP)
Metodę fermentacyjną probówkową (FP) stosuje się do wykrywania bakterii grupy
coli zarówno w wodzie przeznaczonej do spożycia, do potrzeb gospodarczych, jak
również w wodach powierzchniowych i ściekach. Oznaczenie oparte jest na zdolności
tych bakterii do fermentowania laktozy z wytworzeniem w podłożu kwasu (zmiana
zabarwienia pożywki z fioletowej na żółtą) oraz gazu (w rurkach Durhama
umieszczonych w probówkach).
Metoda FP pozwala na określenie najbardziej prawdopodobnej liczby (NPL)
bakterii coli w 100 ml badanej próbki, wyznaczonej z tablic na podstawie rachunku
prawdopodobieństwa, oraz miana coli – najmniejszej objętości badanej wody lub
ś
cieków wyrażonej w ml, w której stwierdza się jeszcze obecność bakterii coli.
Oznaczenie bakterii grupy coli wraz z identyfikacją Escherichia coli przeprowadza
się w kilku etapach, na które składają się badania wstępne, potwierdzające,
uzupełniające i ostateczne.
Materiał: woda wodociągowa, rzeczna
Odczynniki i aparatura:
•
podłoże laktozowe z purpurą bromokrezolową podwójnie stężone z rurkami
Durhama;
•
probówki z płynem do rozcieńczeń (po 9ml).
Wykonanie:
1. Przy pomocy jałowej pipety posiewać nie rozcieńczoną wodę wodociągową w
ilościach: 1 x 50 cm
3
oraz 5 x 10 cm
3
na podłoże laktozowe z purpurą
bromokrezolową podwójnie stężone. W probówkach powinny znajdować się rurki
Durhama, w których zbierać się będzie wytworzony CO
2
.
2. W przypadku spodziewanego większego zanieczyszczenia wody posiać mniejsze
jej objętości:
•
woda z wodociągów nie dezynfekowana, woda z basenu kąpielowego – 5
x 10 cm
3
, 1 x 1 cm
3
, 1 x 0,1 cm
3
•
woda z urządzeń na potrzeby własne – 2 x 10 cm
3
, 2 x 1 cm
3
, 2 x 0,1 cm
3
•
woda powierzchniowa – 2 x 0,1-0,0001 cm
3
(rozc. 10
-1
do 10
-4
)
Objętości 1 cm
3
wody oraz 1 cm
3
z rozcieńczeń od 10
-1
do 10
-4
posiewać na
podłoże laktozowe z purpurą bromokrezolową o stężeniu normalnym.
3. Posiane próbki inkubować w temperaturze 37°C przez 24-48 h.
4. Za wynik dodatni przyjmuje się obecność gazu w rurkach Durhama lub
występowanie pęcherzyków gazu w podłożu przy lekkim wstrząsaniu, a także

4
zmianę barwy z fioletowej na żółtą. Zmiany te wskazują na wzrost bakterii i
fermentację laktozy z wytworzeniem kwasu i gazu.
Za wynik ujemny przyjmuje się brak gazu i zakwaszenia podłoża.
Obecność niewielkich ilości gazu przy słabym zakwaszeniu lub braku
zakwaszenia uznaje się za wynik wątpliwy, wymagający dalszego potwierdzenia.
Jako wynik podać miano oraz NPL bakterii coli.
IV. Badania potwierdzające obecność bakterii grupy coli
Badanie potwierdzające – posiew na podłoże Endo – dokonuje się ze wszystkich
dodatnich i wątpliwych hodowli badania wstępnego, uzyskanych po 24 i 48 h.
Wykonanie:
1. Za pomocą jałowej ezy pobrać niewielką ilość materiału z hodowli na podłożu
laktozowym z purpurą bromokrezolową i posiać na podłoże Endo.
2. Inkubować w temperaturze 37°C przez 24 h.
3. Za wynik dodatni uważa się wzrost gładkich, ciemnoczerwonych koloni z
charakterystycznym metalicznym (fuksynowym) połyskiem.
4. Niektóre szczepy bakterii grupy coli rosną na pożywce Endo w postaci jasno lub
ciemnoróżowych kolonii, z ciemniejszym środkiem bez charakterystycznego
połysku. Obecność tych nietypowych kolonii, przyjmuje się za wynik wątpliwy,
wymagający dalszych badań.
Badania te polegają na:
•
ponownym stwierdzeniu zdolności wyizolowanego szczepu do fermentacji
laktozy z wytworzeniem kwasu i gazu (tzw. wtórna fermentacja laktozy)
•
wybarwieniu komórek metodą Grama
•
wykonaniu testu na osydazę cytochromową (pojawienie się
intensywnego niebieskiego zabarwienia po dodaniu odczynnika na
oksydazę, świadczy o obecności tego enzymu i jednocześnie wyklucza
obecność bakterii grupy coli, które są oksydazoujemne. Gatunki z rodzaju
Aeromonas (Pseudomonas aeruginosa) mogą również wytwarzać kwas i
gaz z laktozy, jedynie pozytywna reakcja na oksydazę odróżnia je od
bakterii grupy coli)
V. Badania identyfikujące Escherichia coli metodą szeregu IMViC
W przypadku konieczności ostatecznego potwierdzenia występowania Eschericia coli w
wodzie, przeprowadza się następujące testy biochemiczne:
•
stwierdzenie zdolności bakterii do wytwarzania indolu (I) z tryptofanu (wynik
dodatni),
•
reakcja z czerwienią metylową (M) (wynik dodatni),
•
reakcja Voges-Proskaura (V), stwierdzająca obecność acetylometylokarbinolu
(wynik ujemny),
•
zdolność wykorzystywania cytrynianu (C) jako jedynego źródła węgla (wynik
ujemny).

5
Badania identyfikujące Eschericia coli rozpoczyna się od wyizolowania czystych kultur z
pożywki Endo. Hodowlę prowadzi się w temp. 37°C. Reakcje na indol, z czerwienią
metylową i odczyn Voges-Proskaura przeprowadza się w probówkach, w których
nastąpił wzrost bakterii, objawiający się zmętnieniem pożywki.
1. Wykrywanie indolu
Wytwarzanie indolu sprawdza się po 24-godzinnej inkubacji w wodzie peptonowej z
tryptofanem, dodając do hodowli po ściance probówki kilka kropli odczynnika Ehrlicha.
Pojawienie się czerwonego zabarwienia na granicy płynów świadczy o obecności indolu,
czyli o wyniku dodatnim.
2. Reakcja z czerwienią metylową
Do hodowli (3,4-dniowej) na podłożu Clarka dodaje się 2 krople czerwieni metylowej.
Wystąpienie wyraźnie czerwonej barwy wskazuje na zakwaszenie pożywki w wyniku
rozkładu glukozy. Świadczy to o dodatnim wyniku reakcji. Kolor żółty określa wynik
ujemny, a kolor pomarańczowy lub jasnoczerwony – wynik wątpliwy.
3. Reakcja Voges-Proskaura
Przeprowadzenie tej reakcji pozwala stwierdzić obecność acetylometylokarbinolu.
Wykonuje się ją po 24-godzinnej hodowli na pożywce Clarka, dodając do hodowli
0,6 ml roztworu 6% α-naftolu rozpuszczonego w alkoholu absolutnym. Po dokładnym
wymieszaniu dodać 0,4 ml 40 % KOH oraz 2 ml roztworu kreatyny. Zawartość probówki
miesza się ponownie i wstawia do cieplarki na 30-45 minut. Wystąpienie intensywnego
różowego lub czerwonego zabarwienia w górnej części płynu oznacza wynik dodatni,
czyli obecność acetylometylokarbinolu. W przypadku wyniku ujemnego pożywka nie
zmienia barwy lub jest zabarwiona na kolor lekko różowy.
4. Zdolność wykorzystania cytrynianu jako jedynego źródła węgla.
Badania to przeprowadza się na pożywce Simmonsa. Hodowle inkubuje się przez
72 h. Brak wzrostu i zmiany zabarwienia ocenia się jako wynik ujemny, co jest cechą
charakterystyczną dla Eschericia coli. Natomiast wzrost na pożywce oraz alkalizacja
podłoża powodująca zmianę zabarwienia na niebieską określa się jako wynik dodatni,
charakterystyczny dla innych pałeczek grupy coli.
Wyszukiwarka
Podobne podstrony:
Kryteria oceny skuteczności działania hamulców, Politechnika Warszawska Wydział Transportu, Semestr
kryteria oceny podręczników artykuł
Kryteria oceny zapisu KTG
Kryteria oceny w nauczaniu zintegrowanym klasa pierwsza(1)
Budowa i zasada działania układu pneumatycznego z?S oraz kryteria oceny
Sprawko2, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
Kryteria oceny zajęć dydaktycznych, Materiały
Kryteria oceny rozprawki
Kryteria oceny dla właściwego doboru systemowych deskowań stropowych
KOŚCIELSKA M Kliniczne kryteria oceny emocji, Pedagogika specjalna, Kościelska M
Kryteria oceny projektow w rama Nieznany
Kryteria oceny testów ortograficznych i dyktand
Kryteria oceny prac stylistycznych
Kryteria oceny wniosków 4.2 PO IG 2010, Fundusze Unijne
kryteria oceny gamy
NAJG6, KRYTERIA OCENY JAKOSCI EKSPERYMENTU
więcej podobnych podstron