1
CHEMIA NIEORGANICZNA II – LABORATORIUM
WYBRANE REAKCJE CHARAKTERYSTYCZNE KATIONÓW GRUPY IIIa
Cu
2+
, Bi
3+
, Hg
2+
, Cd
2+
I. MIEDŹ, Cu
Miedź w suchym powietrzu nie zmienia się, w obecności wilgoci i CO
2
pokrywa się warstwą
zasadowych węglanów o zabarwieniu zielonym (patyna). W szeregu napięciowym metali znajduje się
na prawo od wodoru. Miedź nie roztwarza się w HCl i w rozcieńczonym H
2
SO
4
oraz nie wypiera
wodoru z kwasów. Najlepiej roztwarza się w rozcieńczonym HNO
3
na gorąco:
3Cu + 8HNO
3
= 3Cu(NO
3
)
2
+ 2NO + 4H
2
O
Stężony H
2
SO
4
, po ogrzaniu roztwarza miedź z wydzieleniem SO
2
:
Cu + 2H
2
SO
4
= CuSO
4
+ SO
2
+ 2H
2
O
REAKCJE CHARAKTERYSTYCZNE KATIONU Cu
2+
1. Reakcja kationu Cu
2+
z AKT
Cu
2+
+ S
2-
= CuS
Osad CuS nie roztwarza się w HCl, lecz roztwarza się w rozcieńczonym HNO
3
na gorąco:
3CuS + 2NO
3
+ 8H
+
= 3Cu + 3S + 2NO + 4H
2
O
2. Reakcja kationu Cu
2+
z nadmiarem amoniaku
2Cu
2+
+ 2SO
4
2-
+ 2(NH
3
⋅
H
2
O) = [Cu
2
(OH)
2
]SO
4
+ 2NH
4
+
+ SO
4
2-
[Cu
2
(OH)
2
]SO
4
+ 8(NH
3
⋅
H
2
O) = 2[Cu(NH
3
)
4
]
2+
+ SO
4
2-
+ 2OH
-
+ 8H
2
O
3. Reakcja kationu Cu
2+
z (NH
4
)
2
Hg(SCN)
4
Cu
2+
+ [Hg(SCN)
4
]
2-
= Cu[Hg(SCN)
4
]
4. Reakcja kationu Cu
2+
z K
4
[Fe(CN)
6
]
2Cu
2+
+ [Fe(CN)
6
]
4-
= Cu
2
[Fe(CN)
6
]
W roztworach rozcieńczonych miedzi roztwór zabarwia się na czerwono, a przy większych stężeniach
miedzi wytrąca się czerwono-brunatny osad. Reakcja ta jest bardziej czuła niż reakcja jonów Cu
2+
z
amoniakiem.
2
II. KADM, Cd
Kadm należy do metali nieszlachetnych i z rozcieńczonych kwasów HCl oraz H
2
SO
4
wypiera wodór:
Cd + 2H
+
= Cd
2+
+ H
2
.
Kadm najlepiej roztwarza się w rozcieńczonym HNO
3
na gorąco:
3Cd + 8HNO
3
= 3Cd(NO
3
)
2
+ 2NO + 4H
2
O.
REAKCJE CHARAKTERYSTYCZNE KATIONU Cd
2+
1. Reakcja kationu Cd
2+
z AKT
Cd
2+
+ S
2-
= CdS
1.1 Roztwarzanie wytrąconego osadu w stężonym HCl (co najmniej 6M)
CdS + 4Cl
-
= [CdCl
4
]
2-
+ S
2-
2.
Reakcja kationu Cd
2+
z NaOH
Cd
2+
+ 2OH
-
= Cd(OH)
2
Osad ten nie roztwarza się w nadmiarze NaOH.
2.1.Roztwarzanie wytrąconego osadu w amoniaku
Cd(OH)
2
+ 4(NH
3
⋅
H
2
O) = [Cd(NH
3
)
4
]
2+
+ 2OH
-
+ 4H
2
O
3.
Reakcja kationu Cd
2+
z K
4
[Fe(CN)
6
]
2Cd
2+
+ [Fe(CN)
6
]
4-
= Cd
2
[Fe(CN)
6
]
4.
Reakcja kationu Cd
2+
z K
3
[Fe(CN)
6
]
3Cd
2+
+ 2[Fe(CN)
6
]
3-
= Cd
3
[Fe(CN)
6
]
2
5.
Reakcja kationu Cd
2+
z nadmiarem amoniaku
Cd
2+
+ 2(NH
3
⋅
H
2
O) = Cd(OH)
2
+ 2NH
4
+
Cd(OH)
2
+ 4(NH
3
⋅
H
2
O) = [Cd(NH
3
)
4
]
2+
+ 2OH
-
+ 4H
2
O

3
REAKCJE CHARAKTERYSTYCZNE KATIONU Hg
2+
1. Reakcja kationu Hg
2+
z AKT
Podczas wytrącania siarczku rtęci(II) za pomocą AKT na gorąco, wytrącić się może najpierw biały,
przechodzący w żółty i ceglasty, a wreszcie czarny osad HgS. Te barwne osady to sole podwójne
rtęci(II), HgCl
2
oraz HgS połączone w różnych stosunkach.
Hg
2+
+ S
2-
= HgS
HgS należy do najtrudniej rozpuszczalnych osadów jakie znamy i roztwarza się w wodzie
królewskiej:
3HgS + 12Cl
-
+ 2NO
3
-
+ 8H
+
= 3HgCl
4
2-
+ 2NO + 4H
2
O + 3S
2. Reakcja kationu Hg
2+
z nadmiarem KI
Hg
2+
+ 2I
-
= HgI
2
HgI
2
+ 2I
-
= [HgI
4
]
2-
3.
Redukcja związków rtęci(II) za pomocą SnCl
2
2Hg
2+
+ Sn
2+
+ 8Cl
-
= Hg
2
Cl
2
+ SnCl
6
2-
Hg
2
Cl
2
+ Sn
2+
+ 4Cl
-
= 2Hg + SnCl
6
2-
4. Redukcja związków Hg(II) na płytce miedzianej
Cu + Hg
2+
= Cu
2+
+ Hg
Wykonanie: płytkę miedzianą (może być moneta 1,2,5 –groszowa) starannie przemytą roztworem
amoniaku, a następnie wodą destylowaną umieszczamy na czas 1 minuty w roztworze soli rtęci(II).
Wyjmujemy ją, przemywamy wodą destylowaną i za pomocą szczypiec ogrzewamy ostrożnie nad
palnikiem gazowym. Pod wpływem ogrzewania metaliczna rtęć ulatnia się ( w odróżnieniu od
srebra).
5.
Reakcja kationu Hg
2+
z nadmiarem KSCN
Hg
2+
+ 2SCN
-
= Hg(SCN)
2
Hg(SCN)
2
+ 2SCN
-
= [Hg(SCN)
4
]
2-
6. Reakcja kationu Hg
2+
z amoniakiem
Amoniak z roztworem HgCl
2
wytrąca biały osad:
Hg
2+
+ 2Cl
-
+ 2(NH
3
⋅
H
2
O) = HgNH
2
Cl + NH
4
+
+ Cl
-
+ 2H
2
O
Przy działaniu amoniaku na roztwór Hg(NO
3
)
2
powstaje biały osad azotanu(V)
µ
- amido-
µ
-
oksodirtęci(II):
2Hg
2+
+ NO
3
-
+ 4(NH
3
⋅
H
2
O) = [Hg(NH
2
)(O)Hg]NO
3
+ 3NH
4
+
+ 3H
2
O
4
IV. BIZMUT, Bi
Bizmut nie wypiera wodoru z roztworów kwasów mineralnych (leży na prawo od wodoru w szeregu
napięciowym metali). Dobrze roztwarza się w kwasie azotowym(V) na gorąco:
Bi + 4HNO
3
= Bi(NO)
3
+ NO + 2H
2
O
oraz w stężonym H
2
SO
4
:
2Bi + 6H
2
SO
4
= Bi
2
(SO
4
)
3
+ 3SO
2
+ 6H
2
O
REAKCJE CHARAKTERYSTYCZNE KATIONU Bi
3+
1.
Hydroliza kationu Bi
3+
Bi
3+
+ H
2
O + Cl
-
= BiOCl + 2H
+
Powstający osad nie rozpuszcza się w roztworze NaOH o stężeniu 2M, czym różni się od podobnych
hydrolizujących soli antymonu i cyny.
2.
Reakcja kationu Bi
3+
z AKT
2Bi
3+
+ 3S
2-
= Bi
2
S
3
Bi
2
S
3
roztwarza się na gorąco w rozcieńczonym HNO
3
i stężonym HCl:
Bi
2
S
3
+ 2NO
3
-
+ 8H
+
= 2Bi
3+
+ 2NO + 4H
2
O + 3S
3.
Redukcja związków bizmutu(III) za pomocą cyninu sodowego
2Bi
3+
+ 3[Sn(OH)
3
]
-
+ 9OH
-
= 2Bi
+ 3[Sn(OH)
6
]
2-
Wykonanie: do probówki wlać ok. 1 cm
3
roztworu SnCl
2
i dodawać ostrożnie roztwór NaOH aż
rozpuści się wytrącony biały osad. Ok. 1 cm
3
tak przygotowanego roztworu cyninu sodowego dodać
do 0,5 cm
3
roztworu związku bizmutu(III).
4.
Reakcja kationu Bi
3+
z nadmiarem KI
Bi
3+
+ 3I
-
= BiI
3
BiI
3
+ I
-
= [BiI
4
]
-
5.
Reakcja kationu Bi
3+
z NaOH
Bi
3+
+ 3OH
-
= Bi(OH)
3
Wodorotlenek bizmutu(III), w odróżnieniu od wodorotlenków cyny(II) i antymonu(III), nie roztwarza
się w nadmiarze NaOH i KOH.

5
WSKAZÓWKI DOTYCZĄCE WYKONYWANIA REAKCJI CHARAKTERYSTYCZNYCH
1. Wszystkie reakcje charakterystyczne, chyba że podano inaczej, należy wykonywać w następujący
sposób: pobieramy ok. 5 kropli roztworu wodnego danego kationu, dodajemy ok. 0,5 cm
3
wody
destylowanej a następnie ok. 0,5 cm
3
roztworu odczynnika chemicznego, z którym wykonujemy
reakcję.
2. Jeżeli badamy roztwarzanie wytrąconego osadu to postępujemy następująco:
wytrącony osad przemywamy dwukrotnie 1 cm
3
wody destylowanej. Za każdym razem zostawiamy
zawartość probówki na kilka minut w statywie aby osad opadł na dno probówki. Następnie zlać
ostrożnie roztwór nad osadem do drugiej czystej probówki. Dopiero do tak przemytego osadu
dodajemy odczynnika za pomocą którego roztwarzamy osad.

6
CHEMIA NIEORGANICZNA II – LABORATORIUM
WYBRANE REAKCJE CHARAKTERYSTYCZNE KATIONÓW GRUPY IIIb
As
3+
, As
5+
, Sb
3+
, Sb
5+
I. ARSEN, As
Arsen nie roztwarza się w rozcieńczonym HCl I H
2
SO
4
, natomiast roztwarza się w stężonym HNO
3
(leży na prawo od wodoru w szeregu napięciowym metali):
3As
4
+ 20HNO
3
+ 8H
2
O = 12H
3
AsO
4
+ 20NO
Sole kwasu arsenowego(V) są słabo rozpuszczalne z wyjątkiem soli metali alkalicznych. Ze względu
na to, że właściwości kwasowe arsenu są o wiele silniejsze od zasadowych, kationy As
3+
i As
5+
występują w bardzo niewielu związkach ( AsCl
3
, As
2
S
3
, AsCl
5
, As
2
S
5
), toteż reakcje na kationy As
3+
oraz As
5+
należy przeprowadzać w środowisku kwaśnym:
AsO
3
3-
+ 6H
+
= As
3+
+ 3H
2
O
REAKCJE CHARAKTERYSTYCZNE KATIONU As
5+
1.
Reakcja kationów As
5+
z AKT
2As
5+
+ 5H
2
S = As
2
S
5
+ 10H
+
AsO
4
3-
+ S
2-
+ 8H
+
= As
3+
+ S + 4H
2
O
1.1. Roztwarzanie wytrąconego osadu w KOH
As
2
S
5
+ 6OH
-
= AsO
3
S
3-
+ AsS
4
3-
+ 3H
2
O
1.2. Roztwarzanie wytrąconego osadu w (NH
4
)
2
CO
3
As
2
S
5
+ 3CO
3
2-
= AsO
3
S
3-
+ AsS
4
3-
+ 3CO
2
1.3. Roztwarzanie wytrąconego osadu w kwasie azotowym(V)
3As
2
S
5
+ 40NO
3
-
+ 4H
2
O = 6AsO
4
3-
+ 15SO
4
2-
+ 8H
+
+ 40NO
2.
Reakcja kationu As
5+
z (NH
4
)
2
MoO
4
Wytrąca się żółty osad tetrakis-trimolibdeniano(VI)arsenianu(V) amonu:
AsO
4
3-
+ 3NH
4
+
+ 12MoO
4
2-
+ 24H
+
= (NH
4
)
3
[As(Mo
3
O
10
)
4
] + 12H
2
O
Wykonanie: Do probówki szklanej wprowadzić ok. 0,5 cm
3
roztworu molibdenianu amonowego i
dodawać ostrożnie, kroplami stężony kwas azotowy(V) aż roztworzy się, wytrącony biały osad. Do
tak sporządzonego roztworu dodać 2 lub 3 krople roztworu związków arsenu(V) i następnie
7
ogrzewać zawartość probówki w łaźni wodnej. W temperaturze wrzenia wytrąca się żółty,
krystaliczny osad tetrakis-trimolibdeniano(VI)arsenianu(V) amonu.
3.
Reakcja kationu As
5+
z mieszaniną magnezową
AsO
4
3-
+ Mg
2+
+ NH
4
+
= MgNH
4
AsO
4
4.
Reakcja kationu As
5+
z AgNO
3
AsO
4
3-
+ 3Ag
+
= Ag
3
AsO
4
II. ANTYMON, Sb
Antymon nie wypiera wodoru z roztworów kwasów a najlepiej roztwarza się w stężonym H
2
SO
4
na
gorąco:
2Sb + 6H
2
SO
4
= Sb
2
(SO
4
)
3
+ 3SO
2
+ 6H
2
O
REAKCJE CHARAKTERYSTYCZNE KATIONU Sb
3+
1.
Reakcje charakterystyczne kationów Sb
3+
z AKT
2Sb
3+
+ 3H
2
S = Sb
2
S
3
+ 6H
+
1.1. Roztwarzanie wytrąconego osadu w stężonym HCl
Sb
2
S
3
+ 6H
+
= 3H
2
S + 2Sb
3+
1.2. Roztwarzanie wytrąconego osadu w KOH (nie NaOH!)
Sb
2
S
3
+ 2OH
-
= SbS
2
-
+ SbOS
-
+ H
2
O
Po zakwaszeniu roztworu zawierającego tiosole kwasem, wytrącają się ponownie siarczki antymonu.
2.
Hydroliza kationów Sb
5+
, Sb
3+
Sb
3+
+ Cl
-
+ H
2
O = SbOCl + 2H
+
3.
Redukcja kationu Sb
3+
metalicznym żelazem
2Sb
3+
+ 3Fe = 3Fe
2+
+ 2Sb
4.
Reakcja kationu Sb
3+
z KOH
Sb
3+
+ 3OH
-
= Sb(OH)
3
Sb(OH)
3
+ OH
-
= Sb(OH)
4
-

8
WSKAZÓWKI DOTYCZĄCE WYKONYWANIA REAKCJI CHARAKTERYSTYCZNYCH
1. Wszystkie reakcje charakterystyczne, chyba że podano inaczej, należy wykonywać w następujący
sposób: pobieramy ok. 5 kropli roztworu wodnego danego kationu, dodajemy ok. 0,5 cm
3
wody
destylowanej a następnie ok. 0,5 cm
3
roztworu odczynnika chemicznego, z którym wykonujemy
reakcję.
2. Jeżeli badamy roztwarzanie wytrąconego osadu to postępujemy następująco:
wytrącony osad przemywamy dwukrotnie 1 cm
3
wody destylowanej. Za każdym razem zostawiamy
zawartość probówki na kilka minut w statywie aby osad opadł na dno probówki. Następnie zlać
ostrożnie roztwór nad osadem do drugiej czystej probówki. Dopiero do tak przemytego osadu
dodajemy odczynnika, za pomocą którego roztwarzamy osad.
9
Hg
2+
, Cu
2+
, Cd
2+
, Bi
3+
, As
5+
, Sb
3+
+
AKT, ogrzewanie
Osad I
HgS, CuS, CdS, Bi
2
S
3
, As
2
S
5
, Sb
2
S
3
Roztwór C
Kationy grupy IV
Osad I
HgS, CuS, CdS, Bi
2
S
3
, As
2
S
5
, Sb
2
S
3
+
1M KOH, 3% H
2
O
2
, ogrzewanie
Osad II
HgS, CuS, CdS, Bi
2
S
3
Roztwór D
As
5+
, Sb
3+
Osad II
HgS, CuS, CdS, Bi
2
S
3
+
6M HNO
3
,
ogrzewanie
Osad III
HgS
Roztwór 3
Cu
2+
, Cd
2+
, Bi
3+
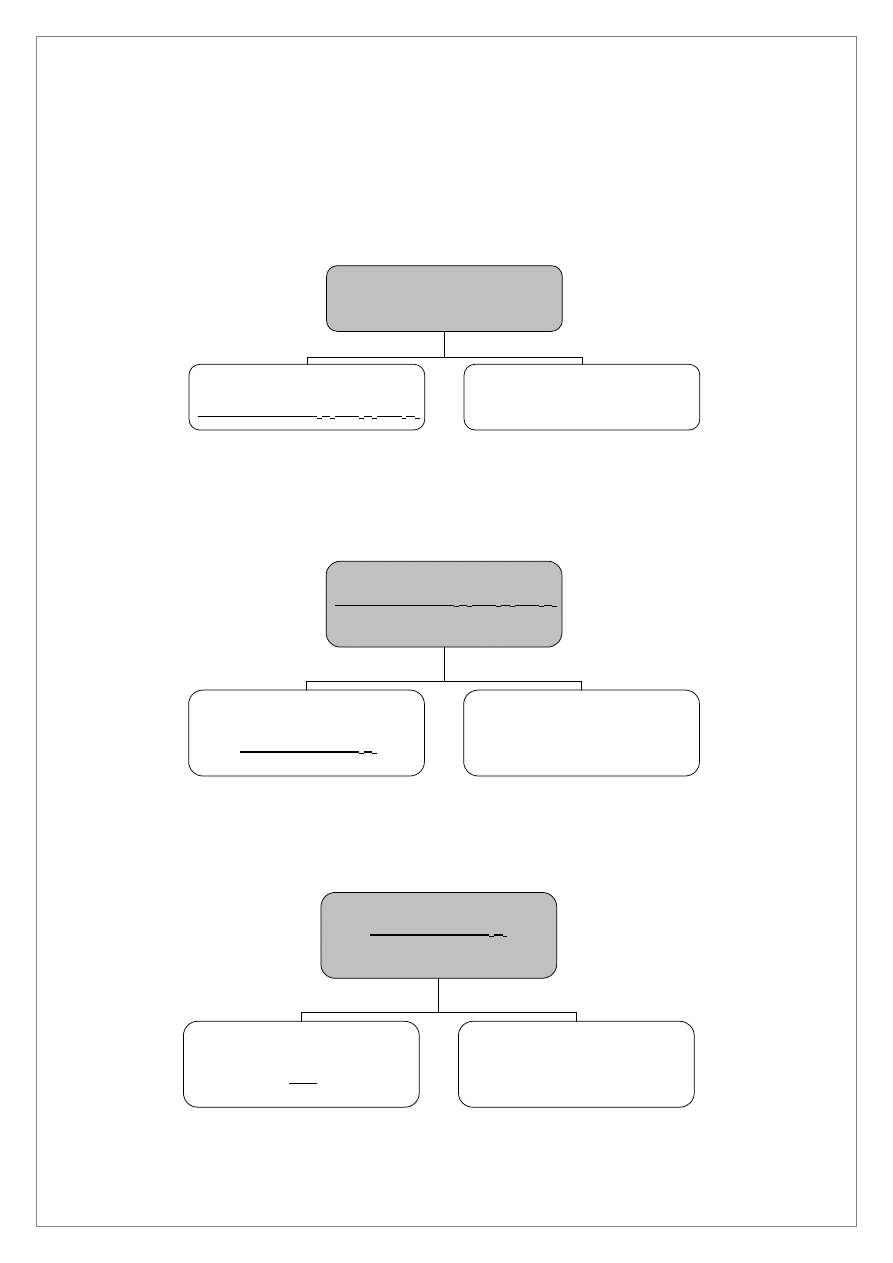
ANALIZA SYSTEMATYCZNA KATIONÓW III GRUPY
Hg
2+
, Cu
2+
, Cd
2+
, Bi
3+
, As
5+
, Sb
3+
Do kwaśnego roztworu po oddzieleniu kationów II grupy ( roztwór B) dodajemy około 2 cm
3
AKT i
ogrzewamy na łaźni wodnej przez co najmniej 15 minut. Wytrącony osad odwirowujemy a w roztworze
wykonujemy próbę na całkowite wytrącenie siarczków III grupy dodając nową porcję AKT i ogrzewając na
łaźni wodnej.
Osad I siarczków kationów III grupy przemywamy gorącym roztworem AKT i odwirujemy.
Do tak przemytego osadu dodajemy 1-2 cm
3
1,0 M KOH (nie NaOH!) i 1-2 cm
3
3% H
2
O
2
i ogrzewamy w
łaźni wodnej. W osadzie II pozostają HgS, CuS, CdS oraz Bi
2
S
3
. Do roztworu 2 przechodzą kationy grupy
IIIb, który będzie analizowany zgodnie z analizą systematyczną kationów grupy IIIb.
Osad II przemywamy dwa razy około 5 cm
3
wody destylowanej i odwirowujemy.
Do probówki szklanej zawierającej przemyty osad II dodajemy ok. 5 cm
3
6,0 M HNO
3
i ogrzewamy na łaźni
wodnej ok. 5 minut i odwirowujemy. W osadzie zostaje HgS a w roztworze znajdują się jony Cu
2+
, Cd
2+
,
Bi
3+
.
10
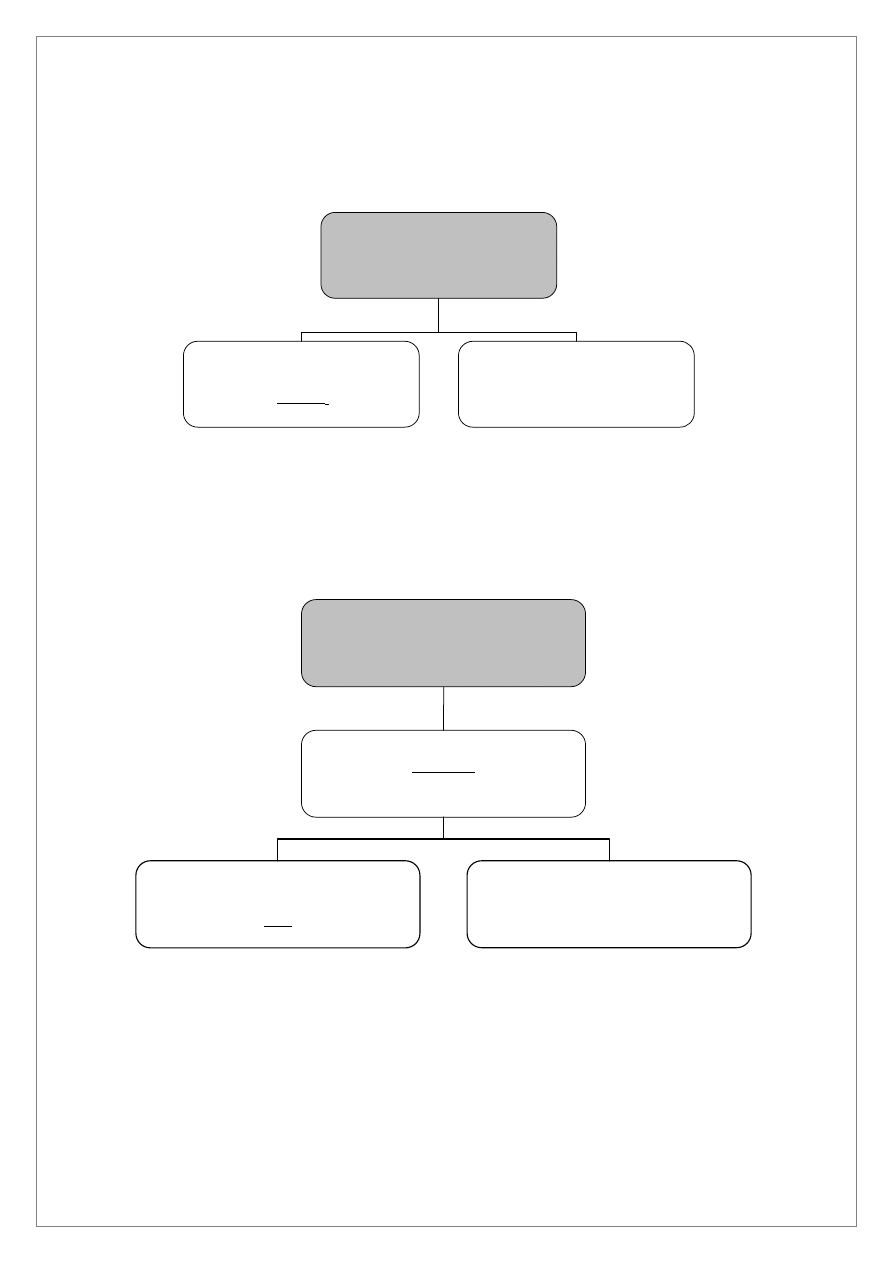
Roztwór 3
Cu
2+
, Cd
2+
, Bi
3+
+
nadmiar stężonego NH
3
·H
2
O
Osad IV
Bi(OH)
3
Roztwór 4
Cu(NH
3
)
4
2+
, Cd(NH
3
)
4
2+
Roztwór 4
Cu(NH
3
)
4
2+
, Cd(NH
3
)
4
2+
+
AKT, ogrzewanie
Osad
CuS, CdS
+
6M HCl
Osad V
CuS
Roztwór 5
[CdCl
4
]
2-
Osad III (HgS) przemyć wodą destylowaną, dodać 3 cm
3
wody królewskiej i ogrzewać na łaźni wodnej (w
szklanej probówce). Roztwór po roztworzeniu HgS odparować w parowniczce porcelanowej prawie do sucha
i dodawać kroplami roztwór SnCl
2
. Pojawienie się białego, szarzejącego osadu świadczy o obecności kationu
Hg
2+
.
Do roztworu 3 dodać w nadmiarze stężonego amoniaku i odwirować. Do roztworu, w obecności nadmiaru
amoniaku przechodzą jony Cu
2+
oraz Cd
2+
a w osadzie pozostaje Bi(OH)
3
.
Osad IV zawierający Bi(OH)
3
przemyć wodą destylowaną i dodać, uprzednio przygotowany roztwór cyninu
sodowego Sn(OH)
3
-
. Czerniejący osad świadczy o obecności jonów Bi
3+
.
Jeśli roztwór 4 jest niebieski to zawiera jony Cu(NH
3
)
4
2+
i ewentualnie Cd(NH
3
)
4
2+
.
Do tego roztworu w probówce szklanej dodajemy AKT i ogrzewamy na łaźni wodnej. Wytrącony osad
przemywamy wodą destylowaną i roztwarzamy w 6M HCl. W osadzie pozostaje CuS a w roztworze jony
Cd
2+
(roztwór 5).
Do roztworu 5 dodajemy amoniaku do odczynu lekko zasadowego, dodajemy AKT i ogrzewamy w łaźni
wodnej. Wytrącenie się żółtego osadu CdS świadczy o obecności kationu Cd
2+
.
11
As
5+
, Sb
3+
+
rozcieńczony HCl, AKT, ogrzewanie
Osad I
As
2
S
5
, Sb
2
S
3
Osad I
As
2
S
5
, Sb
2
S
3
+
2,0 cm
3
stężonego HCl, ogrzewanie
Osad II
As
2
S
5
Roztwór 2
Sb
3+
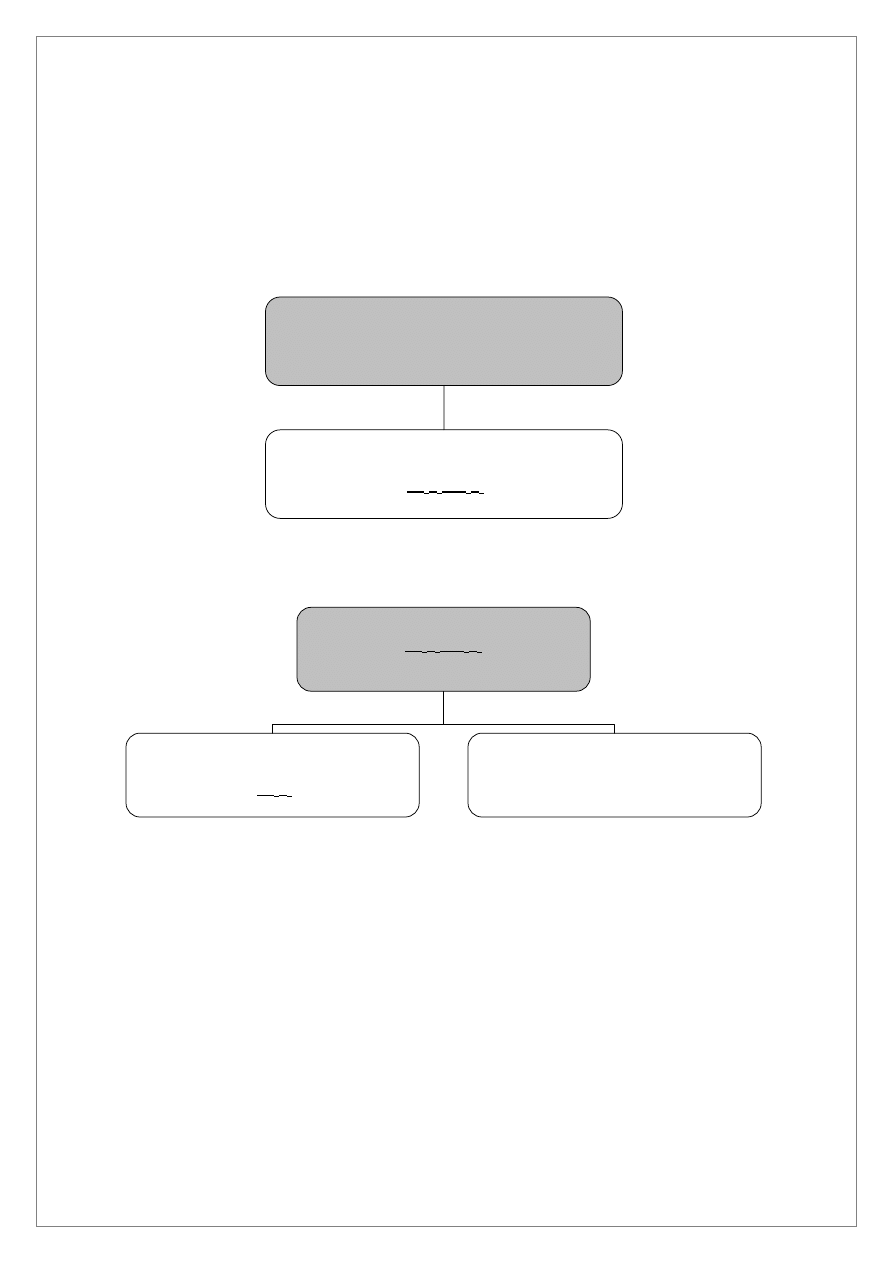
ANALIZA SYSTEMATYCZNA KATIONÓW GRUPY IIIb
As
5+
, Sb
3+
Roztwór D zakwaszamy rozcieńczonym HCl w obecności papierka uniwersalnego, dodajemy AKT
i ogrzewamy w łaźni wodnej. Po schłodzeniu oddzielić roztwór przez dekantację. W roztworze
wykonać próbę na całkowite wytrącenie siarczków (przez dodanie nowej porcji AKT i ogrzewanie).
Po wykonaniu próby na całkowite strącenie, osad I siarczków przemyć wodą destylowaną
i odwirować. W osadzie I znajdują się siarczki As
2
S
5
, Sb
2
S
3
.
Do tak przemytego osadu I w probówce szklanej dodać 2 cm
3
stężonego HCl i ogrzewać w łaźni
wodnej. W osadzie II pozostaje As
2
S
5
a w roztworze 2 znajdują się jony Sb
3+
.
Osad II, As
2
S
5
, przemywamy wodą destylowaną i roztwarzamy na gorąco w stężonym HNO
3
.
Z częścią tak otrzymanego roztworu, zawierającego jony As
5+
, wykonujemy reakcję
charakterystyczną z molibdenianem amonowym. Wytrącający się po ogrzaniu żółty osad świadczy o
obecności jonów As
5+
.
Roztwór 2 ogrzewamy w łaźni wodnej w celu usunięcia H
2
S i po częściowym zobojętnieniu
nadmiaru HCl za pomocą KOH wykonujemy reakcje charakterystyczne dla kationu Sb
3+
(reakcje
hydrolizy, wytrącanie pomarańczowego osadu Sb
2
S
3
, reakcję z nadmiarem KOH).
Wyszukiwarka
Podobne podstrony:
Kationy grupa III
analiza kationów i anionów III, IV i V grupa
odpowiedzi otwp 2010 GRUPA III
ZADANIE A7(5), Radzion Dorota , technologia chemiczna , rok III , grupa III
Miernictwo- Pomiar rezystancji za pomocą mostków technicznych, Rok II AiR grupa III
Kationy grupa II pytania
kationy grupa IV
grupa w szkole projekt, Psychologa społeczna, grupa III
ZADANIE A7(3), Radzion Dorota , technologia chemiczna , rok III , grupa III
ZADANIE A7(3), Radzion Dorota , technologia chemiczna , rok III , grupa III
Kationy grupa II
elektronika, grupa III
Miernictwo- Zastosowanie interfejsu pomiarowego IEC-625, Rok II AiR grupa III_
ZADANIE A7(10), Radzion Dorota , technologia chemiczna , rok III , grupa III
ZADANIE A7(7), Radzion Dorota , technologia chemiczna , rok III , grupa III
Test 2003 Grupa III odp
więcej podobnych podstron