
L
ABORATORIUM Z
C
HEMII
A
NALITYCZNEJ
A
NALIZA ILOŚCIOWA
Studia zaoczne

HARMONOGRAM ZAJĘĆ
Wymiar: 16 godz. 4 pracownie po 4 godz.
I. Kolokwium I (Wagi. Rodzaje wody w związkach nieorganicznych i metody jej
oznaczania.). Odebranie szafek laboratoryjnych ze sprzętem.
Ważenie. Przygotowanie roztworów. Oznaczanie wody
krystalizacyjnej w chlorku magnezu. Przygotowanie roztworu
kwasu solnego.
II. Kolokwium II (Alkacymetria) Oznaczanie wodorotlenku sodowego.
III. Kolokwium III (Argentometria). Oznaczanie chlorków.
IV. Termin rezerwowy. Zdanie szafek laboratoryjnych ze sprzętem. Wpisy zaliczeń do
kart i indeksów.

ZAKRES MATERIAŁU DO KOLOKWIÓW
KOLOKWIUM I
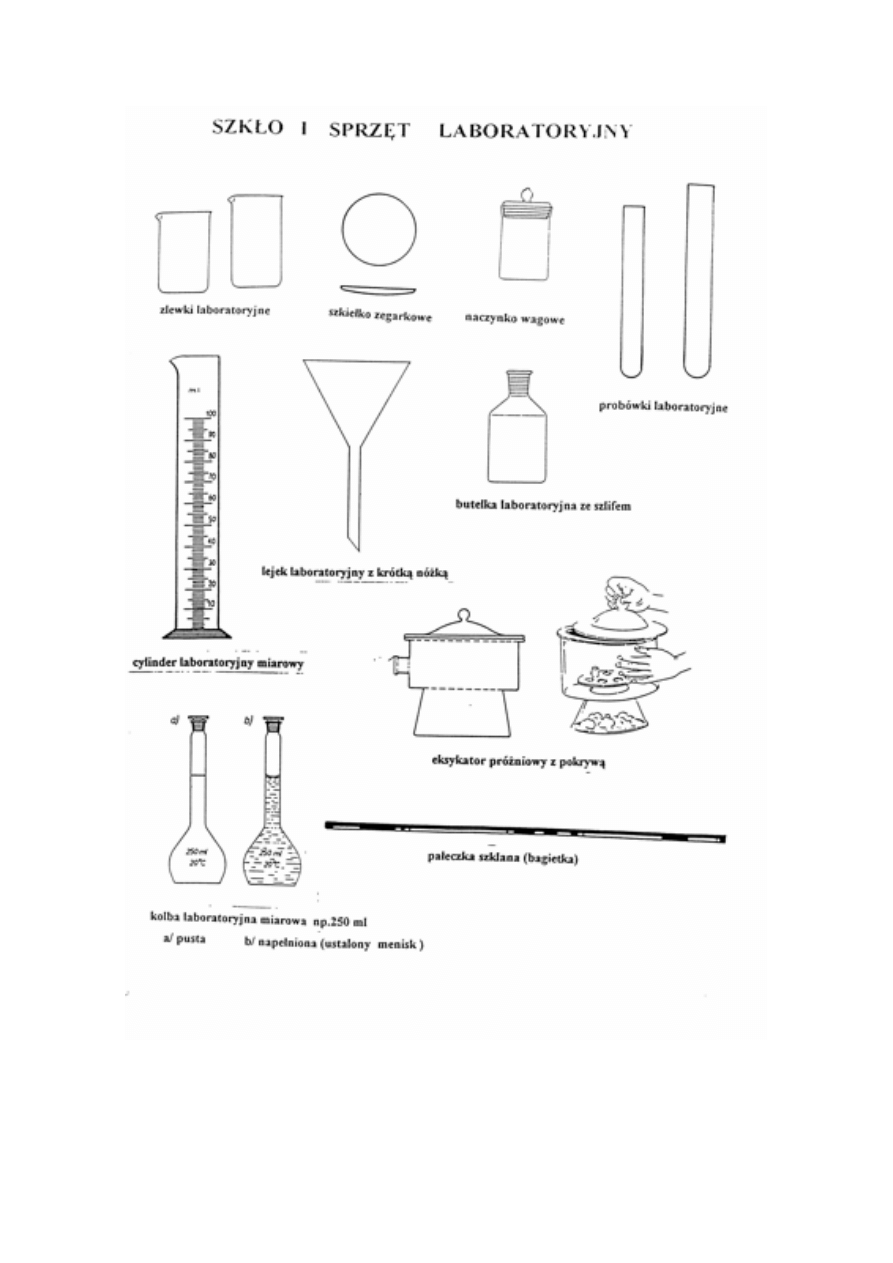
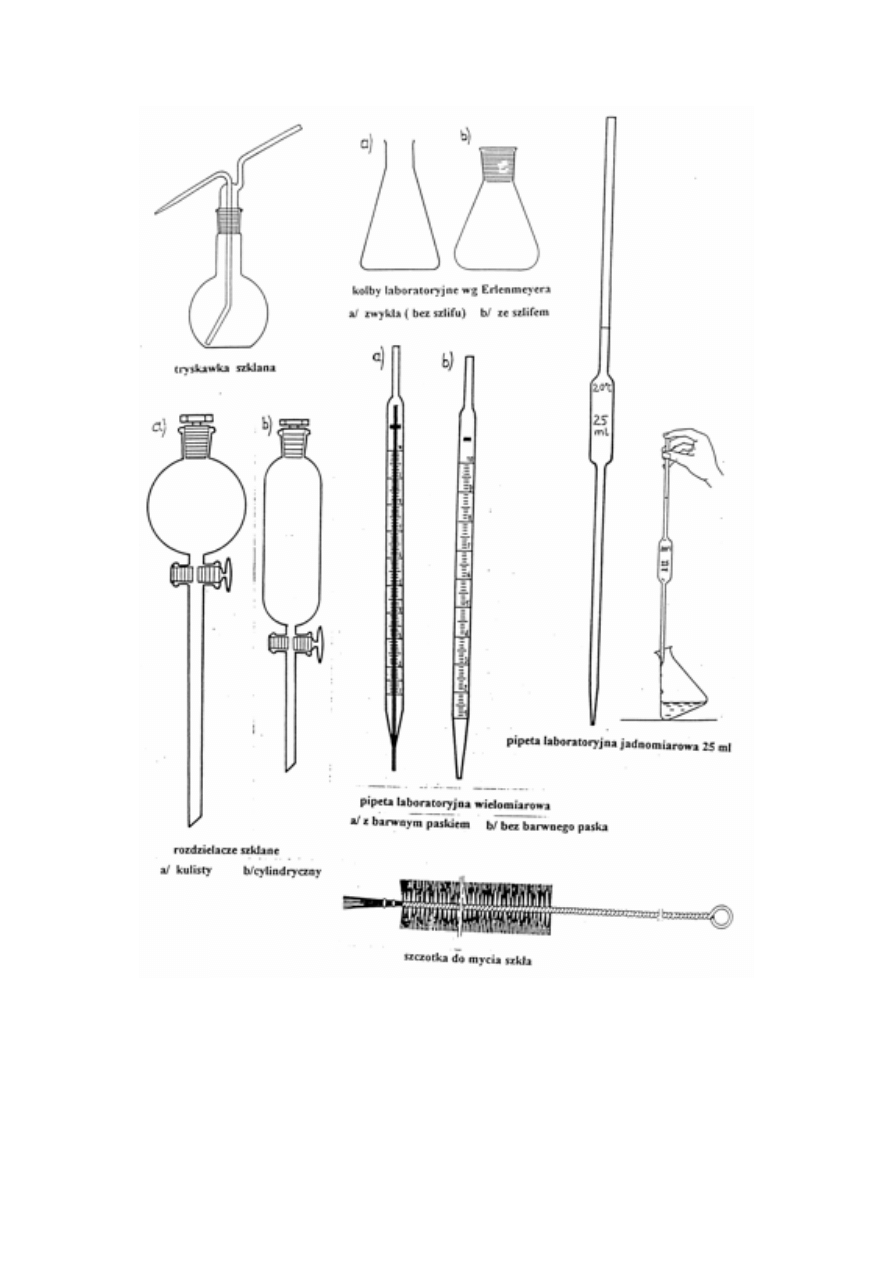
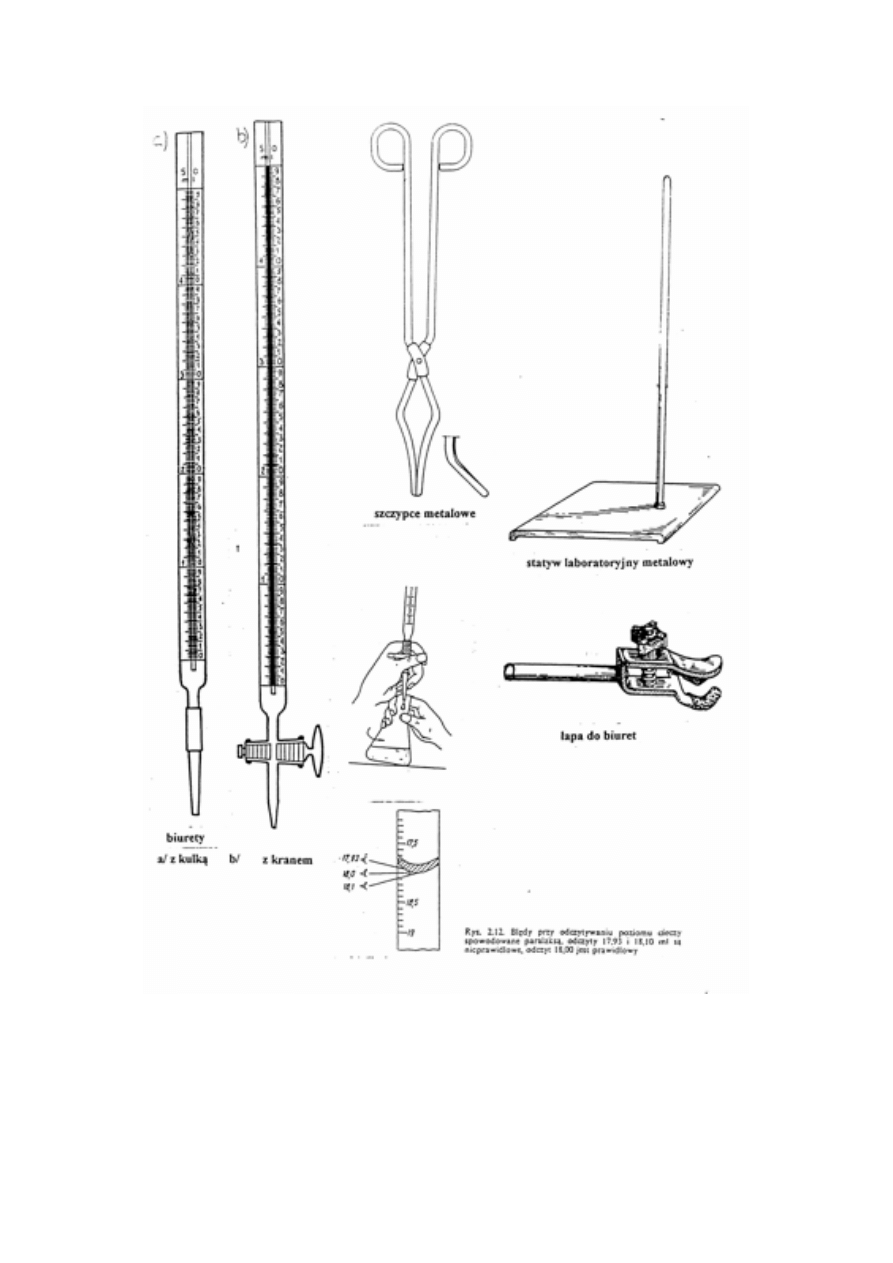
NACZYNIA LABORATORYJNE I WAGI
Rodzaje naczyń laboratoryjnych, nazwy i ich przeznaczenie. Mycie naczyń, roztwory myjące.
Charakterystyka i podział wag. Nośność i czułość wag. Sposoby ważenia na wagach analitycznych i
elektronicznych.
WODA W ZWIĄZKACH NIEORGANICZNYCH
Rodzaje wody w związkach nieorganicznych i metody jej oznaczania.
Oznaczanie wody w chlorku magnezu.
Zadania.
KOLOKWIUM II
ALKACYMETRIA
Analiza miareczkowa
Podział metod miareczkowych wg rodzaju titrantu, sposobu prowadzenia miareczkowania. Błędy w
analizie miareczkowej. Obliczenia w analizie miareczkowej - obliczenia na podstawie stechiometrii
reakcji i stężenia molowego.
Alkacymetria
Reakcje kwas - zasada, reakcje dysocjacji, zobojętniania i hydrolizy. Teoria Arrheniusa, stała
dysocjacji, stopień dysocjacji, stała i stopień hydrolizy, prawo rozcieńczeń Ostwalda. Iloczyn jonowy
wody, definicja pH. Wskaźniki kwasowo - zasadowe wg teorii Ostwalda. Krzywe miareczkowania:
mocnego kwasu mocną zasadą, mocnej zasady mocnym kwasem. Roztwory mianowane,
substancje wzorcowe do mianowania kwasów i zasad.
Oznaczanie wodorotlenku sodowego. Wyprowadzenie wzoru na miano kwasu solnego ustawiane na
węglan sodowy oraz na masę NaOH w próbie.
Zadania.
KOLOKWIUM III
ARGENTOMETRIA
Miareczkowe metody wytrąceniowe. Iloczyn rozpuszczalności. Sposoby miareczkowania roztworami
azotanu srebra. Mianowany roztwór azotanu srebra. Metody oznaczania chlorków wg Mohra i
Volharda.
Oznaczanie chlorków metodą Mohra.
Zadania.
LITERATURA
1.
A. Cygański: Chemiczne metody analizy ilościowej. WNT 1994.
2.
A. Cygański, R. Sołoniewicz: Laboratorium analizy ilościowej. Zeszyt II. Łódź 1986.
3.
J. Minczewski, Z. Marczenko: Chemia analityczna. 2. Chemiczne metody analizy ilościowej. WNT
1997.
4.
R. Kocjan (redakcja): Chemia analityczna Tom 1. Analiza jakosciowa. Analiza ilościowa klasyczna.,
Wydawnictwo Lekarskie PZWL 2002.
5.
M. Wesołowski, K. Szefer, D. Zimna: Zbiór zadań z analizy chemicznej. WNT 2002

Ć
WICZENIE NR
1
Oznaczanie wody krystalizacyjnej w chlorku magnezu, MgCl
2
•6 H
2
O
Podczas suszenia krystalicznego chlorku magnezu w suszarce o temperaturze 120°C zachodzi
reakcja:
MgCl
2
•6 H
2
O → MgCl
2
+ 6 H
2
O
Różnica mas soli przed i po suszeniu odpowiada zawartości wody w preparacie.
Wykonanie oznaczenia
Wysuszyć naczynko wagowe wraz z pokrywką do stałej masy w suszarce o temperaturze
120°C (po wyjęciu z suszarki naczynko ostudzić w eksykatorze do temperatury pokojowej -
ok. 20 min). Odważyć do naczynka na wadze analitycznej około 2 g wodzianu chlorku
magnezu i wstawić otwarte naczynko z odważką do do suszarki o temperaturze 120°C na czas
około 2 godzin. Przenieść naczynko z solą do eksykatora, ostudzić do temperatury otoczenia,
zamknąć naczynko pokrywką i zważyć na wadze analitycznej.
Sprawdzić, czy w wyniku suszenia sól uzyskała już stałą masę. W tym celu umieścić w
suszarce naczynko na dalsze pół godziny, ostudzić i zważyć. Jeżeli różnica ważeń nie jest
większa niż 0, 0004 g, można uznać, że suszenie zostało doprowadzone do stałej masy soli.
Procentową zawartość wody w krystalicznym chlorku magnezu obliczamy ze wzoru:
a
100
m)
-
(a
O
H
%
2
⋅
=
Gdzie: a – odważka wodzianu chlorku magnezowego, g
m – masa preparatu po wysuszeniu do stałej masy, g
Obliczyć teoretyczną zawartość wody w wodzianie chlorku magnezu na podstawie jego
wzoru i porównać z wynikiem uzyskanym w ćwiczeniu. Wytłumaczyć ewentualne różnice.

Ć
WICZENIE NR
2
Oznaczanie wodorotlenku sodowego NaOH
1. Przygotowanie mianowanego roztworu kwasu solnego
Kwas solny o stężeniu 0.1mol/dm
3
sporządza się przez rozcieńczenie stężonego roztworu HCl
ok. 35% masowych o gęstości 1.18 g/cm
3
. Sposób obliczenia objętości stężonego kwasu
solnego, którą należy wziąć do przygotowania 1l roztworu o stężeniu 0,1 mol/dm
3
HCl jest
następujący: Z definicji stężenia wyrażonego w procentach masowych wynika, że 35 g HCl
znajduje się w 100 g roztworu stężonego, tj. w
3
84,7cm
1,18
100
=
.
Masa 0.1 mol roztworu HCl wynosi 0.1 M
HCl
= 0.1·36,5 = 3.65 g HCl. Ta masa znajduje się w
następującej objętości stężonego kwasu solnego:
35 g HCl - 84,7 cm
3
3.65 g HCl - V
x
V
x
=
3
8,83cm
35
84,7
3,65
=
⋅
Należy, więc cylinderkiem odmierzyć 9 cm
3
stężonego roztworu HCl i rozcieńczyć do
objętości 1 dm
3
lub odpowiednio mniejszą objętość stężonego kwasu, jeśli przygotowujemy
0.5 lub 0.3 dm
3
rozcieńczonego kwasu. Otrzymuje się w ten sposób roztwór o stężeniu
przybliżonym, którego dokładne miano ustala się przez miareczkowanie odważek sody
otrzymanej z NaHCO
3
. Podczas takiego miareczkowania wobec oranżu metylowego
przebiega reakcja:
Na
2
CO
3
+ 2HCl → 2NaCl + H
2
O + CO
2
UWAGA! Przygotować 0.5 dm
3
0.1 mol/dm
3
kwasu solnego w butelce z korkiem na szlif.

2. Nastawianie miana 0.1 mol/dm
3
HCl przy użyciu węglanu sodowowego
.
Bezwodny węglan sodowy zawiera zwykle nieco wilgoci oraz kwaśnego węglanu sodowego.
Ogrzewanie w ciągu ok. godziny w temp. 270-300
o
C pozbawia sodę wilgoci oraz domieszek
NaHCO
3
w wyniku termicznego rozkładu:
2 NaHCO
3
→ Na
2
CO
3
+ CO
2
+ H
2
O
Ogrzewanie sody przeprowadza się w tyglu porcelanowym w piecu elektrycznym
z regulowana temperaturą lub w łaźni piaskowej ogrzewanej palnikiem gazowym.
Temperaturę sody w tyglu sprawdza się termometrem, który jednocześnie służy do mieszania,
co pewien czas zawartości tygla. Tygiel z wysuszoną sodą umieszcza się w eksykatorze, a po
ostudzeniu przesypuje się sodę do szczelnego naczynka wagowego, które także przechowuje
się w eksykatorze.
Odważki sody powinny być takiej wielkości, aby podczas miareczkowania zużywano
z biurety 30-40 ml 0.1 mol/dm
3
HCl. Miareczkowanie prowadzi się wobec oranżu
metylowego w sposób podany poniżej.
W naczynku wagowym odważa się dokładnie (przez odsypywanie) 0.15-0.20 g Na
2
CO
3
i przenosi ilościowo do kolbki stożkowej o pojemności 250 cm
3
. Odważony węglan
rozpuszcza się w ok. 60 cm
3
wody destylowanej, dodaje 4 krople oranżu metylowego
i roztwór miareczkuje z biurety roztworem przygotowanego kwasu solnego. Miareczkowanie
prowadzi się aż do pojawienia się barwy cebulkowej, przejściowej miedzy żółtą i czerwoną.
Wykonuje się, co najmniej 3 oznaczenia.
Pod koniec miareczkowania roztwór jest nasycony CO
2
, który obniża nieco pH roztworu
NaCl. W przypadku trudności w ustaleniu końca miareczkowania należy przygotować
roztwór porównawczy, tzw. wzorzec (świadek) miareczkowania, którym jest roztwór
o objętości i stężeniu równych objętości i stężeniu roztworu miareczkowanego w końcu
miareczkowania.

Stężenie kwasu oblicza się wg wzoru:
106
V
m
1000
1
2
c
3
2
CO
Na
HCl
⋅
⋅
⋅
=
gdzie: c
HCl
- stężenie molowe roztworu HCl;
3
2
CO
Na
m
-
odważka Na
2
CO
3
,
V - objętość roztworu HCl zużyta na miareczkowanie odważki sody o masie
3
2
CO
Na
m
.
3. Oznaczenie NaOH
Otrzymane zadanie (próbkę) rozcieńcza się wodą destylowaną do kreski w kolbie miarowej
o objętości 250 cm
3
i dokładnie miesza. Następnie odmierza się pipetą 25 cm
3
tego roztworu
do kolbki stożkowej, dodaje 2-3 krople oranżu metylowego i miareczkuje przygotowanym
roztworem kwasu solnego (ok. 0.1 mol/dm
3
) do zmiany barwy z żółtej na cebulkową.
Wynik oblicza się z wzoru:
40
1000
V
c
M
1000
V
c
m
HCl
HCl
NaOH
HCl
HCl
NaOH
⋅
=
⋅
=
gdzie: c
HCl
- stężenie molowe HCl;
V
HCl
- objętość roztworu HCl zużyta podczas miareczkowania.

Ć
WICZENIE NR
3
Oznaczanie chlorków metodą Mohra.
/. Mianowany roztwór AgNO
3
;
Argentometria to dział analizy miareczkowej wytrąceniowej, w której wykorzystuje się
oznaczanie substancji w wyniku tworzenia podczas miareczkowania trudnorozpuszczalnego
osadu. W metodzie oznaczania chlorków metodą Mohra jako roztwór miareczkujący stosuje
roztwór azotanu srebrowego AgNO
3
, który można przygotować następującymi sposobami:
przez rozpuszczenie w wodzie odważki azotanu srebra o wysokim stopniu czystości lub
przez
rozpuszczenie odważki chemicznie czystego srebra (w postaci druciku) w 10
cm
3
ok. 30%-owego HNO
3
. Po rozpuszczeniu srebra roztwór odparowuje się w celu usunięcia
tlenków azotu (odbarwienie roztworu). Miano roztworu AgNO
3
wyznacza się używając NaCl
lub KC1jako substancję wzorcową.
2. Nastawianie miana AgNO
3
na chlorek sodowy.
Miano roztworu AgNO
3
o stężeniu 0,05 mol/dm
3
ustala się na naważki wysuszonego (ok.2
godz) w temp. 110°C chlorku sodowego. Odważkę NaCl (70-80 mg dokładnie odważoną
przez odsypywanie) rozpuszcza się w ok. 60 ml wody destylowanej (nie zanieczyszczonej
chlorkami), dodaje kilka kropli roztworu K
2
CrO
4
i miareczkuje roztworem AgNO
3
aż do
powstania wyraźnego czerwonobrunatnego zabarwienia nie znikającego w ciągu 20 sekund
mieszania. Roztwór azotanu srebra rozkłada się powoli pod wpływem światła i dlatego
roztwory AgNO
3
należy przechowywać w ciemnych butelkach.
3.
Oznaczanie chlorków metodą Mohra

Metoda Mohra polega na bezpośrednim miareczkowaniu obojętnego roztworu chlorku
mianowanym roztworem AgNO
3
w obecności K
2
CrO
4
jako wskaźnika. Podczas
miareczkowania wytrąca się najpierw trudnorozpuszczalny osad AgCl
Ag
+
+ Cl
-
→ AgCl
↓
Gdy praktycznie cała ilość jonów chlorkowych zostanie wytrącona, nadmiar roztworu
jonów srebrowych Ag
+
reaguje z jonami chromianowymi CrO
4
2-
wytrącając
brunatnoczerwony
osad
chromianu
srebrowego.
Powstanie
brunatnoczerwonego
zabarwienia roztworu wskazuje na koniec miareczkowania.
2 Ag
+
+ CrO
4
2-
→ Ag
2
CrO
4
↓
Odczyn roztworu powinien być obojętny, ponieważ w roztworze kwaśnym jony wodorowe
reagują jonami CrO
4
2-
, tworząc jony wodorochromianowe HCrO
4
-
i dichromianowe Cr
2
O
7
2-
2 CrO
4
2 -
+ 2 H
+
↔ Cr
2
O
7
2 -
+ H
2
O
Powoduje to zmniejszenie stężenia jonów CrO
4
2-
, a w bardziej kwaśnych roztworach osad
może się wcale nie wytrącić.
Ag
2
CrO
4
, jako sól słabego kwasu, ulega rozpuszczeniu w kwaśnych roztworach.
W roztworach silnie zasadowych pH>10,5 następuje wytrącanie Ag
2
O
2 Ag
+
+ 2 OH
-
-→ Ag
2
O + H
2
O
Metody Mohra nie można stosować do oznaczania chlorków w obecności anionów
tworzących w roztworach obojętnych trudnorozpuszczalne sole srebrowe (Br
-
, I
-
, AsO
4
3-
,
PO
4
3-
, CO
3
2-
), kationów tworzących trudnorozpuszczalne chromiany (Ba
2+
, Pb
2+
) oraz
substancji redukujących AgNO
3
do srebra metalicznego ( np. jony Fe
2+
).
Metodą Mohra można oznaczać bromki. Nie można jednak stosować tej metody
do oznaczania jodków i tiocyjanianów, ponieważ jodek i tiocyjanian srebra silnie adsorbują
jony chromianowe, przez co punkt równoważności nie jest wyraźny.

Wykonanie oznaczenia
Po rozcieńczeniu próbki w kolbie miarowej odmierza się pipetą 25 cm
3
(lub 20 cm
3
)
roztworu i przenosi do kolby stożkowej. Roztwór rozcieńcza się do objętości ok. 60 cm
3
,
dodaje 5-6 kropli roztworu K
2
CrO
4
o stężeniu 1 mol/dm
3
i miareczkuje mianowanym
roztworem AgNO
3
aż do powstania zabarwienia beżowego, nie znikającego w ciągu 20 s
mieszania.
Obliczanie wyników
Zawartość chlorków w próbce oblicza się na podstawie wzoru:
m
Cl
-
=
c
AgNO
3
V
AgNO
3
1000
35.45
gdzie:
c
AgNO
3
- stężenie molowe roztworu AgNO
3
;
V
AgNO
3
- objętość cm
3
roztworu AgNO
3
zużyta na miareczkowanie.

KSIĄŻKI W BIBLIOTECE WYDZIAŁOWEJ
1. Francik Renata „Chemia w pigułce" - 1 egz
2. Arni Arnold „Repetytorium z chemii: chemia ogólna i nieorganiczna" - 1 egz. (1995)
3. Badzińska Jadwiga „Testy z chemii: chemia ogólna i nieorganiczna" - I egz. (1996)
4. Materiały przygotowawcze dla kandydatów na akademie medyczne -CHEMIA- testy
z rozwiązaniami. - 1 egz. (1996)
5. Cygański Andrzej, Krystek Jacek, Ptaszyński Bogdan „Obliczenia z chemicznych i
instrumentalnych metod analizy" - 5 egz. (1996)
6. Hulawicki Adam „Reakcje kwasów i zasad w chemii analitycznej" - I egz. (1992)
7. Cygański Andrzej „Metody spektroskopowe w chemii analitycznej" - 3 egz. (1993)
8. Cygański Andrzej „Chemiczne metody analizy ilościowej" - 5 egz. (1987), - 1 2 egz.
(1994)
9. Sołoniewicz Rajmund „Obliczenia z chemii ogólnej i nieorganicznej" - 1 egz. (1993)
10. Cygański A., Sołoniewicz R. „Laboratorium analizy ilościowej" zeszyt 1: 12 egz.,
zeszyt 2 : 9 egz., zeszyt 3:12 egz.
11. Minczewski Jerzy, Marczenko Zygmunt „Chemia analityczna" tom 1: 7 egz., tom 2 : 10
egz., tom 3: 11 egz.
12. Drapała T. „Chemia ogólna nieorganiczna" - 2 egz. (1986)
13. Bielański Adam „Podstawy chemii nieorganicznej" tom 1: 5egz.,tom 2: 5 egz., tom 3 : 5
egz.
14. „Poradnik chemika analityka" 1 i 2 tom po 2 egz. (1989)
15. Szczepaniak Walenty „Metody instrumentalne w analizie chemicznej" - 4 egz. (1995)
16. Witekowa S., Witek T. „Ćwiczenia z analizy jakościowej i ilościowej" cz.2 - 1 egz.
(1970)
17. Lipiec - Szmal „Chemia analityczna" - 3 egz. (1976)
18. Szyszko Edmund „Instrumentalne metody analityczne" - 3 egz. (1975)
19. Cygański Andrzej „Metody elektroanalityczne" - 3 egz. (1991)
20. Williams A.F. „Chemia nieorganiczna. Podstawy teoretyczne." - 1 egz. (1986)
21. Kryściak Jan „Chemiczna analiza instrumentalna" - 1 egz. (1989)
22. Całus Henryk „Obliczenia chemiczne" - 12 egz. (1987)
23. Korczyński A., Sołoniewicz R, „Obliczenia chemiczne" - 10 egz. (1974)
24. Śliwa Alfred (red.) „Zbiór zadań z chemii ogólnej i analitycznej nieorganicznej" - 6 egz.
(1987)
25. Witekowa S. „Ćwiczenia z chemii ogólnej" - 5 egz. (1974) wyd.3
26. Bielański Adam „Chemia ogólna i nieorganiczna" - 16 egz. (1973, 1976)
27. Pazdro Krzysztof M. „Zbiór zadań z chemii dla szkół średnich" (1992) wyd. 5
28. Wesołowski M. i inni „Zbiór zadań z analizy chemicznej" - 3 egz. (1997)

REGULAMIN
PRACOWNI CHEMII ANALITYCZNEJ (I – 3)
1. Studenci są obowiązani do punktualnego uczęszczania na pracownię. W ciągu 15 min. po rozpoczęciu
pracowni zostaje sprawdzona lista obecności.
Ostatnie 10 min. przeznaczone jest na sprzątnięcie stanowisk pracy.
2. Na salę mają wstęp tylko ci studenci, którzy odrabiają w danym terminie ćwiczenie.
3. Poszczególne grupy studenckie pozostają pod opieką osób prowadzących laboratorium, które sprawdzają
obecność, wydają zadania, sprawdzają kolokwia i udzielają wyjaśnień.
4. We wszystkich sprawach dotyczących pracy w laboratorium należy zgłaszać się do osób prowadzących.
5. Każdy student pracujący w laboratorium musi posiadać własny fartuch i ścierkę (ręcznik papierowy).
6. Student w czasie pracy zobowiązany jest do prowadzenia zeszytu laboratoryjnego,
w którym notuje wyniki poszczególnych oznaczeń (ważenia, miareczkowania, itp.) oraz obliczeń.
W tym samym zeszycie opracowuje się sprawozdania, na podstawie których odbywa się zaliczenie
poszczególnych ćwiczeń.
7. Sprawozdanie musi zawierać:
a) tytuł ćwiczenia,
b) wstęp teoretyczny odnośnie danego ćwiczenia,
c) powołanie się na znajdujący się w literaturze przepis analityczny lub dokładny opis czynności,
d) równania reakcji przebiegających w czasie analiz,
e) dane doświadczalne,
f) obliczenia i wynik oznaczenia.
8. Zeszyty ze sprawozdaniami oraz kolbki miarowe na zadania należy zostawiać we wskazanym miejscu w
laboratorium.
9. Kolbka wystawiona na zadanie powinna być czysta i podpisana numerem studenta w grupie.
10. Student otrzymuje zadanie wyłącznie po zdaniu kolokwium dotyczącego danego ćwiczenia.
Studenci w poszczególnych grupach są zobowiązani do zdawania kolokwiów w terminach podanych w
harmonogramie.
11. Studentów obowiązuje utrzymanie czystości na sali ćwiczeń. Każdy student jest odpowiedzialny za
utrzymanie czystości swojego stanowiska pracy.
12. Nie wolno wrzucać żadnych odpadków stałych do zlewów. Należy je wyrzucać do koszy znajdujących się na
sali.
13. Nie wolno pozostawiać ubrań (kurtki, marynarki) na sali ćwiczeń.
14. Teczki i torebki należy składać w wyznaczonym do tego celu miejscu. Nie wolno ich kłaść na podłodze,
stołach czy parapetach.
15. W laboratorium nie wolno spożywać posiłków ani przechowywać żywności. Na posiłek można udać się po
uprzednim ustaleniu terminu wyjścia i powrotu z osobą prowadzącą ćwiczenia.
16. Otwieranie okien na sali może nastąpić po wyrażeniu zgody przez osobę prowadzącą.
17. Reakcje w czasie których następuje wydzielanie się gazów należy wykonywać pod wyciągiem.
18. Obowiązkiem studenta jest maksymalna oszczędność wody, elektryczności i odczynników.

19. Student pracujący w pokoju wagowym musi postępować zgodnie z regulaminem i instrukcją pokoju
wagowego.
20. Każdy student jest odpowiedzialny za otrzymany sprzęt laboratoryjny.
21. Po zakończeniu ćwiczeń student jest zobowiązany schować swój sprzęt, zamknąć szafkę w której się on
znajduje, sprzątnąć stół i sprawdzić czy zamknięty jest dopływ wody.
22. Nieprzestrzeganie niniejszego regulaminu spowoduje w stosunku do winnego wyciągnięcie konsekwencji w
postaci obniżenia stopnia, a ponadto:
a) unieważnienia zadania,
b) dodania karnego zadania,
c) usunięcia z pracowni.
Wyszukiwarka
Podobne podstrony:
instrukcja - ANALIZA ILOŚCIOWA-OBJĘTOŚCIOWA (miareczkowa), Inżynieria środowiska, inż, Semestr II, C
instrukcja - ANALIZA ILOŚCIOWA-WAGOWA, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, labora
Cz 11 Instrumentalne metody analizy ilościowej Wysokosprawna chromatografia cieczowa (HPLC)
Cz 10 Instrumentalne metody analizy ilościowej Metody chromatograficzne
Cz VII Analiza ilosciowa
analiza ilosciowa 6 id 60541 Nieznany (2)
analiza ilosciowa 2 id 60539 Nieznany
Analiza ilosciowa substancji farmakopealnych metoda bromianometryczna
5 INSTRUMENTY ANALIZY FINANSOWEJ, STUDIA, studia II stopień, 1 semestr MSU FiR 2011 2012, Analiza Sp
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna Sprawozdanie 1 kam
Projekt I Analiza ilościowa i jakościowa rynku
(), analiza instrumentalna L, analiza elementarna węgla
Test sprawdzający Z. Hak, VII, VII Analizy ilościowe i graficzne przedstawienie wyników
analiza ilościowa 3
Cwiczenie nr 10 Analiza ilościowa Alkacymetria Oznacznie weglanow i wodoroweglanow
Analiza ilościowa
więcej podobnych podstron