
Ćwiczenie nr 10
ANALIZA ILOŚCIOWA (MIARECZKOWA)
OZNACZANIE PODSTAWOWYCH ANIONÓW
WYSTĘPUJĄCYCH W MATERIAŁACH BUDOWLANYCH
OZNACZANIE ILOŚCIOWE WĘGLANÓW I WODOROWĘGLANÓW
PODSTAWY TEORETYCZNE ANALIZY MIARECZKOWEJ
1. WPROWADZENIE
Metody analizy miareczkowej (analizy objętościowej) polegają na oznaczaniu składnika w
roztworze badanym za pomocą roztworu odczynnika (titranta) o znanym stężeniu, czyli mianie,
odmierzanego dokładnie za pomocą biurety. Operację dodawania roztworu titranta z biurety do
naczynia z roztworem miareczkowanym nazywa się miareczkowaniem. Roztwory odczynników o
znanym stężeniu (mianie) używane do miareczkowania nazywa się roztworami mianowanymi.
Stężenia roztworów mianowanych wyraża się molowością (mol/l lub M ).
W metodach miareczkowych można wykorzystywać reakcje chemiczne:
a) które przebiegają stechiometrycznie (ilościowo),
b) które przebiegają dostatecznie szybko,
c) których punkt równoważnikowy można wyznaczyć z dostateczną dokładnością,
d) w których biorą udział związki chemiczne dające roztwory dostatecznie trwałe w warunkach
miareczkowania.
Metodami miareczkowymi, w zależności od stężenia titranta i wielkości stosowanej biurety, można
oznaczać różne zawartości oznaczanych substancji (zwykle w zakresie 10
-3
- 10
-1
g).
Metody miareczkowe umożliwiają w sprzyjających warunkach oznaczanie z dużą dokładnością (z
błędem względnym 0,1-0,2 %), ustępują jednak nieco pod tym względem metodom wagowym.
Dokładność metod miareczkowych zależy w dużym stopniu od dokładności nastawienia miana
roztworu, którym się miareczkuje. Podczas ważenia na wadze analitycznej możliwy do popełnienia
błąd jest niewielki w porównaniu z błędem, jaki można popełnić podczas odczytywania poziomu
cieczy w biurecie, podczas pipetowania i określania współmierności naczyń miarowych.
Metody miareczkowe przewyższają metody wagowe szybkością wykonania, zwłaszcza wtedy, gdy
w momencie oznaczania danej substancji dysponuje się gotowym nastawionym titrantem.
2. KLASYFIKACJA METOD MIARECZKOWYCH
Metody miareczkowe opierają się w zasadzie na czterech podstawowych typach reakcji
chemicznych, a mianowicie: reakcjach kwas-zasada, reakcjach kompleksowania, reakcjach redoks i
reakcjach strąceniowych. Metody te nazywa się odpowiednio: alkacymetrycznymi (skrót od
alkalimetryczne + acydymetryczne), kompleksometrycznymi, redoksometrycznymi (reduktometryczne
+ oksydymetryczne) i strąceniowymi.
Nazwy metod miareczkowych tworzy się od nazwy titranta z końcówką -metryczny. Na przykład
metody, w których stosuje się mianowane roztwory kwasów, nazywa się acydymetrycznymi
(acydymetria), a metody, w których miareczkuje się mianowanymi roztworami bromianu
potasowego, nazywa się metodami bromianometrycznymi (bromianometria).
W analizie miareczkowej stosuje się przede wszystkim środowisko wodne. W wielu jednak
przypadkach stosuje się metody miareczkowe do oznaczeń w środowiskach niewodnych lub
mieszanych.
W analizie organicznej, obok szeroko stosowanych miareczkowań alkacymetrycznych i redoks,
wykorzystuje się w metodach miareczkowych specyficzne reakcje organiczne, takie jak bromowanie,
diazowanie, sprzęganie, spełniające podstawowe wspomniane wyżej warunki wymagane w analizie
miareczkowej.

3. PUNKT RÓWNOWAŻNIKOWY (PR) I PUNKT KOŃCOWY (PK)
MIARECZKOWANIA. MIANO ROZTWORU
Aby móc oznaczyć daną substancję w roztworze, trzeba znaleźć odpowiedni odczynnik reagujący
z nią w sposób stechiometryczny (ilościowo i bez reakcji ubocznych, zgodnie z założonym
równaniem reakcji) i dostatecznie szybko. Poza tym trzeba znaleźć sposób, który pozwoli łatwo
wyznaczyć punkt, w którym cały oznaczany składnik przereagował z titrantem, aby wtedy właśnie
zakończyć miareczkowanie i zmierzyć (odczytać na biurecie) objętość titranta.
Punkt miareczkowania, w którym oznaczany składnik przereagował ilościowo stechiometrycznie
z dodawanym z biurety odczynnikiem, nazywa się punktem równoważnikowym (PR)
miareczkowania. Istnieją różne sposoby pozwalające ustalić ten punkt. Taki wyznaczony punkt
nazywa się punktem końcowym (PK) miareczkowania. Oczywiście należy dokładać starań, aby
PK=PR, wtedy bowiem miareczkowanie pozwala wyznaczyć zawartość oznaczanego składnika bez
żadnego błędu.
Tak idealne dobranie sposobu oznaczenia PK miareczkowania jest zwykle dość trudne. W
rezultacie PK nie jest idealnie równy PR miareczkowania i różnica ta stanowi błąd miareczkowania.
Obliczona na podstawie PK miareczkowania zawartość oznaczanego składnika jest zwykle zbyt mała
lub zbyt duża.
W przypadku znacznej rozbieżności między PK i PR, w celu uniknięcia większych błędów, można
posłużyć się porównawczym sposobem nastawiania miana roztworu odczynnika do miareczkowania.
Sposób polega na nastawianiu miana na znaną ilość oznaczanego składnika, zawartego w takim
samym roztworze jak badany, przy czym PK miareczkowania wyznacza się w taki sam sposób, jaki
stosuje się w toku analizy. Po takim nastawieniu miana wiadomo, że 1 ml titranta odpowiada ściśle
określonej liczbie gramów oznaczanego składnika. Jest to miano empiryczne titranta, słuszne tylko w
tych dokładnie określonych warunkach miareczkowania.
Zawartość składnika (w gramach) wyznaczoną metodą miareczkową przy zastosowaniu miana
empirycznego otrzymuje się mnożąc liczbę mililitrów titranta zużytą na miareczkowanie przez miano
empiryczne titranta, wyrażone w gramach oznaczanego składnika na 1 ml titranta.
Ponieważ w większości miareczkowań można uznać, że PK = PR, do miareczkowania stosuje się
roztwory, których stężenie jest tak przygotowane, że uwzględnia od razu współczynniki
równoważności wynikające z przeprowadzonych reakcji.
W przypadku miareczkowań strąceniowych i kompleksometrycznych są to roztwory o stężeniu
wyrażanym w mol/l. Ilość składnika (w gramach) wyznaczoną tymi metodami oblicza się mnożąc
liczbę mililitrów titranta zużytą na miareczkowanie przez jego molowość i przez masę molową
(w g/mol) substancji oznaczanej.
W przypadku reakcji alkacymetrycznych i redoksometrycznych najchętniej stosuje się roztwory
zawierające w 11 roztworu: 1, 0,1 lub 0,01 mola kwasu, zasady, utleniacza lub reduktora. Ilość
oznaczanego składnika (w gramach) oblicza się wtedy mnożąc liczbę mililitrów zużytego titranta
przez masę molową (g/mol) i współczynnik równoważności oznaczanego składnika.
Postępowanie mające na celu ustalenie stężenia titranta nazywa się nastawianiem (ustalaniem)
miana roztworu. Ustala się je stosując substancje podstawowe lub inny mianowany roztwór. Miano
nastawione na substancję podstawową nazywa się mianem bezwzględnym.
Substancje podstawowe, spełniające w poszczególnych metodach miareczkowych rolę wzorców
(np. węglan sodowy w alkacymetrii, szczawian sodowy w manganometrii, chlorek sodowy w
argentometrii), muszą odpowiadać określonym wymaganiom. Powinny to być substancje stałe, o
dużym stopniu czystości, łatwe do wysuszenia i niehigroskopijne. Suma domieszek w substancji
podstawowej nie może przekraczać 0,01-0,02 %. Oczywiście przebieg reakcji między substancją
podstawową a roztworem, którego miano ustala się, musi być ściśle stechiometryczny.

4. WSKAŹNIKI PK MIARECZKOWANIA
Punkt końcowy miareczkowania określa się wizualnie, korzystając z barwnych wskaźników, albo
metodami instrumentalnymi. Do najważniejszych należą następujące instrumentalne metody
miareczkowania:
1) potencjometryczne — na podstawie pomiaru zmian potencjału elektrody wskaźnikowej w
czasie miareczkowania;
2) konduktometryczne — na podstawie pomiaru zmiany przewodnictwa roztworu
miareczkowanego;
3) amperometryczne — na podstawie pomiaru zmiany natężenia prądu płynącego w odpowiednim
układzie elektrod w roztworze badanym;
4) spektrofotometryczne — na podstawie pomiaru zmiany absorbancji roztworu.
Wizualne metody wyznaczania PK miareczkowania z zastosowaniem wskaźników polegają na
dodawaniu do roztworu miareczkowanego odpowiednich odczynników, zwanych wskaźnikami, które
zmieniają barwę w PR reakcji titranta z oznaczanym składnikiem. W PR reakcji może zmienić się
barwa wskaźnika (wskaźniki dwubarwne), może zabarwiać się bezbarwny pierwotnie roztwór, może
też nastąpić zanik barwy pierwotnej (wskaźniki jednobarwne).
Wskaźniki zmieniają barwę odpowiednio do zmian zachodzących w roztworze miareczkowanym,
np. wskaźniki alkacymetryczne w zależności od zmiany pH roztworu, wskaźniki redoks w zależności
od zmian potencjału redoks roztworu.
Wskaźniki mogą też zmieniać barwę w wyniku reakcji zachodzących w roztworze w toku
miareczkowania, w których bierze udział sam wskaźnik. Na przykład wskaźniki kompleksometryczne
reagują z oznaczanym jonem metalu tworząc barwny kompleks. W PK miareczkowania titrant,
którym jest w tym przypadku odczynnik kompleksujący oznaczany jon metalu, wypiera wskaźnik z
jego kompleksu z oznaczanym jonem; wolna postać wskaźnika jest inaczej zabarwiona niż jego
kompleks.
Wskaźniki mogą wreszcie reagować pośrednio lub bezpośrednio z nadmiarem titranta. Na
przykład skrobia (stosowana w jodometrii) tworzy z jodem niebieski związek, jony chromianowe (w
argentometrii) reagują z nadmiarem jonów srebra i tworzą czerwonawą zawiesinę (Ag
2
Cr0
4
),
wskazującą na koniec miareczkowania.
Czasami rolę wskaźnika może spełniać sam odczynnik, którym się miareczkuje. Jeżeli silnie
zabarwiony titrant odbarwia się w reakcji z oznaczanym składnikiem, np. roztwór nadmanganianu
potasowego w reakcji ze składnikami redukującymi, to w chwili, kiedy w roztworze substancja
redukująca zostanie utleniona, a zatem w PR miareczkowania, najmniejszy nadmiar titranta zabarwi
roztwór, wskazując na koniec miareczkowania. Oczywiście w tym przypadku zaobserwowany PK
miareczkowania nie pokrywa się z punktem PR; różnica ta odpowiada objętości roztworu odczynnika
koniecznej do zaobserwowania barwy roztworu. Można wówczas wprowadzić poprawkę, odejmując
od całej dodanej objętości titranta objętość konieczną do wywołania widocznego zabarwienia
roztworu.
5. TYPY METOD MIARECZKOWYCH
Jeśli oznaczana substancja reaguje z titrantem stechiometrycznie, szybko i jeśli łatwe jest
określenie końca miareczkowania, to przeprowadza się miareczkowanie bezpośrednie.
Jeśli odczynnik, którym się miareczkuje, reaguje z oznaczanym składnikiem powoli lub jeśli
osiągnięcie PR reakcji wymaga nadmiaru titranta, miareczkowanie bezpośrednie nie daje
zadowalających wyników. Można wtedy posłużyć się metodą miareczkowania odwrotnego. Do
badanego roztworu dodaje się znaną ilość titranta w nadmiarze. Czeka się, aby reakcja z oznaczanym
składnikiem przebiegła do końca, ewentualnie podgrzewa roztwór w celu przyspieszenia osiągnięcia
równowagi reakcji. Następnie odmiareczkowuje się nadmiar odczynnika odpowiednim pomocniczym
mianowanym roztworem, reagującym szybko i stechiometrycznie z titrantem wobec odpowiedniego
wskaźnika. Jako przykład można wymienić kompleksometryczne oznaczanie glinu.
Istnieją wreszcie przypadki, kiedy substancje stosowane w analizie objętościowej nie reagują z

sobą bezpośrednio. Można wtedy zastosować miareczkowanie pośrednie. Polega ono na dobraniu
takiej substancji trzeciej, która reagując stechiometrycznie i ilościowo z oznaczanym składnikiem
tworzy nowy związek, reagujący następnie stechiometrycznie i szybko z titrantem.
Dobrym przykładem miareczkowania pośredniego jest stosowanie jako titranta roztworu
tiosiarczanu sodowego, znanego reduktora. Nie reaguje on niestety ilościowo i stechiometrycznie
z takimi często oznaczanymi utleniaczami, jak jony nadmanganianowe, jony dwuchromianowe i inne.
Stosuje się wtedy pośrednią reakcję tych utleniaczy z jodkami (KI). W ilościowej i szybko
przebiegającej reakcji utleniania jodków zostaje wydzielony jod, który następnie odmiareczkowuje się
mianowanym roztworem tiosiarczanu sodowego.
Do tej kategorii miareczkowań należy też zaliczyć pośrednie oznaczanie anionów za pomocą
EDTA. Anion strąca się w postaci trudno rozpuszczalnego związku z jonami jakiegoś metalu, osad
oddziela się i rozpuszcza, po czym odmiareczkowuje się mianowanym roztworem EDTA jony tego
metalu.
6. WSKAŹNIKI pH
Pomiar wartości pH roztworu jest jednym z podstawowych pomiarów wykonywanych stale w toku
prac chemicznych, a szczególnie analitycznych. Pomiar pH wykonuje się dwiema zasadniczymi
metodami: potencjometryczną, oraz wizualną — na podstawie obserwacji barwy odpowiednich
substancji, tzw. wskaźników pH (zwanych także czasami indykatorami).
Wskaźnikami pH są słabe kwasy bądź słabe zasady organiczne, które reagując z wodą tworzą
układy sprzężone kwas-zasada. Człony układu mają albo różne zabarwienia — są to wtedy wskaźniki
dwubarwne (np. oranż metylowy), albo, gdy tylko jeden z członów układu jest zabarwiony, są to
wskaźniki jednobarwne (np. fenoloftaleina).
Wskaźniki jednobarwne i dwubarwne stosuje się albo same, albo w mieszaninie z obojętnym
barwnikiem, na którego tle zmiana barwy właściwego wskaźnika jest łatwiej zauważalna — są to
wskaźniki mieszane.
Stosuje się też mieszaniny wskaźników, które zmieniają barwę stopniowo w szerokim zakresie
pH. Są to wskaźniki uniwersalne, pozwalające szybko orientacyjnie określać pH. Wskaźniki takie są
zawsze zaopatrzone w skalę barw odpowiadających określonym wartościom pH.
Oprócz opisanych wyżej wskaźników barwnych stosuje się czasami, szczególnie podczas
miareczkowania roztworów zabarwionych, wskaźniki fluorescencyjne, które albo zmieniają barwę
fluorescencji, albo zaczynają fluoryzować przy określonym pH. Oczywiście wszystkie uwagi
dotyczące wskaźników barwnych dotyczą również wskaźników fluorescencyjnych.
W tabeli 1 podano charakterystykę częściej stosowanych wskaźników alkacymetrycznych
(kwasowo-zasadowych). Wiedząc, jakie powinno być pH w punkcie równoważnikowym, dla każdego
miareczkowania można dobrać odpowiedni wskaźnik. Wskaźniki pH stosuje się w postaci roztworów
wodnych lub etanolowych (patrz ostatnia kolumna tabeli 1) oraz w postaci papierków
wskaźnikowych. Są to wąskie paski bibuły nasycone roztworem wskaźnika. Do papierków
nasyconych wskaźnikiem uniwersalnym jest dołączona skala barw, jakie przybiera papierek w
zależności od pH roztworu. Po zanurzeniu papierka do badanego roztworu lub po zwilżeniu kroplą
roztworu, pobraną czystą bagietką, papierek zabarwia się na kolor odpowiadający pH tego roztworu.
Pomiar pH za pomocą wskaźników jest możliwy jedynie w rozcieńczonych roztworach wodnych.
Obecność w roztworze znaczniejszej ilości soli obojętnych wywołuje efekt solny, powodujący
przesunięcie pH zmiany barwy jednej lub obu postaci wskaźnika.
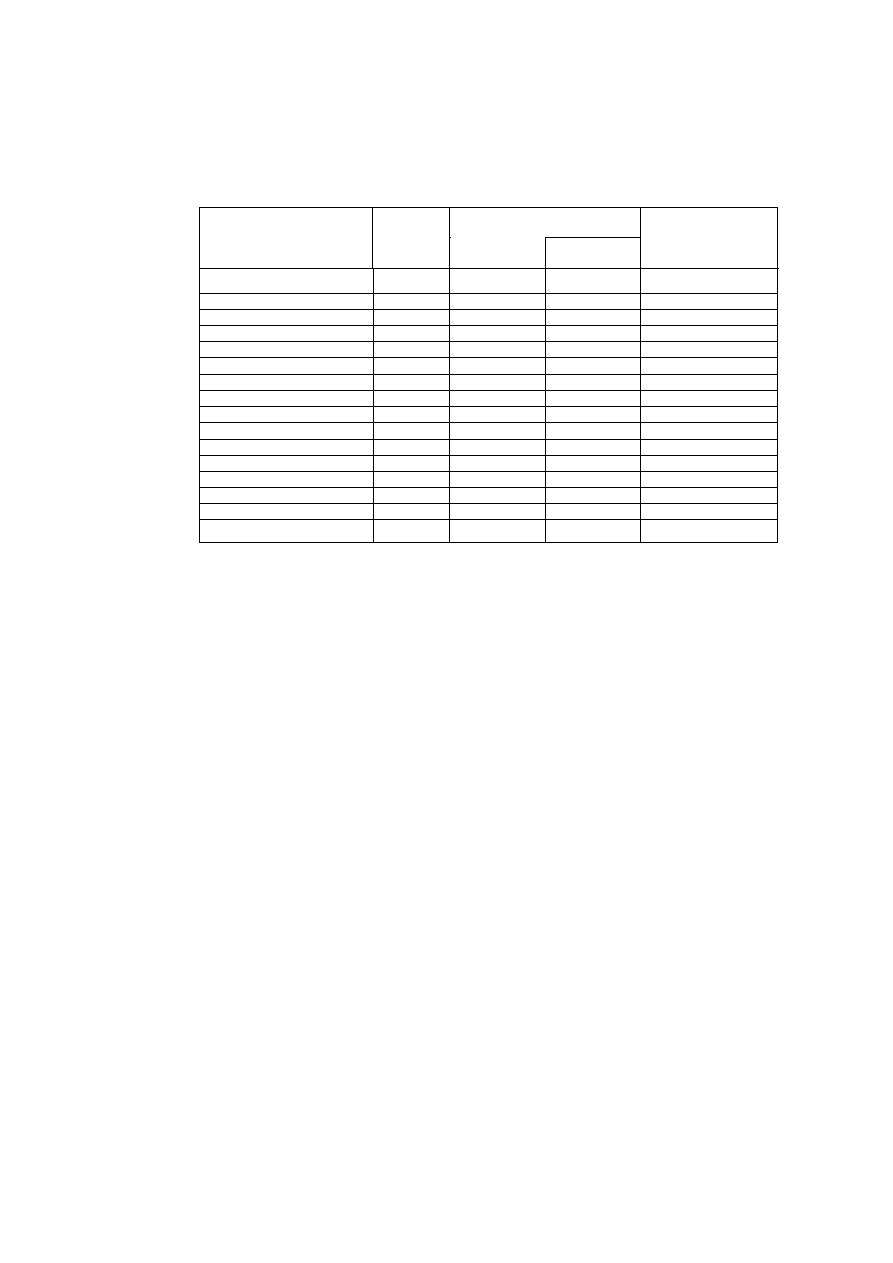
Tabela 1.Wskaźniki alkacymetryczne
Zabarwienie w roztworze
Wskaźniki
Zakres pH
zmiany
barwy
kwaśnym
alkalicznym
Stosuje się jako
roztwór
Czerwień krezolowa
0,2-1,8
czerwone
żółte
wodny 0,1%-owy
Błękit tymolowy
1,2-2,8
czerwone
żółte
wodny 0,05 %-owy
Tropeolina OO
1,3-3,2
czerwone
żółte
wodny 0,1 %-owy
Dinitrofenol
2,4-4,0
bezbarwne
żółte
alkoh. 0,1 %-owy
Żółcień metylowa
2,9-4,0
czerwone
żółte
alkoh. 0.1 %-owy
Oranż metylowy
3,1-4,4
czerwone
pomarańczowe
wodny 0,1 %-owy
Zieleń bromokrezolowa
3,8-5,4
żółte
niebieskie
wodny 0,1 %-owy
Czerwień metylowa
4,2-6,3
czerwone
żółte
alkoh. 0,1 %-owy
Czerwień bromokrezolowa
5,2-6,8
żółte
czerwone
wodny 0,05 %-owy
Błękit bromotymolowy
6,2-7,6
żółte
niebieskie
wodny 0,05 %-owy
Czerwień fenolowa
6,4-8,0
żółte
czerwone
wodny 0,05 %-owy
Czerwień krezolowa
7,2-8,8
żółte
czerwone
wodny 0,1 %-owy
Fenoloftaleina
8,3-10,0
bezbarwne
czerwone
alkoh. 0,5 %-owy
Tymoloftaleina
9,3-10,5
bezbarwne
niebieskie
alkoh. 0,2 %-owy
Żółcień alizarynowa
10,0-12,0
żółte
fioletowe
alkoh. 0,1 %-owy
Tropeolina O
11,0-13,0 żółte
brunatne
alkoh. 0,1 %-owy
7. ZASADOWOŚĆ WODY
Właściwością wody, którą określa się jako zasadowość, jest zdolność do zobojętniania kwasów
mineralnych w określonych warunkach. Właściwość tę nadają wodzie obecne w niej wodorowęglany i
węglany oraz występujące rzadziej wodorotlenki lub w niewielkich stężeniach krzemiany, borany i
fosforany. W wodach naturalnych występują w największych ilościach wodorowęglany wapnia i
magnezu. Poza tym występują węglan magnezowy i w niewielkich stężeniach węglan wapniowy.
Obok wodorowęglanów i węglanów wapnia oraz magnezu w niektórych wodach znajdują się węglany
i wodorowęglany sodu i potasu. W takich przypadkach woda cechuje się większą zasadowością od
twardości ogólnej. Różnica pomiędzy wartością zasadowości a wielkością twardości ogólnej określana
jest jako zasadowość alkaliczna. Ten rodzaj zasadowości powodowany jest właśnie przez zawarte w
wodzie wodorowęglany lub węglany potasowe i sodowe.
Zasadowość wody z punktu widzenia sanitarnego ma znaczenie drugorzędne. Zasadowość ma
natomiast duże znaczenie w ocenie wody do celów gospodarczych i technicznych. Np. zasadowość
ogólna, która odpowiada twardości węglanowej, ma znaczenie w wodzie do zasilana kotłów. Podobnie
niepożądana jest zasadowość alkaliczna w wodzie dla celów technicznych, gdyż wywołuje silne
pienienie wody w kotle. Zasadowość alkaliczna jest niepożądana np. w garbarstwie, gdyż wywołuje
straty garbników.
Oznaczanie zasadowości wody polega na określeniu zawartości w niej związków chemicznych,
które reagują zasadowo w obecności odpowiedniego wskaźnika. Zawartość tych związków określa się
za pomocą miareczkowania roztworem mocnego kwasu, początkowo do pH ok. 8,3, . następnie do pH
ok. 4,5. Reakcje chemiczne podczas oznaczania zasadowości przebiegają następująco:
miareczkowanie do pH ok. 8,3 OH
-
+ H
+
→ H
2
O
miareczkowanie do pH ok. 4,5 CO
3
2-
+ H
+
→ HCO
3
-
HCO
3
-
+ H
+
→ H
2
O + CO
2
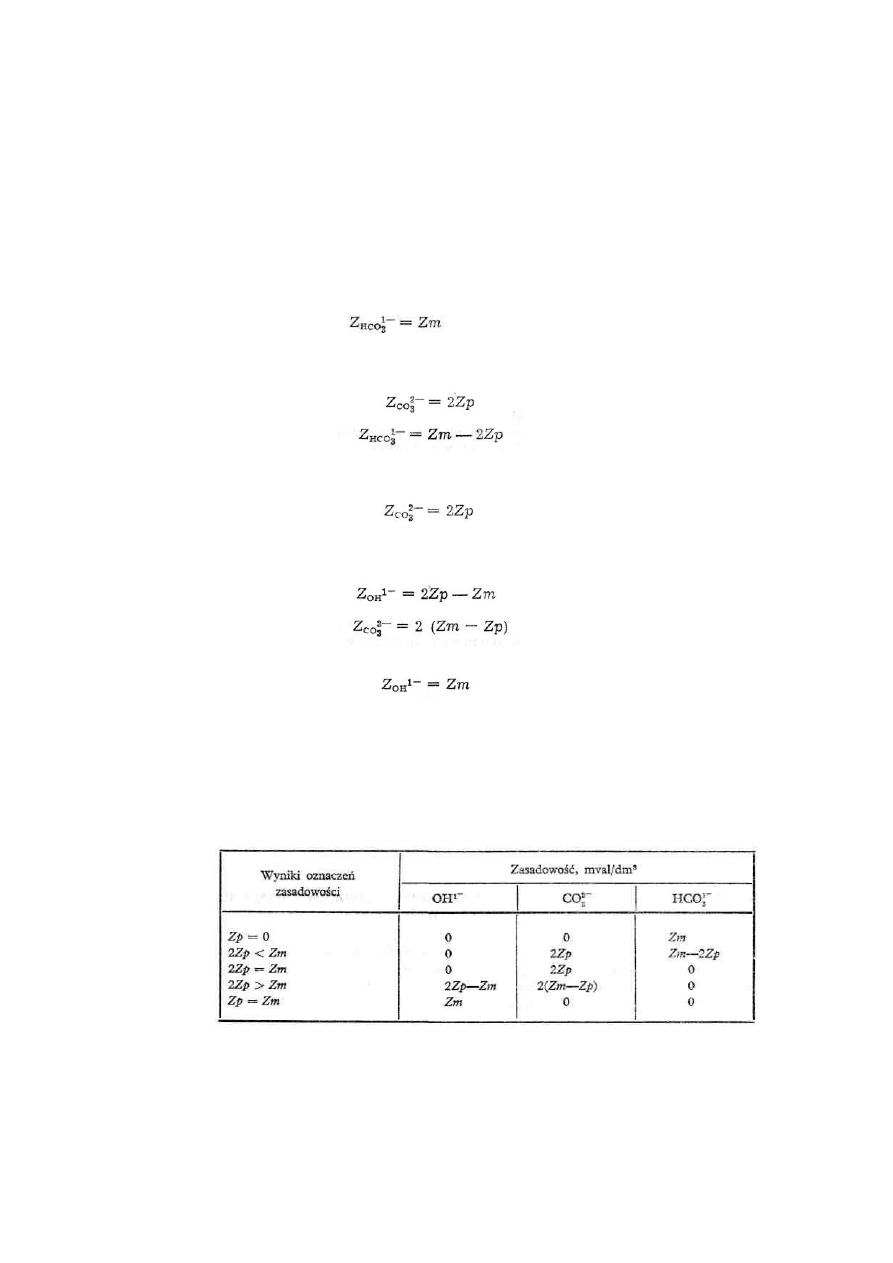
Podczas badań specjalnych rozróżnia się następujące rodzaje zasadowości, zależnie od związku,
który nadaje charakter zasadowy wodzie badanej; zasadowość ogólną (Zm), zasadowość wobec
fenoloftaleiny (Zp), zasadowość węglanową (Z
CO3
2-
), zasadowość wodorowęglanową (Z
HCO3
-
)
zasadowość wodorotlenową (Z
OH
-).
Określenie zasadowość ogólna oznacza sumę wszystkich związków chemicznych w wodzie, które
reagują zasadowo wobec oranżu metylowego pH = 4,5). Zasadowość wobec fenoloftaleiny oznacza
sumę wszystkich związków reagujących zasadowo powyżej pH = 8,3. Dalsze trzy rodzaje

zasadowości powodowane są obecnością w wodzie węglanów, wodorowęglanów i wodorotlenków,
jak na to wskazują ich określenia.
8. OZNACZANIE ZASADOWOŚCI WOBEC FENOLOFTALEINY ZA
POMOCĄ MIARECZKOWANIA
Związki zasadowe zawarte w wodzie są zobojętniane mianowanym roztworem mocnego kwasu
mineralnego do pH = 8,3 przy użyciu roztworu fenoloftaleiny jako wskaźnika. Miareczkowanie
prowadzi się do zaniku różowego zabarwienia próbki. W oznaczaniu przeszkadzają mętność ponad
30 mg/dm
3
i barwa ponad 50 mg/dm
s
Pt. W przypadku gdy mętność wody badanej przekracza 30
mg/dm
3
, należy przed oznaczaniem próbkę przesączyć. Jeżeli woda wykazuje barwę większą niż 50
mg/dm
3
Pt, zasadowość oznacza się za pomocą metody potencjometrycznej.
Odczynniki.
·
Kwas solny cz.d.a. lub kwas siarkowy cz.d.a., roztwór 0,1 m.
·
Fenoloftaleina, roztwór alkoholowy 1%, zobojętniony roztworem wodorotlenku sodowego.
Wykonanie oznaczenia.
Do kolby stożkowej o pojemności 250 cm
8
odmierzyć 100 cm
3
wody badanej i dodać 4 krople
roztworu fenoloftaleiny. Jeżeli woda zabarwi się na kolor różowy, należy ją miareczkować 0,1 m
roztworem kwasu solnego do zaniku zabarwienia. Jeżeli woda nie zabarwi się na różowo, po dodaniu
do niej roztworu fenoloftaleiny, oznacza to, że ten rodzaj zasadowości w wodzie badanej nie
występuje (Zp = 0).
Obliczanie i podawanie wyników. Zasadowość wody wobec fenoloftaleiny Zp obliczyć i podać
zgodnie ze wzorem:
gdzie: a — ilość 0,1 m roztworu kwasu, użyta do zmiareczkowania próbki wody badanej do
pH=8,3, cm
3
,
V — objętość próbki wody użytej do oznaczania, cm
3
.
9. OZNACZANIE ZASADOWOŚCI OGÓLNEJ WOBEC ORANŻU METYLOWEGO
Zasadowość ogólną wody oznacza się za pomocą miareczkowania jej próbki roztworem
mianowanym mocnego kwasu mineralnego do pH = 4,5, wobec oranżu metylowego jako wskaźnika.
Miareczkowanie prowadzi się do zmiany zabarwienia próbki z żółtego na żółtoróżowe.
W oznaczaniu przeszkadzają, podobnie jak przy oznaczaniu zasadowości wobec fenoloftaleiny,
mętność i barwa wody. Czynniki przeszkadzające usuwa się.
Odczynniki.
·
Kwas solny cz.d.a. lub kwas siarkowy cz.d.a., roztwór 0,1 m.
·
Oranż metylowy, roztwór 0,1%.
Wykonanie oznaczenia.
Do oznaczania użyć próbkę po zmiareczkowaniu jej wobec fenoloftaleiny. Do próbki dodać 2—3
krople roztworu oranżu metylowego i miareczkować 0,1 m roztworem kwasu solnego do zmiany jej
barwy na żółtoróżową. Oznaczenia wykonać dla wszystkich próbek badanych przekazanych przez
prowadzącego każdemu zespołowi ćwiczeniowemu.
Obliczanie i podawanie wyników.
Zasadowość ogólną wody obliczyć i podać zgodnie ze wzorem:
gdzie: b — ilość 0,1 m roztworu kwasu, zużyta do zmiareczkowania próbki wody badanej do pH =
4,5 (w przypadku wykonania oznaczenia w próbce uprzednio wykorzystanej do określenia
zasadowości wobec fenoloftaleiny, ilość ta będzie równać się sumie użytego roztworu kwasu na
oba miareczkowania, tj. do pH = 8,3 i do pH od 8,3 do 4,5), cm
3
, V — objętość próbki wody
użytej do oznaczania, cm
3
.
10. OBLICZANIE ZASADOWOŚCI WĘGLANOWEJ, WODOROWĘGLANOWEJ
I WODOROTLENOWEJ
W przypadku zróżnicowania zasadowości ogólnej Zm, na zasadowość węglanową Z
co3
2-
wodorowęglanową Z
HCQ3
-
i wodorotlenową Z
OH
-,
należy poszczególne rodzaje zasadowości obliczyć
wg podanych niżej wzorów i podać ich wartość w mval/dm
3
.
a. Jeżeli Zp = O (próbka wody badanej nie zabarwia się po dodaniu do niej roztworu
fenoloftaleiny), badana woda może zawierać jedynie wodorowęglany, w ilości odpowiadającej
zasadowości ogólnej, wówczas
b. Jeżeli 2Zp < Zm i pH wody < 9,0 jej próbka może zawierać węglany i wodorowęglany, wobec
czego:
c. Jeżeli 2Zp = Zm i pH wody ≤ 9,0, badana jej próbka może zawierać jedynie węglany, nie
zawiera wówczas wodorotlenków i wodorowęglanów, a więc
d. Jeżeli 2Zp > Zm i pH wody ≥ 9,0 jej próbka może zawierać wodorotlenki i węglany, przy
czym
e. Jeżeli Zp = Zm i pH wody ≥ 9,0 badana jej próbka zawiera jedynie wodorotlenki, wówczas
W tabeli 2 podano zestawienie obliczeń, które są słuszne, jeżeli pH próbki wody badanej jest
mniejsze lub równe 9,0. Gdy pH wody jest większe od 9,0 do obliczania zasadowości Z
0H
_
, Z
co3
2-
Z
HCQ3
-
należy stosować sposób podany w p.11 instrukcji.
Tabela 2. Zależność współistnienia jonów wodorotlenowych, wodorowęglanowych i węglanowych
w wodzie o pH < 9,0 w zależności od jej zasadowości
11. OBLICZANIE ZASADOWOŚCI WODOROTLENOWEJ,
WODOROWĘGLANOWEJ I WĘGLANOWEJ,
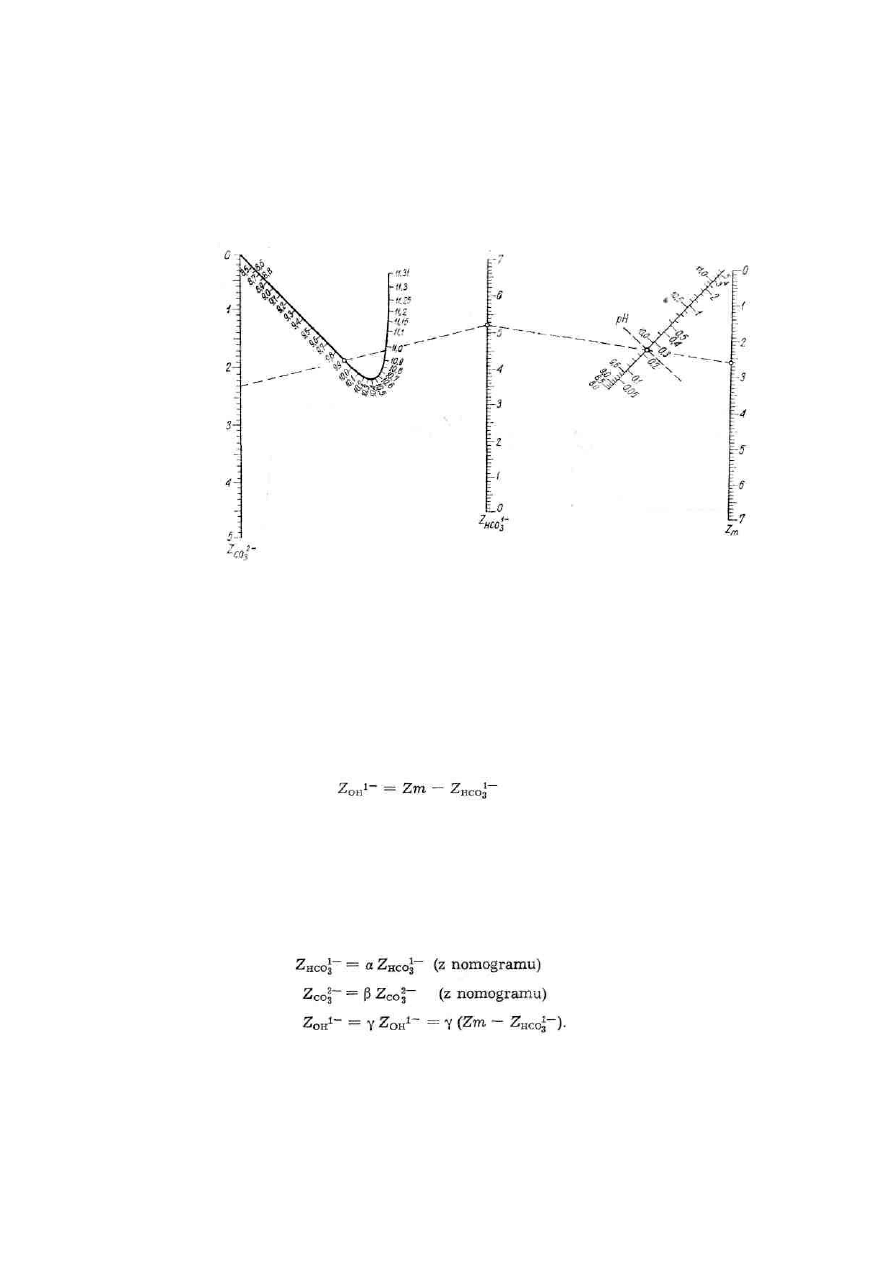
gdy pH wody jest większe od 9 i gdy 2 Zp ≥ Zm
Zasadowość wody w takich warunkach (pH > 9 i 2Zp
≥
Zm) jest wywoływana obecnością zasadowości
węglanowej, wodorotlenowej i wodorowęglanowej, które można obliczyć z nomogramu podanego na
rys. 1.
Rys. 1. Nomogram do oznaczania zasadowości Z
HCO
3-
i Z
CO32
-
W celu określenia zasadowości Z
HCQ3
-
Z
co3
2-
i Z
0H
_
,
-
należy oznaczyć zasadowość ogólną (Zm) i
odczyn wody (pH), następnie znaleźć na wykresie pozostałe zasadowości. Na prostej Zm ustalić
punkt odpowiadający oznaczonej zasadowości ogólnej, na prostej pH zaznaczyć punkt
odpowiadający zmierzonemu pH wody. Połączyć te dwa punkty prostą i przedłużyć ją do przecięcia
z prostą Z
HCO3
-. To miejsce przecięcia wyznacza zasadowość wodorowęglanową Z
HCO3
-. W podobny
sposób znajduje się punkt przecięcia z prostą Z
co3
2-
, który daje zasadowość węglanową.
Zasadowość wodorotlenową oblicza się według wzoru:
Otrzymane z nomogramu wartości poszczególnych zasadowości są słuszne, jeżeli zawartość substancji
rozpuszczonych nie przekracza w wodzie 20 mg/dm
3
(sucha pozostałość próbki przesączonej). Jeżeli
zawartość soli jest większa, do otrzymanych wartości należy wprowadzić poprawki. W tym celu
otrzymaną z wykresu wartość zasadowości należy pomnożyć przez współczynnik dla odpowiedniej
zasadowości podanej w tabelach 2-22, 2-23 i 2-24. Wówczas
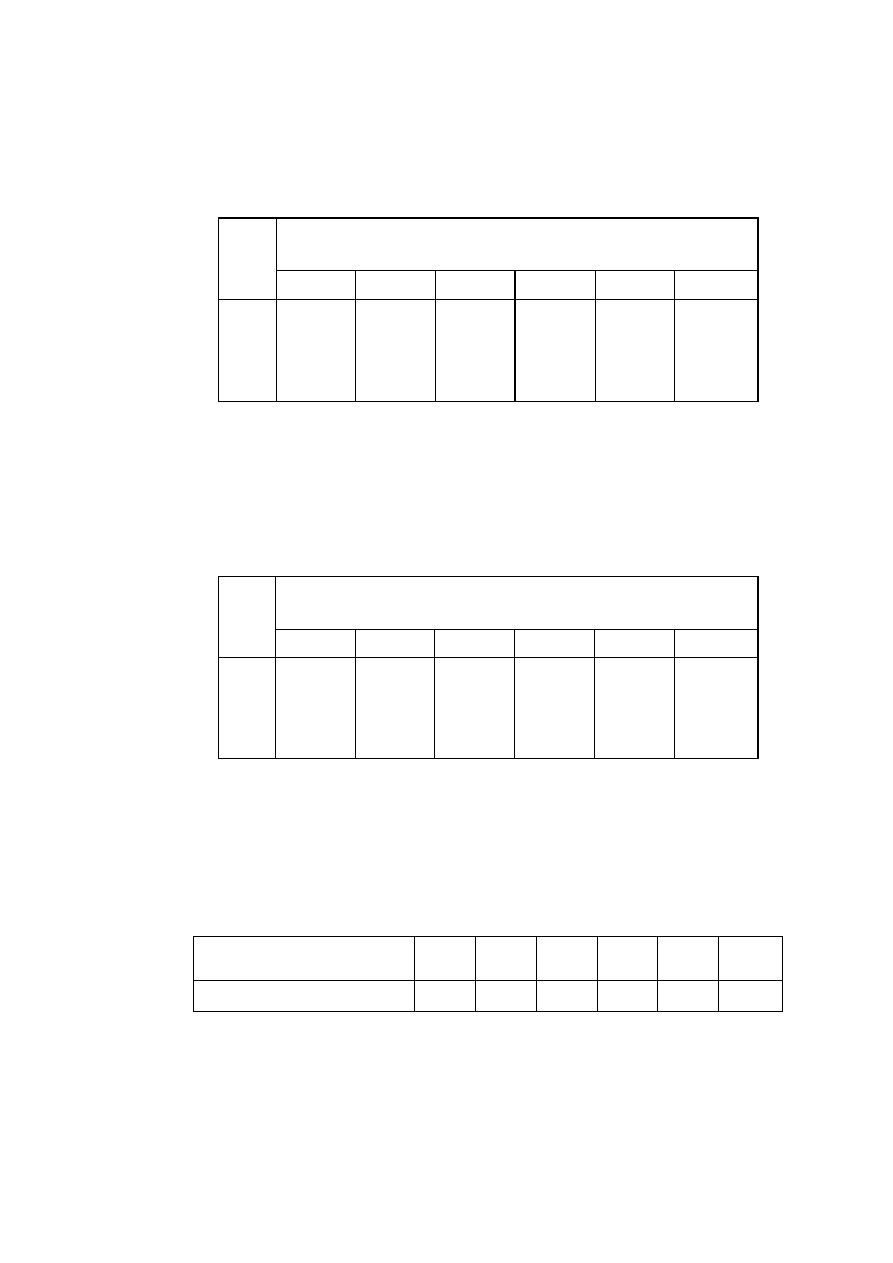
T a b e l a 3. Wartości współczynnika a przy różnych pH i zawartości soli w wodzie (dla Z
HCQ3
-
)
Sucha pozostałość po przesączeniu (zawartość soli)
w wodzie mg/dm
3
pH
50
100
200
300
400
500
8
9
10
11
1,00
0,99
0,98
0,96
1,00
0,99
0,95
0,91
1,00
0,98
0,90
0,84
1,00
0,97
0,87
0,80
1,00
0,97
0,85
0,76
1,00
0,96
0,83
0,73
T a b l i c a 4. Wartości współczynnika β przy różnych pH i zawartości soli w wodzie (dla Z
co3
2-
)
Sucha pozostałość po przesączeniu (zawartość soli)
w wodzie mg/dm
3
pH
50
100
200
300
400
500
8
9
10
11
1,04
1,04
1,02
1,00
1,11
1,09
1,05
1,00
1,24
1,12
1,09
1,01
1,25
1,18
1,12
1,02
1,33
1,30
1,14
1,02
1,39
1,34
1,16
1,02
T a b e l a 4. Wartości współczynnika γ przy różnych zawartościach soli w wodzie (dla Z
0H
_
, )
Sucha pozostałość po
przesączeniu, mg/dm
3
50
100
200
300
400
500
Współczynnik γ
1,03
1,06
1,10
1,13
1,16
1,19
Wyszukiwarka
Podobne podstrony:
Cwiczenie nr 11 Analiza ilościowa (miareczkowa) Oznacznie Ca 2 , Mg 2 Twardosc
Cwiczenie nr 13 Analiza ilościowa Kolorymetria Kolorymetryczne oznacznie Fe 3 , PO4 3
Cwiczenia nr 10 (z 14) id 98678 Nieznany
Zeszyt Ćwiczeń nr 10
Ćwiczenie nr 10 Bloki Dynamiczne
Cwiczenie nr 10 id 125701 Nieznany
Cwiczenia nr 10 RPiS id 124684 Nieznany
ćwiczenia nr 10, 10. rozwojowka, Oles, cw. 10
Zadania do ćwiczeń nr 10 – Dynamika punktu
Analiza ilościowa-objętościowe oznaczanie kwasów i zasad, Energetyka, I rok, chemia
ćwiczenia nr 10, 10. Rozwoj cw.10
INSTRUKCJA DO ĆWICZENIA NR 10, Elektrotechnika, dc pobierane, pnom wimir, PNOM, Materiałki, Materiał
Analiza ilościowa (miareczkowa) Oznaczanie podstawowych kationów występujących w materiałach budowla
ćwiczenie nr 10 moje, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
cwiczenie nr 10(1), Gruntoznawstwo, konspekty II
Cwiczenie nr 10
więcej podobnych podstron