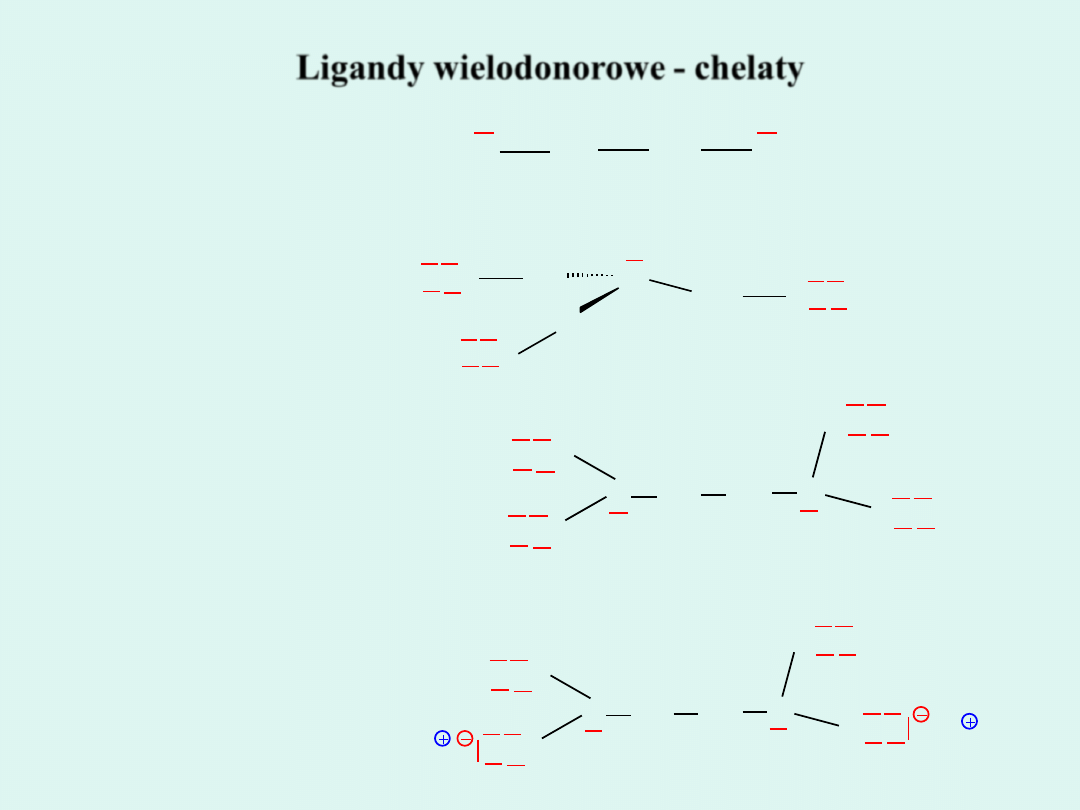
Ligandy wielodonorowe - chelaty
Etylenodiamina
Komplekson I
Komplekson II
Komplekson III
EDTA
CH
2
CH
2
NH
2
H N
2
N
CH
2
CH
2
CH
2
HOOC
COOH
HOOC
CH
2
CH
2
N
N
COOH
COOH
HOOC
HOOC
CH
2
CH
2
N
N
COOH
HOOC
COO
Na
Na
OOC
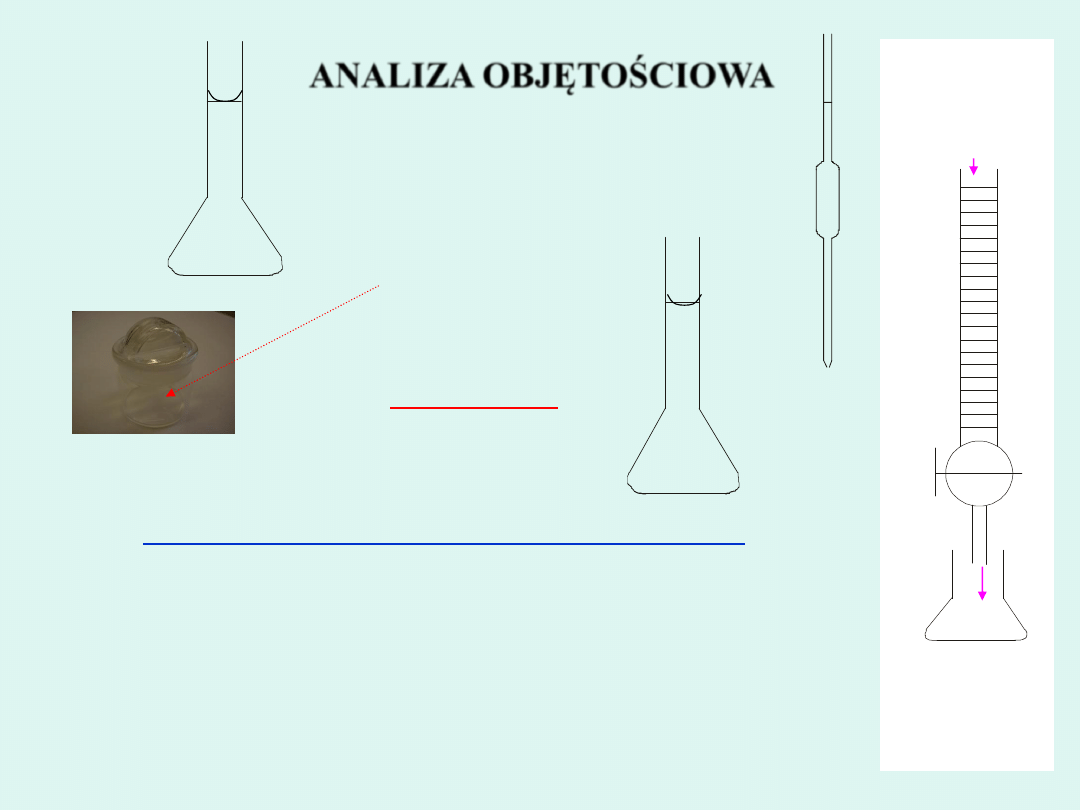
ANALIZA OBJĘTOŚCIOWA
Kompleksometria
Substancja podstawowa:
(EDTA),
M = 372,24 g·mol
–1
kolby
EDTA
EDTA
EDTA
V
M
m
c
Kolba miarowa
Pipeta
Roztwór
EDTA
Mg
2+
Biureta
Kolba stożkowa
ETAPY OZNACZENIA KOMPLEKSOMETRYCZNEGO
1. Przygotowanie roztworu substancji podstawowej w kolbie miarowej
2. Miareczkowanie roztworu badanego
EDTA
Naczyńko wagowe
Mg
2+
CE---Mg
2+
+ EDTA
2–
=
CE
+ Mg---EDTA
Jak w oznaczeniach kompleksometrycznych określa się punkt równoważności molowej?
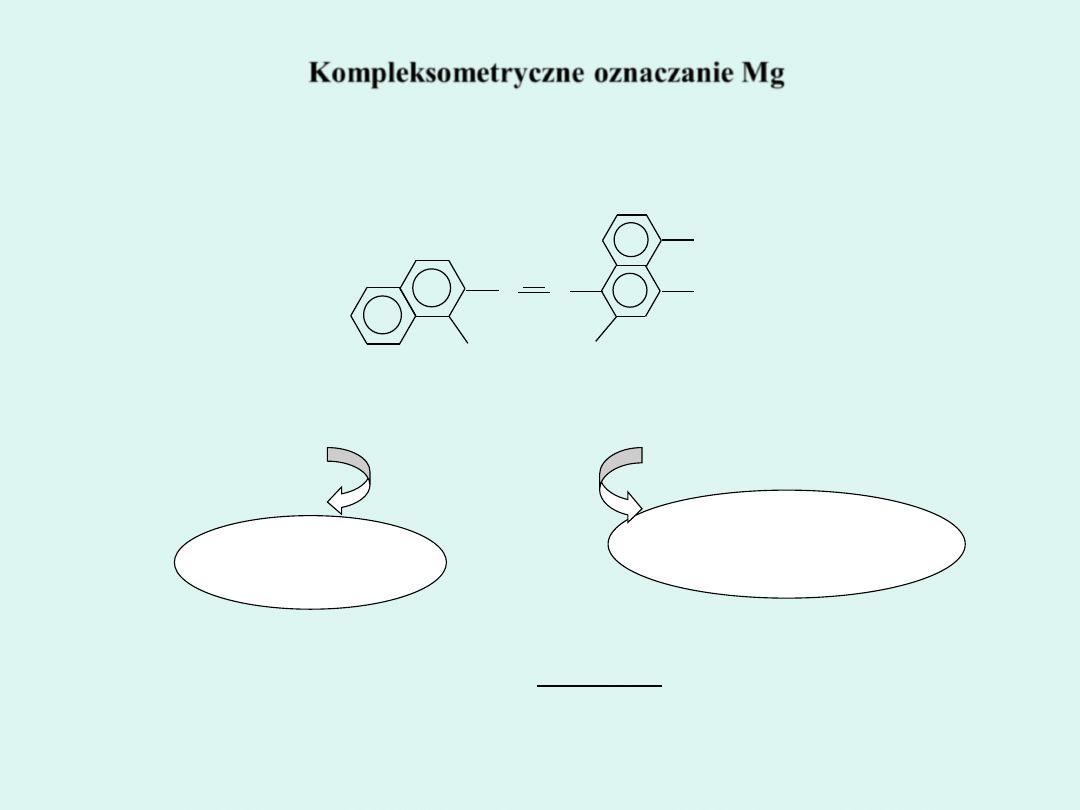
Kompleksometryczne oznaczanie Mg
N
N
NO
2
SO
3
-
O
H
O
H
Jak w oznaczeniach kompleksometrycznych określa się punkt równoważności molowej?
Czerń eriochromowa (CE)
CE---Mg
2+
+ EDTAH
2
2–
=
CE
+ Mg---EDTAH
2
Kompleks barwy
wiśniowoczerwonej
Niebieskie zabarwienie od
uwolnionej czerni
eriochromowej (CE)
1
2
2
2
EDTAH
Mg
n
n
PRM
Substancja podstawowa: sól disodowa kwasu etyleno-diamino-tetraoctowego,
EDTAH
2
Na
2
·H
2
O).
1
24
,
372
2
2
2
mol
g
M
O
H
Na
EDTAH
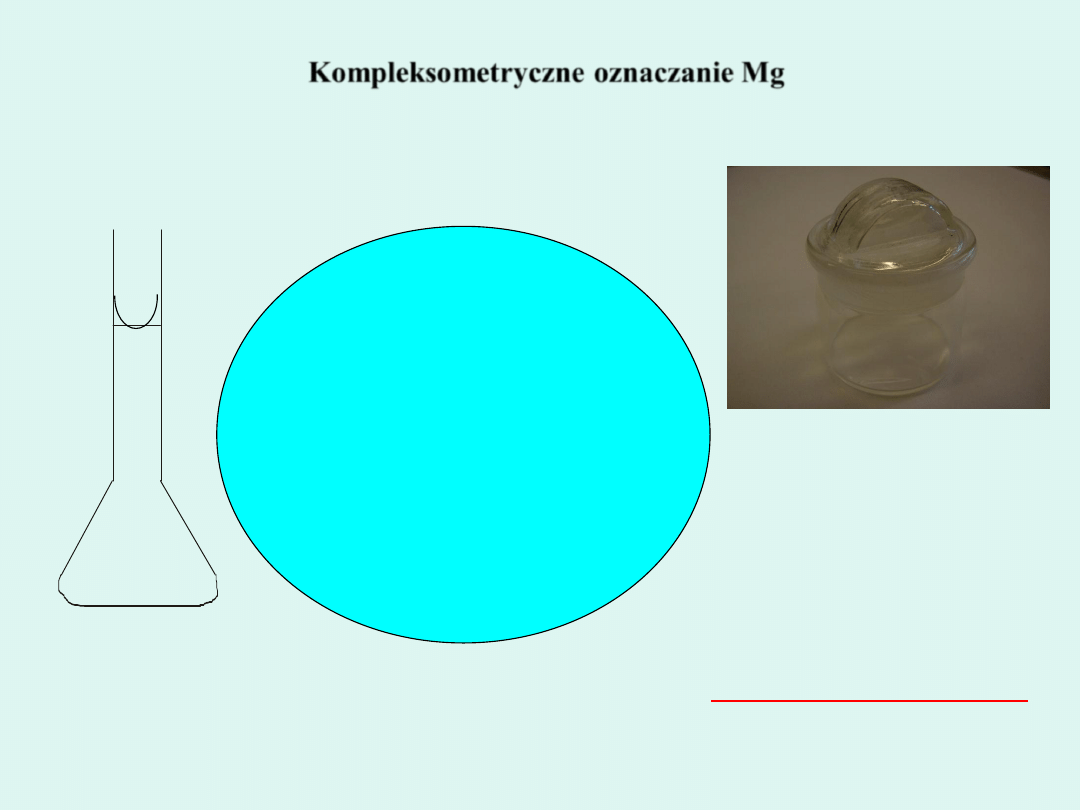
Kompleksometryczne oznaczanie Mg
1. Do kolby miarowej z
wersenianem disodowym wlewać
wodę destylowaną poprzez lejek, w
celu dokładnego spłukania lejka.
2. Następnie wyjąć lejek z kolby i
uzupełnić roztwór w kolbie wodą
destylowaną tak, aby menisk dolny
roztworu był styczny z kreską kolby
miarowej. Ostatnie 2 cm
3
uzupełnić
pipetą.
1
,
2
2
2
2
2
2
2
2
k
O
H
Na
EDTAH
O
H
Na
EDTAH
EDTAH
V
M
m
c
EDTAH
2
Na
2
Kompleksometryczne oznaczanie Mg
1. Otrzymany w kolbie miarowej badany
roztwór uzupełnić wodą destylowaną do kreski
miarowej i dokładnie wymieszać
2. Pobrać pipetą roztwór z kolby miarowej
i przenieść ilościowo do kolby stożkowej
3. Dodać do kolby stożkowej szczyptę czerni
eriochromowej (
CE
) i 10 cm
3
buforu
amonowego i dokładnie wymieszać. Otrzymany
roztwór powinien mieć barwę winnoczerwoną
4.
Mg
2+
Biureta
(roztwór EDTAH
2
2-
)
Kolba stożkowa
(roztwór Mg
2+
,
bufor amonowy,
czerń eriochromowa )
2
2
2
2
2
2
Mg
EDTAH
EDTAH
Mg
V
c
V
c
2
2
2
,
Mg
k
Mg
Mg
c
V
M
m
CE---Mg
2+
+ EDTAH
2
2–
=
CE
+ Mg---EDTAH
2
Miareczkować
do zmiany
zabarwienia na
kolor
niebieski
Kompleksometryczne oznaczanie Mg i Ca
Biureta
(roztwór EDTAH
2
2-
)
1.
CE---Mg
2+
+
CE---Ca
2+
+ EDTAH
2
2–
=
CE
+ Mg---EDTAH
2
+ Ca---EDTAH
2
1. Otrzymany w kolbie miarowej badany
roztwór uzupełnić wodą destylowaną do kreski
miarowej i dokładnie wymieszać
2. Pobrać pipetą roztwór z kolby miarowej
i przenieść ilościowo do kolby stożkowej
3. Dodać do kolby stożkowej szczyptę czerni
eriochromowej (
CE
) i 10 cm
3
buforu
amonowego i dokładnie wymieszać. Otrzymany
roztwór powinien mieć barwę winnoczerwoną
4.
Miareczkować
do zmiany
zabarwienia na
kolor
niebieski
Kolba stożkowa
(roztwór Ca
2+
i Mg
2+
,
bufor amonowy,
czerń eriochromowa )
n(Mg
2+
) + n(Ca
2+
) = n
EDTA
Mg
2+
,
Ca
2+
Kompleksometryczne oznaczanie Mg i Ca
Ca
2+
Biureta
(roztwór EDTAH
2
2-
)
1.
MU---Ca
2+
+ EDTAH
2
2–
=
MU
+ Ca---EDTAH
2
1. Otrzymany w kolbie miarowej badany roztwór
uzupełnić wodą destylowaną do kreski miarowej i
dokładnie wymieszać
2. Pobrać pipetą roztwór z kolby miarowej
i przenieść ilościowo do kolby stożkowej
3. Dodać do kolby stożkowej szczyptę mureksydu
(
MU
) i 10 cm
3
roztworu NaOH (2 mol/dm
3
)
i dokładnie wymieszać. Otrzymany roztwór
powinien mieć barwę różowoczerwoną
4.
Miareczkować do
zmiany zabarwienia
na kolor
niebieskofioletowy
Kolba stożkowa
(roztwór Ca
2+
i Mg
2+
,
NaOH,
mureksyd )
n(Ca
2+
) = n
EDTA
EDTA
EDTA
Ca
Mg
c
V
n
n
1
2
2
EDTA
EDTA
Ca
c
V
n
2
2
1
2
2
EDTA
Ca
Mg
n
n
n
1.
CE---Mg
2+
+
CE---Ca
2+
+ EDTAH
2
2–
=
CE
+ Mg---EDTAH
2
+ Ca---EDTAH
2
2.
MU---Ca
2+
+ EDTAH
2
2–
=
MU
+ Ca---EDTAH
2
II Miareczkowanie Ca
2
2
EDTA
Ca
n
n
EDTA
EDTA
EDTA
Mg
c
V
V
n
)
(
2
1
2
I Miareczkowanie Mg i Ca
Mg
2+
,
Ca
2+
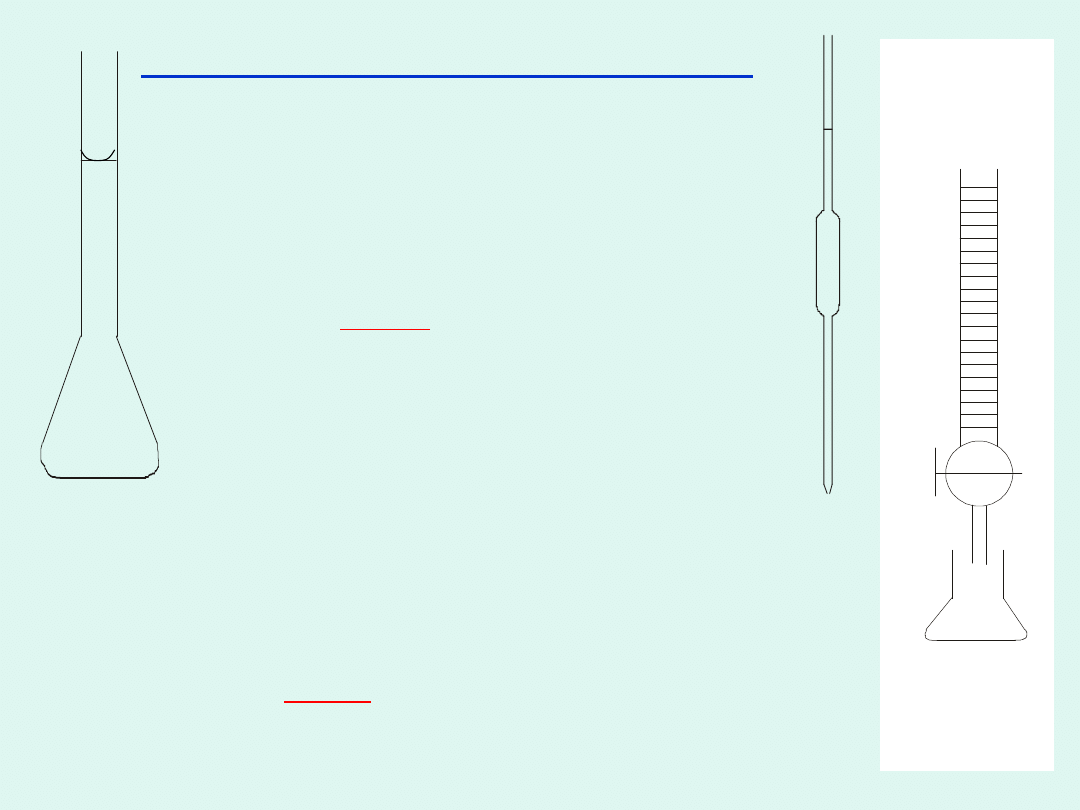
EDTA
EDTA
Ca
c
V
n
2
2
EDTA
EDTA
EDTA
Mg
c
V
V
n
)
(
2
1
2
Roztwór
EDTA
Biureta
Kolba stożkowa
EDTA
EDTA
Ca
Pipety
Kolby
Ca
c
V
M
V
V
m
2
2
EDTA
EDTA
EDTA
Mg
Pipety
Kolby
Mg
c
V
V
M
V
V
m
)
(
2
1
2
Obliczenie masy Mg i Ca w badanym roztworze
1.
MU---Ca
2+
+ EDTAH
2
2–
=
MU
+ Ca---EDTAH
2
2.
CE---Mg
2+
+
CE---Ca
2+
+ EDTAH
2
2–
=
CE
+ Mg---EDTAH
2
+ Ca---EDTAH
2
Mg
2+
,
Ca
2+

Kompleksometria
Przykład:
Do 50 cm
3
0,02500 molowego roztworu wersenianu dwusodowego wprowadzono próbkę
CaCl
2
. Nadmiar wersenianu odmiareczkowano za pomocą 16,6 cm
3
roztworu azotanu magnezu
o stężeniu 0,03668 mol · dm
-3
. Oblicz masę próbki CaCl
2
.
Dane:
V(EDTAH
2
Na
2
) = 50 cm
3
c(EDTAH
2
Na
2
) = 0,02500 mol/dm
3
V(Mg(NO
3
)
2
) = 16,6 cm
3
c(Mg(NO
3
)
2
) = 0,03668 mol/dm
3
M(CaCl
2
) = 111 g/mol
Należy obliczyć:
m(CaCl
2
) = ?
Rozwiązanie:
2. Mg
2+
+
CE
+
EDTAH
2
2–
=
CE---Mg
2+
+ Mg---EDTAH
2
1. Ca
2+
+ EDTAH
2
2–
= Ca---EDTAH
2
2
2
2
2
Mg
Ca
EDTAH
n
n
n
2
2
2
2
Mg
EDTAH
Ca
n
n
n
g
c
V
c
V
M
m
Mg
Mg
EDTA
EDTAH
CaCl
CaCl
07112
,
0
)
03668
,
0
0166
,
0
025
,
0
05
,
0
(
111
)
(
2
2
2
2
2
2
2
2

Przykład:
Próbkę o masie 2,5505 g rozpuszczono w wodzie, uzyskując 200 cm
3
roztworu. Do
zmiareczkowania 50 cm
3
tego roztworu wobec czerni eriochromowej, zużyto 18,0 cm
3
roztworu EDTA
o stężeniu 0,0250 mol · dm
-3
, a do zmiareczkowania 50 cm
3
roztworu wobec mureksydu, zużyto
10,0 cm
3
tego samego roztworu wersenianu. Oblicz procentową zawartość magnezu w próbce.
Kompleksometria
Dane:
m
Mg
+ m
Ca
= 2,5505g
V
kolby
= 200 cm
3
V
pipety
= 50 cm
3
V
1
(EDTAH
2
2-
) = 18 cm
3
V
2
(EDTAH
2
2-
) = 10 cm
3
c(EDTAH
2
Na
2
) = 0,02500 mol/dm
3
M
Mg
= 24 g/mol
M
Ca
= 40 g/mol
Należy obliczyć:
% Mg = ?
Rozwiązanie:
2
2
2
2
Ca
EDTAH
n
n
2
2
2
2
1
Mg
Ca
EDTAH
n
n
n
4
,
2
10
5
,
2
025
,
0
01
,
0
2
EDTA
EDTA
Ca
c
V
n
1.
CE---Mg
2+
+
CE---Ca
2+
+ EDTAH
2
2–
=
CE
+ Mg---EDTAH
2
+ Ca---EDTAH
2
2. MU
---
Ca
2+
+ EDTAH
2
2–
= MU + Ca---EDTAH
2
4
,
1
10
5
,
4
025
,
0
018
,
0
2
2
EDTA
EDTA
Mg
Ca
c
V
n
n
g
M
n
m
Mg
Mg
Mg
2
4
10
92
,
1
24
10
0
,
2
4
50
200
4
10
2
Mg
n
75
,
0
100
5505
,
2
10
92
,
1
100
5505
,
2
%
2
Mg
m
Mg
Wyszukiwarka
Podobne podstrony:
Cz VII Analiza ilosciowa
analiza ilosciowa 6 id 60541 Nieznany (2)
analiza ilosciowa 2 id 60539 Nieznany
Analiza ilosciowa substancji farmakopealnych metoda bromianometryczna
Projekt I Analiza ilościowa i jakościowa rynku
Test sprawdzający Z. Hak, VII, VII Analizy ilościowe i graficzne przedstawienie wyników
Cwiczenie nr 10 Analiza ilościowa Alkacymetria Oznacznie weglanow i wodoroweglanow
Analiza ilościowa
Obliczenia statystyczne w chemicznej analizie ilościowej
04 Wykonywanie analiz ilosciowy Nieznany (2)
Chemiczne metody analizy ilościowe śr leczniczych Rajzer
Instrukcje analiza ilościowa
IDENTYFIKACJA I ANALIZA ILOŚCIOWA IAA ASPARAGINIANU hplc
analiza ilosciowa A8 alkacymetria
Analiza ilosciowa
Cz 11 Instrumentalne metody analizy ilościowej Wysokosprawna chromatografia cieczowa (HPLC)
Analiza ilościowa-objętościowe oznaczanie kwasów i zasad, Energetyka, I rok, chemia
Klasyczna analiza ilościowa
M Deka,M Turowska Laboratorium Analizy Ilościowej
więcej podobnych podstron