
Wstęp
Kolagen jest podstawowym bia³kiem organizmu ludzkie-
go, dominuje w tkance ³¹cznej, która jest podstaw¹ biernego
uk³adu narz¹du ruchu - koœci, œciêgien i wiêzade³.
Tkanka ³¹czna odró¿nia siê od innych tkanek szeregiem
specyficznych cech morfologicznych i biochemicznych. Naj-
bardziej typowym jej atrybutem jest du¿a zawartoœæ sk³adni-
ków pozakomórkowych, które mo¿na je podzieliæ na cztery
podstawowe grupy. S¹ to: kolageny róznych typów, prote-
oglikany, elastyna oraz glikoproteiny strukturalne
Ogólne informacje o kolagenie
Kolagen jest bia³kiem pozakomórkowym, stanowi oko³o
1/3 wszystkich bia³ek ludzkiego organizmu. Wykazuje szereg
specyficznych cech w zakresie sk³adu chemicznego oraz bu-
dowy przestrzennej. Oko³o 30% reszt aminokwasowych ko-
lagenu stanowi glicyna, a oko³o 20-25% stanowi¹ cykliczne
iminokwasy: prolina i hydroksyprolina. Na szczególn¹ uwa-
gê zas³uguje obecnoœæ hydroksyproliny, który to iminokwas
niezwykle rzadko wystêpuje w innych bia³kach zwierzêcych.
Glicyna jest rozmieszczona równomiernie na ca³ej d³ugoœci
³añcucha bia³kowego, dlatego te¿ kolagen mo¿e byæ rozpatry-
wany jako polimer tripeptydu Gly-X-Y, gdzie w pozycji
X wystêpuje prolina lub hydroksyprolina. W kolagenie w nie-
wielkich iloœciach wystêpuj¹ aminokwasy aromatyczne
i siarkowe.
Obecnoœæ du¿ej liczby reszt prolilowych i hydroksyproli-
lowych sprawia, ¿e ³añcuchy kolagenowe nie tworz¹ typowej
dla wiêkszoœci bia³ek alfa helisy. Uk³adaj¹ siê one w struktu-
rê trihelikaln¹, charakterystyczn¹ niemal¿e wy³¹cznie dla ko-
lagenu. £añcuchy kolagenowe s¹ bardziej rozci¹gniête w kie-
runku osiowym ni¿ ³añcuch bia³kowy tworz¹cy alfa helisê.
Z tego powodu kolagen nie wytwarza wi¹zañ wodorowych
pomiêdzy zwojami tego samego ³añcucha. Wi¹zania wodoro-
we powstaj¹ pomiêdzy grupami C=O proliny i grupami
N-H glicyny s¹siednich ³añcuchów.
Jednostk¹ strukturaln¹ kolagenu jest tropokolagen, z³o¿o-
ny z trzech ³añcuchów polipeptydowych, zwanych podjed-
nostkami. Cz¹steczki tropokolagenu mog¹ byæ homotrimera-
mi, z³o¿onymi z trzech identycznych podjednostek, lub hete-
rotrimerami zawieraj¹cymi dwie jednakowe i jedn¹ inn¹,
albo zawieraj¹cymi trzy ró¿ne podjednostki.
Bia³ka kolagenowe, oprócz charakterystycznych domen tri-
helikalnych, posiadaj¹ w swojej budowie fragmenty nie objê-
te struktur¹ potrójnej helisy. Fragmenty te ró¿ni¹ siê sk³adem
i sekwencj¹ aminokwasow¹ od czêœci trihelikalnej. Mog¹ one
wystêpowaæ na koñcach cz¹steczki tropokolagenu, b¹dŸ te¿
przedzielaæ strukturê trihelikaln¹. W niektórych kolagenach
stanowi¹ kilka procent ich masy, w innych obejmuj¹ przewa-
¿aj¹c¹ czêœæ cz¹steczki tropokolagenu.
Trihelikalna struktura tropokolagenu chroni to bia³ko przed
dzia³aniem wiêkszoœci enzymów proteolitycznych. N-koñco-
we i C-koñcowe fragmenty cz¹steczki tropokolagenu, zwane
telopeptydami nie s¹ objête struktur¹ potrójnej helisy i s¹ po-
datne na dzia³anie wiêkszoœci proteinaz.
Polimorfizm molekularny kolagenu
Kolagen jest bia³kiem niejednorodnym. Istnieje co naj-
mniej 27 genetycznie odrêbnych typów tego bia³ka. Ró¿ni¹
siê one sk³adem podjednostkowym, mas¹ cz¹steczkow¹,
sk³adem i sekwencj¹ aminokwasow¹, stopniem hydroksylacji
i glikozylacji oraz struktur¹ przestrzenn¹.
Tabela I przedstawia kolageny ró¿nych typów i ich sk³ady
podjednostkowe.
Ze wzglêdu na wspólne cechy budowy i wytwarzane struk-
tury przestrzenne kolageny mo¿na podzieliæ na kilka grup.
S¹ to:
- kolageny tworz¹ce w³ókna
- kolageny tworz¹ce mikrow³ókna
- kolageny wystêpuj¹ce na obrze¿ach w³ókien
- kolageny b³onowe
- kolagen kotwicz¹cy
Kolageny tworzące włókna
Kolageny tworz¹ce w³ókna maj¹ zbli¿on¹ budowê cz¹-
steczki. Podstawowa cz¹steczka - tropokolagen ma d³ugoœæ
oko³o 300 nm. Fragment trihelikalny sk³ada siê z oko³o 330
powtarzaj¹cych siê sekwencji Gly-X-Y. Szereg cz¹steczek
tropokolagenów zachodzi „dachówkowato” na siebie z prze-
suniêciem o 1/4 d³ugoœci, w ten sposób obszary homologicz-
ne s¹siednich cz¹steczek le¿¹ naprzeciw siebie. W mikrosko-
pie elektronowym daje to efekt poprzecznego pr¹¿kowania
w³ókien kolagenowych. Struktura w³ókien jest stabilizowana
przez miêdzycz¹steczkowe wi¹zania poprzeczne. Struktury
takie tworz¹ kolageny typu I, II, III, V oraz kolagen typu XI.
Kolagen typu I
Kolagen typu I jest najlepiej poznanym bia³kiem kolageno-
wym. Stosunkowo dobrze rozpuszcza siê w roztworach soli
obojêtnych i rozcieñczonych kwasach. W wyniku denaturacji
termicznej rozpada siê na podjednostki 1(I) i 2(I),
które mo¿na rozdzieliæ metod¹ chromatografii na kolumnie
z karboksymetyloceluloz¹ lub metod¹ elektroforezy na ¿elu
Roczniki Naukowe Wy¿szej Szko³y Wychowania Fizycznego i Turystyki w Supraœlu - 2006
Kolagen - podstawowe białko organizmu ludzkiego
Krzysztof Janusz Sobolewski
Wy¿sza Szko³a Wychowania Fizycznego i Turystyki w Supraœlu
5
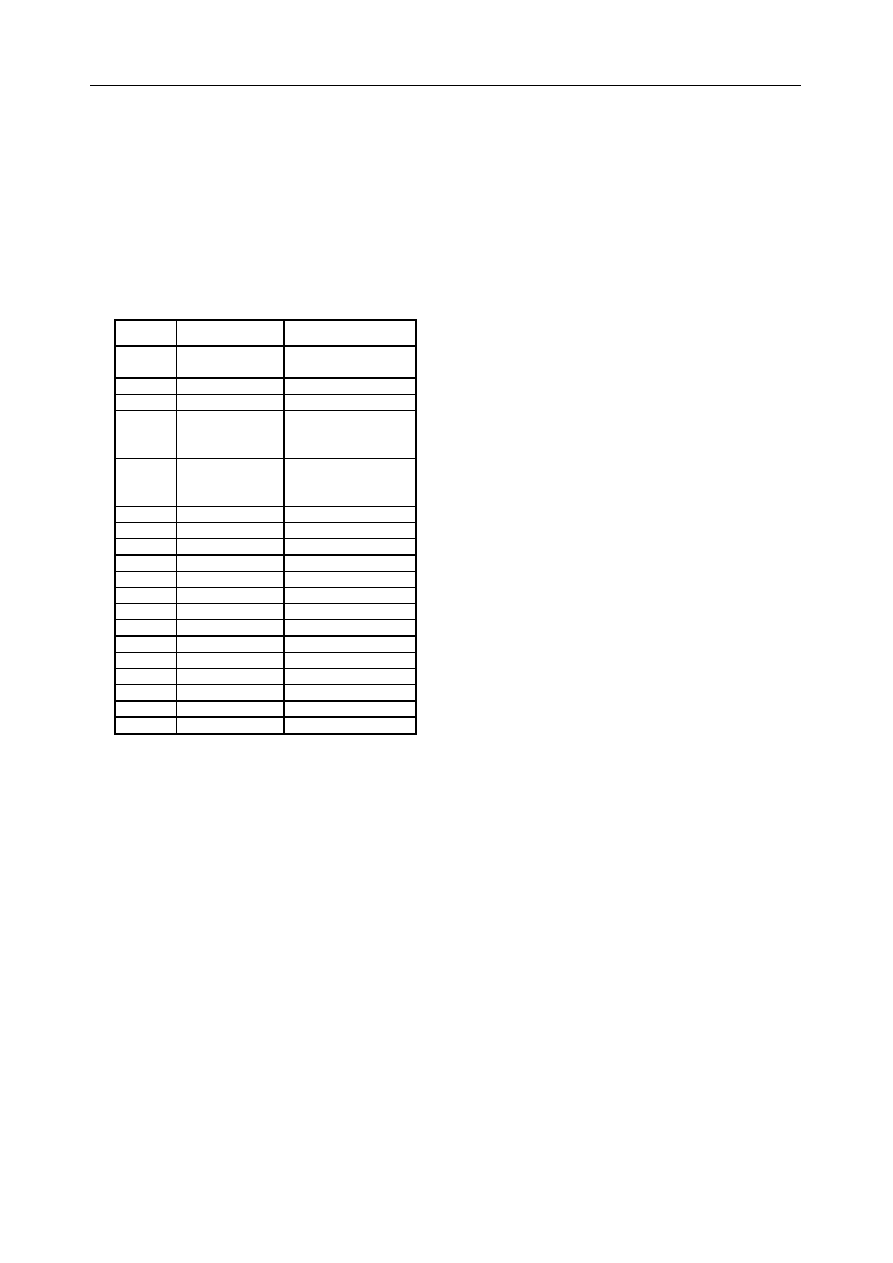
poliakryloamidowym w obecnoœci siarczanu dodecylosodo-
wego. Kolagen typu I jest g³ównym typem tego bia³ka, domi-
nuje w œciêgnach, skórze, koœciach i têtnicach.
Kolagen typu II
Kolagen typu II wystêpuje wy³¹cznie w chrz¹stce i sk³ada
siê z trzech jednakowych podjednostek 1 typu II. W porów-
naniu z kolagenem typu I cechuj¹ siê one wiêksz¹ zawarto-
œci¹ hydroksylizyny i hydroksylizylopochodnych glikozy-
dów, przy równoczeœnie mniejszej zawartoœci lizyny.
Charakterystyczn¹ cech¹ kolagenu typu II jest tworzenie w³ó-
kien o ma³ej œrednicy, o du¿ej sprê¿ystoœci i odpornoœci na
obci¹¿enie.
Kolagen typu III
Kolagen typu III towarzyszy kolagenowi typu I. Jest bia³-
kiem trudno rozpuszczalnym. Ograniczona proteoliza pepsy-
n¹ zwiêksza jego rozpuszczalnoœæ. Cz¹steczka tropokolagenu
sk³ada siê z trzech jednakowych podjednostek 1 typu III.
Ka¿da z nich zawiera po 2 reszty cysteiny, pomiêdzy którymi
wystêpuj¹ miêdzy³añcuchowe mostki disiarczkowe. Stosu-
nek iloœciowy kolagenu typu III do kolagenu typu I decyduje
o œrednicy w³ókien. Stwierdzono, ¿e w³ókna o wysokiej za-
wartoœci kolagenu typu III cechuj¹ siê ma³¹ œrednic¹. Pozwa-
la to przypuszczaæ, ¿e kolagen tego typu reguluje gruboœæ
w³ókien kolagenowych.
Kolagen typu V
Bia³ko to podobnie jak kolagen typu III, z regu³y towarzy-
szy kolagenowi typu I. Sk³ad aminokwasowy tego kolagenu
odbiega od sk³adu kolagenów innych typów. Niewielka za-
wartoœæ alaniny i du¿a liczba reszt hydroksylizyny upodabnia
go do kolagenu b³on podstawnych. Z drugiej strony brak cy-
steiny oraz stosunkowo ma³a zawartoœæ hydroksyproliny czy-
ni¹ go podobnym do kolagenu typu I. Sk³ad podjednostkowy
kolagenu typu V jest niejednorodny. Mo¿e on sk³adaæ siê
z trzech jednakowych podjednostek 1, z dwóch podjednostek
1 i jednej 2 lub trzech ró¿nych podjednostek 1, 2, 3 typu V.
Wraz ze wzrostem zawartoœci tego kolagenu we w³óknach
maleje ich œrednica.
Kolagen typu XI
Kolagen typu XI wystêpuje wy³¹cznie w chrz¹stce. Two-
rzy wspólne w³ókna z kolagenem typu II. Kolagen ten sk³ada
z trzech ró¿nych podjednostek , z których dwie zbli¿one s¹
pod wzglêdem sk³adu aminokwasowego do podjednostek
kolagenu typu V, a jedna - do podjednostki kolagenu typu II.
Kolageny obrzeży włókien
Na obrze¿ach w³ókien kolagenowych, w niewielkich ilo-
œciach wystêpuj¹ kolageny innych typów, charakteryzuj¹ce
siê nieci¹g³¹ struktur¹ potrójnej helisy. Okreœla siê je skróto-
wo nazw¹ FACIT: „Fibril-associated collagens with interrup-
ted triple-helices”. Ich cz¹steczki maj¹ kilka obszarów potrój-
nie helikalnych, przerywanych obszarami o innej strukturze
przestrzennej. Do grupy tej nale¿¹ kolageny typu IX, XII,
XIV i XVI.
Kolagen typu IX wystêpuje wy³¹cznie w chrz¹stce, towa-
rzyszy kolagenowi typu II. Wystêpuje w miejscu krzy¿owa-
nia siê w³ókien kolagenu typu II. Jest heterotrimerem, sk³ada
siê z trzech ró¿nych podjednostek typu IX. Jedna z nich jest
noœnikiem kowalencyjnie zwi¹zanego ³añcucha glikozoami-
noglikanowego.
Kolagen typu XII jest homotrimerem. Posiada dwa obsza-
ry trihelikalne, jeden z nich wi¹¿e kolagen typu I. Koniec
aminowy ka¿dej podjednostki tworzy odrêbny obszar globu-
larny, co nadaje cz¹steczce tego bia³ka kszta³t krzy¿a.
Kolagen typu XIV ma budowê zbli¿on¹ do kolagenu typu
XII. Sk³ada siê z trzech jednakowych podjednostek 1 typu
XIV.
Kolagen tworzący mikrowłókna
Jest heterotrimerem z³o¿onym z trzech ró¿nych podjed-
nostek 1, 2, 3 typu VI. Krótki fragment trihelikalny wystê-
puje w œrodku cz¹steczki. Globularne fragmenty N- koñcowe
i C- koñcowe stanowi¹ oko³o 70% masy cz¹steczki. Kolagen
typu VI wydzielany jest do przestrzeni pozakomórkowej
w postaci dimerów lub tetramerów. Tworzy cienkie mikro-
w³ókna, bez poprzecznego pr¹¿kowania.
Kolageny błonowe
Kolagen typu IV
Kolagen typu IV jest g³ównym sk³adnikiem b³on podstaw-
nych. Bia³ko to jest prawie ca³kowicie nierozpuszczalne ze
wzglêdu na liczne wi¹zania z innymi sk³adnikami b³on pod-
stawnych. Kolagen typu IV sk³ada siê z podjednostek, zawie-
Typ kolagenu
Podjednostki
Sk³ad podjednostkowy cz¹steczki
I
α1(I), α2(I)
[
α1(I)]
2
α2(I)
[
α1(I)]
3
II
α1(II)
[
α1(II)]
3
III
α1(III)
[
α1(III)]
3
IV
α1(IV), α2(IV), α3(IV)
α4(IV), α5(IV), α6(IV)
[
α1(IV)]
2
α2(IV)
[
α3(IV)]
2
α4(IV)*
[
α5(IV)]
2
α6(IV)*
V
α1(V), α2(V), α3(V)
[
α1(V)]
3
[
α1(V)]
2
α2(V)
α1(V)α2(V)α3(V)
VI
α1(VI), α2(VI), α3(VI)
α1(VI)α2(VI)α3(VI)
VII
α1(VII)
[
α1(VII)]
3
VIII
α1(VIII), α2(VIII)
[
α1(VIII)]
2
α2(VIII)*
IX
α1(IX), α2(IX), α3(IX)
α1(IX)α2(IX)α3(IX)
X
α1(X)
[
α1(X)]
3
XI
α1(XI), α2(XI), α3(XI)
α1(XI)α2(XI)α3(XI)
XII
α1(XII)
[
α1(XII)]
3
XIII
α1(XIII)
[
α1(XIII)]
3
*
XIV
α1(XIV)
[
α1(XIV)]
3
XV
α1(XV)
[
α1(XV)]
3
*
XVI
α1(XVI)
[
α1(XVI)]
3
*
XVII
α1(XVII)
[
α1(XVII)]
3
*
XVIII
α1(XVIII)
[
α1(XVIII)]
3
*
XIX
α1(XIX)
[
α1(XIX)]
3
*
* prawdopodobny sk³ad podjednostkowy cz¹steczki
Tab. 1. Polimorfizm molekuklarny kolagenu
Roczniki Naukowe Wy¿szej Szko³y Wychowania Fizycznego i Turystyki w Supraœlu - 2006
6

raj¹cych po oko³o 1700 reszt aminokwasowych, tworz¹cych
du¿y fragment globularny w pobli¿u koñca karboksylowego.
Sk³ad podjednostkowy kolagenu tego typu jest bardzo zró¿-
nicowany. Poznano co najmniej 6 podjednostek typu IV, wy-
stêpuj¹cych w ró¿nych, wzajemnych kombinacjach. D³ugoœæ
odcinka potrójnie helikalnego wynosi oko³o 390 nm, a struk-
tura trihelikalna nie jest ci¹g³a. Cz¹steczki kolagenu typu IV
wi¹¿¹ siê ze sob¹ koñcami aminowymi i karboksylowymi
tworz¹c typow¹ dla siebie sieæ przestrzenn¹, w oczkach któ-
rej lokalizuj¹ siê inne sk³adniki b³on podstawnych.
Kolagen typu VIII
Wystêpuje g³ównie w b³onie Descemeta. Jest heterotrime-
rem, sk³ada siê z ró¿nych podjednostek typu VIII. W porów-
naniu z kolagenami innych typów posiada podjednostki
o mniejszych masach cz¹steczkowych. W obszarze trihelikal-
nym wystêpuj¹ odcinki o innej strukturze przestrzennej. Cz¹-
steczka tego bia³ka przyjmuje kszta³t pa³eczki z domenami
globularnymi na obu koñcach. Szeœæ cz¹steczek kolagenu ty-
pu VIII ³¹czy siê tymi domenami, tworz¹c charakterystyczn¹
sieæ przestrzenn¹.
Kolagen tworzący włókna kotwiczące
Kolagen typu VII tworzy w³ókna kotwicz¹ce. Cz¹steczka
tego bia³ka sk³ada siê z trzech jednakowych podjednostek
1 typu VII. W porównaniu z innymi kolagenami zawiera
mniej glicyny i alaniny, wiêcej cysteiny oraz waliny. W³ókna
kolagenu typu VII wnikaj¹ bezpoœrednio do b³on podstaw-
nych, dlatego te¿ zasadnicz¹ rol¹ tego bia³ka jest wi¹zanie
b³on podstawnych do otaczaj¹cego podœcieliska.
Kolageny innych typów
Kolagen typu X jest homotrimerem. Wykazuje podobn¹
budowê do kolagenu typu VIII. Wystêpuje w chrz¹stkach
w po³¹czeniu z kolagenem typu II. Kolageny typu XIII, XV,
XVII, XVIII i XIX s¹ ma³o poznane. Charakteryzuj¹ siê licz-
nymi fragmentami nie objêtymi struktur¹ potrójnej helisy.
S¹ one obecnie przedmiotem intensywnych badañ.
Biosynteza i posttranslacyjna modyfikacja
kolagenu
Kolagen syntetyzowany jest przez komórki wed³ug ogól-
nych zasad biosyntezy bia³ka. Synteza ³añcuchów kolagenu
zachodzi na polisomach zwi¹zanych z b³onami siateczki en-
doplazmatycznej. £añcuchy te posiadaj¹ na koñcu amino-
wym hydrofobowy fragment peptydowy, zwany sekwencj¹
sygna³ow¹, typowy dla bia³ek sekrecyjnych. Sekwencja sy-
gna³owa umo¿liwia cz¹steczce prokolagenu translokacjê
przez b³ony szorstkiej siateczki endoplazmatycznej.
Produkt translacji - prokolagen podlega specyficznym, po-
sttranslacyjnym modyfikacjom, które mo¿na podzieliæ na na-
stêpuj¹ce etapy:
- hydroksylacjê niektórych reszt prolilowych i lizylowych
- glikozylacjê niektórych reszt hydroksylizylowych
- wytworzenie struktury trihelikalnej
- proteolityczn¹ konwersjê prokolagenu do tropokolagenu
- wytwarzanie w³ókien (fibrogenezê)
Posttranslacyjna modyfikacja umo¿liwia powstanie struktury
trihelikalnej wewn¹trz komórki oraz umo¿liwia wytworzenie,
poza komórk¹, w³ókien kolagenowych
Degradacja kolagenu
Istniej¹ dwa g³ówne mechanizmy degradacji kolagenu: po-
zakomórkowy i wewn¹trzkomórkowy.
W degradacji pozakomórkowej bior¹ udzia³ specyficzne
metaloproteinazy: kolagenazy, ¿elatynazy, stromelizyny oraz
matrylizyna. Metaloproteinazy „matrix” syntetyzowane s¹
w postaci proenzymów. Zasadnicz¹ rolê w degradacji kolage-
nu pe³ni¹ kolagenazy, dzia³aj¹ce w œrodowisku obojêtnym.
S¹ to najbardziej specyficzne enzymy degraduj¹ce kolagen.
Pod ich dzia³aniem kolageny tworz¹ce w³ókna rozpadaj¹ siê
na dwa wielkocz¹steczkowe fragmenty: tropokolagen A i tro-
pokolagen B. Pierwszy z nich stanowi 3/4, a drugi 1/4 masy
cz¹steczki tropokolagenu. Produkty kolagenolizy ulegaj¹ de-
naturacji termicznej ju¿ w temperaturze organizmu, a trac¹c
trihelikaln¹ strukturê staj¹ siê podatne na dzia³anie nieswo-
istych proteinaz, które trawi¹ je do drobnocz¹steczkowych
peptydów i wolnych aminokwasów. Zidentyfikowano co naj-
mniej trzy kolagenazy: kolagenazê fibroblastów, kolagenazê
neutrofili oraz kolagenazê 3, produkowan¹ przez chondrocy-
ty. Kolagenazy posiadaj¹ zdolnoœæ trawienia kolagenów wy-
twarzaj¹cych w³ókna.
Czêœæ w³ókien kolagenowych, otoczona wypustkami cyto-
plazmatycznymi mo¿e zostaæ wch³oniêta przez komórki na
drodze fagocytozy, gdzie ulega degradacji przy udziale enzy-
mów lizosomalnych, g³ównie katepsyn. Równie¿ w ten spo-
sób, w komórce degradowany jest nowopowsta³y prokolagen.
Znaczenie biologiczne kolagenu
Szczególnie w du¿ych iloœciach kolagen wystêpuje w ko-
œciach, chrz¹stkach, œciêgnach, wiêzad³ach, powiêziach oraz
w skórze. Czyli mo¿na stwierdziæ, i¿ jest podstaw¹ biernego
narz¹du ruchu: koœci i uk³adu stawowo-wiêzad³owego.
Kolagen nie tylko wype³nia przestrzeñ pomiêdzy komór-
kami. Jego zasadnicza funkcja polega na zapewnieniu tkance
wytrzyma³oœci mechanicznej (g³ównie twardoœæ, sztywnoœæ
czy sprê¿ystoœæ). Znaczenie roli kolagenu najlepiej ilustruje
choroba, w której na wskutek wady genetycznej dochodzi do
powstania nieprawid³owego kolagenu. Choroba ta nosi na-
zwê Osteogenesis imperfecta, a osoby dotkniête wymienion¹
chorob¹ charakteryzuj¹ siê nadmiern¹ ³amliwoœci¹ koœci.
Wytrzyma³oœæ mechaniczna koœci tych osób mo¿na porów-
naæ do wytrzyma³oœci mechanicznej kartki, wcale nie naj-
grubszego papieru.
Kolagen uczestniczy w wielu procesach fizjologicznych
jak i patologicznych. Wi¹¿e wodê w tkance, bierze udzia³
w procesach krzepniêcia krwi, w procesach regeneracyjnych
zwi¹zanych z gojeniem siê ran, tworzeniem blizny czy rege-
neracji koœci po z³amaniach.
W ostatnich latach kolagen wykorzystywany jest w prze-
myœle kosmetycznym.
Roczniki Naukowe Wy¿szej Szko³y Wychowania Fizycznego i Turystyki w Supraœlu - 2006
7

Z uwagi na fakt licznych po³¹czeñ kolagenu ze specyficz-
nymi receptorami b³onowymi, bia³ko to wp³ywa na funkcje
licznych komórek. Rezultatem takiego oddzia³ywania mog¹
byæ zró¿nicowane efekty biologiczne, zwi¹zane g³ównie
z procesami wzrostu i ró¿nicowania, adhezji czy migracji ko-
mórek.
Piśmiennictwo
1.
Aumailley M, Gayraud B: Structure and biologi-
cal activity of the extracellular matrix. J Mol Med 76:
253-265, 1998
2.
Bañkowski E: Polimorfizm molekularny kolage-
nu krêgowców. Post Biochem 28: 301-330, 1982
3.
Bañkowski E, Pa³ka J: Polimorfizm molekularny
kolagenu: kolageny typów VI-XII. Post Biochem 35: 397-
413, 1989
4.
Bateman J, Lamande SR, Ramshaw JA: Colla-
gen superfamily. W: Extracellular Matrix 2. (Comper WD-
-ed.) Harwood Academic Publishers GmbH, Amsterdam
1996, 23-67
5.
Brodsky B, Ramshaw JA: The collagen triple-
-helix structure. Matrix Biol 15: 545-554, 1997
6.
Brown JC, Timpl R: The collagen superfamily.
Int Arch Allergy Immunol 107: 484-490, 1995
7.
Burgeson RE, Nimni ME: Collagen types. Mole-
cular, structure and tissue distribution. Clin Orthop 282:
250-272, 1992
8.
Dioszegi M, Cannon P, Van Wart HE: Vertebrate
collagenases. Methods Enzymol 248: 413-431, 1995
9.
Hulmes DJ: The collagen suprafamily - diverse
structures and assemblies. Essays Biochem 27: 49-67,
1992
10.
Kielty CM, Hopkinson I, Grant ME: The colla-
gen family: structure, assembly and organization. W: Con-
nective Tissue and Heritable Disorders. (Royce PM, Stein-
man B-eds.) Wiley-Liss, New York 1993, 103-147
11.
Kuivaniemi H, Tromp G, Prockop DJ: Mutations
in collagen genes: causes of rare and some common dise-
ases in humans. FASEB J 5: 2052-2060, 1991
12.
Mayne R, Brewton RG: New members of the col-
lagen superfamily. Curr Opin Cell Biol 5: 883-890, 1993
13.
Olsen BR: Collagen biosynthesis. W: Cell biolo-
gy of extracellular matrix. (Hay ED-ed.) Plenum Press,
New York and London 1991, 177-220
14.
Parsons SL, Watson SA, Brown PD, Collins HM,
Steele RC: Matrix metalloproteinases. Br J Surg 84: 160-
166, 1997
15.
Pihlajaniemi T, Rehn M: Two new collagen sub-
groups: membrane-associated collagens and types XV
and XVII. Prog Nucleic Acid Res Mol Biol 50: 225-262,
1995
16.
Prockop DJ, Kivirikko KI: Collagens: molecu-
lar, biology, diseases, and potentials for therapy. Annu
Rev Biochem 64: 403-434, 1995
17.
Ruoslahti E: Integrins. J Clin Invest 87: 1-5,
1991
18.
Shaw LM, Olsen BR: FACIT collagens: diverse
molecular bridges in extracellular matrices. Trends Bio-
chem Sci 16: 191-194, 1991
19.
van der Rest M, Garrone R: Collagen family of
proteins. FASEB J 5: 2814-2823, 1991
Roczniki Naukowe Wy¿szej Szko³y Wychowania Fizycznego i Turystyki w Supraœlu - 2006
8
Wyszukiwarka
Podobne podstrony:
PODSTAWY TEORII ORGANIZACJI I ZARZĄDZANIA Konwersatorium 1
PODSTAWY ZARZĄDZANIA ORGANIZOWANIE
organizm ludzki w służbie życia
aminy otrzymywanie, podstawy chemii organicznej
(8) Podstawowe elementy organizowaniaid 1180
11 Podstawy chemii organicznej Profesor Boduszek
004 Podstawy klasyfikacji organizmów
Wpływ niedoboru ruchu na organizm ludzki, kosmetologia, ogólne
rola i podstawowe składniki czynnika ludzkiego w przedsiębio, Ekonomia, ekonomia
podstawy prawne i organizacyjne NBP
Podstawy Prawne i Organizacyjne Oświaty
Podstawy zarządzaia i organizacji zagadnienia
więcej podobnych podstron