
1
wersja z dn. 10.04.2014r.
Niskotemperaturowe zagęszczanie wybranych produktów spożywczych -
wymiana masy
Wprowadzenie
W procesie wymiany masy jeden ze składników mieszaniny płynów jest
przemieszczany z miejsca o wyższym stężeniu do miejsca o mniejszym stężeniu. Procesy
wymiany masy charakteryzują się podobnym przebiegiem do procesów wymiany ciepła, gdyż
substancja jest przenoszona w kierunku spadku stężenia, podobnie jak energia w postaci
ciepła przenoszona jest w kierunku spadku temperatury. Zarówno strumień masy, jak również
ciepła uzależnione są od potencjału i oporu a zależności te są analogiczne do prawa Ohma. W
procesach technologicznych stosowanych w przemyśle spożywczym ruch masy jest
zjawiskiem powszechnym. Kontrola przebiegu procesu wymiany masy podczas przetwarzania
żywności jest niezbędna w celu uzyskania wysokiej jakości produktu gotowego. Procesami, w
których m.in. zachodzi wymiana masy jest proces:
suszenie (woda odparowuje z ciała stałego lub cieczy do otaczającego gazu),
krystalizacja (substancja krystalizowana przechodzi z roztworu do kryształu),
ekstrakcja (składnik lub składniki ekstrahowane przechodzą z ciała stałego lub cieczy
do rozpuszczalnika),
odparowywanie (zagęszczanie) (polega na usunięciu z produktu spożywczego części
wody),
solenie i peklowanie (sól lub mieszanki peklującej przechodzą z roztworu do wnętrza
tkanki),
wędzenie (składniki dymu wędzarniczego wnikają z fazy gazowej do wnętrza ciała
stałego).
Wymiana masy może zachodzić w fazie ciekłej lub gazowej. Ponadto może towarzyszyć jej
zmiana fazy lub wymiana ciepła. Wymiana masy zachodząca w nieruchomym ośrodku lub
poruszającym się z małymi prędkościami odbywa się na drodze dyfuzji molekularnej
(przenoszenia molekularnego) wywołanej bezładnymi ruchami cząsteczek, podobnie jak w
przypadku przewodzenia ciepła. W przypadku, gdy ośrodek porusza się z dużymi
prędkościami wymiana masy zachodzi w wyniku konwekcji. Przenoszenie konwekcyjne
masy wynika z sił ciążenia ziemskiego (konwekcja naturalna) lub z siła działających na
układ z zewnątrz, np. pompa, mieszadło (konwekcja wymuszona).

2
Wymiana masy przez dyfuzję
Molekularne przenoszenie masy (na drodze dyfuzji) występuje w przypadku płynu
pozostającego w spoczynku lub poruszającego się ruchem laminarnym. W warunkach
izobaryczno-izotermicznych siłą napędową procesu przepływu masy jest różnica stężeń, a
gęstość strumienia masy w warunkach ustalonych opisuje pierwsze prawo Fick’a :
(1.)
n
A
=D
A
(
)
gdzie: n
A
– gęstość strumienia masy składnika A w kierunku l, mol/m
2
s); D
A
– współczynnik
dyfuzji składnika A, m
2
/s; c
A
– stężenie składnika A, mol/m
3
; l – odległość, m.
Surowce i produkty przemysłu spożywczego w większości przypadku stanowią
wieloskładnikowe i wielofazowe złożone układy. Jednakże, z punktu widzenia dyfuzji można
je traktować jako dwuskładnikowe (składające się z np. wody i rozpuszczonych w niej
substancji). W rozważaniach dotyczących dyfuzji masy można uwzględniać dyfuzję
pojedynczego składnika lub wszystkich substancji rozpuszczonych, traktowanych
sumarycznie (dyfuzja ekstraktu) w układzie. W przypadku, gdy woda przemieszcza się w
materiale, wówczas ciało stałe traktowane jest jako obojętne (inert) (Lewicki, 2005).
Całkowanie równania I prawa Fick’a w granicach (c
A1
, c
A2
) i (l
1
, l
2
) ma postać:
(2.)
n
A
=
(c
A1
c
A2
)
W przypadku roztworów ciekłych i ciał stałych w rozważaniach wygodniej stosować jest
stężenia poszczególnych składników. Natomiast w przypadku roztworów gazowych powinno
się posługiwać prężnością par składników zamiast ich stężeniem. Przy założeniu, że roztwór
gazowy charakteryzuje się cechami gazu doskonałego, wykorzystując równanie Clapeyrona,
można przedstawić (Lewicki, 2005):
(3.)
c
A
=
gdzie: p
A
– prężność pary składnika A, Pa; R – stała gazowa, J/(mol
); T – temperatura, K.
Opór dyfuzyjny przepływu masy wyliczany jest ze wzoru:
(4.)
n
A
=

3
W związku z tym opór molekularnego przepływu masy w cieczy lub ciele stałym w ujęciu
ogólnym można przedstawić w sposób następujący:
(5.)
R
dyf
Natomiast dla fazy gazowej wyrażony jest wzorem:
(6.)
R
dyf
Dyfuzja nieustalona masy ma miejsce w płynach i ciałach stałych. Rozpuszczanie ciała
stałego, spoczywającego na dnie zbiornika, wypełnionego cieczą jest jednym z przykładów
tego procesu. Gęstość roztworu jest największa przy powierzchni ciała stałego i maleje w
miarę oddalania się od dna zbiornika. W warunkach izotermicznych nie wystąpi konwekcja
naturalna. W przypadku ciał stałych dyfuzja ma z reguły charakter nieustalony. Równania,
które opisują dyfuzję nieustaloną są wyprowadzane metodą bilansowania. Bilans składnika A
w mieszaninie dwuskładnikowej o objętości kontrolnej, z uwzględnieniem możliwości zaniku
składnika lub wytworzenia go w wyniku reakcji chemicznej, otrzymuje się wyrażenie
(Lewicki, 2005):
(7.)
gdzie: r
A
– szybkość tworzenia lub zaniku składnika A w wyniku reakcji chemicznej,
mol/(m
3
s.
W przypadku, gdy nie występują reakcje chemiczne równanie (4.) można uprościć do II
prawa Fick’a, które stanowi podstawę rozwiązania większości zagadnień związanych z
dyfuzją nieustaloną. Najczęściej występuje dyfuzja jednokierunkowa, a warunki początkowe i
brzegowe dopasowywane są do konkretnej sytuacji molekularnej wymiany masy. Równanie
to ma postać (Lewicki, 2005):
(8.)

4
Wymiana masy w wyniku konwekcji
Wymiana masy wewnątrz płynu, pomiędzy płynem i powierzchnią ciała stałego lub
powierzchnią międzyfazową w różnych układach o ograniczonej rozpuszczalności może
zachodzić drodze konwekcji swobodnej (naturalnej) lub wymuszonej. Konwekcja wymuszona
ma miejsce podczas przepływu wywołanego działaniem sił zewnętrznych, natomiast
konwekcja swobodna masy to przepływ spowodowany różnicami gęstości płynu na skutek
różnicy stężeń temperatury (Kaleta i Górnicki, 2009). Przepływ masy w wyniku konwekcji
można wyjaśnić za pomocą modelu warstewkowego oraz modeli penetracyjnych (Lewicki,
2005).
Przenoszenie substancji z głębi fazy płynnej do powierzchni międzyfazowej (lub odwrotnie)
nazywamy procesem wnikania masy.
Przenoszenie substancji pomiędzy dwiema fazami przez powierzchnię rozdziału nazywamy
procesem przenikania masy.
Model warstewkowy (Whitmana) zakłada, że przy powierzchni międzyfazowej znajduje się
bardzo cienka nieruchoma warstwa płynu, w związku z tym jej prędkość równa jest 0.
Natomiast dalsze warstwy płynu poruszają się ruchem laminarnym, tworząc warstwę o
grubości
. Im warstwa położona dale od środka płynu pojawia się i zwiększa się burzliwość
przepływu, w taki sposób, że w odległości
od powierzchni między fazowej nie występuje
różnica stężeń pomiędzy poszczególnymi warstwami (płyn jest wymieszany). Natomiast w
warstwie nieruchomej oraz w podwarstwie Prandtla ruch masy odbywa się na drodze dyfuzji,
zaś stężenie przenoszonego składnika wraz z odległością zmienia się w sposób liniowy,
zgodnie z I prawem Fick’a. Jednym z głównych założeń tego modelu jest to, że całkowity
opór przepływu masy ma miejsce w warstwie zastępczej o grubości
, która obejmuje część
płynu poruszającego się ruchem przejściowym. Ponadto opór przepływu masy na drodze
dyfuzji w warstwie zastępczej jest równy oporowi rzeczywistego wnikania masy na skutek
zarówno procesu dyfuzji, jak i konwekcji (Lewicki, 2005).
Uwzględniając równania (5. ) i (6.):
Opór konwekcyjny wnikania masy w cieczy można wyliczyć ze wzoru:
(9.)

5
Opór konwekcyjny wnikania masy w gazie można wyliczyć ze wzoru:
(10.)
W związku z tym, że nie jest znana grubość fikcyjnej warstwy zastępczej , do obliczeń
wprowadza się współczynnik wnikania masy k, którego odwrotność stanowo opór
konwekcyjnego wnikania masy.
Współczynnik wnikania masy w cieczy wyliczany jest z równania:
(11.)
natomiast współczynnik wnikania masy w gazie:
(12.)
gdzie: k
c
– współczynnik wnikania masy odniesiony do różnicy stężeń, m/s; k
p
–
współczynnik wnikania masy odniesiony do różnicy prężności par, mol/(Pa
m
2
Model penetracyjny (Higby’ego) z modyfikacjami Dankwertsa opiera się na założeniu, że
zawirowania, które maja miejsce wewnątrz płynu, zachodzą również przy powierzchni
międzyfazowej, powodując ciągłe jej odnawianie. Na granicy faz ruch masy odbywa się na
drodze dyfuzji, natomiast zawirowania przenoszą porcje płynu wraz z zawartym w niej
składnikiem do wewnętrznych warstw płynu. W związku z tym, że nie każda porcja
powierzchni międzyfazowej płynu jest odnawiany z taką samą częstotliwością, średni
strumień masy determinowany jest funkcją rozkładu czasu przebywania porcji płynu na
powierzchni (Lewicki, 2005).
Poniższe kryteria bezwymiarowe charakteryzujące ruch masy przez wnikanie masy mogą być
otrzymane na drodze analizy wymiarowej danych doświadczalnych, na podstawie
różniczkowych bilansów ciągłości przepływu strugi oraz ruchu masy, lub/oraz teorii
podobieństwa (Kaleta i Górski, 2009):
6
Liczba Sherwooda (Sh) - charakteryzuje wnikanie masy. Stanowi miarę stosunku
szybkości wnikania masy do szybkości wnikania dyfuzji.
(13.)
Liczba Schmidta (Sc) – opisuje prawdopodobieństwo pól prędkości i stężenia w
przepływającym płynie. Stanowi kryterium podobieństwa właściwości fizycznych
substancji w zjawiskach przenoszenia masy. Jest miarą stosunku szybkości
cząsteczkowego przenoszenia pędu do szybkości dyfuzji.
(14.)
Liczba Grashofa (Gr
m
dyfuzyjna) – opisuje konwekcję swobodną (stężeniową).
Stanowi miarę stosunku siły wyporu powstałej w wyniku różnicy stężeń w różnych
punktach płynu do siły tarcia wewnętrznego.
(15.)
lub
Liczba Reynoldsa (Re)
Ponadto przy opisywaniu zjawisk związanych z przepływem masy uwzględnia się (Kaleta i
Górski, 2009):
Liczbę Fouriera (Fo
m
dyfuzyjna) – jest to kryterium podobieństwa pól stężenia i
opisującej związek pomiędzy szybkością zmiany pola stężenia właściwościami
fizycznymi a wymiarami geometrycznymi.
(16.)
Liczbę Biota (Bim dyfuzyjna) – charakteryzuje wpływ warunków wnikania masy na
powierzchni na przebieg dyfuzji w bryłach. Stanowi miarę stosunku oporu masowego
ciała stałego do oporu masowego płynu.
(17.)
gdzie: D
s
– współczynnik dyfuzji składnika A w ciele stałym A.

7
Liczbę Pécleta (Pe
m
dyfuzyjnej) – opisuje wnikanie masy przy przepływie płynów.
Jest miarą stosunku szybkości konwekcyjnego przenoszenia masy do szybkości
dyfuzji.
(18.)
Jednakże, wykorzystując zasady analogii zjawisk należy pamiętać o poniższych założeniach:
właściwości fizyczne płynu muszą być stałe,
prędkość przepływu masy musi być mała, aby profil prędkości nie był deformowany
w wyniku oddziaływania strumienia masy,
przepływ masy musi odbywać się w układach rozcieńczonych, ze względu na to, że
współczynniki wnikania nie mogą zależeć od stężenia,
wnikanie ciepła nie może przebiegać w obecności wewnętrznych źródeł ciepła,
musi być zachowane pełne podobieństwo geometryczne układów, podobieństwo
przepływów oraz podobieństwo warunków początkowych i brzegowych (Kaleta i
Górski, 2009).
Przepływ masy między fazami – pomiędzy dwoma fazami płynnymi
Przepływ masy pomiędzy dwiema fazami płynnymi ma miejsce, gdy ciecz ma kontakt
z inną cieczą lub gazem. Przy założeniu, że tylko na granicy faz występuje stan równowagi
fizykochemicznej, stężenia składnika po obu stronach granicy faz mogą być powiązane ze
sobą współczynnikiem podziału. Czyli
(19.)
gdzie: c
Af
– stężenie składnika na granicy faz, mol/m
3
; I, II – numery faz.
Gęstość strumienia masy w każdej z faz można wyliczyć z równania:
(20.)
(
)
oraz
(
)

8
Współczynnik przenikania masy opisany jest wzorem:
(21.)
Na podstawie powyższego równania można stwierdzić, że całkowity opór konwekcyjnego
przepływu masy pomiędzy dwoma płynami jest równy sumie oporów wnikania masy po obu
stronach granicy faz. W związku z tym, przy dużej różnicy w wartościach oporów wnikania
masy, o wartości współczynnika przenikania masy decyduje większy opór wnikania (Lewicki,
2005).
Przepływ masy między fazami – pomiędzy fazą płynną a fazą stałą
Przepływ masy pomiędzy fazą płynną a fazą stałą ma miejsce tylko wtedy, gdy ciało
stałe ma kontakt z cieczą lub gazem. Proces wymiany masy ma charakter nieustalony, a
strumień masy jest zmienny w czasie. W związku z tym opis przepływu masy w tym układzie
musi uwzględniać określenie rozkładu stężenia składnika przenoszonego składnika pomiędzy
fazami. Przy założeniu że dyfuzja zachodzi w jednym kierunku (ciało nieskończone), a
współczynnik dyfuzji jest stały można zastosować równanie:
(22.)
Rozwiązanie powyższego równania uzależnione jest od określonych warunków
początkowych i brzegowych, które wynikają ze sposobu prowadzenia procesu.
Odparowywanie
Proces mający na celu usunięcie z roztworu części rozpuszczalnika, który prowadzi do
wzrostu stężenia nielotnych części stałych określane jest mianem zagęszczania lub
odparowywania. Proces ten prowadzony jest w wyparkach próżniowych. Urządzenia te mogą
pracować w układach jedno- lub wielodziałowych. W przypadku aparatów działających w
układzie jednodziałowym odparowanie zadanej ilości rozpuszczalnika następuje w jednym
aparacie (rys.1). Natomiast instalacja wielodziałowa składa się z kilku szeregowo
połączonych aparatów, przy czym proces odparowywania zachodzi w poszczególnych
elementach układu. Niezależnie od rodzaju aparatu i jego konstrukcji wyparki powinny
charakteryzować się:
wysoką intensywnością procesu wymiany ciepła przy ustalonej różnicy temperatury;

9
minimalnymi stratami ciepła do otoczenia;
możliwością rozwinięcia dużej powierzchni wymiany ciepła w jednym aparacie;
skutecznym i ciągłym odprowadzaniem skroplin i gazów nieskraplających się z
komory grzejnej;
ciągłym i skutecznym oddzieleniem kropel cieczy unoszonych przez powstałe opary
dużą kompatybilnością, prostotą konstrukcji i obsługi, jak również czynności
związanych z eksploatacją, czyszczeniem i renowacją.
Dobór konstrukcji wyparki uzależniony jest również od:
właściwości roztworu takich jak: lepkość, skłonność do tworzenia piany, wrażliwość
termiczna, wielkość depresji temperatury, agresywność, rodzaj zanieczyszczeń,
możliwość krystalizacji;
rodzaj czynnika grzejnego, który determinuje uzyskanie odpowiednia wartości
współczynnika wnikania ciepła;
rodzaj tworzywa z jakiego wykonane jest urządzenie.
Rys. 1.Schemat wyparki rotacyjnej
Poszczególne elementy wyparki:
A – kolba okrągłodenna na szlif umieszczona (skośnie) w łaźni grzejnej,
B – łaźnia grzejna, najczęściej wodna ale może być olejowa, termostatowana oraz ogrzewana
elektrycznie,

10
C – zestaw łożysk i zębatek, który umożliwia ruch obrotowy zamocowane kolby
okrągłodennej przez silnik ukryty w korpusie wyparki. Ruch ten wymusza również stałe
obracanie się kolby z odparowywana cieczą, co gwarantuje intensywne i równomierne
ogrzewanie jej przez łaźnie oraz mieszanie cieczy, co bardzo przyspiesza proces jej
odparowywanie.
D i E - umożliwiają podnoszenie i opuszczanie całej konstrukcji szklanej, co pozwala
stosowanie większych i mniejszych kolb z odparowywana cieczą,
F – chłodnica zwrotna, na której skrapla się odparowywana ciecz,
G – odbieralnik, kolba okrągłodenna, w której zbiera się odparowywana ciecz,
H – kran, do którego przyłącza się wąż prowadzący dalej do pompy próżniowej lub wodnej.
Proces parowania cieczy ma miejsce w każdej temperaturze, a jego szybkość
uzależniona jest od różnicy prężności pary na powierzchni roztworu i w otaczającej
przestrzeni. Natomiast praktyczne znaczenie dla procesu zagęszczania ma tylko proces
przeprowadzany w temperaturze wrzenia roztworu. Wrzenie to proces zmiany stanu ciekłego
w stan gazowy w stałej temperaturze, przy prężności pary równej ciśnieniu całkowitemu
występującemu w układzie. Jednakże, nie zawsze zastosowanie wysokiej temperatury jest
możliwe ze względu na obecność termolabilnych składników w zagęszczanym roztworze. W
związku z tym w wielu wypadkach proces odparowywania prowadzi się w urządzeniach
pracujących pod ciśnieniem niższym od atmosferycznego, co pozwala na przeprowadzenie
procesu odparowania poniżej temperatury 100 °C. Dobór parametrów procesu odparowania
oraz właściwy sposób jego przeprowadzenia determinuje jakość produktu finalnego. W
przypadku produkcji soków owocowych powszechnie stosowane jest zagęszczenie w
wyparkach w zakresie temperatur 50-70 °C, co jest możliwe dzięki zastosowaniu obniżonego
ciśnienia. Ponadto zastosowanie niskich temperatur podczas odparowywania determinuje
wysoką jakość uzyskiwanych soków (Cortes i wsp., 2006).
W urządzeniach, w których odparowywanych jest głównie woda stosowane są przede
wszystkim skraplacze bezprzeponowe, skraplające opary w wyniku bezpośredniego
zetknięcia z czynnikiem chłodzącym. W przemyśle spożywczym najczęściej
wykorzystywanym czynnikiem chłodzącym jest woda. W celu obniżenia temperatury
czynnika chłodzącego można wymieszać wodę z glikolem etylenowym (temp. zamarzania -22
°C).
W wyniku procesu odparowywania rozpuszczalnika z roztworu np. wody zachodzi
proces zagęszczania w wyniku, którego ulegają zmianom właściwości fizyczne roztworów.
11
Wielkość zachodzących zmian uzależniona jest od początkowego stężenia substancji
rozpuszczonych. Przede wszystkim w miarę zagęszczania roztworu zwiększa się gęstość i
lepkość, natomiast maleje ciepło właściwe i przewodność ciepła właściwa. Utrudniona
cyrkulacja powoduje, że wartość współczynnika wnikania ciepła maleje, a opór wnikania
ciepła od powierzchni grzejnej do zagęszczanego roztworu rośnie. Ponadto słaba cyrkulacja
może być przyczyną odkładania się osadów na powierzchni grzejnej od strony zagęszczanego
roztworu. Osad charakteryzuje się małą przewodnością cieplną właściwą, co stanowi
przyczynę zwiększenia oporu cieplnego przewodzenia przez ścianę grzejną. W konsekwencji
prowadzi to do obniżenia wartości współczynnika przenikania ciepła w czasie procesu
zagęszczania, co prowadzi do pogorszenia warunków wymiany ciepła w wyparce.
Jedną z przyczyn pogorszenia warunków wymiany ciepła jest występowanie strat
temperaturowych, które warunkowane są zjawiskami fizykochemicznymi zachodzącymi
podczas wrzenia roztworu oraz oporami hydraulicznymi przepływu oparów między działami
w wyparkach wielodziałowych.
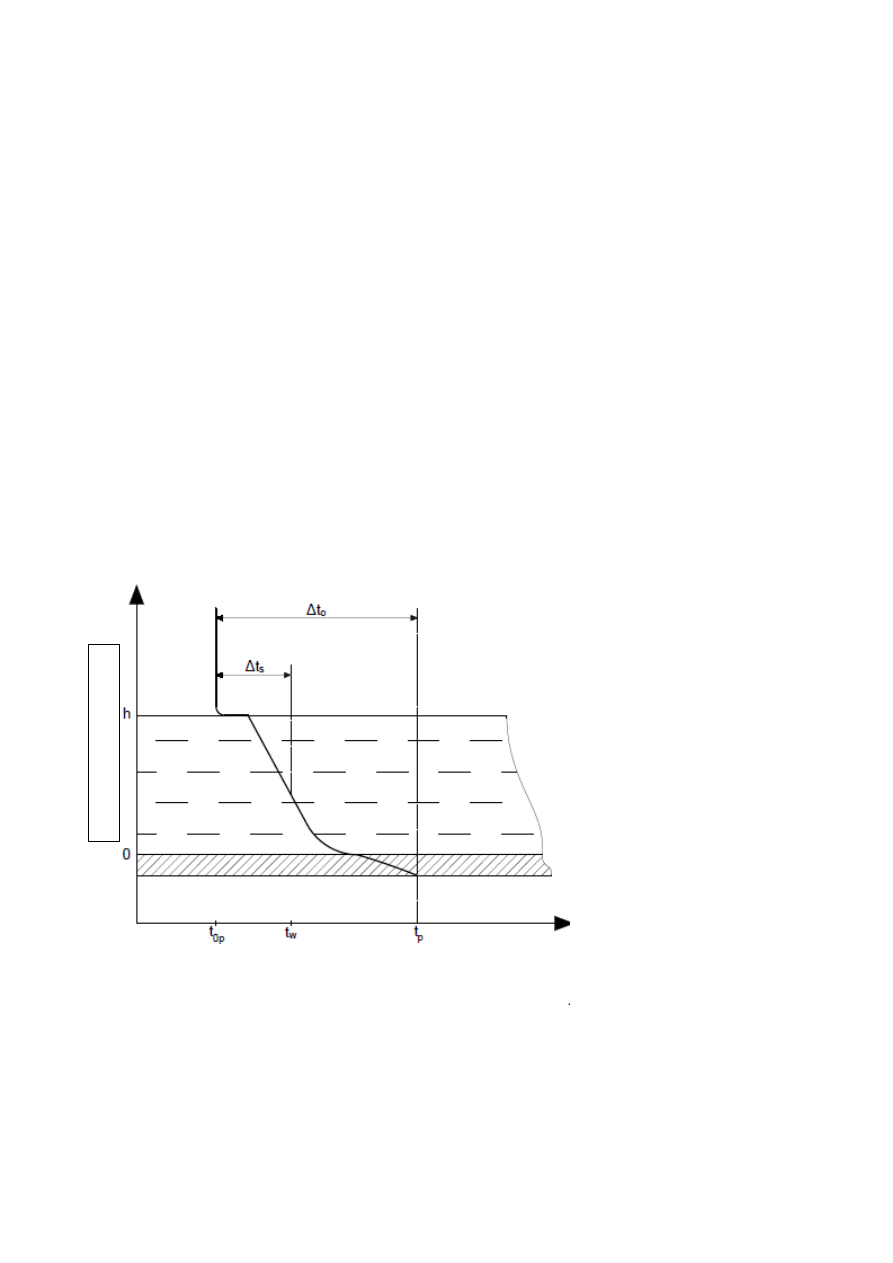
Rys. 2. Rozkład temperatury w zagęszczany roztworze (Witrowa-Rajchert, 2002).
Główną przyczyną strat temperaturowych jest podwyższanie temperatury wrzenia
roztworu ze względu na obecność substancji rozpuszczonych (zgodnie z prawem Raoult’a).
wy
so
ko
ść
w
ar
st
wy
ciec
zy

12
W związku z tym, im stężenie substancji rozpuszczonych w roztworze jest większe, tym
temperatura wrzenia roztworu jest wyższa. W przypadku, gdy temperatura skraplania pary
grzejnej (jako czynnika grzejnego) jest stała, to wzrost temperatury wrzenia prowadzi do
zmniejszenia różnicy temperatury pomiędzy czynnikiem grzejnym a zagęszczanym
roztworem, jak również ograniczenia ilości ciepła dostarczanego do roztworu. Różnica
pomiędzy temperaturą wrzenia roztworu a temperaturą wrzenia czystego rozpuszczalnika
(jednoznaczną z temperaturą oparów gromadzących się nad powierzchnią cieczy, która jest
temperaturą nasycenia pary wodnej przy danym ciśnieniu określana jest jako
fizykochemiczna strata temperatury (rys.2.). Jednakże w przypadku wyparek, w których słup
zagęszczanej cieczy ma wysokość wyższą od 1 m, uwzględnia się tzw. hydrostatyczną stratę
temperatury. Ciśnienie hydrostatyczne słupa cieczy powoduje, że temperatura wrzenia
wewnątrz jest wyższa niż na powierzchni roztworu (większemu ciśnieniu odpowiada wyższa
temperatura wrzenia). Wpływ ciśnienia hydrostatycznego jest tym większy, im niższe
ciśnienie jest stosowane w procesie zagęszczania.
Wyparki jednodziałowe charakteryzują się:
dużym zużyciem ciepła,
stosunkowo długim czasem trwania procesu odparowania,
dużym wykorzystania czynnika chłodzącego.
Zjawiska te, można wyeliminować przy wykorzystaniu wyparek wielodziałowych, które
wykorzystują proces termokompresji oparów, co pozwala uzyskać i utrzymać wyższą
temperaturę czynnika grzejnego od temperatury ogrzewanego roztworu.
Różnica pomiędzy temperaturą czynnika grzejnego (t
p
) a temperaturą wrzenia roztworu (t
w
)
stanowi siłę napędową ruchu ciepła podczas procesu odparowania – użyteczna różnica
temperatury (∆t
uż
). Temperatura ta, jest niższa od ogólnej różnicy temperatury (∆t
0
) ze
względu na występowanie strat temperatury (∆t
s
):
(23.)
∆t
uż
∆t
0
∆t
s
t
p
t
w
Zastosowanie wyparek
Wyparki są bardzo często używanym sprzętem, który przyspiesza wiele prac laboratoryjnych.
Stosuje się je do:
szybkiego zatężania roztworów,

13
suszenia i dosuszania rozmaitych substancji stałych,
regeneracji rozpuszczalników,
odparowywania rozpuszczalników z mieszanin reakcyjnych i ekstrakcyjnych,
szybkiego oddzielania lotnych produktów reakcji od osadów stanowiących produkty
uboczne - zamiast uciążliwej i długotrwałej filtracji,
prowadzenia reakcji równowagowych, które wymagają stałego odprowadzania ze
środowiska lotnych produktów ubocznych.
Stosowane są także w przemyśle spożywczym w celu zagęszczenia substancji, np.:
przemysł mleczarski - zagęszczenie mleka (do 3x),
przemysł owocowo - warzywny :dżemy, marmolady, koncentrat pomidorowy, soki
owocowe,
przemysł koncentratów spożywczych - odżywki, ekstrakty kawy i herbaty,
przemysł cukrowniczy - zagęszczenie soku z buraków,
przemysł cukierniczy - masa karmelowa,
przemysł ziemniaczany - zagęszczanie kwasowych hydrolizatów skrobiowych,
przemysł gorzelniczy - zagęszczanie odcieku z wywaru.
Wyszukiwarka
Podobne podstrony:
wymiana masy, Studia
audyt W2 c wymiana okien id 722 Nieznany (2)
wm sciaga, IŚ Tokarzewski 27.06.2016, IV semestr COWiG, Wymiana Masy, WM XYZ, wykład-wm, Wymiana mas
Obliczanie powierzchni wymiany masy w wybranych typach absorbentow
obliczanie powierzchni wymiany masy
ĆWICZENIE NR 03 - Stopień zagęszczenia gruntów sypkich ID, Mechanika Gruntów
wymiana masy 08 pytania
Analogie pomiędzy wymianą masy i ciepła, Uczelnia, Metalurgia
Klek wymiana ciepla id 236139 Nieznany
oddychanie i wymiana gazowa id Nieznany
Obliczanie powierzchni wymiany masy w wybranych typach absorbentow
obliczanie powierzchni wymiany masy
Lab I Pomiar Masy Instrukcja id 74985
Propozycje pytań na Zaawansowane procesy wymiany ciepła i masy Errata
wymiana ciepla i masy ZAMIANA JEDNOSTEK
wymiana ciepla i masy, przew przen plaska, 1
wymiana ciepla i masy, Własności fizyczne suchego powietrza tablice, Własności fizyczne suchego powi
masy Temat 4 Odrobinska id 7656 Nieznany
więcej podobnych podstron