Copyright by Studium Oświatowe „Tutor”
dr inż. Zdzisław Głowacki, Toruń 2013
ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU
ROZPOCZĘCIA EGZAMINU!
TUTOR
CH-RP 201306
I ogólnopolska próbna matura
„CHEMIA Z TUTOREM”
dla uczniów klas przedmaturalnych
POZIOM ROZSZERZONY
Czas pracy: 150 minut
Instrukcja dla zdającego
1. Sprawdź, czy arkusz egzaminacyjny zawiera 16 stron (zadania 1–26).
Ewentualny brak zgłoś przewodniczącemu zespołu nadzorującego
egzamin.
2. Rozwiązania i odpowiedzi zapisz w miejscu na to przeznaczonym
przy każdym zadaniu.
3. W rozwiązaniach zadań rachunkowych przedstaw tok rozumowania
prowadzący do ostatecznego wyniku. Pamiętaj o jednostkach.
4. Pisz czytelnie. Używaj długopisu / pióra tylko z czarnym tuszem
/ atramentem.
5. Nie używaj korektora, a błędne zapisy wyraźnie przekreśl.
6. Pamiętaj, że zapisy w polu oznaczonym jako brudnopis
nie podlegają ocenie.
7. Możesz korzystać z karty wybranych tablic chemicznych
dopuszczonej przez CKE, jako pomoc egzaminacyjna, linijki oraz
prostego kalkulatora.
8. Uwaga! Jeżeli w treści zadania nie podano inaczej, to wartości
mas atomowych z układu okresowego pierwiastków zaokrąglaj
w obliczeniach do liczb całkowitych, a tylko w przypadku atomu
chloru do części dziesiętnych.
9. Na arkuszu wpisz swój numer PESEL.
Życzymy powodzenia!
12 czerwca 2013 r.
Za rozwiązanie
wszystkich zadań
można otrzymać
łącznie
60 punktów
Wypełnia zdający przed rozpoczęciem pracy
PESEL ZDAJĄCEGO
KOD
ZDAJĄCEGO
2
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
www.tutor.edu.pl
„Tutor”
Toruń, ul. Warszawska 14/2
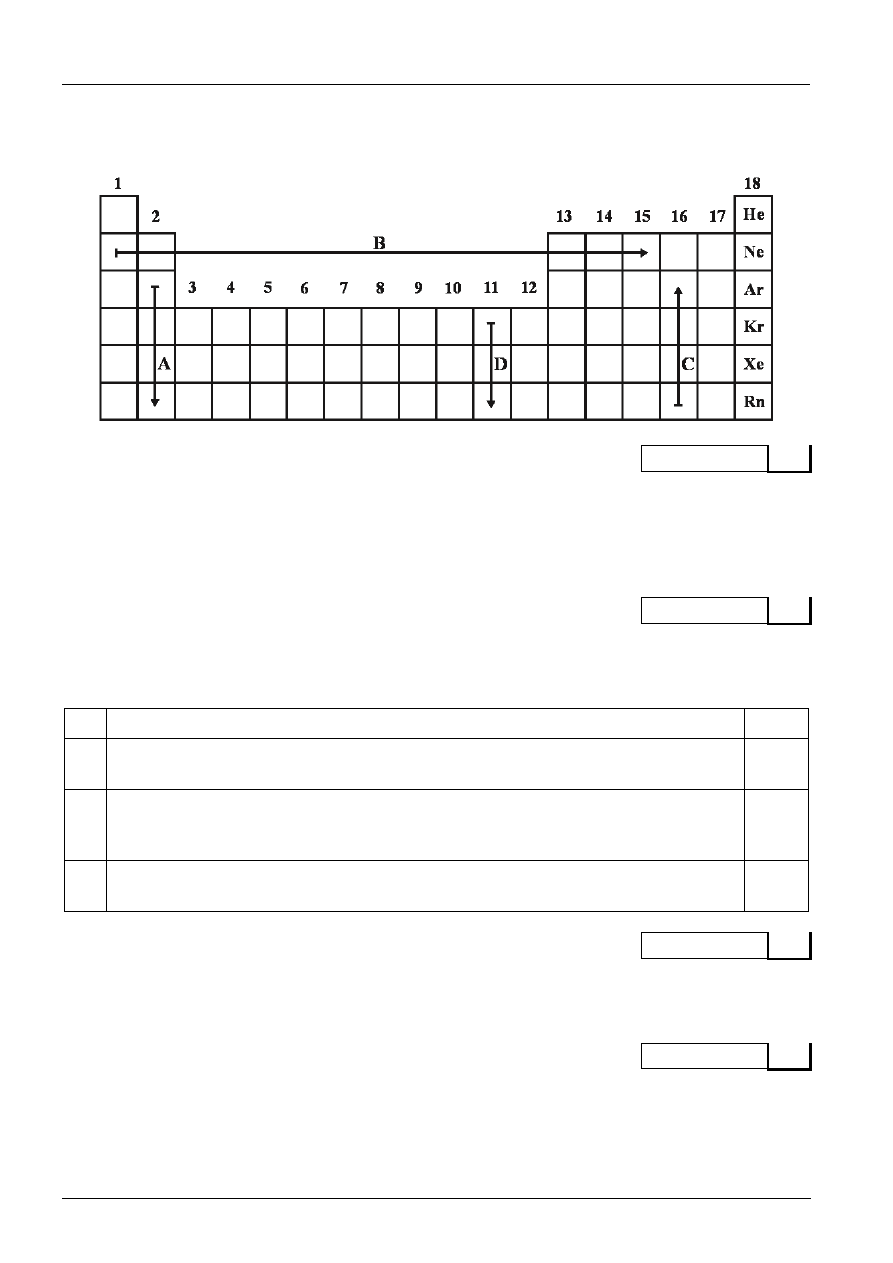
Rysunek do zadań 1., 2., 3. i 4.
Schematyczny rysunek przedstawiający fragment układu okresowego pierwiastków.
Zadanie 1. (1 pkt)
przyznane punkty
Kierunek wzrostu aktywności chemicznej pierwiastków w zaznaczonych strzałkami grupach wskazują
poprawnie strzałki (podkreśl dobre odpowiedzi):
Strzałka A
Strzałka B
Strzałka C
Strzałka D
Zadanie 2. (1 pkt)
przyznane punkty
Oceń prawdziwość stwierdzeń wpisanych do tabeli. Wpisz literę P, jeżeli stwierdzenie jest prawdziwe,
lub literę F, jeżeli jest fałszywe.
Stwierdzenie
P/F
1.
Moc wodorotlenków tworzonych przez pierwiastki z grupy pierwszej i drugiej rośnie
w kierunku wskazanym przez strzałkę A.
2.
Właściwości kwasowe tlenków na najwyższych stopniach utlenienia tworzonych
przez pierwiastki objęte strzałkami B i C rosną zgodnie z kierunkiem wskazywanym
przez te strzałki.
3.
Zgodnie ze strzałką A maleje promień jonowy jonów prostych tworzonych przez te
pierwiastki.
Zadanie 3. (1 pkt)
przyznane punkty
Zaznacz (zamaluj) na schemacie układu pozycję tego pierwiastka z czwartego okresu, u którego
w wyniku promocji elektronowej występuje sześć niesparowanych elektronów walencyjnych.
Zadanie 4. (1 pkt)
przyznane punkty
Wypisz symbole tych strzałek, które w zaznaczonej grupie lub w okresie wskazują poprawnie atomy
pierwiastków uszeregowane wraz ze wzrostem liczby orbitali typu s.
Odpowiedź: ................................................................................................................................................
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
3
www.szkolna.pl
Zadanie 5. (2 pkt)
przyznane punkty
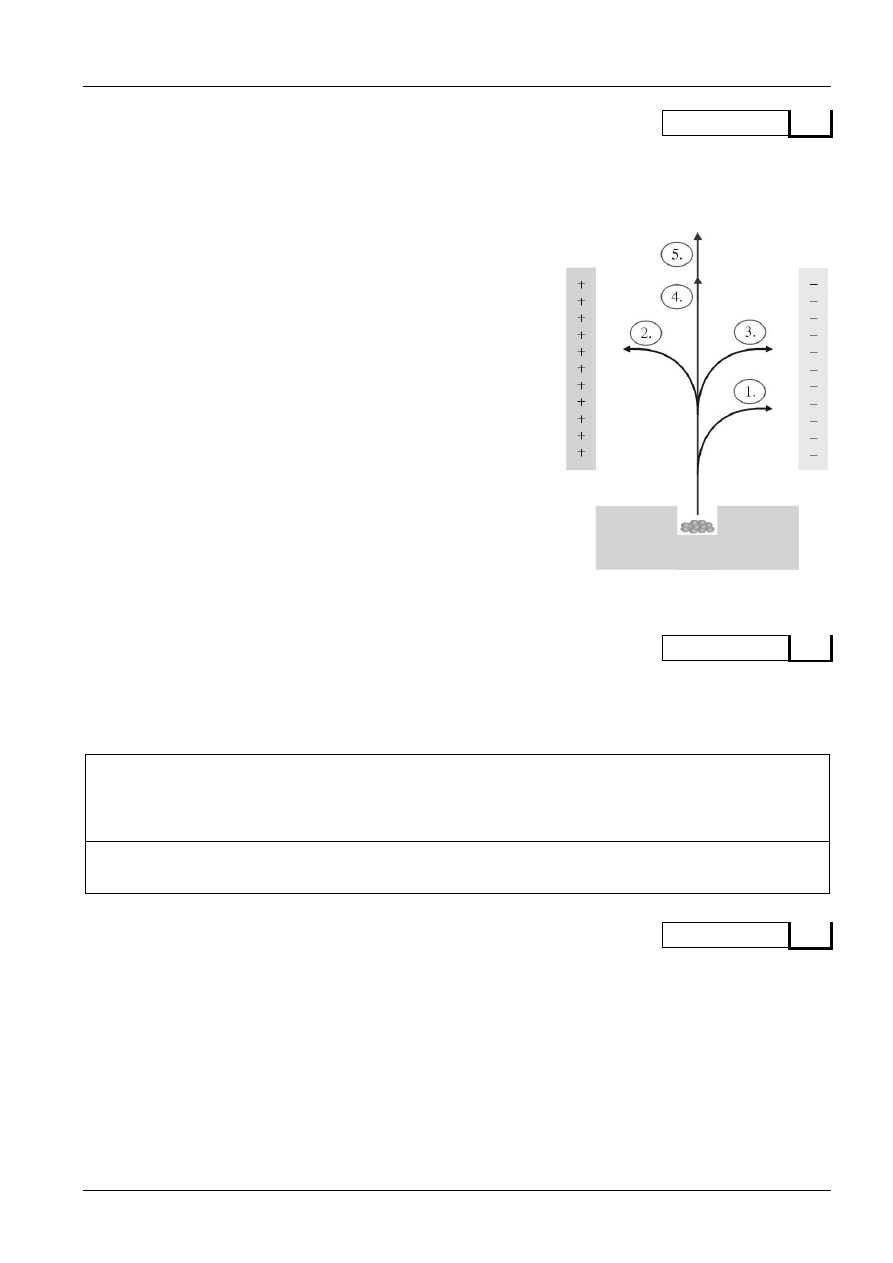
Poniżej przedstawiono rysunek, który ilustruje rodzaje promieniowania, jakie mogą być
zaobserwowane w trakcie przemian jądrowych, oraz zachowanie tego promieniowania w polu
elektrostatycznym. Uzupełnij legendę do rysunku, nazywając i krótko charakteryzując emitowane
wiązki.
1. .................................................................................................
.....................................................................................................
2. .................................................................................................
.....................................................................................................
3. .................................................................................................
.....................................................................................................
4. .................................................................................................
.....................................................................................................
5. .................................................................................................
.....................................................................................................
Zadanie 6. (1 pkt)
przyznane punkty
Okres półtrwania izotopu wodoru –
3
H – trytu wynosi 12 lat. W roku 2000 do pracowni naukowej
zakupiono próbkę tego izotopu o masie 0,1 grama. W którym roku masa tego izotopu wodoru
zmniejszy się do 12,5 mg?
Obliczenia:
Odpowiedź: ...........................................................................................................................................
Zadanie 7. (1 pkt)
przyznane punkty
Wiek niektórych znalezisk archeologicznych można określić na podstawie zawartości w nich izotopu
węgla
14
C, którego okres półtrwania wynosi ok. 5570 lat. Czy korzystając z tej metody, można określić
wiek starożytnego kreteńskiego sarkofagu wykonanego ze skały węglanowej? Odpowiedź uzasadnij.
.....................................................................................................................................................................
.....................................................................................................................................................................
.....................................................................................................................................................................
Rodzaje promieniowania

4
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
www.tutor.edu.pl
„Tutor”
Toruń, ul. Warszawska 14/2
Zadanie 8. (4 pkt)
przyznane punkty
a) Wpisz do tabeli wzory chemicznie i nazwy produktów będących w warunkach normalnych
gazami, które powstaną w reakcjach podanych substratów. Jeżeli produkt gazowy nie powstaje,
wpisz: nie wydziela się.
substraty
produkt gazowy
1. węglan wapnia, kwas solny
2. aluminium, stężony wodorotlenek sodu
3. tlenek magnezu, kwas bromowodorowy
4. miedź, stężony kwas azotowy(V)
5. siarczek potasu, kwas chlorowodorowy
b) Zapisz cząsteczkowo równanie reakcji chemicznej opisanej w pkt 1.
....................................................................................................................................................................
c) Zapisz w sposób jonowy skrócony równanie reakcji chemicznej opisanej w pkt 5.
....................................................................................................................................................................
Zadanie 9. (2 pkt)
przyznane punkty
Do naczynia zawierającego siarczan(VI) miedzi(II) wstawiono blaszkę wykonaną z kadmu. Po
pewnym czasie blaszkę wyjęto i stwierdzono, że jej masa zmalała o 3,2 g. Zapisz jonowo równanie
chemiczne opisujące zachodzące procesy. Ile gramów wynosi masa miedzi osadzonej na blaszce
kadmowej? Masę podaj z dokładnością do dziesiątych części grama.
Równanie reakcji: .................................................................................................................................
Obliczenia:
Odpowiedź: ...........................................................................................................................................
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
5
www.szkolna.pl
Zadanie 10. (2 pkt)
przyznane punkty
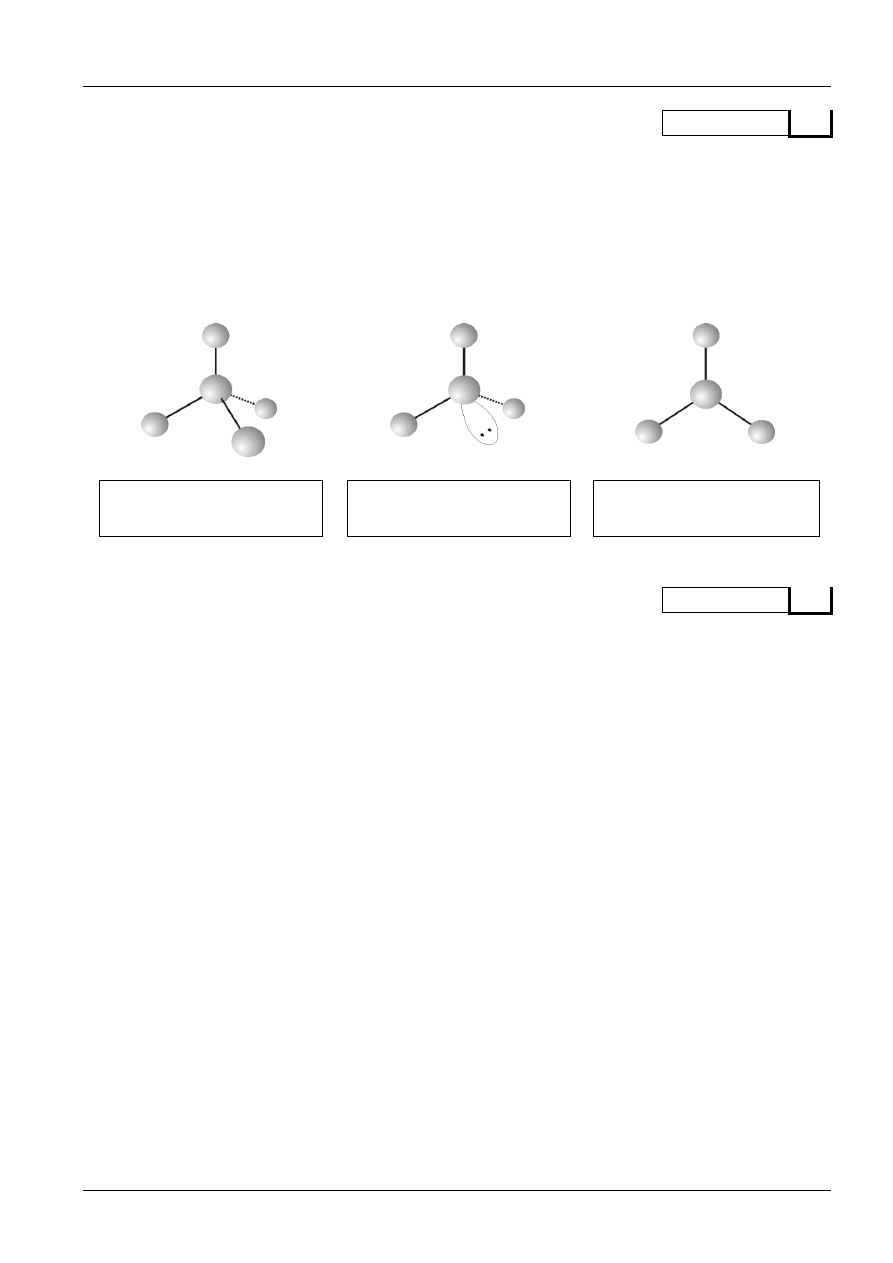
Mając do dyspozycji atomy wodoru, węgla, tlenu, azotu, siarki i chloru, zaproponuj cząsteczki lub
jony geometrią odpowiadające modelom na poniższym rysunku. Pod każdym modelem wpisz wzory
chemiczne dwóch różnych chemicznych indywiduów, które mają analogiczną budowę (patrz
przykład). Każda kulka może odzwierciedlać dowolny atom, proporcje w wielkościach atomów
poszczególnych pierwiastków nie muszą być zachowane. Każda kreska obrazuje dowolne wiązanie
chemiczne (także wielokrotne). Łezka z dwiema kropkami przedstawia wolną parę elektronową.
Przykład.
a)
b)
CH
4
, NH
4
+
Zadanie 11. (5 pkt)
przyznane punkty
Jedną z metod otrzymywania chloru jest działanie stężonego kwasu solnego na stały manganian(VII)
potasu. Jony manganianowe(VII) ulegają w tej reakcji redukcji do kationów Mn
2+
. Napisz równania
jonowo-elektronowe procesów utleniania i redukcji oraz przebieg tej reakcji za pomocą równania
jonowego skróconego.
a) Reakcja utleniania
.....................................................................................................................................................................
b) Reakcja redukcji
.....................................................................................................................................................................
c) Równanie chemiczne opisanej reakcji otrzymywania chloru w formie jonowej skróconej
.....................................................................................................................................................................
6
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
www.tutor.edu.pl
„Tutor”
Toruń, ul. Warszawska 14/2
d) Oblicz, jaką objętość stężonego kwasu solnego (36% masowych, gęstość roztworu d = 1,18 g/cm
3
)
zużyto do wytworzenia 1000 cm
3
gazowego chloru znajdującego się w pojemniku pod ciśnieniem
10 000 hPa w temperaturze pokojowej (25
C). Objętość podaj z dokładnością do 1 cm
3
. Stała
gazowa R = 8,31 J
mol
1
K
1
.
Obliczenia:
Odpowiedź: ...........................................................................................................................................
Zadanie 12. (2 pkt)
przyznane punkty
Dany jest zbiór jonów i cząsteczek:
NO
3
Pb
2+
S
2
O
3
2
NH
3
Fe
2+
SO
3
2
IO
3
a) Które z wymienionych wyżej jonów i cząsteczek mogą być tylko utleniaczami? Otocz kółkiem
wybrane indywidua chemiczne.
b) Wpisz do tabeli poniżej tylko te jony, które są zasadami w myśl teorii Brönsteda oraz dopisz do
nich sprzężone z nimi kwasy. (Uwaga! Nie musisz zapełniać całej tabeli.)
zasady
sprzężone kwasy
Zadanie 13. (1 pkt)
przyznane punkty
Uszereguj zasady sprzężone z podanymi kwasami w kolejności od najsłabszej do najmocniejszej:
HCl, HBr, HClO, HBrO.
....................................................................................................................................................................
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
7
www.szkolna.pl
Zadanie 14. (2 pkt)
przyznane punkty
a) Stała dysocjacji słabego kwasu K = 10
6
. Jaki jest stopień dysocjacji tego kwasu w roztworze
o stężeniu 0,01 mol
dm
3
? Odpowiedź podaj w procentach.
Obliczenia:
Odpowiedź: ...........................................................................................................................................
b) Oblicz pH roztworu kwasu jednoprotonowego o stężeniu 0,001 mol
dm
3
, którego stała dysocjacji
K = 10
7
.
Obliczenia:
Odpowiedź: ...........................................................................................................................................
BRUDNOPIS. Zapisy w brudnopisie nie podlegają ocenie!
8
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
www.tutor.edu.pl
„Tutor”
Toruń, ul. Warszawska 14/2
Zadanie 15. (3 pkt)
przyznane punkty
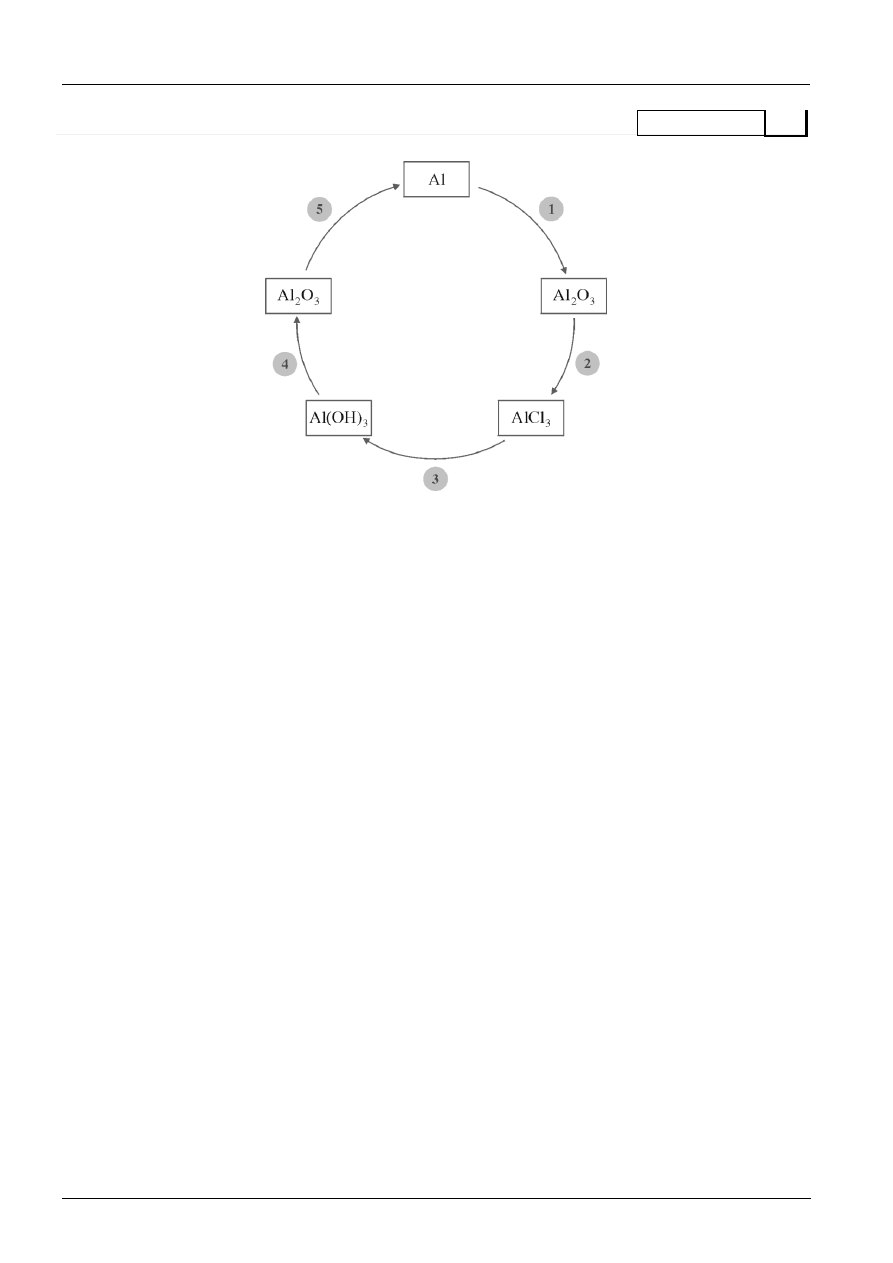
a) Jaką metodą można otrzymać glin z tlenku glinu – proces nr 5 na chemografie obok? Podaj
metodę przemysłową lub zaproponuj własną.
....................................................................................................................................................................
....................................................................................................................................................................
....................................................................................................................................................................
b) Za pomocą równań reakcji chemicznych zapisz przemiany oznaczone numerami 2 i 3
przedstawione na kolistym chemografie.
....................................................................................................................................................................
....................................................................................................................................................................
c) Zapisz równania reakcji chemicznych w formie jonowej skróconej, które wykażą właściwości
amfoteryczne wodorotlenku glinu.
....................................................................................................................................................................
....................................................................................................................................................................
....................................................................................................................................................................
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
9
www.szkolna.pl
Zadanie 16. (5 pkt)
przyznane punkty
Tabela.
Rozpuszczalność bezwodnych soli w g/100 g wody
Wzór
Nazwa soli
0°C
20°C
40°C
60°C
80°C
100°C
KNO
3
azotan(V) potasu
13,6
31,9
62,9
109,0
170,9
242,4
KBr
bromek potasu
53,9
65,1
75,9
86,0
95,2
103,3
a) Przedstaw za pomocą wykresu zmiany rozpuszczalności podanych w tabeli soli w zależności od
temperatury.
b) Odczytaj z wykresu, w jakiej temperaturze rozpuszczalności obu tych soli są równe.
Odpowiedź: ......................................................................................................................................................

10
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
www.tutor.edu.pl
„Tutor”
Toruń, ul. Warszawska 14/2
c) Jaką maksymalną masę bromku potasu można całkowicie rozpuścić w 20 ml wody o temperaturze
70°C?
Obliczenia:
Odpowiedź: ...........................................................................................................................................
d) W 80 g wody rozpuszczono 100 g azotanu(V) potasu i otrzymano roztwór nasycony. O ile stopni
należy oziębić roztwór, żeby wydzieliło się 45 g tej soli?
Obliczenia:
Odpowiedź: ...........................................................................................................................................
Zadanie 17. (4 pkt)
przyznane punkty
500 cm
3
roztworu zawierającego 0,5 mola AgNO
3
zmieszano z roztworem o tej samej objętości
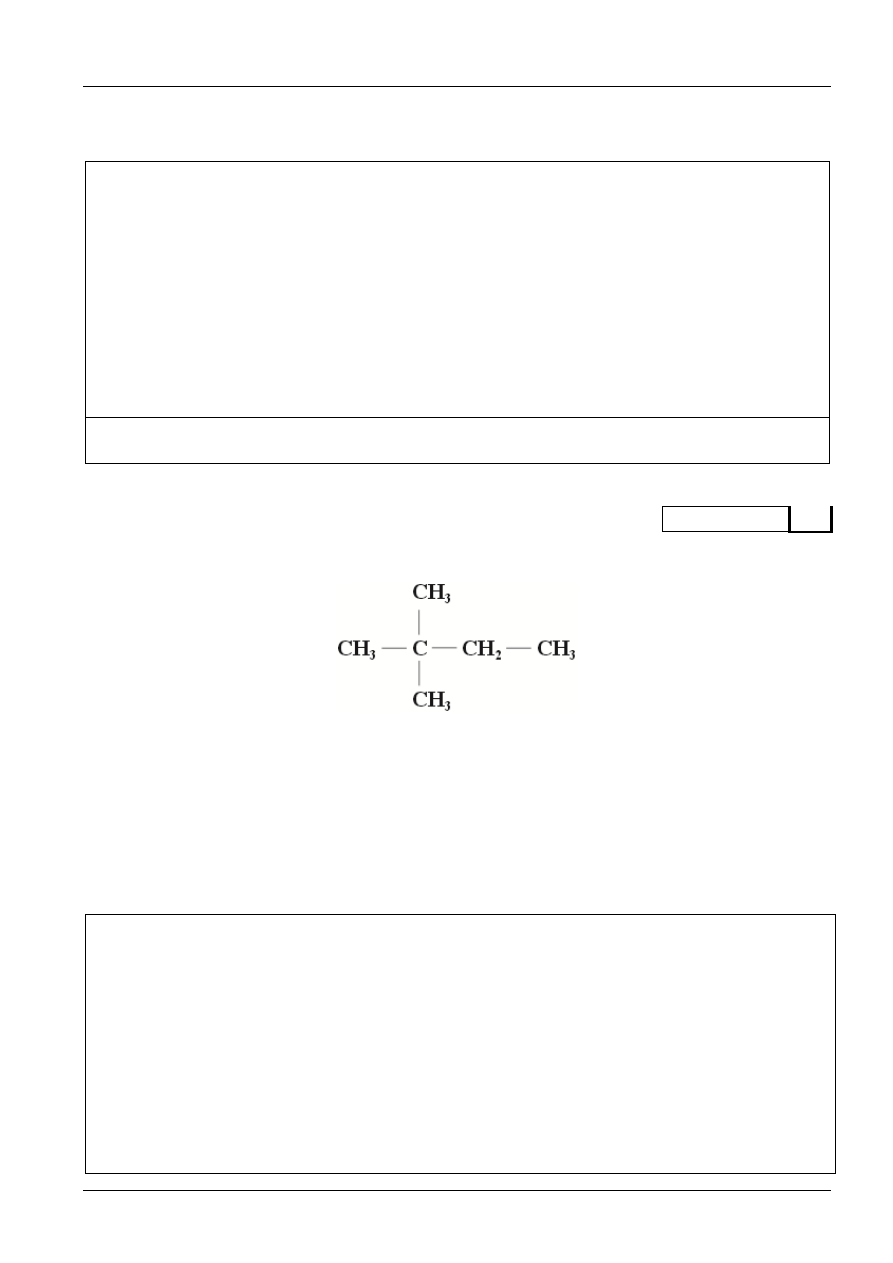
zawierającym 1 mol NaCl.
a) Napisz w formie jonowej skróconej równanie reakcji.
............................................................................................................................................................................
b) Uszereguj jony, pochodzące z dysocjacji soli, zgodnie z ich rosnącym stężeniem w tym roztworze.
............................................................................................................................................................................
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
11
www.szkolna.pl
c) Ile gramów osadu utworzy się w wyniku reakcji? Oblicz, w przybliżeniu, jaka liczba jonów srebra
pozostanie w roztworze. Iloczyn rozpuszczalności AgCl wynosi Ir = 10
10
.
Obliczenia:
Odpowiedź: ...........................................................................................................................................
Zadanie 18. (2 pkt)
przyznane punkty
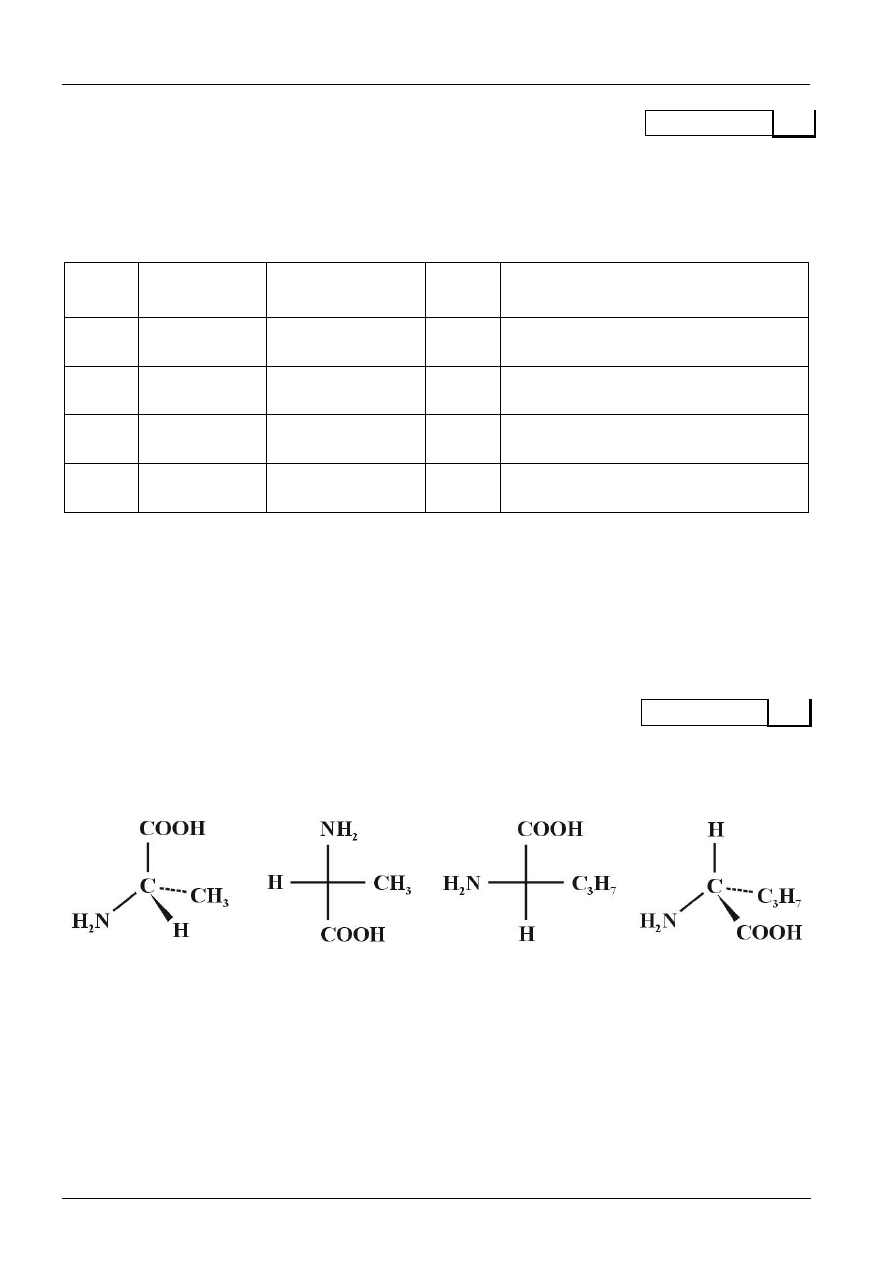
Przeprowadzono wolnorodnikowe chlorowanie alkanu o podanej na rysunku strukturze.
a) Ile różnych monochloropochodnych, będących izomerami, można otrzymać w tej reakcji? Zwróć
uwagę na możliwość występowania izomerów optycznych.
.....................................................................................................................................................................
b) Narysuj ich wzory półstrukturalne i podaj ich nazwy systematyczne.
wzory półstrukturalne
nazwy systematyczne
12
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
www.tutor.edu.pl
„Tutor”
Toruń, ul. Warszawska 14/2
Zadanie 19. (3 pkt)
przyznane punkty
Poniżej wpisano do tabeli nazwy ośmiu związków pogrupowanych w cztery pary. Które pary
związków nie stanowią wobec siebie izomerów? W przypadku gdy związki te są izomerami, określ,
jaki rodzaj izomerii występuje pomiędzy nimi. Wypisz z tabeli nazwy związków, które są optycznie
aktywne.
nr pary
związek I
związek II
izomery
tak/nie
rodzaj izomerii
I
etanol
eter dimetylowy
II
kwas etanowy
metanian metylu
III
2-metylopentan 2,3-dimetylopentan
IV
glukoza
sacharoza
Związkami optycznie aktywnymi są: ........................................................................................................
....................................................................................................................................................................
Zadanie 20. (1 pkt)
przyznane punkty
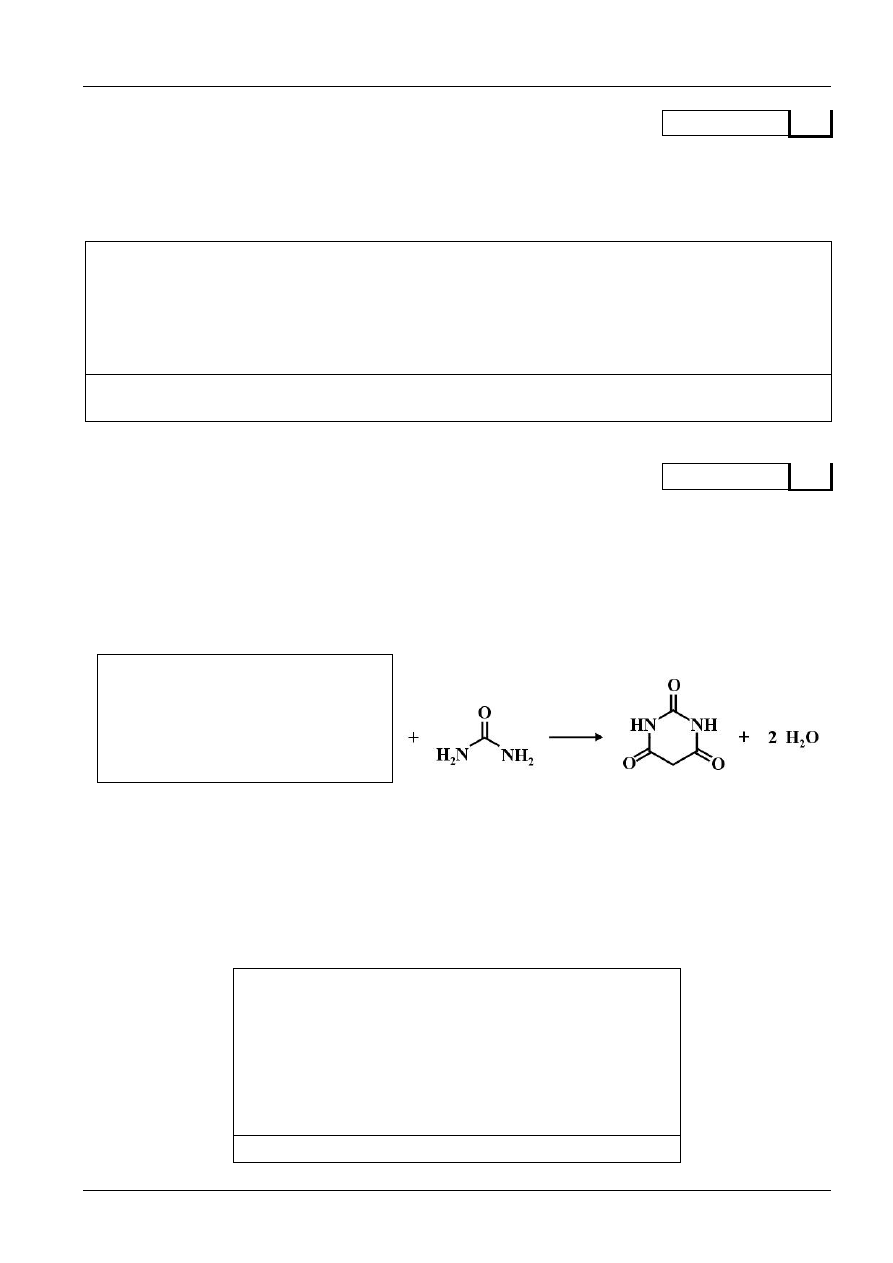
Wskaż, które aminokwasy należą do szeregu konfiguracyjnego L, a które do D.
A.
B.
C.
D.
Odpowiedź: Do szeregu L należy(ą) …………..….., a do szeregu D należy(ą) …….……………….. .
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
13
www.szkolna.pl
Zadanie 21. (2 pkt)
przyznane punkty
W wyniku analizy elementarnej stwierdzono, że próbka 100 mg związku zawiera 40 mg węgla, 6,7 mg
wodoru oraz 53,3 mg tlenu. Podaj wzór półstrukturalny oraz nazwę najprostszego estru o najniższej
masie cząsteczkowej, który mógłby w wyniku analizy wykazać taki sam skład jak badany związek.
Obliczenia:
Odpowiedź: ...........................................................................................................................................
Zadanie 22. (3 pkt)
przyznane punkty
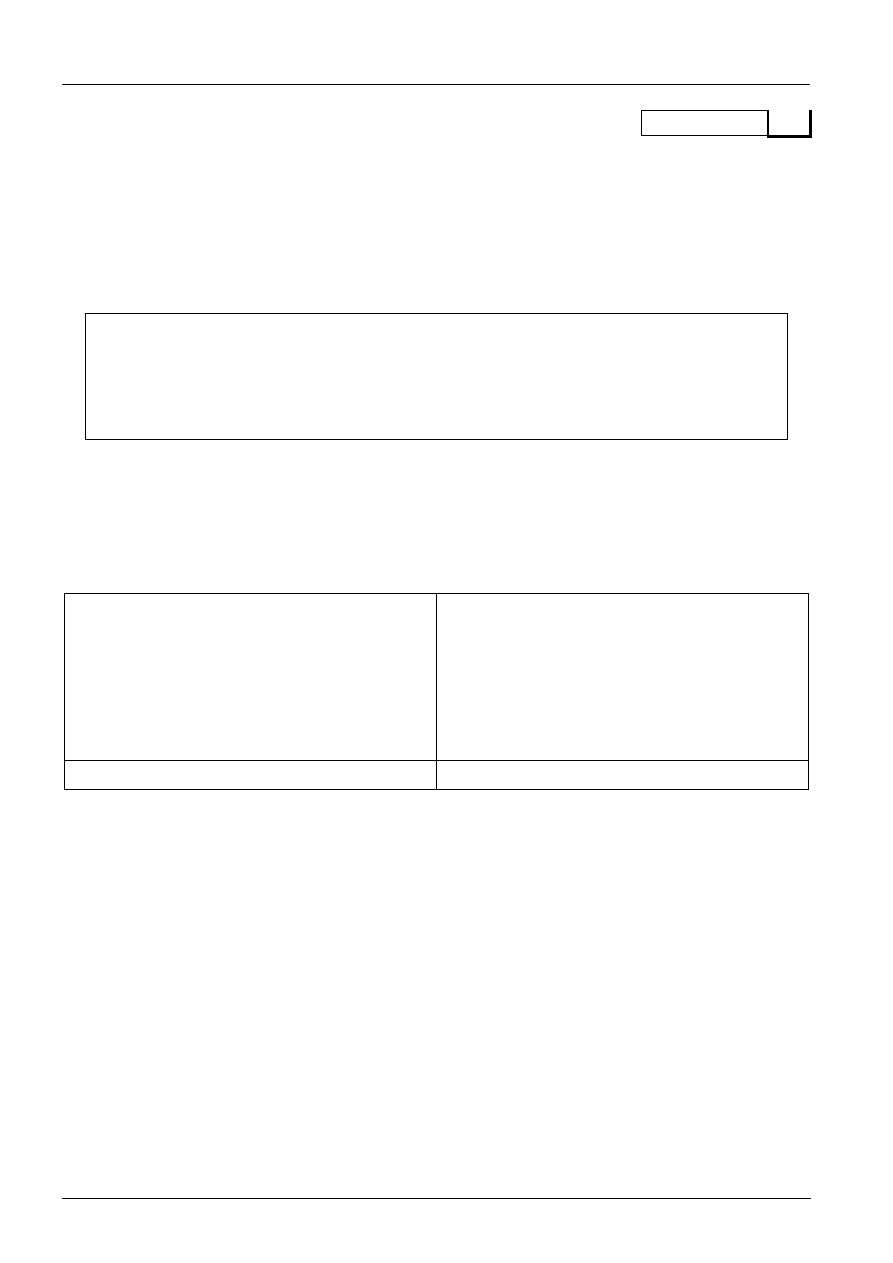
W grudniu 1864 roku Adolf von Baeyer otrzymał nowy związek chemiczny, który ku pamięci pewnej
Barbary, nazwał kwasem barbiturowym. Kwas barbiturowy to organiczny związek chemiczny,
heterocykliczny amid występujący w kilku formach tautomerycznych. Pochodne kwasu barbiturowego
nazywane są barbituranami. Stosuje się je powszechnie jako środki nasenne.
Reakcję i wzór półstrukturalny kwasu barbiturowego ilustruje poniższy rysunek (niestety
niekompletny).
nazwa: ………………………………….
kwas barbiturowy
…………………………………………
a) Narysuj w oznaczonym polu powyżej wzór półstrukturalny brakującego substratu oraz podaj jego
nazwę systematyczną.
b) Narysuj w oznaczonym polu dowolną odmianę tautomeryczną tego kwasu.
odmiana tautomeryczna kwasu barbiturowego
14
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
www.tutor.edu.pl
„Tutor”
Toruń, ul. Warszawska 14/2
Zadanie 23. (5 pkt)
przyznane punkty
Fenyloalanina – kwas 2-amino-3-fenylopropanowy – należy do podstawowych aminokwasów,
z których zbudowane są białka i peptydy. Tak jak wszystkie inne aminokwasy posiada wysoką
temperaturę topnienia. Wysoka temperatura topnienia wskazuje m.in. na występowanie tych
cząsteczek w postaci wewnętrznych soli
anion tworzy grupa karboksylowa, a kationem jest
protonowana grupa aminowa.
a) Narysuj wzór półstrukturalny fenyloalaniny w postaci soli wewnętrznej.
b) Przeprowadzono reakcję kondensacji naturalnej L-fenyloalaniny. W mieszaninie poreakcyjnej
stwierdzono obecność dipeptydów prostych (liniowych) oraz cyklicznych. Zapisz wzór
półstrukturalny dipeptydu, który może powstać w wyniku kondensacji dwóch cząsteczek
fenyloalaniny połączonych jednym wiązaniem peptydowym, oraz wzór półstrukturalny cząsteczki
cyklicznego dipeptydu zawierającego dwa wiązania peptydowe. Zaznacz na rysunku wiązania
peptydowe.
dipeptyd liniowy
dipeptyd cykliczny
c) Czy każdy z tych dipeptydów może występować w postaci soli wewnętrznej? Odpowiedź
uzasadnij.
....................................................................................................................................................................
....................................................................................................................................................................
d) Czy oba dipeptydy będą cząsteczkami optycznie aktywnymi? Odpowiedź uzasadnij.
....................................................................................................................................................................
....................................................................................................................................................................
....................................................................................................................................................................
© dr inż. Zdzisław Głowacki
Oficyna Wydawnicza „Tutor”
15
www.szkolna.pl
Zadanie 24. (2 pkt)
przyznane punkty
Wpisz do tabelki odczyn, jaki wykaże wodny roztwór aminokwasu lub pochodnej aminokwasu.
aminokwas lub pochodna aminokwasu
odczyn
1.
alanina (punkt izoelektryczny = 6,02)
2.
kwas glutaminowy (punkt izoelektryczny = 3,22)
3.
sól sodowa fenyloalaniny
Zadanie 25. (2 pkt)
przyznane punkty
Do 0,3 dm
3
roztworu glukozy o stężeniu 15% i gęstości 1,2 g/cm
3
dodano 200 g 20% roztworu
sacharozy o gęstości 1,2 g/cm
3
oraz enzym inwertazę w celu przyspieszenia hydrolizy sacharozy.
Roztwór dopełniono wodą do objętości 1 dm
3
. Oblicz całkowite stężenie molowe glukozy w tym
roztworze, wiedząc, że sacharoza uległa całkowitej hydrolizie. Wynik podaj z dokładnością do części
tysięcznych mol/dm
3
.
Obliczenia:
Odpowiedź: ...........................................................................................................................................
BRUDNOPIS. Zapisy w brudnopisie nie podlegają ocenie!
16
I ogólnopolska próbna matura „Chemia z Tutorem” dla uczniów klas przedmaturalnych
www.tutor.edu.pl
„Tutor”
Toruń, ul. Warszawska 14/2
Zadanie 26. (2 pkt)
przyznane punkty
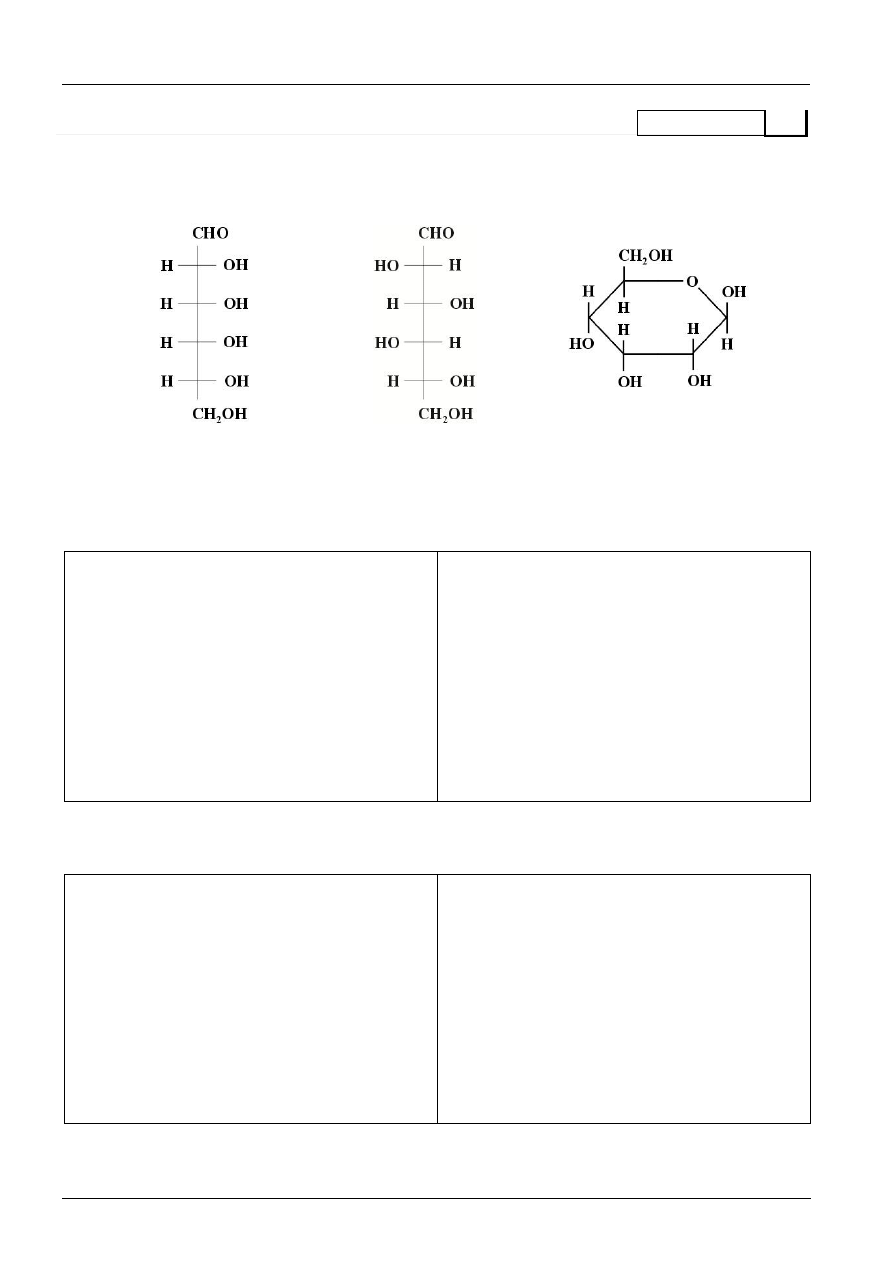
Rysunek poniżej przedstawia wzory D-(+)-allozy w projekcji Fischera i Hawortha oraz D-(
)-idozy
w projekcji Fischera.
D-(+)-alloza
D-(
)-idoza
D-(+)-allozopiranoza
anomer
Narysuj wzory półstrukturalne:
a) L-(
)-allozy w projekcji Fischera
b) anomeru β-D-(
)-idozopiranozy
c) dwóch głównych produktów reakcji D-(
)-idozy z alkoholem metylowym w obecności HCl.
Reakcji ulegają cząsteczki w formie pierścieniowej, produktami w tej reakcji są acetale.
KONIEC ARKUSZA. DZIĘKUJEMY!
Wyszukiwarka
Podobne podstrony:
chemia z tutorem arkusz 12 06 2013
chemia z tutorem odpowiedzi 12 Nieznany
Grupa2 Kolokwium 12 06 2013
Botanika 12 06 2013
wykład 7 (12 06 2013) ES mięśni prądem średniej częstotliwości
arkusz 2 opm chemia z tutorem 12 06 2014 klasy przedmaturalne
arkusz 2 opm chemia z tutorem 12 06 2014 klasy przedmaturalne
logistyk 06 2013 praktyczny arkusz
05 OZE 2013 12 06 sk
05 OZE 2013 12 06 en
eksploatacji portow i terminali 06 2013 arkusz
MPLP 376;377 12.06.;24.06.2013
logistyk 06 2013 praktyczny arkusz
eksploatacji portow i terminali 06 2013 arkusz
2013 12 06 Droga do piekła
2013 12 06 Awantura po wykładzie gender
rj lato 9 06 2013 tab 12
RJ pociągów międzynarodowych wer C3 od 14 04 08 06 2013 stan na 12 04 2013
więcej podobnych podstron