
StudenciStudentom
DIAGNOSTYKA
LABORATORYJNA
WYKŁADY
Przepraszamy za grafikę…
To nie nasze dzieło, my próbowaliśmy jakąś ją reanimować, ale twórca tego
tekstu zbyt pomotał funkcje Worda.
Ja już osobiście palce mam poobcierane od obróbki graficznej tego tekstu i
bawić się tym dalej nie mam zamiaru…
Oddaję to tak, jak teraz jest – tzn. bardziej ekonomicznie niż oryginał ☺

Diagnostyka laboratoryjna – wykłady
1/32
Diagna – Wykład 1
Tryb życia, a zdrowie
Papierosy
Negatywne skutki palenia:
zwiększona agregacja płytek
zwiększone wytwarzanie tromboksanu A
zwiększona synteza katecholamin
wzrost
ciśnienia tętniczego krwi
zwiększone ryzyko wystąpienia migotania komór
zwiększenie stężenia HbCO
podniesienie poziomu LDL
obniżenie poziomu HDL
Palenie papierosów działa synergistycznie z nadmiernym stresem i zanieczyszczeniem środowiska.
Dużo bardziej niebezpieczne jest palenie bierne, szczególnie jeśli dotyczy dzieci.
Aktywność fizyczna
Korzyści z codziennej, umiarkowanej aktywności fizycznej:
podniesienie poziomu HDL
obniżenie poziomu LDL
obniżenie poziomu TAG
rozbudowa sieci naczyń włosowatych w mięśniu sercowym i innych narządach
zwiększona aktywność fibrynolityczna
zwiększenie o 30% działania insuliny
obniżenie ciśnienia tętniczego krwi
obniżenie częstości skurczów serca
wzmocnienie
odporności humoralnej i komórkowej
Warto tu zaznaczyć, że ciśnienie skurczowe nie powinno przekraczać 130 mmHg (140 mmHg – dopuszczalne),
rozkurczowe 85 mmHg (90 mmHg – dopuszczalne).
Otyłość
Pozytywne efekty otyłości u niewiast po 40 roku życia:
piękno i kobiecy urok (Rubens, Łysiak, Torliński)
ukrywa objawy starzenia się
aromataza – enzym obecny w tkance tłuszczowej (endogenna suplementacja estrogenami)
Negatywne aspekty otyłości:
nadmierna masa ciała
przedwczesne
bóle
kręgosłupa i stawów
przeciążenie układu krążenia
Diagna – Wykład 2
Badania skriningowe – mocz, OB/BOF, morfologia
Mocz
Glukoza w moczu – do 1g/dobę to wynik stresu (katecholaminy) – wynik negatywny.
Bilirubina – test powinien być negatywny.
Ciała ketonowe – bardzo łatwo przechodzą przez błonę komórkową. W określonym pH ciała ketonowe zakwaszają
środowisko. Przy nadmiernym stężeniu ciał ketonowych dochodzi do kwasicy.
Ciężar właściwy moczu zależy od ilości zawartej w nim wody, ilość ta jest bardzo zmienna.
Najbardziej stałym wskaźnikiem opisującym mocz jest zawartość kreatyniny.
Obecność składników morfotycznych krwi – jeśli krwinki są wyługowane to znaczy, że pochodzą z górnych
odcinków układu moczowego, jeżeli pochodzą np. z pęcherza to są „świeże”.
pH – obniżenie pH zależy m.in. od fosforanów; w niskim pH wytrącają się moczany.
Zmętnienie – występuje przy zapaleniach układu moczowego lub w wyniku wytrącania się kryształów moczanów,
fosforanów, węglanów i szczawianów.
Białko (PRO) – u zdrowych ludzi wydalanie białka z moczem nie przekracza 30 mg/dobę. Wydalanie 30 – 300
mg/dobę oznacza tzw. mikroalbuminurię. Świadczy ona o rozwijającej się nefropatii. Nie jest ona wykrywalna w
standardowych testach, wymaga zastosowania metod immunoenzymatycznych.
Urobilinogen (URO) – naturalny barwnik moczu.
Azotany (NIT) – powinny być ujemne.
Leukocyty (LEU) – jak wyżej.
Wersja poprawiona – usunięto
około 20 błędów w stosunku
wersji pierwotnej.
Diagnostyka laboratoryjna – wykłady
2/32
Odczyn Biernackiego (OB)
Wartości referencyjne:
• kobiety – do 12 mm/h i do 20 mm/h po 60 r.ż.
• mężczyźni – do 8 mm/h i do15 mm/h po 60 r.ż.
Przyczyny wzrostu OB:
laboratoryjne:
wzrost
stężenia globulin
spadek
stężenia albuminy
wzrost
stężenia fibrynogenu
spadek liczby RBC
kliniczne:
stany
zapalne
choroba
reumatyczna
nowotwory (ziarnica złośliwa)
ciężkie niedokrwistości
martwica
tkanek
(zawał, uraz)
fizjologicznie
(ciąża, połóg, miesiączka, podeszły wiek)
Podstawowy wpływ na szybkość opadania krwinek ma rozkład białek. Wzrost OB występuje też gdy zmniejszona
jest liczba krwinek czerwonych, wynika to z tego, że błona erytrocytów jest spolaryzowana (ma ładunek ujemny), co
powoduje odpychanie się erytrocytów – mniej krwinek to mniejsze oddziaływanie i przyspieszone opadanie.
OB ma swoje zalety i wady. Z jednej strony jest to tania i czuła metoda monitorowania skuteczności terapii, z
drugiej strony prawidłowe OB nie wyklucza nawet poważnych chorób.
Przy podwyższonym OB zawsze należy ustalić przyczynę tego stanu.
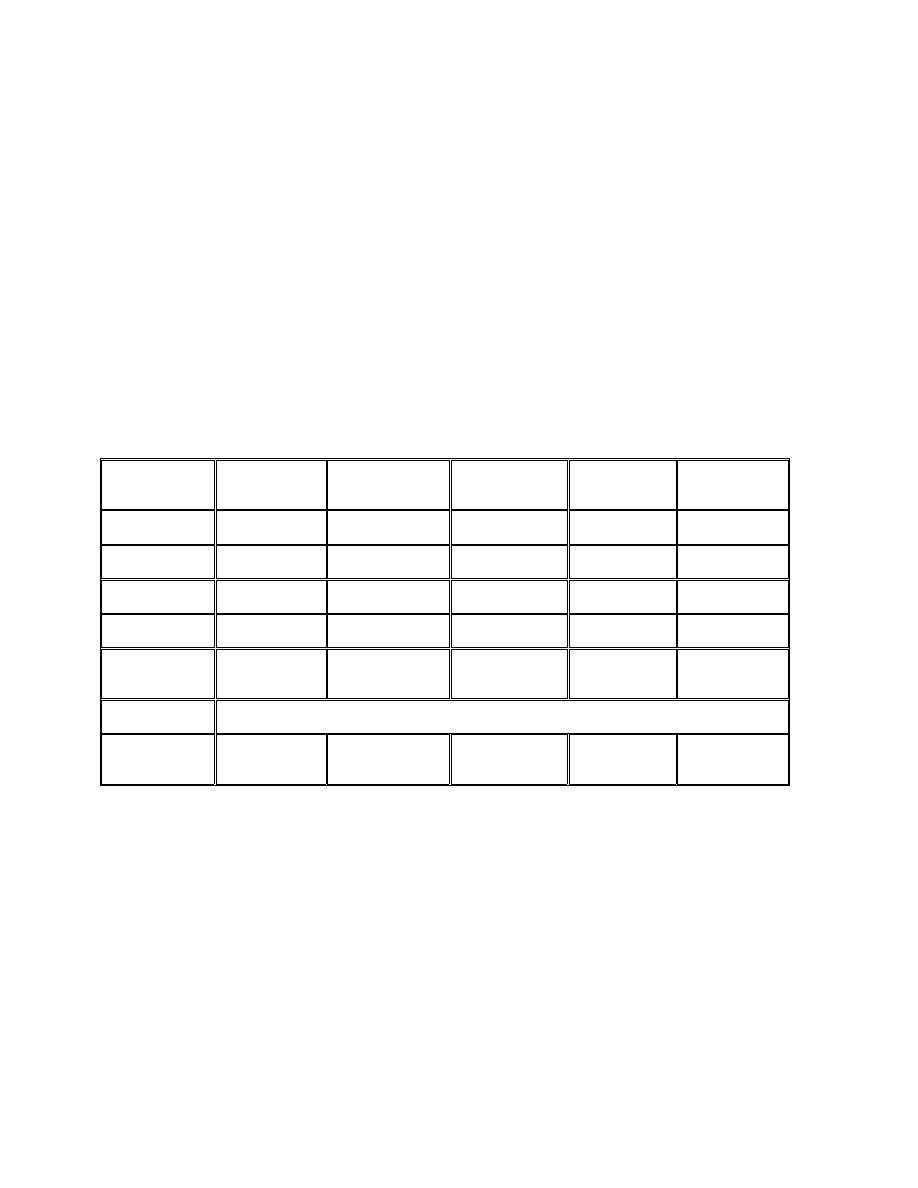
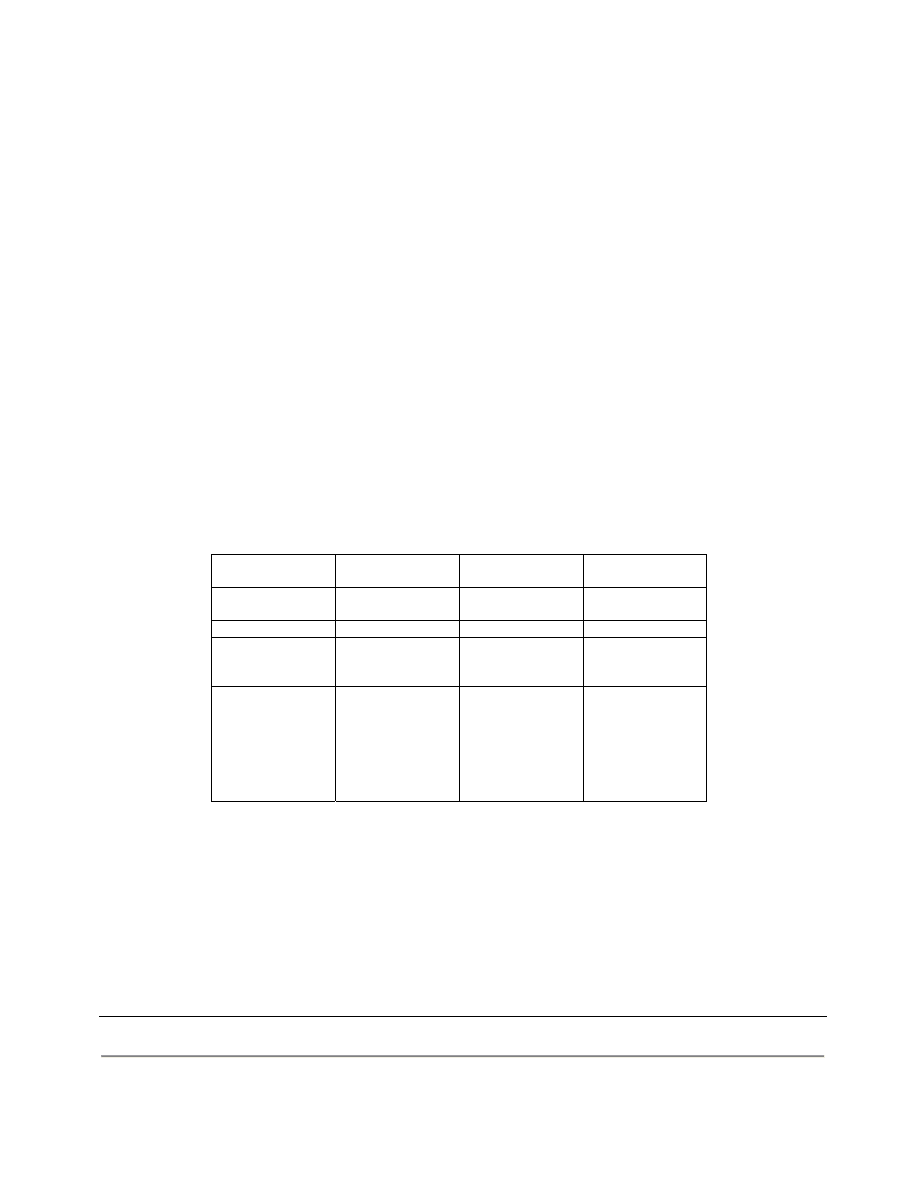
A teraz coś z zupełnie innej beczki, czyli żelazo i BOF.
Stężenie
żelaza
(50 – 175ug/dl)
Stężenie
transferyny
(180 – 410mg/dl)
Stężenie
ferrytyny
(15 – 200ug/l)
Stężenie
albuminy
(35 – 50g/l)
Stężęnie CRP
(0 – 5 mg/l)
Stan zapalny
obniżone obniżone podwyższone obniżone podwyższone
Rzeczywisty
niedobór żelaza
obniżone podwyższone obniżone
bez zmian
bez zmian
Utajony niedobór
żelaza
bez zmian
bez zmian
obniżone
bez zmian
bez zmian
Niedobór żelaza
Stan zapalny
obniżone
bez zmian
bez zmian
(obniżone) podwyższone
Niedożywienie
bez niedoboru
żelaza
(obniżone) (obniżone) (obniżone) (obniżone) bez
zmian
Brak
aminokwasów
wszystkie białka obniżone
Niedobór żelaza
Stan zapalny
Niedożywienie
znacznie
obniżone
(obniżone) (obniżone) znacznie
obniżone
podwyższone
Transferyna jest normalnie wysycona żelazem w 30%.
CRP – stężenie tego białka wzrasta nawet 1000 razy, wzrost jest szybki i gwałtowny; poziom tego białka
oznaczamy gdy nie ma zgodności pomiędzy wynikiem badania OB a stanem klinicznym.
Wszystkie cztery białka są białkami ostrej fazy. Dodatnie to ferrytyna i CRP, ujemne to transferyna i albumina.
Poziom żelaza w stanie zapalnym obniża się ponieważ jest ono magazynowane w ferrytynie. Proces ten ogranicza
dostęp bakterii do żelaza – hamuje ich rozwój.
Przy niedoborze żelaza zwiększa się synteza transferyny w wątrobie – pozwala to wychwycić możliwie dużo żelaza.
Określenie „utajony niedobór żelaza” oznacza, niedobór w którym nie występują jeszcze objawy kliniczne.
HCT
Hematokryt może być określany metodą manualną lub z użyciem analizatora.
Wartości referencyjne to:
• 0,37 – 0,47 l/l – kobiety
• 0,40 – 0,54 l/l – mężczyźni
• 0,44 – 0,64 l/l – noworodki
• 37 – 54% – analizator

Diagnostyka laboratoryjna – wykłady
3/32
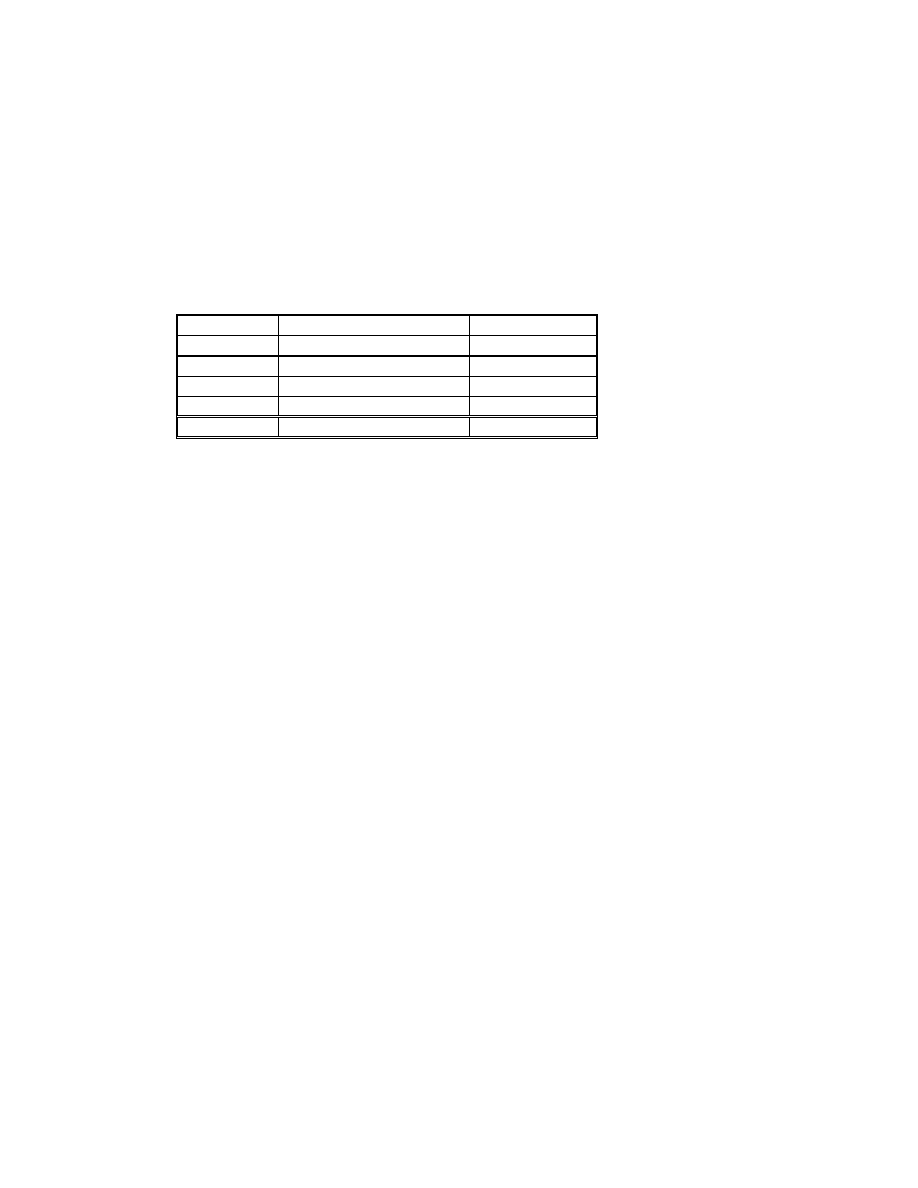
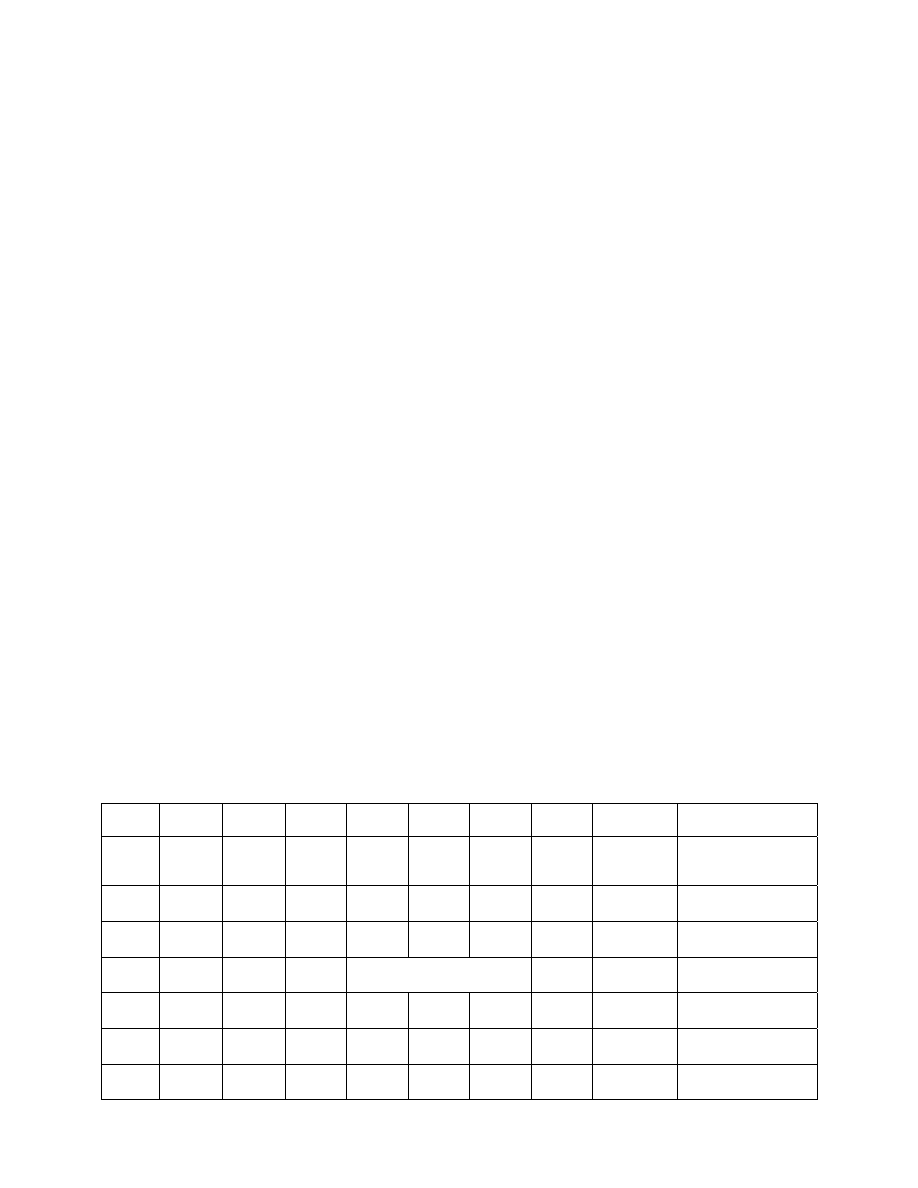
SCHORZENIE HCT
OSOCZE
KRWINKI
Krwotok
bez zmian
równomierna utrata osocza i krwinek
Niedokrwistość obniżenie wzrost
objętości Utrata
Nadkrwistość wzrost
wzrost
objętości zwiększenie liczby
Przewodnienie obniżenie wzrost
objętości bez
zmian
Odwodnienie wzrost
spadek
objętości bez
zmian
Mix obniżenie spadek
objętości Utrata
Kiedy spadek HCT informuje o zmniejszeniu liczby RBC (chodzi o całkowitą pulę, a nie o ilość/mm
3
)
?
• w normowolemii i hipowolemii obniżenie HCT oznacza obniżenie liczby RBC
• w
hipowolemii
spowodowanej:
hipohydratacją HCT rośnie, a liczba RBC nie zmienia się
krwotokiem HCT jest bez zmian, a liczba RBC obniża się
• w hiperwolemii spadek HCT przy wzroście objętości osocza nie informuje nas o spadku liczby RBC
W drugiej dobie po krwotoku następuje przesunięcie płynu z przestrzeni wewnątrzkomórkowej do naczyń. Po
wyrównaniu objętości płynu obraz przypomina przewlekłą niedokrwistość.
Kiedy HCT rośnie?
• przy
zwiększeniu liczby krwinek czerwonych lub przy zwiększeniu odsetka krwinek dużych
• przy spadku objętości osocza
Zwiększenie liczby krwinek czerwonych występuje w czerwienicy prawdziwej, kiedy to szpik produkuje krwinki
czerwone w nadmiernej ilości lub w nadkrwistościach wtórnych które mogą być wywołane chorobami płuc,
anastomozami tętniczo – żylnymi, wadami serca, chorobami nerek (gdy dochodzi do nadprodukcji EPO –
nowotwory, wodonercze).
Zwiększenie HCT w nadkrwistości zwiększa lepkość krwi, co powoduje przeciążenie lewej komory, a w efekcie jej
przerost.
Wzrost HCT wynikający ze zmniejszenia objętości osocza występuje w przypadku:
• oparzeń
• zapalenia
otrzewnej
• zaburzeń gospodarki wodno – elektrolitowej takich jak: biegunki, wymioty, nadmierne pocenie się
• żywienia parenteralnego (gdy źle wyrównywany jest poziom płynów)
Czerwienica górska – w warunkach wysokogórskich, przy obniżonym ciśnieniu parcjalnym tlenu dochodzi do
nadprodukcji EPO, powoduje to zwiększenie liczby RBC. Poza tym występują zaburzenia gospodarki wodno –
elektrolitowej, czego efektem są: biegunki, pocenie się. Zjawisko występowania czerwienicy górskiej jest stosowane
jako doping w sporcie.
Diagna – Wykład 3
(Wykład jest sponsorowany przez litery F i U oraz cyfrę 3)
Morfologia
RBC
RBC to liczba krwinek czerwonych w określonej objętości krwi. Najczęściej stosuje się dwie jednostki:
×10
12
/l lub
×10
6
/ul (liczbowo są one sobie równe).
Wartości referencyjne RBC, są różne w zależności od płci oraz wieku i wynoszą:
• 4 – 5,5 ×10
12
/l dla kobiet (3 – 3,5
×10
12
/l dla kobiet w ciąży)
• 4,5 – 6 ×10
12
/l dla mężczyzn
• 6,5 – 7,5 ×10
12
/l dla noworodków
• 4 – 6 ×10
12
/l to wartość na którą zaprogramowane są najczęściej analizatory
Zwiększenie RBC występuje w wypadku:
nadkrwistości
odwodnienia
(hipohydratacja)
Obniżenie RBC występuje w wypadku:
niedokrwistości (anemii)
przewodnienia
Retikulocyty
Retikulocyt – nie ma jądra, ale ma RNA, rybosomy, i wszystko inne. Etap retikulocytu jest ostatnim etapem, w
którym może być skorygowany niedobór hemoglobiny.
Liczba względna retikulocytów we krwi to 0,5 – 2% (USA) lub 5 – 20‰ (promili), jest to tzw. RC lub RET.
ARC (Absolute Reticulocyte Count) wynosi 25 – 75
×10
9
/l (USA).
Przy niewielkiej liczbie retikulocytów we krwi precyzja pomiarów jest mała.

Diagnostyka laboratoryjna – wykłady
4/32
Zwiększenie liczby retikulocytów (retikulocytoza) występuje w:
zespołach hemolitycznych
ostrych
stanach
niedotlenienia
pierwszych dniach po ostrym krwotoku
okresie
między 5., a 9. dniem skutecznego leczenia niedokrwistości z niedoboru Fe
okresie
między 5., a 9. dniem skutecznego leczenia niedokrwistości z niedoboru witaminy B
12
Obniżenie liczby retikulocytów występuje w:
niedokrwistości aplastycznej
niedokrwistości hipoplastycznej
anemii z niedoboru Fe lub witaminy B
12
i kwasu foliowego (niewłaściwie leczonej)
Przy anemii wylicza się tzw. skorygowaną (względną) liczbę retikulocytów – CRC (Corrected Reticulocyte Count).
Liczba ta podaje jaka byłaby liczba retikulocytów gdyby RBC była prawidłowa.
(l/l)
0,45
(l/l)
HCT
ret(%)
CRC
×
=
RPI (Reticulocyte Production Index) – indeks retikulocytów (również określany przy anemii).
45%
HCT
HCT
CRC
RPI
×
=
RPI informuje nas o tym czy odpowiedź szpiku na anemię jest adekwatna. Jeżeli jest to RPI>3, a jeżeli nie to
RPI<2.
Stężenie hemoglobiny
Stężenie hemoglobiny zależy od wieku i płci. Jednostką jest g/l krwi lub mmol
(monomeru hemoglobiny)
/l krwi.
g/l
× 0,6206 = mmol/l
Jest to jedyny parametr, który można oznaczyć we krwi zhemolizowanej.
Wartości referencyjne:
• 115 – 160 g/l lub 7,2 – 10 mmol/l dla kobiet
• 125 – 180 g/l lub 7,8 – 11,3 mmol/l dla mężczyzn
• 142 – 196 g/l lub 8,8 12,2 mmol/l dla noworodków
• 12 – 18 g/dl – analizator
U kobiet w ciąży przy stężeniu hemoglobiny poniżej 10 g/dl (6,2 mmol/l) mówimy o niedokrwistości.
Zwiększenie stężenia hemoglobiny występuje w wypadku:
nadkrwistości
odwodnienia
Obniżenie stężenia hemoglobiny występuje w wypadku:
niedokrwistości
przewodnienia
Jeżeli obniżenie stężenia hemoglobiny jest spowodowane niedoborem Fe to po podaniu leków badanie kontrolne
wykonuje się (tak jak przy niedokrwistości) po ok. 10 dniach – wzrost stężenia hemoglobiny o 20 – 30 g/l świadczy
o skutecznym leczeniu.
U człowieka o masie 65 kg przetoczenie 500 ml krwi (ok. 70 g hemoglobiny) powoduje wzrost stężenia hemoglobiny
we krwi o 12,3 g/l.
Generalnie: HGB to mniej więcej RBC
× 3, a HCT% to mniej więcej HGB × 3.
Hipoksja
Etapy adaptacji do hipoksji:
ból
głowy
niepokój
zawroty
głowy
przyspieszony
oddech
przyspieszony
tętno
po 24 godzinach (czujemy się lepiej):
skurcz
zatok
śledziony (uruchomienie rezerw erytrocytów)

Diagnostyka laboratoryjna – wykłady
5/32
zwiększenie stężenia 2,3 bisfosfoglicerynianu w krwinkach czerwonych, a w efekcie obniżenie
powinowactwa hemoglobiny do O
2
i nasilenie efektu Bohra
po 7 dniach:
zwiększenie syntezy EPO, co prowadzi do zwiększania syntezy krwinek czerwonych
Diagna – Wykład 4
(Ostrzeżenie: Czytanie niniejszego wykładu może prowadzić do spontanicznego samozapłonu – Minister Zdrowia Szczęścia Pomyślności)
Morfologia – c.d.
MCV – średnia objętość krwinki czerwonej, równa stosunkowi HCT/RBC; MCV = 80 – 100fl (fl – fentolitr = 10
–15
l)
RWD – odchylenie standardowe w stosunku do MCV; wynosi ono 11,5 – 14,5% średniej objętości krwinki
czerwonej. RWD określa w sposób obiektywny anizocytozę.
MCH – średnia masa hemoglobiny w statystycznej krwince MCH = HGB/RBC i wynosi 27 – 34pg
MCHC – stężenie hemoglobiny w krwinkach czerwonych MCHC = HGB/HCT i wynosi 31 – 37g/dl krwinek
HDW – odchylenie standardowe MCHC; HDW = 2,2 – 3,2g/dl
MCV
WZROST
(>100fl – makrocyt)
• fizjologicznie
u
noworodków
• anemia makrocytowa z niedoboru witaminy
B
12
i kwasu foliowego
• hipotoniczna
hipohydratacja
SPADEK
(<80fl – mikrocyt)
• anemia mikrocytowa z niedoboru Fe
• hipertoniczna
hipohydratacja
Jeżeli MCV i RWD są w normie to można wykluczyć anemie niedoborowe.
MCV jest stabilne dla zdrowej osoby (bardzo stabilne), dlatego też wynik badania należy porównać z poprzednimi.
Jeżeli MCV spada to trzeba pamiętać o tym, że:
• należy ustalić przyczynę tego spadku
• w Polsce najczęściej występuje anemia mikrocytowa, hipochromiczna z niedoboru Fe
• najczęściej pojawia się anizocytoza – rośnie RDW i rośnie odsetek mikrocytów ( gdy jeszcze HGB, MCH i
MCHC są w normie!)
• gdy MCV i RWD są w normie to należy zrezygnować z oceny gospodarki żelazowej
• w
późnym okresie anemii z niedoboru Fe spada MCHC, HGB (poniżej 90g/l) i wysycenie transferyny
żelazem
• rzadko
występuje (ale występuje) anemia mikrocytowa angiopatyczna z fragmentacją krwinek we krwi
obwodowej
Przy wzroście MCV:
• 50% to niedobór witaminy B
12
i kwasu foliowego
• 25% to alkoholizm i choroby wątroby
• 25% wynika z innej przyczyny np.:
terapii cytostatykami i antagonistami kwasu foliowego, inhibitorami DNA, cyklofosfamidem
1
itp.
rzekoma makrocytoza w chorobie zimnych aglutynin – należy ogrzać próbkę do 37
0
C, bo w niższych
temperaturach krwinki łączą się w większe aglomeraty co analizator odczytuje jako obniżenie RBC i
wzrost MCV oraz MHC
Sferocyty mogą zostać rozpoznane jako normocyty, gdy bierze się pod uwagę MCV lub jako mikrocyty gdy
wykonujemy badanie mikroskopowe.
Histogram – pozwala na ocenę jednorodności populacji krwinek czerwonych, może służyć do monitorowania
skuteczności leczenia anemii i oceny czasu przeżycia subpopulacji krwinek czerwonych (np.: po przetoczeniu krwi,
po przeszczepach szpiku).
MCH – średnia masa hemoglobiny w statystycznej krwince czerwonej może być wyrażana w pg/krwinkę lub w
fmol/krwinkę, 1fmol = 1pg
× 0,06206. Wartość referencyjna MCH wynosi 27 – 34pg (lub 1,7 – 2,7fmol). Jeżeli MCH
jest obniżone to mówimy o hipochromii, a gdy jest podwyższone o hiperchromii (dla porządku dodam, że normalne
MCH oznacza normochromię).
Przyczyny wzrostu MCH:
• niedokrwistości makrocytowe nadbarwliwe (zwłaszcza niedokrwistości megaloblastyczne)
• marskość wątroby

Diagnostyka laboratoryjna – wykłady
6/32
Przyczyny obniżenia MCH:
• niedokrwistości niedobarwliwe (szczególnie z niedoboru Fe)
• w
chorobach
nowotworowych
Generalnie na podstawie MCH niedokrwistości można podzielić na: normobarwliwe, niedobarwliwe, nadbarwliwe
(komórkowe).
Niedokrwistość:
zaburzona
erytropoeza:
• anemia z hipoproliferacji:
anemia normocytowa normochromatyczna (czerwone krwinki mikroskopowo bez
zmian, MCV, RDW – bez zmian):
hipoplazja
szpiku
zbyt
mała stymulacja erytropoetyną
anemia
różnorodna (RBC mikroskopowo prawidłowe, RDW podwyższone):
dysmielopoeza
przerzuty
nowotworów
• anemia z zaburzeniami dojrzewania RBC w szpiku:
MCV < 80fl, RDW podwyższone:
anemia mikrocytowa, hipochromiczna z niedoboru Fe
MCV < 80fl, RDW bez zmian:
talasemia
choroby
przewlekłe
MCV > 100fl (100 – 115fl), RDW podwyższone:
choroba
alkoholowa
MCV > 115fl, RDW podwyższone:
niedobór kwasu foliowego
niedobór
witaminy
B
12
prawidłowa erytropoeza:
o anemie
hemolityczne:
• zaburzenia
wewnątrzkrwinkowe:
defekty
błonowe:
obniżenie odporności osmotycznej krwinek
eliptocytoza,
sferocytoza,
akantocytoza
hemoglobinopatie (elektroforeza HGB)
enzymopatie:
niedobór
(obniżenie aktywności) kinazy kreatynowej (PK)
niedobór (obniżenie aktywności) dehydrogenazy glukozo – 6 –
fosforanowej (G6PD)
• zaburzenia
zewnątrzkrwinkowe:
anemia autoimmunohemolityczna (odczyn Coombsa)
fragmentacja
RBC:
mikroangiopatia
oparzenia
o anemia pokrwotoczna normocytowa normochromiczna
MCHC – średnie stężenie hemoglobiny w odwirowanych krwinkach czerwonych można podawać w g/l
RBC
lub w
mmol/l
RBC
, 1mmol monomeru hemoglobiny = 1g
× 0,06206. Wartości referencyjne to 310g/l (19 – 23 mmol/l).
Analizatory zwykle podają wynik badania MCHC w g/dl.
Przyczyny wzrostu MCHC:
• wrodzona
niedokrwistość sferocytowa (MCHC – górna granica normy)
• odwodnienie
hipertoniczne
• przyczyny hematologicze (rzadko)
Należy zaznaczyć, że MCHC fizycznie nie może przekroczyć 38g/dl, ponieważ iloczyn rozpuszczalności
hemoglobiny w wodzie wynosi 38%.
Przyczyny obniżenia MCHC:
• znaczna retikulocytoza (przełom retikulocytowy; MCHC – dolna granica normy)
• niedokrwistość z niedoboru żelaza
• odwodnienie
hipotoniczne
1
– cyklofosfamid – lek przeciwnowotworowy stosowany w ziarnicy złośliwej, nowotworach układu chłonnego, przewlekłej
białaczce limfatycznej, raku sutka, oskrzeli, jajnika, gruczołu krokowego, i układu moczowego oraz jako lek immunosupresyjny;
lek upośledza zdolności krwiotwórcze szpiku
Diagnostyka laboratoryjna – wykłady
7/32
Diagna – Wykład 5
Płytki krwi
Wartości referencyjne: 130 – 400
× 10
3
/ul
krwi
(
×10
9
/l
krwi
)
PCT – objętość płytek w całkowitej krwi; 0,1 – 0,4%
MPV – objętość płytek; 7,2 – 11,1fl
PDW – odchylenie standardowe; 25 – 65%
Białe krwinki
Wartości referencyjne: 4 – 10
× 10
3
/ul
krwi
(
×10
9
/l
krwi
)
U statystycznego Kowalskiego w jednym mikrolitrze krwi znajduje się 7000 leukocytów. 1% z tej liczby to 70
leukocytów. Wiedząc o tym i znając wartości referencyjne procentowego składu białych krwinek można obliczyć ile
powinno być krwinek określonego typu (naturalnie jeżeli ktoś ma np. 8500 leukocytów/ul to należ przeliczyć podane
wartości).
Leukocytogram wg Schillinga:
3 – 5%
neutrofile pałeczkowate 310
–
350/ul
45 – 65%
neutrofile segmentowane
3150 – 4550/ul
2 – 7%
monocyty
140 – 490/ul
1 – 4%
eozynofile
70 – 280/ul
0 – 1%
bazofile
0 – 70/ul
20 – 45%
limfocyty
1400 – 3150/ul
Komórki LUC (Large Unstained Cells) – stanowią 0 – 4% WBC. W analizatorach chemicznych są to duże komórki
krwi obwodowej, bez aktywności peroksydazy. Do LUC zalicza się:
plazmocyty
reaktywne
limfocyty
erytroblasty
limfoblasty
mieloblasty peroksydazo – ujemne
Liczba LUC zwiększa się w chorobach proliferacyjnych układu chłonnego i szpiku.
Leukopenia – przyczyny:
• hipoplazja
szpiku
• uszkodzenie szpiku (promieniowanie jonizujące, leki, zatrucia środkami chemicznymi)
• hipersplenizm
• przerzuty nowotworowe do szpiku
• wyniszczenie
(kaheksja
1
)
Leukocytoza przyczyny:
• zakażenia (bakteryjne, grzybami, pasożytami, pierwotniakami, wirusami – nie wszystkie)
• nowotwory
• uszkodzenia (oparzenia, urazy, zabiegi operacyjne, zawał serca)
• zaburzenia metaboliczne (kwasica cukrzycowa, dna moczanowa, toksyny mocznicowe)
• hematologiczne
zespoły rozrostowe
• w
warunkach
fizjologicznych:
po
intensywnym
wysiłku
po
obfitym
posiłku
w
stresie
przy wydzielaniu adrenaliny i hormonów steroidowych (lub po ich podaniu)
W granulocytopenii występuje względna leukocytoza.
Monocyty – opuszczając szpik posiadają wszystkie antygeny zgodności tkankowej. We krwi obwodowej przebywają
1 – 3 dni. Po tym okresie wędrują do tkanek i przekształcają się w makrofagi. Makrofagi w różnych tkankach różnią
się morfologicznie i czynnościowo. Mamy więc: komórki Browicz – Kupfera (makrofagi w wątrobie), makrofagi
pęcherzykowe (makrofagi w płucach), osteoklasty (makrofagi w kościach), mikroglej (makrofagi w OUN).
Wszystkie makrofagi mają zdolność fagocytozy, usuwają obumarłe komórki, zdenaturowane białko, kompleksy
immunologiczne oraz wydzielają: IL1 i TNF.
Monocytoza – przyczyny:
• niektóre
zakażenia wirusowe i bakteryjne (np.: mononukleoza zakaźna, paradury, kiła)
• nowotwory
• kolagenozy

Diagnostyka laboratoryjna – wykłady
8/32
• urazy
chirurgiczne
APC – komórki prezentujące antygen. Zalicza się do nich monocyty i makrofagi oraz limfocyty B.
Bazofile – uczestniczą w reakcji nadwrażliwości natychmiastowej. Mają one na powierzchni 30 – 100 tys.
powierzchniowych receptorów dla fragmentu Fc IgE, z których 20 – 50% jest wysycone IgE. Oznacza to, że do
wystąpienia reakcji brakuje tylko antygenu.
Jeżeli alergen połączy się z IgE pojawiają się objawy choroby atopowej. Dochodzi do degranulacji bazofili i
uwalniają się mediatory, są to m.in.:
histamina
SRSA (wolno reagująca substancja anafilaktyczna – jest to zestaw leukotrienów)
Uwolnienie histaminy prowadzi z jednej strony do zwiększenia przepuszczalności naczyń i obrzęków, z drugiej do
poszerzenia naczyń i spadku ciśnienia krwi.
W oskrzelach i jelitach histamina powoduje skurcz.
Bazocytoza – przyczyny:
• stany alergiczne i uczulenia na leki
• przewlekła białaczka szpikowa
• przewlekłe stany zapalne przewodu pokarmowego
Eozynofile – działają bakteriobójczo, ale słabiej niż neutrofile; żyją 8 – 12 dni w krwiobiegu (neutrofile 8h).
Eozynofilia – przyczyny:
• choroby
pasożytnicze
• choroby
alergiczne
i
zakaźne
• niektóre
białaczki szpikowe
1
– kaheksja sensu stricte to wyniszczenie spowodowane chorobą nowotworową, a nie każde wyniszczenie (ogólnie
wyniszczenie to inanitio)
Diagna – Wykład 6
(Wykład zawiera fenyloalaninę i nie może być czytany przez chorych na fenyloketonurię.)
Granulocyty
Granulocyty w szpiku można podzielić na pule:
• I pula to komórki hematopoetyczne, które mają zdolność do podziałów i różnicowania
• II pula to granulopoetyczne komórki macierzyste ukierunkowane, które mają zdolność do
nieodwracalnego różnicowania się
• III pula to proliferujące nutrocyty dojrzewające (4 dni); należą tu mieloblasty, promielocyty i mielocyty
• IV pula to nieproliferujące neutocyty dojrzewające (4 dni); w skład tej puli wchodzą metamielocyty,
neutrocyty o jądrze pałeczkowatym i neutrocyty o jądrze segmentowanym. Pula ta stanowi tzw. rezerwę
szpikową granulocytów obojętnochłonnych.
Uwalnianie neutrocytów z rezerwy szpikowej do krwi w warunkach homeostazy jest kontrolowane przez mechanizm
sprzężenia zwrotnego i zależy od liczby neutrocytów we krwi. Uwalnianie zachodzi pod wpływem czynnika NRA
(Neutrofil Releasing Activity).
Na uwalnianie neutrocytów mają wpływ czynniki powodujące zaburzenia homeostazy, takie jak:
infekcje – endotoksyny bakteryjne
uszkodzenie
tkanek
antygeny
nowotworów
Inne czynniki wpływające na uwalnianie neutrocytów ze szpiku to:
kortykosteroidy
glukagon
składowa C
3e
komplementu
inerleukina 1 (z makrofagów)
Neutrocyty obecne w naczyniach można podzielić na pulę krążącą (44%) i pulę marginalną (56%). Przeniesienie
neutrocytów z puli marginalnej do puli krążącej podwaja ich liczbę w krwiobiegu, zjawisko wywołują następujące
czynniki:
stres
adrenalina
posiłek
wysiłek fizyczny

Diagnostyka laboratoryjna – wykłady
9/32
Wymienione czynniki mogą być przyczyną błędów analiz laboratoryjnych.
Rozmieszczenie neutrocytów w organizmie:
• szpik kostny – 90% (synteza 10
11
/dobę)
• naczynia – 2 do 3% (8 godzin)
• tkanki – 7 do 8%
Neutrocyty przekraczają ścianę naczyń i wnikają do tkanek (nie powracają do łożyska naczyniowego). W tkankach
mogą pełnić różne funkcje i mogą się z nimi dziać różne rzeczy:
• ochrona
błon śluzowych tkanek kontaktujących się ze środowiskiem zewnętrznym:
przewód
pokarmowy
układ oddechowy
układ moczowo – płciowy
• migracja do ogniska zapalnego
• pozostałe są niszczone przez makrofagi śledziony i wątroby
Neutrofile działają tylko w środowisku wodnym co ma znaczenie przy wysychaniu błon śluzowych (u niemowlaków,
kobiet w okresie klimakterium).
Czynniki chemotaktyczne dla neutrofili (migruję w stronę większego stężenia):
składowe dopełniacza C
5a
, C
3a
kompleks
C
5
– C
6
– C
7
(kalikreina)
proaktywator
plazminogenu
leukotrieny
produkty rozpadu granulocytów
N–formylo–metionylo–peptydy
bekteryjne
Opsonizacja bakterii:
IgG
składowa C
3b
Fagocytoza zachodzi dzięki receptorom neutrocytów, są to receptory dla:
Fc
IgG
składowe C
3b
, C
5a
, C
3a
N–formylo–metionylo–peptydów
czynników
chemotaktycznych
PAF
(czynnik
aktywujący płytki)
Tworzenie fagolizosomów jest stymulowane przez TUFTSIN (tetrapeptyd ze śledziony).
Neutrocytoza – przyczyny:
• stan zapalny (bakterie, pierwotniaki, grzyby, pasożyty, wirusy np.: wirus półpaśca)
• choroby nowotworowe (oskrzela, trzustki, żołądka)
• choroby rozrostowe szpiku
• uszkodzenia tkanek (urazy zabiegi chirurgiczne, zawały serca, płuc, martwice, rzucawka porodowa)
Przyczyny neutropenii:
• uszkodzenie szpiku )promieniowanie, cytostatyki, toksyczne leki)
• niedokrwistość aplastyczna
• rekonwalescencja w niektórych chorobach:
gruźlicy
durze
chorobach wirusowych (grypa, odra, różyczka)
malarii
Eksplozja oddechowa neutrofila jest efektem połączenia się receptorów z opsoninowaną cząsteczką. W komórce
neutrocytu dochodzi do pewnych zmian:
nieodwracalny wzrost katabolizmu glukozy i uruchomienie rezerw glikogenu prowadzi do zwiększenia
stężenia kwasu mlekowego (obniżenie pH) oraz NADPH + H
+
wzrost
pochłaniania O
2
endoproteinazy i fosfolipaza A
2
uczynniają obecną w błonie lipooksygenazę co prowadzi do zwiększenia
wydzielania LTB
4
i LTD
4
(pobudzenie reakcji zapalnej, chemotaksja, pobudzenie makrofagów (które
zwiększają wydzielanie IL1) oraz limfocytów Th (które zwiększają wydzielanie IL2))
powstanie
fagosomu
Wyróżnia się dwa systemy bakteriobójcze: tlenowozależny i tlenowoniezależny.

Diagnostyka laboratoryjna – wykłady
10/32
oksydaza NADPH
Tlenowoniezależny system bakteriobójczy.
Degranulacja do wnętrza fagosomu:
• ziarnistości specyficzne (2/3) :
fosfataza
alkaliczna
laktoferyna C (i inne białka zasadowe wiążące Fe – uniemożliwia to bakterii wzrost)
• ziarnistości azurofilne (1/3):
hydrolazy
degradujące bakteryjne białka,lipidy, polisacharydy, kwasy nukleinowe (katepsyna D i G,
lizozym, elastaza, kwaśne hydrolazy, fosfolipaza i inne)
Tlenowozależne mechanizmy bakteriobójcze:
2O
2
+ NADPH + H
+
2O
2
’
–
+ NADPH
+
+ 2H
+
O
2
’
–
+ O
2
’
–
+ 2H
+
H
2
O
2
+ O
2
O
2
’
–
+ H
2
O
2
1
O
2
+ OH’ + OH
–
H
2
O
2
+ Cl
–
OCl
–
( O + Cl
–
) +H
2
O
H
2
O
2
+ 2Cl
–
+ 2H
+
2Cl
–
+ H
2
O
H
2
O
2
+ OCl
–
1
O
2
+ Cl
–
+H
2
O
SOD – dysmutaza ponadtlenkowa
MPO – mieloperoksydaza
Produkowane w tych procesach wolne rodniki mogą wywierać szkodliwe działanie na tkanki gdy: opóźnione jest
zamknięcie się fagosomu lub gdy zfagocytowana zostanie zbyt duża komórka (np. komórka śródbłonka) i fagosom
„nie domknie” się.
Wolne rodniki uszkadzają tkanki ponieważ aktywują lokalne mediatory zapalne.
Do tego typu uszkodzeń dochodzi w:
• ognisku niedokrwiennym zawału serca
• reumatoidalnym zapaleniu stawów
• wstrząsie septycznym
• zapaleniu
trzustki
• obrażeniach wielonarządowych
Przed szkodliwym działaniem wolnych rodników chronią tzw. zmiatacze wolnych rodników:
• wewnątrzkomórkowe:
cytoplazmatyczna dysmutaza ponadtlenkowa (zawierająca Cu
2+
i Zn
2+
)
mitochondrialna dysmutaza ponadtlenkowa (zawiera Mn
2+
, jest podobna do bakteryjnej dysmutazy)
katalaza
peroksydaza
glutationu
• pozakomórkowe:
transferyna
ceruloplazmina
witamina
C
witamina
E
witamina
A
Diagna – Wykład 7
Białka osocza
U statystycznego człowieka białka to 15 kg masy ciała. 4% z tej ilości (600g) stanowią białka osocza. 60% białek
osocza (ok. 340g) znajduje się w obszarze pozanaczyniowym, 40% (ok. 240g) to białka obecne w osoczu krwi (60 –
80g/l surowicy). W osoczu występuje ok. 300różnych białek.
SOD
MPO
MPO
MPO
Diagnostyka laboratoryjna – wykłady
11/32
75% białek osocza syntezowanych jest w wątrobie, synteza na rybosomach trwa 1 – 2min, modyfikacja
posttranslacyjna trwa 20 – 40min. Wątroba nie przechowuje zsyntezowanych białek.
Pozostałe 25% to immunoglobuliny, białko w chylomikronach (synteza w jelitach), apoferrytyna (synteza w jelitach),
hormony peptydowe, białka powstające w szpiku.
200 – 300g białek na dobę ulega degradacji w lizosomach, z tej ilości 25g stanowią białka osocza.
Okres półtrwania białek zależy od ich funkcji:
białka krzepnięcia – kilka godzin
albuminy i niektóre immunoglobuliny – ok. 21 dni
hemoglobina – ok. 100 dni
W ciągu doby tracimy przez przewód pokarmowy ok. 5g białka, z moczem wydalane jest 20 – 80mg (albuminy do
30mg). Rutynowe metody pozwalają wykryć białko w moczu gdy jego wydalanie przekroczy 300mg.
Albuminy
1g albuminy ma zdolność wiązania 18g wody. Ta własność sprawia, iż albuminy odpowiadają za równowagę
pomiędzy objętością wewnątrznaczyniową i zewnątrznaczyniową.
Albuminy pełnią też funkcje transportowe – hormony, leki, pierwiastki (Ca
2+
, Mg
2+
, pierwiastki śladowe), wolna
bilirubina.
Białka transportowe – przykłady:
• transferyna – transportuje Fe
• transkobalamina – transportuje witaminę B
12
• haptoglobina
–
wyłapuje wolną hemoglobinę – wolna Hb jest niebezpieczna ponieważ krystalizuje w
nerkach (niskie pH) i może doprowadzić do niewydolności nerek; haptoglobina jest dużym białkiem i Hb
związana z nią nie przesącza się
• białka transportowe dla hormonów sterydowych
Enzymy – przykłady:
• białka krzepnięcia krwi – bez nich przeżycie nie byłoby możliwe, ale ich aktywacja musi być ograniczona
do określonego obszaru
• inhibitory proteaz – inhibitory białek krzepnięcia, inhibitory katepsyn (enzymy proteolityczne uwalniane
m.in. przez komórki nowotworowe)
• ceruloplazmina – odpowiada za transport Cu
2+
, ma właściwości oksydoredukcyjne i utrzymuje równowagę
między Fe
2+
i Fe
3+
Odporność
Białka osocza pełniące funkcje obronne to: układ dopełniacza i immunoglobuliny.
Bufory
18% objętości buforowej zależy od białek osocza.
Materiał zapasowy
W głodzeniu białka osocza są źródłem aminokwasów, jeżeli to nie wystarcza organizm korzysta z białek
mięśniowych.
Zmiany stężenia białka w surowicy
Generalnie jeden litr surowicy zawiera 60 – 80g białka, z czego 35 – 50g stanowią albuminy. Jeżleli stężenie białka
jest niższe mówimy o hipoproteinemii, a jeśli jest wyższe o hiperproteinemii.
Hipoproteinemia – przyczyny:
• zmniejszenie
syntezy
białek w wątrobie:
niedobór aminokwasów egzogennych w diecie
zaburzenia
wchłaniania
choroby
wątroby (marskość, nowotwory pierwotne wątroby, przerzuty nowotworowe w wątrobie)
• zwiększona utrata białka:
zespół nerczycowy
oparzenia
stany kataboliczne (np. gorączka)
sepsa
niektóre
nowotwory
wysięk skórny
• zaburzenia syntezy immunoglobulin
• zwiększenie objętości osocza:
przewodnienie
Diagnostyka laboratoryjna – wykłady
12/32
hipotonia
Jeżeli stężenie białka w surowicy spadnie poniżej 45g/l (20g albumin/l) to dochodzi do obrzęków, przesięków i
hipowolemii.
Hiperproteinemia – przyczyny:
• hipergammaglobulinemia:
poliklonalna (infekcje, choroby autoimmunizacyjne)
monoklonalna (szpiczak mnogi, makroglobulinemia Waldenstroema, choroba łańcuchów ciężkich)
• odwodnienie
Na koniec warto zaznaczyć, że w marskości wątroby ilość białka ogólnie zmniejsza się, nie dochodzi jednak do
równomiernego obniżenia poziomu wszystkich białek – spada ilość albumin, ale jednocześnie podnosi się poziom
immunoglobulin. W efekcie stężenie białka całkowitego w surowicy utrzymuje się w dolnych granicach normy.
Elektroforeza
W elektroforezie białka osocza rozkładają się na pewne frakcje:
• albuminy
(55%)
• α
1
− globuliny:
α
1
− inhibitory proteaz
α
1
− kwaśna glikoproteina
białka krzepnięcia
insulina
apoA
• α
2
− globuliny:
α
2
– makroglobulina
haptoglobina
ceruloplazmina
apoC
część IgA
protrombina
enzymy (np.: aminotransferaza asparaginianowa, izoenzymy dehydrogenazy mleczanowej i inne)
• β – globuliny (dzielą się na β
1
i β
2
globuliny):
transferyna
składowe dopełniacza
β
2
– mikroglobulina
apoB
100
część IgA
część IgG
część IgM
hemopeksyna
properdyna
aminotransferaza
alaninowa
• granica
między
β i γ – globulinami to białko C – reaktywne
• γ – globuliny:
IgA
IgM
IgG
Diagna – Wykład 8
Zapalenia
Ostra faza pojawia się w wyniku uszkodzenia tkanek, zapalenia, infekcji, martwicy, w ostatnich dniach ciąży. Białka
ostrej fazy dzielimy na białka pozytywne (ich stężenie w czasie ostrej fazy rośnie min. o 25%) i negatywne (ich
stężenie spada w ostrej fazie).
Pozytywne białka ostrej fazy:
• wzrost
stężenia ok. 1000 razy:
CRP
(białko C – reaktywne)
SAA
(składnik surowiczy amyloidu A)
• wzrost
stężenia 2 – 5 razy:
fibrynogen
haptoglobina
α
1
– inhibitor proteinaz (
α
1
PI)

Diagnostyka laboratoryjna – wykłady
13/32
α
1
– antychymotrypsyna (ACT)
α
1
– kwaśna glikoproteina (AGP) – dawniej zwana orozomukoidem
• wzrost
stężenia o ok. 50%:
ceruloplazmina
składowe dopełniacza
Negatywne białka ostrej fazy:
albumina
transferyna
α
2
HS glikoproteina (HS – ciepłostabilna)
Wszystkie BOF są glikoproteinami, z wyjątkiem dwóch pozytywnych (CRP, SAA) i jednego negatywnego
(albuminy).
Pod względem kinetyki BOF dzielimy na białka pierwszego i drugiego rzutu. Białka pierwszego rzutu to te, których
stężenie wzrasta po 6 – 8h od zadziałaniu bodźca, szczyt osiąga w 1 – 2 dobie, a po zaniknięciu bodźca szybko
wraca do normy (T
1/2
wynosi ok. 6h). Do białek pierwszego rzutu należą: CRP, SAA, ACT.
Stężenie białek drugiego rzutu wzrasta po 24 – 48h od zadziałania bodźca, osiąga szczyt po 72 – 96h i wolno
obniża się po ustaniu działania bodźca. Do białek drugiego rzutu należą wszystkie BOF oprócz: CRP, SAA i ACT.
BOF są syntezowane w: wątrobie, monocytach i granulocytach z wielopłatowym jądrem. Synteza BOF jest
regulowana przez cytokiny (głównie przez IL6):
• CRP – wzrost ekspresji genomu jest regulowany przez IL6
• albuminy – wiele cytokin
• fibrynogen – produkcja jest stymulowana przez IL6, a hamowana przez IL1 i TNF
• AGP – do stymulacji produkcji potrzebne są IL6 + IL1 lub IL6 + TNF
Rola białek ostrej fazy.
Białka ostrej fazy ułatwiają eliminację bakterii. Część białek ostrej fazy to inhibitory proteinaz. Ostre zapalenie
trzustki, rozległe oparzenia, urazy tkanek powodują obniżenie poziomu inhibitorów proteinaz.
Patobiochemia zapalenia
Zapalenie jest podstawowym odczynem obronnym organizmu, niemniej jednak odczyn ten może być szkodliwy
jeżeli:
bodziec zapalny jest zbyt silny
występuje nadmiar lub niedobór mediatorów zapalenia
występuje niedobór inhibitorów mediatorów zapalenia np.: niedobór inhibitora składowej C
1
komplementu
Klasyczne objawy zapalenia
1
:
• Calor
(zwiększenie ucieplenia)
• Rubor
(zaczerwienienie)
• Tumor
(obrzęk)
• Dolor
(ból)
• Functio laesa (upośledzenie funkcji)
Klinicznie zapalenia dzielimy na ostre i przewlekłe.
Zmiany elektroforetyczne białek:
• obniża się stężenie albumin (BOF), co wynika ze zwiększonej przepuszczalności naczyń i ze
zwiększonego katabolizmu
• wzrasta
stężenie
α
1
i
α
2
– globulin (BOF)
• zmiany
w
obrębie frakcji
β – globulin są nieregularne, choć zawsze dochodzi do obniżenia stężenia
transferyny (BOF)
• typowe
zmiany
frakcji
γ – globulin:
przez pierwsze 1 – 2 tyg. zwiększone jest stężenie IgM natomiast poziom IgG jest w normie
po 2 – 4 tyg. rośnie stężenie IgG, a poziom IgM wraca do normy; to odwrócenie proporcji IgM/IgG
to przejście zapalenia ostrego w przewlekłe
Ostra reakcja zapalna:
• 5 objawów zapalenia
• zmiany
stężeń BOF
• OB – umiarkowany lub znaczny wzrost
• leukocytoza
z
przesunięciem obrazu krwi w lewo
• zmiany
elektroforetyczne
białek
Diagnostyka laboratoryjna – wykłady
14/32
plazminogen
trypsyna
kininaza I
bradykinina
lizylobradykinia
• nadkrzepliwość/niedokrzepliwość
• trombocytopenia
• fibrynoliza
• mediatory
zapalenia:
aminy
biogenne
oligopeptydy
składowe komplementu
pochodne kwasu arachidonowego
Aminy biogenne
Histamina
Jest uwalniana z komórek tucznych i z bazocytów. Najczęściej łącznie uwalniane są z histamina, serotonina i
heparyna.
Jeśli chodzi o receptory dla histaminy to są ich dwa rodzaje: H
1
i H
2
. Pobudzenie receptorów H
1
powoduje:
skurcz
mięśni oskrzeli
rozkurcz
mięśni naczyń i obniżenie ciśnienia krwi
zwiększenie przepuszczalności i obrzęk
skurcz
mięśni gładkich jelit
Pobudzenie receptorów H
2
powoduje:
zwiększenie częstości pracy serca
zwiększenie wydzielania gastryny i w efekcie zwiększenie wydzielania HCl przez komórki okładzinowe
Serotonina
Jest uwalniana przez komórki tuczne i płytki krwi. Co do jej działania to w małych stężeniach powoduje ona skurcz
mięśni naczyń i zwiększenie ciśnienia krwi, w dużych stężeniach rozszerza ona naczynia krwionośne i powoduje
obniżenie ciśnienia krwi, poza tym powoduje nieznaczne zwiększenie przepuszczalności naczyń. Serotonina pełni
też inne funkcje: jest neuroprzekaźnikiem w OUN, oddziałuje na błonę śluzową jelit pobudzając perystaltykę.
Oligopeptydy – kininy:
Kalikreina przekształca kininogeny w kininy. Większe znaczenia ma kalikreina plazminowa niż kontaktowa (tzn.
powstała pod wpływem czynnika kontaktu Hagemana).
Kininy są inaktywowane przez kininazy.
Met – Liz – Arg – Pro – Pro – Gly – Phe – Ser – Pro – Phe – Arg
Czynniki krzepnięcia
XII i XI
aktywny czynnik
kontaktu Hegemana
prokalikreina
kalikreina
plazmina
kininogeny
kininy
metionylolizobradykinina

Diagnostyka laboratoryjna – wykłady
15/32
Funkcje kinin:
• powodują uwalnianie ze śródbłonka: PGI
2
, EDRF, PAF
• rozszerzają naczynia obniżając tym samym ciśnienie krwi
• zwiększają przepuszczalność naczyń krwionośnych (obrzęk)
• powodują uczucie bólu (np. w zawale serca)
• są mediatorem reakcji wstrząsowej
Trombocytopenia
Toksyny bakteryjne powodują powstawanie agregatów płytek, dochodzi do ich degranulacji, uwalniana jest
histamina i PGI
2
.
Fibrynoliza
Odpowiadają za nią proteinazy pochodzenia leukocytarnego, wątrobowego, a także te uwalniane z uszkodzonych
komórek (np. katepsyny w chorobach trzustki).
1
– cztery z wymienionych (rubor,calor, tumor, dolor) objawów sformułował Celsus w I wieku p.n.e., Galen dodał do nich jeden
(functio laesa) w II wieku n.e.
Diagna – Wykład 9
Noradrenalina (NA) jest neuroprzekaźnikiem uwalnianym z zakończeń włókien współczulnych w obecności Ca
2+
.
Jej działanie zależy od rodzaju i lokalizacji receptora który jest pobudzany. Receptorów tych jest kilka rodzajów:
• α
1
– skurcz mięśni gładkich naczynia (to działanie przeważ w warunkach fizjologicznych)
• α
2
– pobudzenie receptorów zlokalizowanych na zakończeniach włókien nerwowych hamuje wydzielanie
NA
• β
1
– rozkurcz mięśni gładkich
• β
2
– jeżeli są zlokalizowane na włóknach nerwowych to powodują zwiększenie wydzielania NA
Blokery receptorów
α (np. fentoloamina) powodują rozszerzenie naczyń, gdyż przewagę uzyskują receptory β.
Blokery receptorów
β natomiast powodują skurcz mięśni gładkich naczyń.
Pobudzenie włókien przywspółczulnych powoduje rozkurcz naczyń wieńcowych. Wynika to z faktu, iż
acetylocholina zwiększa wydzielanie PGI
2
i EDRF, które to są czynnikami powodującymi rozszerzenie się naczyń.
Nadmierny skurcz naczyń wieńcowych może wynikać z:
• α
1
– stymulacja (ciągły stres)
• wzrost
stężenia Ca
+2
• obniżenie stężenie Mg
+2
• podwyższenie poziomu TXA
2
• miażdżyca (wzrost poziomu LTB
4
, LTD
4
, wzrost ekspresji receptorów histaminowych H
2
i serotoninowych
S
2
, obniżenie poziomu PGI
2
i ERDF)
• uogólniona
kurczliwość naczyń
Przyspieszenie akcji serca – skutki.
W sarkoplazmie obniża się stosunek ATP/ADP i fosfokreatyny/kreatyny. Dochodzi do aktywacji translokazy
adenylanowej
1
. W mitochondriach również obniża się stosunek ATP/ADP, co jest najsilniejszym stymulatorem
fosforylacji oksydatywnej. Dochodzi więc do nasilenia fosforylacji oksydatywnej i zwiększenia stężenia ATP w
mitochondriach (mitochondria stanowią ok. 35% objętości mięśnia sercowego).
Należy mieć na uwadze, iż tlenowa specjalizacja metabolizmu serca, powoduje całkowitą zależność tego narządu
od dopływu tlenu (w sercu znajduje się bardzo dużo mioglobiny magazynującej tlen).
Substraty energetyczne mięśni.
Mięsień szkieletowy w spoczynku zużywa głównie WKT, podczas pracy natomiast glukozę, WKT i ciała ketonowe.
Mięsień sercowy zużywa mleczan i ciała ketonowe (O
2
), glukozę (O
2
i beztlenowo) oraz WKT (O
2
).
Jeśli chodzi o poziom WKT we krwi to w stanie sytości obniża się on, jednocześnie dochodzi do zwiększenia
stężenia glukozy i insuliny, w adipocytach nasila się lipogeneza i słabnie lipoliza. W stanie głodu mamy sytuację
odwrotną – podnosi się poziom WKT we krwi, obniża się stężenie glukozy i insuliny, a w adipocytach hamowana
jest lipogeneza, a nasila się lipoliza.
Metabolizm w dobrze ukrwionym mięśniu sercowym w czasie wysiłku fizycznego.
Przyspieszone zużywanie ATP w cytoplazmie komórki mięśnia sercowego prowadzi do:

Diagnostyka laboratoryjna – wykłady
16/32
• zwiększenia stężenia ADP w cytoplazmie
• zwiększenie aktywności translokazy nukleotydów adenylanowych
• zwiększenie stężenia ADP w mitochondriach
• obniżenie stężenia NADH i FADH
2
w mitochondriach
• nasilenie przemian w cyklu Krebsa
• obniżenie stężenia mitochondrialnego acetylo – CoA
• nasilenie
β – oksydacji acylo – CoA
• wzrost
stężenia CoA i karnityny
• nasilenie transportu WKT (acylo – CoA) z cytoplazmy do mitochondriów
• zwiększenie wychwytu WKT z surowicy
Odpowiedzią biochemiczną na obciążenie wysiłkiem mięśnia sercowego jest zwiększenie wychwytu WKT z
surowicy do cytoplazmy i dalej z cytoplazmy do mitochondriów. Nasila się też katabolizm acylo – CoA.
Zwiększenie stężenia WKT i acylo – CoA w komórce hamuje wychwyt glukozy, jej transport przez błonę i
katabolizm.
Tylko w wypadku zwiększenia stężenia insuliny (egzogenna insulina) zwiększonej pracy mięśnia sercowego
towarzyszy wzrost katabolizmu WKT i glukozy
2
.
Metabolizm w niedotlenionym mięśniu sercowym ( przepływ krwi prawidłowy, mniej oksyhemoglobiny):
• niedotlenienie
hamuje
fosforylację oksydacyjną
• zwiększenie stężenia NADH w mitochondriach
• zwiększenie stosunku NADH/NAD
+
• obniżenie stosunku ATP/ADP w mitochondriach i cytoplazmie
• hamowanie cyklu Krebsa
• hamowaniu
β – oksydacji
• hamowanie dekarboksylacji oksydacyjnej pirogronianu
• nasilenie glikolizy beztlenowej (20 – krotny wzrost zużycia glukozy):
nasilenie transportu glukozy
nasilenie
glikogenolizy
wzrost
aktywności heksokinazy (Hx), fosfofruktokinazy (PFK)
obniżenie stężenia glukozo – 6 – fosforanu
obniżenie stosunku ATP/ADP w cytoplazmie (mimo nasilenia glikolizy serce otrzymuje jedynie ok.
10 – 15% ATP w porównaniu z warunkami tlenowymi)
• zwiększenie stężenia fosfodihydroksyacetonu w cytoplazmie
• wzrost
aktywności enzymu Baranowskiego
• zwiększenie stężenia α – glicerolofosforanu w cytoplazmie
• wychwyt WKT przez serce nie zmienia się lub jest nieznacznie obniżony
• nasilenie syntezy TAG co pogłębia deficyt ATP
Metabolizm w mięśniu sercowym niedokrwionym – ograniczony dopływ krwi prawidłowo wysyconej tlenem.
Efektem niedokrwienia, oprócz niedotlenienia są trudności z dowozem substratów energetycznych i eliminacją
produktów przemiany materii.
Ognisko zawałowe jest ogniskiem niedokrwienia (ok. 5% przepływu krwi z krążenia obocznego). Cechami
charakterystycznymi dla obszaru niedokrwionego są: stała, choć znikoma podaż tlenu oraz akumulacja kwasu
mlekowego.
W ognisku niedokrwienia początkowo dochodzi do 15 – krotnego zwiększenia glikolizy beztlenowej (glukoza z
glikogenolizy), po ok. 30 min. trwania niedokrwienia glikoliza beztlenowa spada do normalnego poziomu, po ok. 60
min. dochodzi do dalszego hamowania glikolizy beztlenowej – wyczerpanie zapasów glikogenu.
Zmiany metaboliczne:
• znaczny
wzrost
stężenia kwasu mlekowego, a co za tym idzie zwiększenie stężenia H
+
• zwiększenie stosunku NADH/NAD
+
w cytoplazmie
• niedobór tlenu prowadzi do hamowania fosforylacji oksydacyjnej:
zwiększenie stosunku NADH/NAD
+
w mitochondriach
hamowanie
cyklu
Krebsa
• hamowanie
β – oksydacji
• hamowanie transportu acylo – CoA do mitochondriów, gromadzenie się WKT w cytoplazmie
Źródłem ATP w niedokrwionym mięśniu sercowym jest szczątkowe spalanie acetylo – CoA (z pirogronianu) w cyklu
Krebsa i łańcuch oddechowym.
Konsekwencje braku ATP to:
• zaburzenia
rytmu
serca
• szybkie
zanikanie
siły skurczu
• uwalnianie mioglobiny i enzymów wskaźnikowych

Diagnostyka laboratoryjna – wykłady
17/32
Objawy prodromalne (2 – 3 tyg.) zawału serca:
bóle zamostkowe w klatce piersiowej (ból może nie występować u chorych na cukrzycę)
ciągłe uczucie zmęczenia
uczucie
duszności
nadciśnienie
1
– enzym błony wewnętrznej mitochondrium, transportuje nukleotydy adenylanowe – „Podstawy cytofizjologii” M. Zabel
2
– według „Biochemii Klinicznej” S. Angielskiego zużycie glukozy rośnie przy zwiększeniu pracy mięśnia sercowego
Diagna – Wykład 10
Cukrzyca
Przyczyny zgonu chorych na cukrzycę (związane z cukrzycą) to: miażdżyca i śpiączka.
Brak insuliny powoduje, że:
• spada wykorzystanie glukozy jako substratu energetycznego
• zmniejsza
się spichrzanie glukozy w komórkach mięśniowych, wątrobowych i adipocytach, efektem jest
to, że pacjent chudnie, zwiększa się glikemia, a przy glikemii > 180 mg/dl pojawia się glukozuria, która
wywołuje diurezę osmotyczną i poliurię, to z kolei prowadzi do odwodnienia i zwiększenia pragnienia
• nasila
się glikacja białek, co wpływa na funkcję białek takich jak apolipoproteiny czy białka strukturalne
• nasilenie
się szlaku poliolowego
Szlak poliolowy jest to szlak przemian D – glukozy do sorbitolu przy udziale reduktazy aldozowej i dalej do D –
fruktozy z udziałem dehydrogenazy sorbitolu. Pierwszej reakcji towarzyszy przejście NADPH do NADP
+
, drugiej
przemiana NAD
+
do NADH. Wyczerpanie komórkowych zapasów NADPH i NAD
+
, które są niezbędne do syntezy
glutationu i NO powoduje nasilenie stresu oksydacyjnego.
Odkładanie się sorbitolu (soczewka, siatkówka, nerwy obwodowe, nerka) prowadzi do zaćmy i neuropatii (w tych
dwóch wypadkach wpływ odkładania się sorbitolu jest w pełni potwierdzony).
Autooksydacja glukozy – prowadzi do powstania wolnych rodników. Autooksydacji może podlegać glukoza wolna i
związana z białkami.
W cukrzycy wytwarzanie wolnych rodników przez fagocyty jest niekontrolowane.
W chorobie tej gorzej funkcjonują enzymy takie jak: dysmutaza ponadtlenkowa i katalaza. To upośledzenie funkcji
wynika z glikacji tych enzymów.
Brak insuliny ma wpływ nie tylko na metabolizm węglowodanów ale również lipidów i białek. Jeśli chodzi o
węglowodany to zwiększenie glikemii jest przyczyną wspomnianych już zmian: diurezy osmotycznj, glikacji białek,
nasilenia szlaku poliolowego, nasilenia stresu oksydacyjnego. Jeśli chodzi o lipidy to:
• dochodzi do glikacji apolipoprotein (ma to znaczenie zwłaszcza dla LDL – apo B)
• nasilenie stresu oksydacyjnego powoduje modyfikację cząstek LDL (oksy – LDL), co czyni te LDL
nierozpoznawalnymi (glikacja apolipoprotein ma ten sam efekt)
• pojawia
się więcej WKT (synteza VLDL i ciał ketonowych)
Przy braku insuliny zaburzona jest też gospodarka potasowa – stężenie potasu rośnie, co wynika z kilku przyczyn:
po pierwsze obniżenie poziomu insuliny bezpośrednio powoduje uwolnienie potasu z komórek, po drugie potas jest
uwalniany z rozpadających się komórek i po trzecie w kwasicy (nierzadkiej w cukrzycy) dochodzi do uwalniania
potasu z komórek.
Kwasicy ketonowej nie musi jednak towarzyszyć hiperkalemia, ponieważ potas jest tracony przez nerki na skutek
diurezy osmotycznej, poza tym ciała ketonowe wydalane są z moczem jako sole potasowe i sodowe – utrata
potasu.
Tak czy owak lecząc śpiączkę cukrzycową należy monitorować elektrolity.
Późne powikłania cukrzycowe – na ich powstanie ma wpływ kilka czynników:
• hiperglikemia
• glikacja
białek
• zaburzenia gospodarki lipidowej
• nasilenie szlaku poliolowego
• nasilony
stres
oksydacyjny
Hyperhomocysteinemia – nasila zaburzenia krzepnięcia i powoduje modyfikację apoB w LDL; jest czynnikiem
aterogennym (miażdżycorodnym) i trombogennym.
U cukrzyków występuje wzrost stężenia lipoproteiny a (norma – do 30 mg/dl), która ogranicza fibrynolizę. W skład
lipoproteiny a wchodzi apo a, która blokuje receptor dla plazminogenu.
Tutaj powinny się znajdować normy glikemii na czczo, ale są one na kserówkach z ćwiczeń więc nie będę się
przeciążać.
Diagnostyka laboratoryjna – wykłady
18/32
Diagna – Wykład 11
Hipoglikemia, głodzenie
W czasie głodzenia dochodzi do zwiększenia zużycia WKT i redukcji zużycia glukozy, nasila się też rozpad
glikogenu.
Jeśli chodzi o odżywianie się to mamy dwie fazy: anaboliczną i kataboliczną.
W tym miejscu warto zaznaczyć, że ketogeneza nie jest mechanizmem ochronnym w ostrej hipoglikemii, ale pełni
taką funkcję w hipoglikemii przewlekłej.
Glukagon i adrenalina mają doraźne działanie hiperlipemizujące. Kortyzol i hormon wzrostu działają długotrwale.
Hipoglikemię dzielimy na głodową i reaktywną (poposiłkową).
Hipoglikemia reaktywna:
• hipoglikemia
pokarmowa
• wrodzona nietolerancja fruktozy
• okres
poprzedzający wystąpienie cukrzycy typu II
• hipoglikemia idiopatyczna (czynnościowa)
Pacjenci z hipoglikemią na czczo mogą mieć komponentę reaktywną, ale pacjenci z hipoglikemią reaktywną nie
mają hipoglikemii na czczo.
Poposiłkowy hiperinsulinizm występuje po zabiegach operacyjnych, w wyniku których skrócony został przewód
pokarmowy lub przecięty został nerw błędny, co powoduje szybkie opróżnianie żołądka i szybkie wchłanianie
glukozy, co z kolei nasila wydzielanie insuliny. Stężenie insuliny obniża jednak się wolniej niż stężenie glukozy.
Przekarmienie glukozą lub sacharozą może prowadzić do stymulacji układu współczulnego co prowadzi do
nasilenia uwalniania adrenaliny. Długotrwałe przekarmianie i stymulacja układu współczulnego może prowadzić do
wyczerpania rezerw insuliny w trzustce i rozwoju cukrzycy.
Hipoglikemia głodowa
Przyczyny tej choroby mogą być różne:
obniżenie produkcji glukozy
• niedobory
hormonalne:
niedoczynność przysadki
niedoczynność kory nadnerczy
niedobór
glukagonu
• defekty
enzymatyczne:
glukozo–6–fosfataza
fosforylaza
wątrobowa
karboksylaza
pirogronianowa
• niedobór
substratów:
hipoglikemia ketogenna noworodków
znaczące niedożywienie
późny okres ciąży
przewlekła niewydolność nerek
dystrofia
mięśniowa
Faza Podstawowy
hormon
Osoczowe
substraty
Kierunek zmian
Aktywne procesy
anaboliczna
Insulina Zwiększenie
stężenia glukozy,
TAG,
aminokwasów i
obniżenie stężenia
WKT i ciał
ketonowych.
Magazynowanie i
produkcja energii.
1. odkładanie
glikogenu
2. synteza
aminokwasów
3. formowanie TAG
kataboliczna
Glukagon Obniżenie stężenia
glukozy, TAG,
aminokwasów i
zwiększenie
stężenia WKT i ciał
ketonowych.
Uwalnianie
zmagazynowanych
zapasów.
1. glikogenoliza
2. glukoneogeneza
3. proteoliza
4. lipoliza
5. ketogeneza

Diagnostyka laboratoryjna – wykłady
19/32
• nabyte
choroby
wątroby:
wątroba zastoinowa
zapalenie
wątroby
marskość wątroby
mocznica
• subatancje chemiczne (leki):
alkohol
salicylany
nadmierne
zużycie glukozy:
• hiperinsulinizm:
insulinoma
egzogenna
insulina
autoimmunologiczny
zespół insulinowy
wstrząs endotoksyczny
• właściwy poziom insuliny:
guzy
części zewnątrzwydzielniczej trzustki
wady metabolizmu kwasów tłuszczowych
kacheksja z niedoboru tłuszczów
Jeżeli do zrównoważenia hipoglikemii trzeba zużyć >200g glukozy to choroba wynika ze zwiększonego zużycia
glukozy. Jeżeli trzeba zużyć <200g glukozy to nie można wyciągnąć żadnych wniosków.
Jeszcze parę słów o alkoholu:
Utlenianie alkoholu zwiększa stężenie NADH, co obniża glukoneogenezę. Poza tym niedobór tiaminy i
podwyższony poziom NADH prowadzą do zablokowania dehydrogenazy pirogronianowej, czego skutkiem jest
zwiększenie stężenia pirogronianu i mleczanu.
Jeszcze parę faktów odnośnie samej diagnostyki:
1. O hipoglikemii mówimy gdy stężenie glukozy we krwi spadnie poniżej 45 mg/dl.
2. Współczynnik stężenia insuliny (
µg/ml) do stężenia glukozy (mg/dl) powinien wynosić < 0,3 (0,4).
3. Stężenie C – peptydu w osoczu powinno wynosić 1 – 2
µg/l (0,33 – 0,55 mmol/l).
4. Przedłużone głodzenie:
• w czasie 72 – godzinnego testu podaje się tylko płyny
• mierzenie
stężenia glukozy, insuliny i kortyzolu co 6h oraz w momencie wystąpienia objawów
hipoglikemii
5. Przedłużony OGTT
1
:
• test 5 – godzinny
• pomiar
stężenia glukozy i insuliny co 1h oraz w momencie wystąpienia objawów hipoglikemii
6. Test hamowania endogennej insuliny:
• wlew
dożylny insuliny 0,1 U/kg m.c.
• w
ciągu 60 min. glikemia obniża się do około 45 mg/dl, a stężenie C – peptydu spada poniżej
1,2
µg/l
7. Test prowokacji glukagonem:
• 1mg glukagonu dożylnie
• pomiar glikemii co 10 min.
• szybki wzrost glikemii i następnie powrót do wartości wyjściowych w ciągu 90 min.
1
– doustny test obciążenia glukozą Oral Glucose Tolerance Test
To by było na tyle, jeśli chodzi o
wykłady z diagnostyki, teraz
medycyna laboratoryjna.
Diagnostyka laboratoryjna – wykłady
20/32
Medycyna laboratoryjna – Wykład 1
Zawał, miażdżyca i lipoproteiny
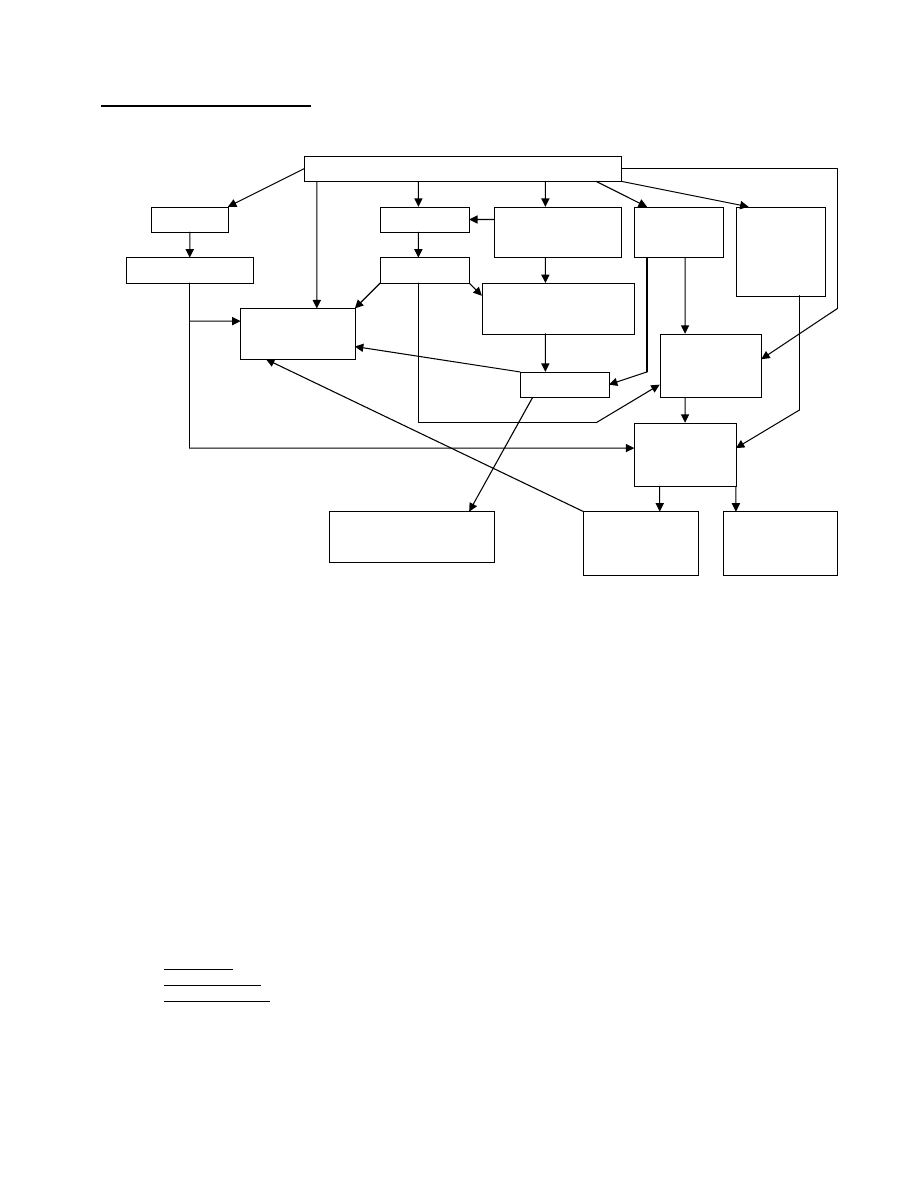
Zawał mięśnia sercowego doprowadza m.in. do aktywacji układu adrenergicznego, czego efektem jest:
Do tego przejrzystego jak asfalt schematu trzeba jeszcze dodać parę słów. Po pierwsze aktywacja układu
dopełniacza doprowadza (przy udziale IL1 – z makrofagów) do migracji i naciekania obszaru niedokrwienia przez
granulocyty, co z kolei prowadzi do martwicy ogniska i do uwalniania anionorodnika ponadtlenkowego, rodnika
hydroksylowego, tlenu singletowego, LTB
2
, i PAF (pobudzającego wydzielanie TXA
2
).
Podwyższone stężenie Ca
+2
w komórce powoduje zwiększenie aktywności oksydazy ksantynowej, co prowadzi do
nasilenia syntezy rodników tlenowych w brzeżnej warstwie niedokrwienia, a w fazie reperfuzji w całym tym obszarze
(dostęp O
2
).
Postępowanie w bólu wieńcowym:
• uspokoić
• nitrogliceryna
• aspiryna
Jednorazowe podanie aspiryny powoduje trwałe zablokowanie syntezy tromboksanu w danej populacji płytek (płytki
żyją ok. 1 tyg.). Duże dawki blokują syntezę prostacykliny – brak efektu.
W zawale należy podawać płyn łączony: K
+
+ glukoza + insulina.
Diagnostyka
Na diagnostykę zawału składają się: obraz kliniczny, EKG oraz oznaczenie markerów biochemicznych.
Aby wykluczyć zawał oznacza się:
mioglobinę
masę troponiny
masę izoenzymu sercowego kinazy kreatynowej
Mioglobina jest niespecyficzna, ale pozwala określić czy proces zawałowy został zahamowany czy postępuje
(kinetyka zawału).
Jeśli chodzi o TnC to nie można odróżnić czy pochodzi ona z serca czy z mięśni szkieletowych, można natomiast
wskazać pochodzenie TnT i TnI.
Kinaza kreatynowa wykazuje aktywność po kilku godzinach (ok. 8h), jeżeli ocenia się masę, a nie aktywność to
można wykryć enzym wcześniej i można określić od jak dawna jest on obecny w osoczu.
Pobudzenie układu adrenergicznego
RAA
Utrata K
+
i Mg
+
Zburzenia
rytmu serca
lipoliza
WKT
Hamowanie
sekrecji insuliny
Upośledzenie
wchłaniania glukozy
Kwasica
Hormony
tarczycy
Agregacja
płytek i
zab. w
uwalnianiu
TXA
2
Zwiększenie
zapotrzebow
ania na O
2
Brak ATP i
uszkodzenie
serca
Obniżenie
stężenia K
+
w
komórce
Podwyższone
stężenie Ca
+2
w komórce
Aktywacja składowych
dopełniacza

Diagnostyka laboratoryjna – wykłady
21/32
Jeżeli w ciągu 4 – 6h od wystąpienia objawów nie wystąpi wzrost poziomu TnI to można wykluczyć zawał.
Najwcześniej ze wszystkich markerów pojawia się mioglobina, drugi w kolejności pojawia się izoenzym sercowy
kinazy kreatynowej (wzrasta też aktywność całkowitej kinazy kreatynowej, potem pojawiają się pozostałe markery.
Izoformy CK – MB
CK – MB
2
jest izoformą tkankową; zawiera dodatkową lizynę.
CK – MB
1
jest izoformą osoczową; bez lizyny; szybciej wędruje do katody
CK – MM ma trzy izoformy- CK – MM
1
, CK – MM
2
, CK – MM
3
(ta ostatnia izoforma jest formą tkankową; z lizyną;
wolno wędruje do katody).
U ludzi zdrowych stosunek CK – MB
1
/CK – MB
2
= 1, czyli CK – MB
2
stanowi 50% CK – MB. Po ok. 4h od zawału
CK – MB
2
stanowi już 75% CK – MB. Po 12h wzrasta stężenie CK – MB
1
, ale CK – MB
2
to i tak ponad 75% ogólnej
CK – MB.
Wykluczenie zawału serca na podstawie aktywności enzymu jest możliwe po ok. 10h. Ocena masy lub izoformy
enzymu pozwala wykluczyć zawał w pierwszych 4h.
Przedwczesna miażdżyca
O przedwczesnej miażdżycy mówimy wtedy gdy pojawia się ona przed 55 rokiem życia u mężczyzn lub przed 65
rokiem życia u kobiet.
Czynniki ryzyka przedwczesnej miażdżycy :
hiperlipoproteinemia
nadciśnienie
otyłość
cukrzyca
palenie
tytoniu
brak
wysiłku fizycznego
CNS lub choroby innych tętnic u członków rodziny
płeć męska
młody wiek
typ
zachowania
A
Lipoproteiny
W centralnej części lipoproteiny znajdują się triacyloglicerydy i estry cholesterolu, zewnętrznie umiejscowione są
fosfolipidy, wolny cholesterol i apoproteiny. Apoproteiny mogą być peryferyjne lub integralne (np.: apo B, apo A).
Jeśli chodzi o ich funkcje to są one ligandami dla receptorów, pełnią rolę enzymów poza tym duże znaczenie ma ich
hydrofilność.
Podział lipoprotein:
Ultrawirowanie:
• chylomikrony (0,900 – 0,960)
• VLDL (0,960 – 1,006)
• LDL
1
lub IDL (1,006 – 1,019)
• LDL
2
(1,019 – 1,063)
• HDL (1,063 – 1,210)
Lipidogram
(elektroforeza):
• WKT
związane z albuminą
• α
1
– lipoproteiny (0,25 – 0,46 g/g śr. 35) – odpowiadają frakcji HDL
• pre
β – lipoproteiny (0,17 – 0,33 g/g śr. 25) – odpowiadają frakcji VLDL
• β – lipoproteiny (0,32 – 0,48 g/g śr. 40) – odpowiadają frakcji LDL
• chylomikrony – nie wędrują w polu elektrycznym
Precypitacja – do rozdzielenia lipoprotein tą metodą wykorzystuje się heparynę lub siarczan dekstranu i
jony dwuwartościowe (np. Ca
2+
); w supernatancie pozostają HDL
2
i HDL
3
, w osadzie natomiast znajdują
się VLDL, LDL i HDL
1
.
Jeszcze słowo wyjaśnienia odnośnie jednostki g/g – oznacza ona jaka część barwnika została związana przez
poszczególne frakcje.
Współczynniki.
Stosunek:
α + pre β + β / α u zdrowych ludzi wynosi 2,5 – 3,0. Zwiększenie się tego stosunku do 10 jest
równoznaczne z dwukrotnym zwiększeniem ryzyka wystąpienia przedwczesnej miażdżycy, a zwiększenie się go do
23 oznacza trzykrotny wzrost tego ryzyka.
Innym współczynnikiem, który można określać jest stosunek: chol. we frakcji LDL / chol. we frakcji HDL, optimum to
wartości 2,5 – 3,0.
A teraz trochę o poszczególnych frakcjach:
LDL
1
i LDL
2
stanowią frakcję LDL
Diagnostyka laboratoryjna – wykłady
22/32
HDL lub
α – lipoproteiny składają się w 50% z protein i w 50% ze składników lipidowych. Połowę składników
lipidowych (25% całości) stanowią fosfolipidy, 1/3 stanowi cholesterol, a reszta to triacyloglicerole. Funkcją tych
lipoprotein jest transport fosfolipidów i estrów cholesterolu do wątroby. Im więcej jest ich we krwi tym mniejsze
ryzyko rozwoju miażdżycy.
LDL lub
β – lipoproteiny składają się w 80% ze składników lipidowych i w 20% z protein. 60% składników
lipidowych stanowi cholesterol i estry cholesterolu, 20% to fosfolipidy i 20% to triacyloglicerole. Funkcją tej frakcji
jest transport cholesterolu z wątroby do tkanek. Im wyższy poziom tych lipoprotein tym większe ryzyko rozwoju
miażdżycy.
VLDL lub pre
β – lipoproteiny składają się w 90% ze składników lipidowych i w10% z protein. Triacyloglicerole
stanowią 50% składników lipidowych na pozostałe 50% składają się fosfolipidy i cholesterol. Wysoki poziom tych
lipoprotein zwiększa ryzyko rozwoju miażdżycy (choć nie są tak groźne jak LDL).
Chylomikrony składają się głównie ze składników lipidowych, proteiny stanowią 1 – 2%. Triacyloglicerole stanowią
90% składników lipidowych, pozostałe 10% to fosfolipidy i cholesterol. Funkcją chylomikronów jest transport
egzogennych TAG z jelit. Chylomikrony nie odgrywają dużej roli w rozwoju miażdżycy.
Wolne kwasy tłuszczowe:
• są transportowane w osoczu z albuminami (kilka miejsc wiązania o różnym powinowactwie)
• stężenie zmienne – maleje po posiłku węglowodanowym i rośnie ponownie przed kolejnym posiłkiem
• wartości referencyjne:
0,4 – 0,8 mmol/l po posiłku węglowodanowym
0,7 – 0,8 mmol/l w głodzeniu
do 2,0 w cukrzycy niewyrównanej
do 1,0 po posiłku tłuszczowym
• stężenie rośnie w następujących sytuacjach: stres, wysiłek, głód, cukrzyca (wzrost stężenia WKT w
osoczu jest jednym z pierwszych objawów)
• w cytozolu WKT wiązane są prze białko Z, które pełni rolę podobną jak albumina w surowicy
A teraz dla odmiany tabelka – procentowa zawartość apoprotein w poszczególnych frakcjach lipoprotein:
Chyl
VLDL
LDL
HDL
Apo A
25%
ślad – 80%
Apo B
15%
35%
>95% –
Apo C
50%
50%
ślad 10%
Apo D
ślad
ślad – 5%
Apo E
10%
15%
ślad 5%
Apoproteiny
Apo A
1
– wartości referencyjne to 2,43 – 3,86 g/l; wyróżniamy apo A I i apo A II. Wartości referencyjne apo A
I są
różna dla mężczyzn i kobiet, i wynoszą: M 1,15 – 1,9 g/l, K 1,15 – 2,2 g/l. Apo A I to główna apoproteina HDL, jest
aktywatorem LCAT. Apo A II stabilizuje strukturę HDL.
Zwiększenie stężenia apo A występuje na skutek działania estrogenów (ciąża) oraz w rodzinnej
hiper –
α –lipoproteinemii, wiąże się ono ze zmniejszeniem ryzyka rozwoju miażdżycy. Obniżenie poziomu apo A
występuje jako efekt rodzinnej hipo –
α –lipoproteinemii oraz w chorobie Tangierskiej (patrz wykład 2.), efektem jest
zwiększenie ryzyka wystąpienia miażdżycy.
Apo B – 100 – wartości referencyjne to: M 0,6 – 1,5 g/l, K 0,7 – 1,6 g/l. Apoproteina ta jest ligandem dla receptorów
LDL (receptory te rozpoznają apo B/E), jest to główna apoproteina LDL (pochodzi z VLDL do których jest
wbudowywana w wątrobie).
Zwiększenie jej stężenia występuje w pod wpływem działania progesteronu (ciąża), zwiększa ono ryzyko
wystąpienia miażdżycy. Obniżenie stężenia występuje w rodzinnej hipo –
β – lipoproteinemii oraz jako efekt
działania estrogenów.
Apo B – 48 – jest to jedna z głównych apoproteina chylomikronów, syntetyzowana w jelicie.
Apo C I – aktywator LCAT.
Apo C II – aktywator LPL, główna apoproteina VLDL i chylomikronów. Obniżenie stężenia apo C II występuje we
wrodzonym niedoborze autosomalnym, w hiperchylomikronemii oraz na czczo.
Diagnostyka laboratoryjna – wykłady
23/32
Apo C III – hamuje LPL.
Apo D – przenosi estry cholesterolu w HDL.
Apo E – ligand dla receptora apo E i apo B/E.
Apo a – ma budowę zbliżoną do plazminogenu (wiąże się tam gdzie plazminogen, a nie ma jego aktywności),
wiąże się z apo B mostkiem disiarczkowym, jest to składnik lipoproteiny a, jest bardzo aterogenna.
LCAT (acylotransferaza lecytyna – cholesterol)
Jest syntetyzowana w wątrobie, głównie w HDL. Jej aktywatory to: apo A Katalizuje ona reakcję estryfikacji
cholesterolu (substraty to cholesterol i lecytyna, a produkty to estry cholesterolu i lizolecytyna). Estry cholesterolu
są hydrofobowe dlatego znajdują się one w rdzeniu HDL. Sytuacją optymalną jest stosunek lecytyny do
cholesterolu jak 3:1, taka sytuacja występuje tylko w HDL
3
.
LPL (lipaza lipoproteinowa)
Jej aktywatorem jest apo C II, hamują ją apo C III i apo C I. Syntetyzowana jest w komórkach różnych narządów i
tkanek (tkanka tłuszczowa, mięsień sercowy, mięśnie szkieletowe, gruczoł piersiowy, wątroba – lipaza wątrobowa
jest inna!).
Enzym zlokalizowany jest na powierzchni komórek śródbłonka naczyń włosowatych, stąd LPL pozawątrobowa
uwalniana jest do surowicy przez heparynę.
LPL różnego pochodzenia cechuje różne powinowactwo do substratu (TAG). LPL serca ma duże powinowactwo,
natomiast powinowactwo LPL tkanki tłuszczowej jest małe (enzym ten działa tylko w obecności insuliny).
Funkcją tego enzymu jest zapewnienie napływu WKT do tkanek. W przypadku serca WKT są substratem
energetycznym, w tkance tłuszczowej są z nich syntetyzowane triacyloglicerydy, służące jako materiał zapasowy.
Na zakończenie wartości referencyjne dla cholesterolu, TAG, LDL i HDL.
ZDROWI ZAGROŻENI
MIAŻDŻYCĄ
KONIECZNA
TERAPIA
CAŁKOWITY
CHOLESTEROL
150 – 190 mg/dl
200 – 240 mg/dl
>240 mg/dl
TAG
<150 mg/dl
150 – 200 mg/dl
>200 mg/dl
CHOLESTEROL
W LDL
<115 mg/dl
(u osób z CNS
<100 mg/dl)
115 – 160 mg/dl
>160 mg/dl
CHOLESTEROL
W HDL
>35 mg/dl
(0,9 mmol/l)
Optimum to:
M 35 – 70 mg/dl
(0,9 – 1,8 mmol/l)
K 40 – 80 mg/dl
(1,0 – 2,1 mmol/l)
<35
mg/l
Na koniec tego zakończenia przeliczniki:
Cholesterol:
1 mmol/l = 1 mg/dl
× 0,0259
TAG
1 mmol/l = 1 mg/dl
× 0,0114
Na absolutny koniec, końca tego zakończenia „test zimnej flotacji”:
Mętną surowicę zostawiamy na noc w lodówce, jeżeli rano na powierzchni pojawi się kożuszek, a surowica będzie
klarowna to znaczy, że przyczyną zmętnienia były chylomikrony, jeżeli surowica pozostanie mętna i nie pojawi się
kożuszek to znaczy, że za zmętnienie odpowiada VLDL, a jeżeli surowica pozostanie mętna i jednocześnie pojawi
się kożuszek świadczy to o obecności zarówno chylomikronów jak i VLDL.
1
– Harper wspomina jeszcze o apo A IV, która jest wydzielana z chylomikronami, ale przenoszona do HDL; jest związana z
tworzeniem lipoprotein bogatych w TAG; synteza w ścianie jelita; funkcja nieznana

Diagnostyka laboratoryjna – wykłady
24/32
Medycyna laboratoryjna – Wykład 2
Zaburzenia metabolizmu lipoprotein
W chorobach związanych z metabolizmem lipoprotein podstawowe badania to:
• ocena wizualna surowicy
• poziom
całkowitego cholesterolu w surowicy
• poziom TAG w surowicy
• poziom cholesterolu – HDL
• poziom apo A, apo A I i apo B
• lipidogram
Pierwotna hiperlipoproteinemia – diagnostyka:
• wykluczyć wtórne hiperlipoproteinemie
• trzeba
stwierdzić trzykrotnie dyslipoproteinemię:
w
odstępach 7 – 14 dniowych
w
warunkach
standardowych
w okresie stabilizacji masy ciała
w czasie stosowania zwykłej diety
po 4 tygodniach od odstawienia leków
• choroba
rodzinna
• wzrost poziomu pojedynczej frakcji lipoprotein
• często komplikacje sercowo – naczyniowe
• Xanthoma
na
skórze
• zaburzeniom lipidowym często towarzyszą zaburzenia metabolizmu węglowodanów i kwasu moczowego
• klasyfikacja
wg
Fredericksona
• gdy surowica jest mleczna wykonuje się test zimnej flotacji
TYP I
• inne nazwy to: choroba Buerger – Gruetza
1
, hyperchylomikronemia, hipertriacyloglicerydemia
indukowana tłuszczami, hiperlipemia egzogenna
• stanowi 1% pierwotnych hiperlipoproteinemii
• surowica
żółto – mleczna, po teście zimnej flotacji przezroczysta z kożuszkiem
• bardzo
wyraźny wzrost poziomu TAG (do 12 mmol/l, wartości referencyjne to < 1,7 mmol/l)
• przyczyny: deficyt LPL lub apo C II
• dziedziczenie autosomalne recesywne
• objawy
u
dzieci:
hepatosplenomegalia
Xanthoma
siatkówka
hiperlipemiczna
kolka brzuszna (pierwszy objaw)
TYP IIa
• inne nazwy: hipercholesterolemia rodzinna, Xanthomatoza hipercholesterolemiczna rodzinna,
hiperbetalipoproteinemia
• stanowi 40% pierwotnych hiperlipoproteinemii
• dziedziczenie autosomalne dominujące (różne objawy u homo i heterozygot)
• przyczyna: niedobór receptora apo B/E
• surowica
żółta przezroczysta
• bardzo wzrasta poziom całkowitego cholesterolu (15 – 25 mmol/l, wartości referencyjne to ok. 5 mmol/l)
• zwiększa się stężenie β – lipoprotein (LDL)
• wcześnie rozwija się ciężka miażdżyca, szczególnie u homozygot, heterozygoty – nagła śmierć ok. 40 –
45 roku życia
TYP IIb
• inne nazwy: hipercholesterolemia mieszana, hipercholesterolemia z hipertriacyloglicerydemią
• surowica
żółta opalizująca
• jest to defekt poligenowy
• zwiększenie poziomu całkowitego cholesterolu do 10 – 15 mmol/l
• zwiększenie stężenia β – lipoprotein (LDL)
• zwiększenie poziomu TAG do 6 – 8 mmol/l
• zwiększenie poziomu pre β – lipoprotein (VLDL)
Diagnostyka laboratoryjna – wykłady
25/32
TYP III
• inna nazwa: dysbetalipoproteinemia
• stanowi < 5% pierwotnych hiperlipoproteinemii
• zwiększenie poziomu TAG
• zwiększenie poziomu całkowitego cholesterolu
• w lipidogramie szerokie pasmo β (od pre β – lipoprotein (VLDL) do β – lipoprotein (LDL))
• przyczyna:
występowanie apo E 2/2 (85%) lub apo E 4/2 (15%) – wyróżnia się trzy allele genu
kodującego apo E: E
2
, E
3
i E
4
co daje sześć fenotypów apo E, receptory hepatocytów dla apo B/E nie są
wrażliwe na apo E 2/2 i są mało wrażliwe na apo E 4/2
• miażdżycorodność
TYP IV
• inne nazwy: hipertriacyloglicerydemia indukowana węglowodanami, hiperlipemia endogenna
• często połączona jest z cukrzycą i otyłością
• komplikacje sercowo – naczyniowe występują później niż w typach II i III
• przyczyna:
obniżenie stosunku apo C II / apo C III
• surowica
żółto – mleczna, po teście zimnej flotacji bez zmian
• poziom
TAG
zwiększony do ok. 10 mmol/l
• wzrost
stężenia pre
β – lipoprotein (VLDL)
• nietolerancja glukozy – obniżenie wrażliwości na insulinę
• podobna do hipertriacyloglicerydemii alkohowej
• poprawa po diecie ryżowo – jabłkowej
TYP V
• inne nazwy: hipertriacyloglicerydemia mieszana, hiperlipemia egzogenno – endogenna,
hipertriacyloglicerydemia indukowana tłuszczami i węglowodanami
• stanowi < 5% pierwotnych hiperlipoproteinemii
• poziom
TAG
rośnie do ok. 20 mmol/l
• podniesienie poziomu dwóch frakcji: chylomikronów i pre β – lipoprotein (VLDL)
• bez komplikacji sercowo – naczyniowych
• często z cukrzycą i zapaleniem trzustki
TYP VI
• inna nazwa: hiperalfalipoproteinemia
• członkowie rodzin w których występuje ten typ hiperlipoproteinemii są długowieczni, obniża się ryzyko
rozwoju miażdżycy tętnic
• skład HDL nie różni się od prawidłowego
Należy pamiętać, że u osób z poziomem Ch – HDL poniżej 35 mg/dl (0,9 mmol/l) ryzyko rozwoju miażdżycy jest
ośmiokrotnie większe niż u osób z poziomem Ch – HDL równym 60 mg/dl (1,5 mmol /l).
Stężenie Ch – HDL jest regulowane przez czynniki genetyczne, hormonalne, środowiskowe i leki. Wzrost poziomu
Ch –HDL występuje pod wpływem estrogenów, umiarkowanego wysiłku fizycznego i polifenoli (czerwone wino,
zielona herbata). Obniżenie poziomu Ch – HDL występuje jako efekt zwiększenia poziomu TAG lub palenia tytoniu.
Ogólna charakterystyka hiperlipoproteinemii:
TYP CHOL TAG CHYL VLDL IDL LDL HDL Test
zimnej
flotacji
SUROWICA
I
bez
zmian
znaczny
wzrost
wzrost bez
zmian
bez
zmian
bez
zmian
bez
zmian
wykonać mleczna
/
przezroczysta z
kożuszkiem
IIa
znaczny
wzrost
bez
zmian
bez
zmian
bez
zmian
bez
zmian
wzrost bez
zmian
zbędny przezroczysta
żółta
IIb
znaczny
wzrost
wzrost bez
zmian
wzrost bez
zmian
wzrost bez
zmian
zbędny opalizująca
III
wzrost wzrost bez
zmian
wzrost
(szerokie pasmo
β)
bez
zmian
zbędny opalizująca
IV
bez
zmian
znaczny
wzrost
bez
zmian
wzrost bez
zmian
bez
zmian
bez
zmian
wykonać mleczna
/
mleczna
V
bez
zmian
znaczny
wzrost
wzrost wzrost bez
zmian
bez
zmian
bez
zmian
wykonać
mleczna / mleczna z
kożuszkiem
VI
bez
zmian
bez
zmian
bez
zmian
bez
zmian
bez
zmian
bez
zmian
wzrost zbędny przezroczysta
żółta

Diagnostyka laboratoryjna – wykłady
26/32
W hiperlipoproteinemii o typu IV poziom całkowitego cholesterolu nie przekracza 240 mg/dl, poziom TAG
przekracza 200 mg/dl. W hiperlipoproteinemii typu IIa jest dokładnie odwrotnie. Hiperlipoproteinemia o typie IIb
cechuje się zwiększeniem poziomu wolnego cholesterolu ponad 240 mg/dl i zwiększeniem poziomu TAG ponad
200 mg/dl.
Hiperlipoproteinemie wtórne:
• cukrzyca:
wzrost poziomu TAG (w kwasicy ketonowej)
wzrost
stężenia całkowitego cholesterolu (aterogenny)
• choroby
tarczycy:
wzrost poziomu TAG (w hiper i hipotyreozie)
całkowity cholesterol rośnie w obrzęku śluzowatym, a obniża się w chorobie Basedowa
• dna
moczanowa:
wzrost
stężenia całkowitego cholesterolu
wzrost
stężenia TAG
• choroby
wątroby:
cholestaza
–
wzrost
stężenia całkowitego cholesterolu i lipoproteiny X
hepatitis – wzrost stężenia całkowitego cholesterolu; zmiany poziom cholesterolu mają znaczenie
prognostyczne – zmniejszenie stężenia oznacza zdrowienie, podwyższenie poziomu oznacza ostrą
niewydolność wątroby
zespół Zieve (alkoholowy) – hiperlipoproteinemia, żółtaczka, hemoliza
marskość żółciowa – wzrost stężenia
β – lipoprotein, bilirubiny sprzężonej i fosfatazy alkalicznej
glikogenozy – wzrost poziomu TAG
• zapalenie trzustki ostre i przewlekłe:
wzrost poziomu TAG (proces może przebiegać w drugą stronę tzn. wysoki poziom TAG może
spowodować zapalenie trzustki)
• nerczyce
lipidowe:
zwiększenie stężenia całkowitego cholesterolu
zwiększenie stężenia TAG
zmiany
stężenia całkowitego cholesterolu i TAG są proporcjonalne do hipoalbuminemii i proteiinurii
• zespół Cushinga:
wzrost
stężenia TAG
często postać jatrogenna z powodu długiego leczenia kortykosteroidami
Zmiany poziomu lipoprotein w cholestazie wewnątrz i zewnątrzwątrobowej
W żółtaczce zastoinowej dochodzi do zwiększenia poziomu LDL i obniżenia poziomu HDL. Wzrost stężenia frakcji
LDL obejmuje lipoproteiny z różnymi apoproteinami (apo A, apo B, apo X). Rośnie głównie stężenie lipoproteiny X
(LDL zawierająca apo X), lipoproteina ta nie występuje w surowicy osób zdrowych, ponieważ jest usuwana z żółcią.
Stężenie lipoproteiny X zależy od nasilenia i czasu trwania cholestazy.
Do wykrywania LP X używa się swoistych przeciwciał anty – LP X.
Hipolipoproteinemie wrodzone:
• abetalipoproteinemia:
cecha autosomalna recesywna – objawy występują tylko u homozygot
brak syntezy apo B – brak chylomikronów, VLDL i LDL
niedobór
witamin
ADEK
demielinizacja spowodowana brakiem LDL
obniżenie odporności mechanicznej erytrocytów – niedobór cholesterolu w erytrocytach
objawy:
biegunki
(obniżony rozwój u dzieci), zmiany w układzie nerwowym, zwyrodnienie siatkówki
(utrata wzroku), akantocytoza
• choroba
Tangierska:
cecha autosomalna recesywna – pełne objawy występują u homozygot
brak apo A I w surowicy, jest ona syntetyzowana, ale katabolizm zachodzi bardzo szybko u
homozygot jej poziom to zaledwie 1% normy
objawy to powiększenie i pomarańczowe zabarwienie migdałków, powiększenie wątroby, śledziony
i węzłów chłonnych
brak lub deficyt prawidłowych HDL
po
40
roku
życia zwiększone ryzyko wystąpienia miażdżycy (heterozygoty – 26%, homozygoty –
49%)
• rodzinny niedobór LCAT:
dziedziczenie autosomalne recesywne – pełne objawy u homozygot
heterogenność frakcji
zwiększenie stężenia wolnego cholesterolu i lecytyny
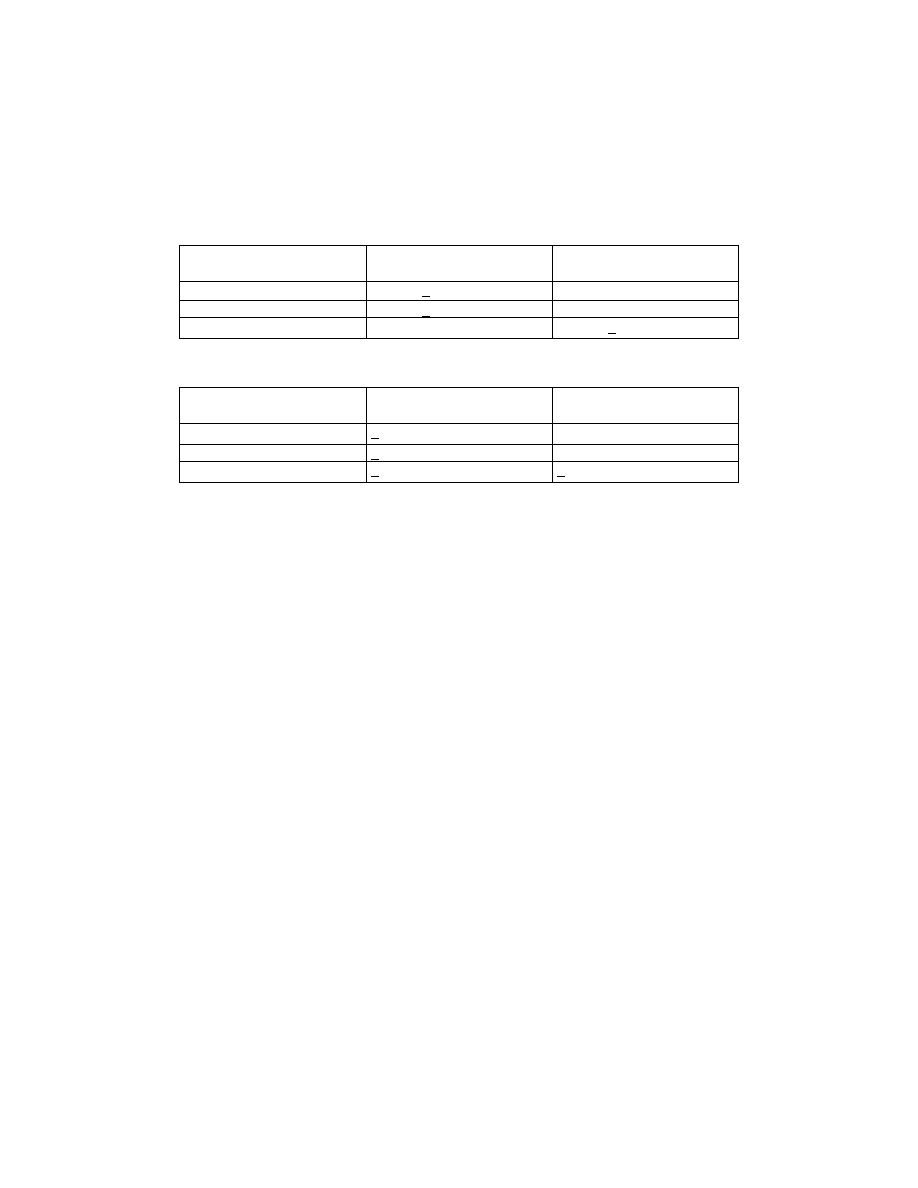
Diagnostyka laboratoryjna – wykłady
27/32
objawy: niedokrwistość (obniżone wytwarzanie i zwiększona eliminacja erytrocytów), zmiany w
nerkach (mikroalbuminuria prowadząca do białkomoczu i dalej do niewydolności nerek), zmętnienie
rogówki u dzieci (cholesterol)
Diagnostyka i leczenie hiperlipoproteinemii
Diagnostyka – w Europie oznacza się na czczo stężenie całkowitego cholesterolu i cholesterolu LDL, w USA
stężenie całkowitego cholesterolu i cholesterolu HDL oznacza się przygodnie, a na czczo oznacza się stężenie
cholesterolu LDL.
Wybór terapii zależy od stężenia cholesterolu LDL:
Leczenie dietą
Stan pacjenta
Wskazanie do leczenia
(poziom LDL – chol)
Cel leczenia
(poziom LDL – chol)
Bez CNS i najwyżej 1 ICR
> 160 mg/dl
<160 mg/dl
Bez CNS i 2 lub więcej ICR
> 130 mg/dl
<130 mg/dl
Objawy CNS
> 100 mg/dl
< 100 mg/dl
Leczenie farmakologiczne
Stan pacjenta
Wskazanie do leczenia
(poziom LDL – chol)
Cel leczenia
(poziom LDL – chol)
Bez CNS i najwyżej 1 ICR
> 190 mg/dl
<160 mg/dl
Bez CNS i 2 lub więcej ICR > 160 mg/dl
<130 mg/dl
Objawy CNS
> 130 mg/dl
< 100 mg/dl
CNS – choroba niedokrwienna serca
ICR – czynnik ryzyka
Lipoproteina a
Wartości referencyjne stężenia LP (a) – poniżej 30 mg/dl. Jest to LDL zawierająca apo (a). Jest ona dodatnim
białkiem ostrej fazy budową przypominającym plazminogen. Jest to niezależny czynnik ryzyka rozwoju CNS. Może
być usuwana z krwi przez plazmaferezę.
Homocysteina (HCY)
2
Homocysteina może być przekształcana do aktywnej metioniny, cysteiny (wit. B
6
) lub metioniny (kwas foliowy i wit.
B
12
). Jej stężenie nie powinno przekraczać 16
µmol/l, jeżeli jest większe mówimy o hiperhomocysteinemii, którą
można podzielić na umiarkowaną (16 – 30
µmol/), pośrednią (30 – 100 µmol/) i ciężką (> 100 µmol/).
Przyczyny:
• genetyczne
• niedobór
witamin
• niewydolność nerek (hiperhomocysteinemia wtórna)
• choroby nowotworowe (hiperhomocysteinemia wtórna)
• leki i używki (alkohol, kawa, papierosy)
Objawy kliniczne:
• miażdżyca naczyń ( z zaburzeniami mają związek reaktywne formy tlenu, LDL, NO)
• zakrzepy
i
zatory
• nadmierna
długość kości
• osteoporoza
• opóźnienie rozwoju umysłowego
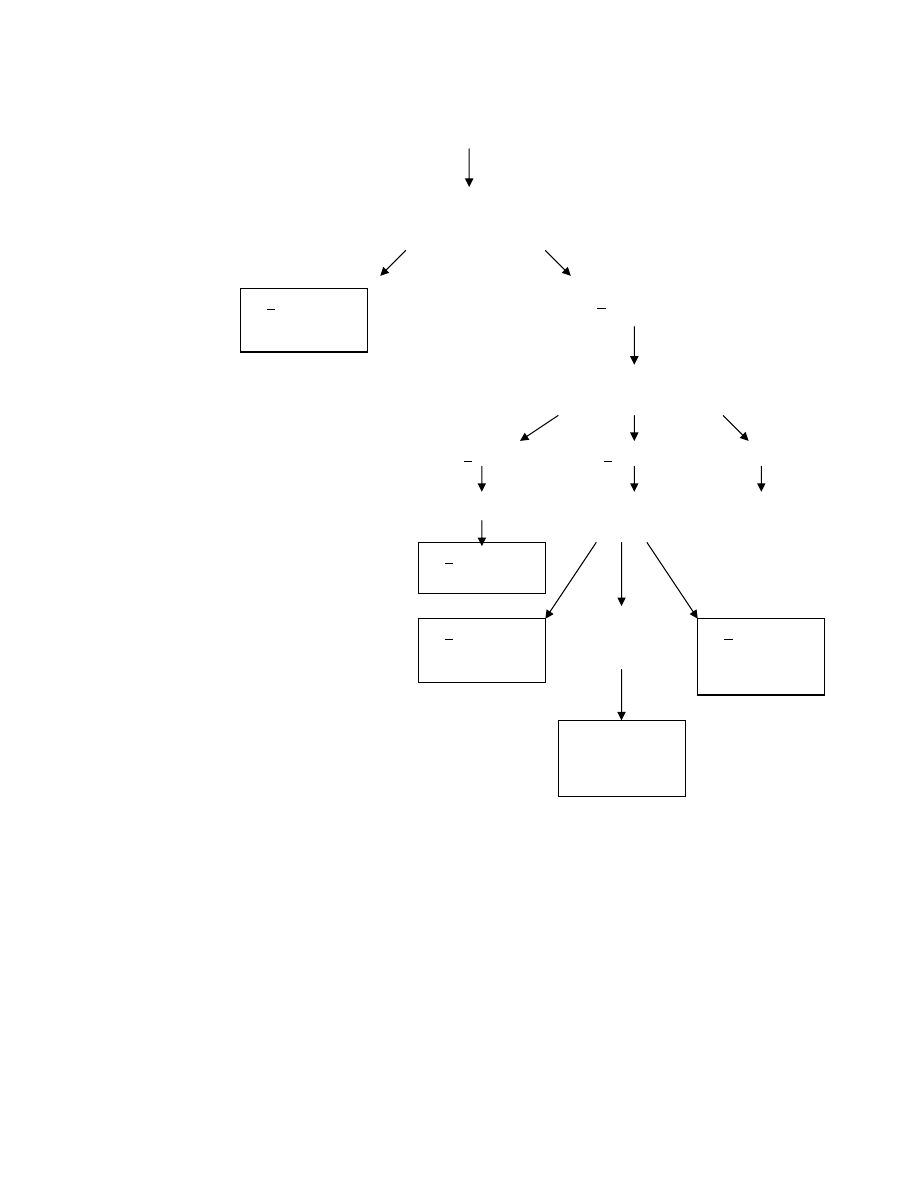
Diagnostyka laboratoryjna – wykłady
28/32
Postępowanie w przypadku podejrzenia cukrzycy
Zespół metaboliczny (zespół X):
• podwyższenie poziomu TAG
• obniżenie poziomu cholesterolu HDL
• upośledzona tolerancja glukozy
• hiperinsulinemia
• insulinooporność
• hiperurykemia
• hiperhomocysteinemia
• mikroalbuminuria
• nadciśnienie tętnicze
• hiperleptynemia
• leptynooporność
• otyłość brzuszna
• zaburzenia
hemostazy
Objawy hiperglikemii,
glukozuria lub hiperglikemia
przygodna.
Oznaczyć glikemię o
dowolnej porze dnia.
> 200 mg/dl
2
× stwierdzone
CUKRZYCA
> 100 mg/dl
Oznaczyć glikemię
na czczo
> 90
> 110
> 125
Powtórzyć
Wykonać OGTT
2h
Całoroczna
kontrola glikemii
> 125 mg/dl
CUKRZYCA
< 200 i >140
mg/dl
> 200 mg/dl
CUKRZYCA
typu II
< 140 mg/dl
Nieprawidłowa
glikemia na
czczo
IGT
(upośledzona
tolerancja
glukozy)

Diagnostyka laboratoryjna – wykłady
29/32
Na koniec jeszcze jedna sprawa z zupełnie innej beczki. Na wykładach z diagnostyki przewijało się określenie „typ
zachowania A” (czynnik ryzyka rozwoju przedwczesnej miażdżycy) , oto cechy charakterystyczne tego typu
zachowania:
skrajne
ambicje
perfekcjonizm
nadmierna
odpowiedzialność
agresywność
niecierpliwość
nadmierna
pobudliwość
Dla odmiany typ zachowania B cechuje:
umiarkowana
chęć współzawodnictwa
kontynuacja
dążenia do celu w „łagodny sposób”
łagodność i cierpliwość
brak
pośpiechu
łatwość odprężania się
zadowolenie
z
życia
1
– to „ue” w obu nazwiskach ma zastąpić u umlaud
2
– zależności między homocysteiną, metioniną i cysteiną są opisane w „Patofizjologii” Maślińskiego na str.327 – 328
Medycyna laboratoryjna – Wykład 3
Diagnostyka nowotworów
Komórki nowotworowe są komórkami własnymi organizmu. Powstają one cały czas u każdego człowieka. Układ
immunologiczny eliminuje je. Immunosupresja (np. po przeszczepie) zwiększa ryzyko wystąpienia nowotworów,
głównie białaczek i chłoniaków.
O wyleczeniu nowotworu mówimy, gdy nie dochodzi do wznowy przez 5 lat.
W diagnostyce nowotworów decydujące znaczenie ma badanie. Immunosupresja (np. po przeszczepie) zwiększa
ryzyko wystąpienia nowotworów, głównie białaczek i chłoniaków.
W diagnostyce nowotworów rozstrzygający jest wynik badania histopatologicznego. Badania dodatkowe to: USG,
KT, endoskopia, badanie fibroskopem.
Badania laboratoryjne – markery nowotworowe:
• brak 100% – owej czułości diagnostycznej tzn. prawidłowy lub nieoznaczalny poziom – stężenie
markerów NIGDY nie wyklucza choroby nowotworowej
• pozwalają na ocenę postępu/cofania się choroby
• pozwalają monitorować skuteczność terapii
• pozwalają na szybkie wykrycie wznowy (kolejne kontrole co 2 mies., a jeśli wyniki są różne o to co
miesiąc; wynik należy odnosić do poprzednich, a nie do wartości referencyjnych)
Leczenie nowotworów – chirurgia, radioterapia i chemioterapia. Szanse na wyleczenie zależą od: stanu
zaawansowania choroby, lokalizacji i rodzaju nowotworu.
Markery nowotworowe:
• CEA (antygen karcinoembrionalny) – normalne stężenie < 5 µg/l (< 10 µg/l u palaczy); stężenie wzrasta w
raku jelita grubego, przerzutach do wątroby i we wznowie raka piersi
• AFP (alfafetoproteina) – normalne stężenie < 7,5 µg/l; stężenie wzrasta pierwotnym raku wątroby i w raku
jąder
• CA 125 – normalne stężenie < 35000 j/l; stężenie rośnie w adenocarcinoma jajnika, raku trzustki i raku
jelita grubego
• HCG – normalne stężenie < 5j/l; stężenie rośnie w zaśniadzie groniastym, guzach trofoblastu,
potworniakach jąder i jajników
• CA 15 – 3 normalne stężenie < 25000 j/l stężenie rośnie w raku piersi
• Receptory steroidowe (w tkance nowotworowej) – norma to > 10 fmol/mg białka cytozolowego; ich ilość
spada w raku piersi
• CA 19 – 9 normalne stężenie < 37000 j/l; stężenie rośnie w raku trzustki i raku jelita grubego
• PSA – norma to < 4 µg/l (u mężczyzn do 40 r.ż.); stężenie rośnie w raku prostaty
• CA 72 – 4 – norma to < 4000 j/l; stężenie rośnie w raku żołądka
• (TPA) CYFRA – norma to < 3,3 µg/l; stężenie rośnie w raku oskrzela niedrobnokomórkowym
• (TPA) TPS – norma to < 60 j/l; stężenie rośnie w raku pęcherza moczowego
• S 100 – norma to < 0,6 µg/l; stężenie rośnie w czerniaku
• Tyreoglobulina – norma to < 35 µg/l; stężenie rośnie w pęcherzykowym raku tarczycy
• Kalcytonina – norma to < 10 µg/l; stężenie rośnie w rdzeniowym raku tarczycy
Diagnostyka laboratoryjna – wykłady
30/32
Teraz jeszcze co nieco o poszczególnych markerach.
CEA, AFP i CA 125 to markery płodowo – zarodkowe.
CEA – w pierwszym etapie występuje u 20% chorych, w drugim stadium u 50%, w ostatnim stadium u 95% - nie
nadaje się do badań przesiewowych. Stężenie tego markera może wzrastać w niektórych stanach zapalnych –
zapalenie trzustki, wrzody żołądka i dwunastnicy, marskość wątroby – w tych stanach jednak stężenie CEA nie
przekracza 20
µg/l, a w raku jelita grubego wynosi ono ponad 100 µg/l. Po udanym zabiegu normalizacja stężenia
następuje po 3 – 4 tygodniach. CEA, CA 125 i C 19 – 9 oznaczane jednocześnie pozwalają wykryć raka trzustki w
92% przypadków, a raka jelita grubego w 80%.
AFP – w warunkach fizjologicznych jest produkowana przez wątrobę i nabłonek jelitowy płodu – chroni płód przed
estrogenami matki. Maksymalne stężenie występuje w 2 trymestrze ciąży, potem poziom AFP obniża się. Jest
obecna w minimalnych ilościach u ludzi zdrowych, u kobiet w ciąży jej stężenie dochodzi do 500
µg/l. Nie jest
testem specyficznym dla nowotworu, dodatnie wyniki otrzymuje się u 50 % chorych z marskością wątroby i w innych
stanach zapalnych, jednak tu wzrost jest nieznaczny. W pierwotnym raku wątroby stężenie rośnie kilkadziesiąt razy
ponad normę. AFP pozwala n różnicowanie embrionalnego raka jąder od nasieniaka. Poziom tego markera po
udanym zabiegu normalizuje się po ok. 3 tygodniach.
HCG – pozwala wykryć ciąże po 9 dniach od zapłodnienia. W zaśniadzie groniastym i guzach trofoblastu prawie w
100% dochodzi do wzrostu stężenia. 40 % guzów zarodkowych nienasieniakowatych uwalnia HCG lub AFP, 40%
uwalnia jedno i drugie, 20 % nie uwalnia nic.
CA 15 – 3 – nie ma znaczenia w wykrywaniu raka piersi, jego stężenie wzrasta co prawda w 70% przypadków, ale
wzrost ten występuje po objawach klinicznych. Obniżenie poziomu tego markera jest dobrym wskaźnikiem
rokowniczym.
Receptory steroidowe – estrogenowe, progesteronowe. Ich poziom ma znaczenie rokownicze. Rokowanie jest
tym lepsze im większa jest ilość receptorów. Jeżeli poziom tylko jednego typu receptorów jest wysoki to lepiej jest
gdy są to receptory progesteronowe.
CA 19 – 9 – (GICA) – stężenie rośnie generalnie w nowotworach przewodu pokarmowego (głównie w raku trzustki i
jelita grubego). W raku trzustki czułość diagnostyczna wynosi 85%.
PSA – jest to proteaza serynowa. Jeżeli pojawia się w surowicy wywołuje odpowiedź wątroby, w której zachodzi
synteza inhibitora. Powinowactwo PSA wytwarzanego przez prostatę jest zbliżone do trypsyny i chymotrypsyny. Po
badaniu palpacyjnym i pobraniu wycinka poziom PSA w surowicy gwałtownie rośnie. Badanie poziomu PSA jest
dwukrotnie czulsze od dotychczas stosowanego badania sterczowego izoenzymu fosfatazy kwaśnej.
Przy interpretacji wyniku należy analizować całkowity PSA (tPSA) i wolny PSA (fPSA). W raku prostaty dochodzi do
znacznego zwiększenia stężenia tPSA. Poziom rzędu 8 – 10
µg/l oznacza z reguły gruczolaka, ale decydujące
znaczenie ma ilość fPSA, w raku prostaty stanowi on 10 – 18%, w gruczolaku 18 – 25%.
PSAD – gęstość antygenu specyficznego dla prostaty w stosunku do objętości gruczołu krokowego.
TPA – antygen peptydowy tkankowy – jest to fragment trzech cytokeratyn (cytokeratyny 8, 18 i 19). (TPA) CYFRA
to fragment cytokeratyny 19, (TPA) TPS to fragment białka M.
S 100 – monitorowanie terapii czerniaka. Jeżeli u pacjenta z czerniakiem po leczeniu poziom S 100 spada poniżej
0,3
µg/l oznacza to najlepsze rokowanie – brak przerzutów. Poziom powyżej 0,6 µg/l oznacza przerzuty i źle rokuje.
Medycyna laboratoryjna – Wykład 4
Nowotwory c.d.
Hormony ektopowe:
• synteza zachodzi w nowotworach litych nie wywodzących się z łożyska
• synteza zachodzi poza fizjologicznym źródłem danego hormonu
• synteza nie podlega kontroli
• identyczne
właściwości immunologiczne jak fizjologiczne hormony
• zazwyczaj
słabsza aktywność biologiczna
• są to peptydy (nie stwierdzono ektopowej produkcji hormonów sterydowych i tyroksyny)
• skutki metaboliczne i objawy kliniczne produkcji hormonów ektopowych są takie jak efekty nadczynności
określonych gruczołów dokrewnych
• synteza ektopowa wyprzedza objawy kliniczne nowotworu
• po wykluczeniu fizjologicznej
• pomagają w diagnozowaniu nowotworu
Ektopowe wydzielannie hormonów – zmiany we krwi:
• obniżenie liczby krwinek czerwonych, zmieniony kształt i wielkość krwinek czerwonych, skrócony czas
przeżycia w krwioobiegu
• osoczowa aktywacja krzepnięcia (zakrzepy w mikrokrążeniu z utajonym krwawieniem!)
• zmiany
stężenia jonów – wzrost poziomu Na
+
i obniżenie poziomu K
+
zwiększenie poziomu Ca
+2
(występuje też w pierwotnych nowotworach osteolitycznych i przerzutach do kości – rak stercza, piersi i
szpiczakach)

Diagnostyka laboratoryjna – wykłady
31/32
• rośnie stężenie Cu
+2
i ceruloplazminy w surowicy i obniża się stężenie Cu
+2
w erytrocytach i innych
komórkach (wzrasta aktywność wolnych rodników; w ziarnicy złośliwej i raku płuc wzrost poziomu Cu
+2
w
surowicy jest proporcjonalny do zaawansowania: skuteczna terapia – obniżenie poziomu, przerzuty i
wznowa – wzrost stężenia
• obniża się stężenie Fe w surowicy (toksohormon tkanki nowotworowej)
• obniża się stężenie Zn (im bardziej zaawansowany rak oskrzela tym mniej Zn w surowicy)
Hydrolazy w chorobach nowotworowych:
• izoenzymy fosfatazy kwaśnej:
pierwotny nowotwór kości i przerzuty do kości o typie osteolitycznym
rak stercza, szczególnie w stadium przerzutów do kości, jeszcze przed klinicznym ich ujawnieniem
rak piersi w stadium przerzutów do kości (pomyślna terapie – obniżenie poziomu, wznowa –
zwiększenie poziomu)
• izoenzym kostny fosfatazy zasadowe
pierwotny
nowotwór
kości i przerzuty do kości o typie osteoplastycznym (90% chorych z mięsakiem
kościopochodnym; po udanym zabiegu następuje spadek poziomu; wznowa i przerzuty cechują się
zwiększeniem poziomu)
• izoenzym
wątrobowy fosfatazy zasadowej:
pierwotne
nowotwory
wątroby
przerzuty
do
wątroby (wzrost aktywności jest proporcjonalny do zmian; poziom bilirubiny pozostaje
bez zmian)
• 5’–nukleotydaza:
przerzuty
do
wątroby (poziom rośnie bardzo wcześnie gdy jeszcze poziom fosfatazy zasadowej i
scyntygrafia nie wykazują zmian)
przerzuty do kości (rośnie poziom izoenzymu kostnego fosfatazy zasadowej)
pomocnicza w monitorowaniu terapii nowotworu
Dysproteinemie:
• niespecyficzna:
hipoalbuminemia – spadek jest wprost proporcjonalny do zaawansowania i zależy od lokalizacji
nowotworu (80% chorych z rakiem żołądka i płuc)
wzrost
stężenia
α
1
i α
2
– globulin (lipoproteiny, białka transportujące np. ceruloplazmina, czynniki
krzepnięcia, haptoglobina)
rzadko
występuje wzrost poziomu
β – globulin (transferyna)
mierny
wzrost
γ – globulin (maskowany rozcieńczeniem – zwiększenie uwodnienia w kaheksji)
poziom
białka całkowitego może być pozornie prawidłowy pozornie prawidłowy:
hipoalbuminemia z hiperglobulinemią
hipoprotenemie w nowotworach przewodu pokarmowego
• specyficzne
białko M (monoklonalne):
szpiczaki
α, β i γ
choroba
łańcuchów ciężkich
choroba
łańcuchów lekkich (
λ lub κ)
makroglobulinemia
Waldenstroema
białko Bence – Jonesa (dimer łańcuchów lekkich) – jest obecne w szpiczaku i chorobie łańcuchów
lekkich, nie występuje natomiast w chorobie łańcuchów ciężkich i makroglobulinemii
Waldenstroema
Kacheksja:
• wynika ze zmniejszonego przyjmowania pokarmów, z upośledzonej hydrolizy i zaburzonego wchłaniania
substancji odżywczych
• zaburzenia przemiany materii
• powikłania procesami zapalnymi
• utrata
składników tkanki zdrowej na korzyść rosnącego nowotworu (nasilenie glikolizy beztlenowej i
syntezy białek)
• w
mięśniach dochodzi do proteolizy i glikogenolizy (autokanibalizm, kreatynuria, pułapka azotowa –
wbudowywanie w tkanki nowotworu
• nasilenie podstawowej przemiany materii (w przeciwieństwie do stanu głodu)
• nasilenie lipolizy i spalania tłuszczów
• hamowanie lipogenezy przez kachektynę, wydzielaną przez makrofagi chorych na nowotwór
• przewodnienie: zwiększenie objętości płynu pozakomórkowego, obniżenie objętości płynu
wewnątrzkomórkowego, obniżenie proporcji wody wewnątrzkomórkowej do wody całkowitej poniżej 0,35
• zalecenia:
zwiększenie spożycia pełnowartościowego białka oraz zwiększenie kaloryczności posiłku

Diagnostyka laboratoryjna – wykłady
32/32
Na wykładzie omówione były też wolne rodniki. Z przyczyn niezależnych (czytaj: nie chce mi się tego pisać)
materiał ten nie został tu zamieszczony. Pytania z tego zakresu się zdarzają więc lepiej to doczytać.
W tworzeniu niniejszego opracowania oprócz mojej skromnej osoby
brali także udział: PBM (executive producer) oraz niezależni
wysokiej klasy eksperci z całej Polski, od Przemyśla po Słupsk.
Ostrzeżenie !!!
W myśl zasady RWD informuję, że niniejsze opracowanie może
zawierać (czytaj: zawiera) błędy, nieścisłości, niedociągnięcia,
dwuznaczności, za których skutki nie odpowiadam.
Wyszukiwarka
Podobne podstrony:
Wyklad 8, III rok, Diagnostyka laboratoryjna, Wykłady diagnostyka
Diagnostyka laboratoryjna wykład 4
Diagnostyka laboratoryjna Wykład Moczowy
serologia-skrót (1), III rok, Diagnostyka laboratoryjna, Wykłady diagnostyka
Diagnostyka laboratoryjna Wykład Miażdżyca i zawał
Diagnostyka laboratoryjna Wykład Skazy krwotoczne
Diagnostyka laboratoryjna Wykład Wątroba
Diagnostyka laboratoryjna wyklad 1 morfologia krwi, III rok, Diagnostyka laboratoryjna, Koło 1
Diagnostyka laboratoryjna Wykład Zapalenia
Diagnostyka laboratoryjna Wykład Odrębności w wynikach
zawał-wykład, III rok, Diagnostyka laboratoryjna, Wykłady diagnostyka
Wyklad 8, III rok, Diagnostyka laboratoryjna, Wykłady diagnostyka
więcej podobnych podstron