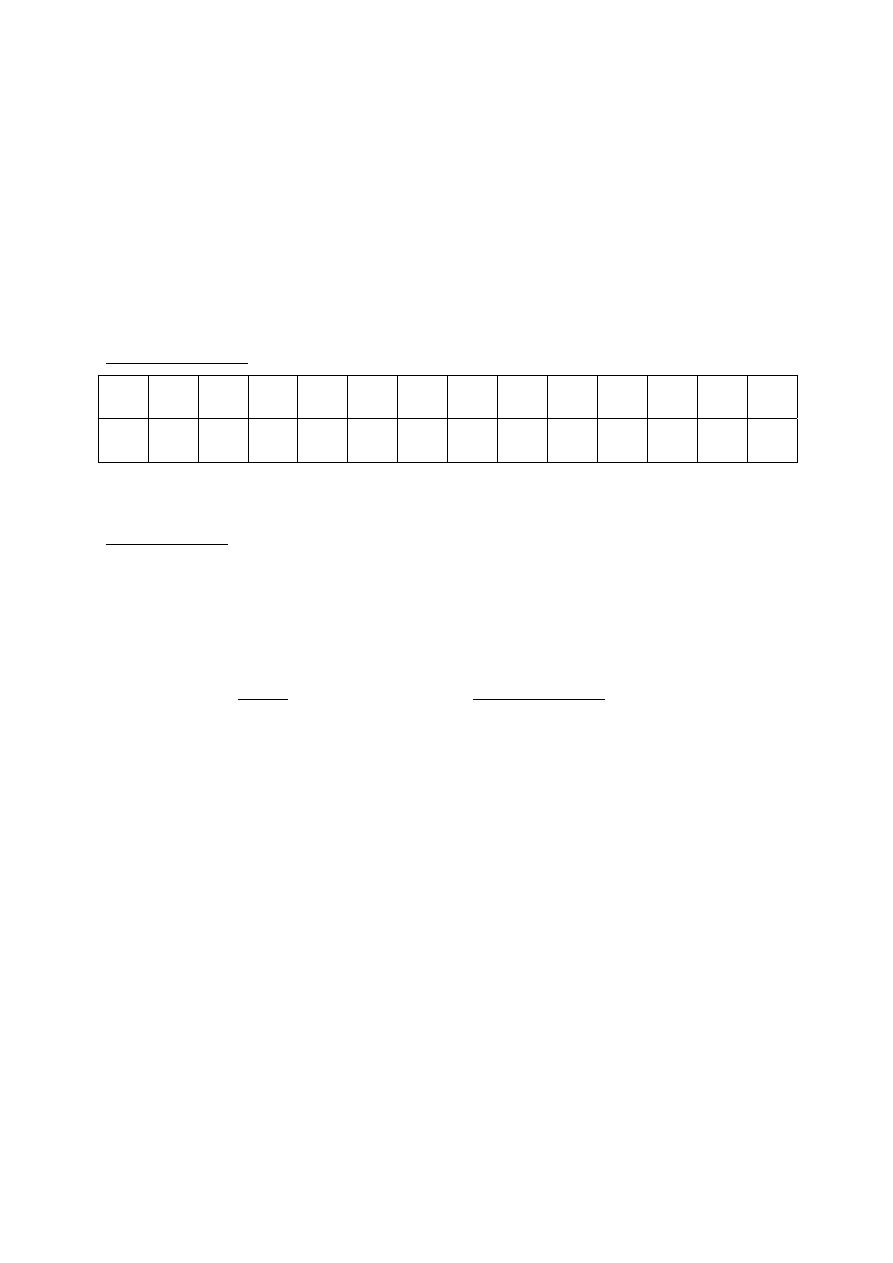
KLUCZ ODPOWIEDZI
KONKURS PRZEDMIOTOWY DLA UCZNIÓW SZKÓŁ
GIMNAZJALNYCH WOJEWÓDZTWA PODKARPACKIEGO
Przedmiot: CHEMIA
/etap szkolny/
Możliwa do uzyskania liczba punktów: 45 pkt.
Zadania zamknięte:
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D B D B C B C A C C D C A C
Razem 14 pkt
Zadania otwarte:
Zadanie 15 (0 – 6 pkt)
Za każdą poprawnie wpisaną nazwę 1 pkt
Za każdy poprawnie wpisany wzór 1 pkt
Punkty przyznajemy wyłącznie w przypadku pełnej nazwy ( z podaną wartościowością).
Nazwa
1. wodorotlenek wapnia
2. siarczan (VI) magnezu
3. chlorek sodu
Wzór sumaryczny
1. Ca(OH)
2
2. MgSO
4
3. NaCl
6 x 1 pkt = 6 pkt
Zadanie 16 ( 0 – 6 pkt)
Za podanie nazwy i wzoru wybranego odczynnika (np. K
3
PO
4
– fosforan (V) potasu) po 1 pkt
2 x 1p = 2 pkt
Za każde poprawnie napisane równanie w formie cząsteczkowej i jonowej po 1 pkt
Nie punktuje się formy skróconej.
Jeżeli uczeń poda dwa różne odczynniki lub błędny odczynnik (który nie pozwoli na strącenie
osadów w obu probówkach) nie otrzymuje punktów (ani za wybranie odczynnika ani za
równania)
4 x 1 p = 4 pkt
Strona 1 z 4

Zadanie 17. (0 – 6 pkt)
Obliczenie masy początkowej roztworu
m
r
= d * V
m
r =
1,8 g/cm
3
* 120 cm
3
= 216 g 1 pkt
Obliczenie masy substancji (kwasu siarkowego(VI))
95% * 216
m
s
= = 205,2 g 1 pkt
100%
Obliczenie objętości roztworu końcowego
V = 120 cm
3
+ 30 cm
3
= 150 cm
3
1 pkt
Obliczenie masy roztworu końcowego
m
r =
1,71 g/cm
3
* 150 cm
3
= 256,5 g 1 pkt
Obliczenie stężenia roztworu
205,2 g
c
p
= * 100% = 80 % 1 pkt
256,5 g
Obliczenia mogą być robione innymi metodami – przy poprawnej innej metodzie i obliczeniach
należy przyznać maksymalną liczbę punktów.
Za podanie przyczyny zwiększenia objętości ( i masy roztworu) – higroskopijność (pochłanianie
pary wodnej, pochłanianie wody) 1 pkt
Zadanie 18. (0 – 4 pkt.)
a) Na powierzchni żelaza powstał czerwonobrązowy (ceglasty, rdzawy) osad, roztwór zmienił
barwę z niebieskiej na jasnozieloną 1 pkt
(jeśli uczeń podał tylko jedną obserwację poprawną przyznajemy 1 pkt; jeśli uczeń napisał, że
powstał osad brązowy lub czerwony należy uznać odpowiedź za poprawną)
b) za prawidłowo napisane równanie reakcji w formie jonowej skróconej (za równanie
napisane w innej formie uczeń punktu nie otrzymuje)
Fe + Cu
2+
Fe
2+
+ Cu 1 pkt
c) za prawidłowo obliczoną różnicę mas
64 g (Cu) – 56 g (Fe) = 8 g 1 pkt
za prawidłowo obliczoną masę miedzi, jaka wydzieliła sie na płytce
64 g - 8 g
x - 0,04 g
x = 0,32 g 1 pkt
Strona 2 z 4
Zadanie 19. ( 0 – 4 pkt )
Za obliczenie masy NaCl zawartej w 2 dag rodzynek 1 pkt
100 g – 25 mg
20 g - x
x = 5 mg
Za obliczenie masy NaCl zawartej w 1 dag fig 1 pkt
100 g – 34 mg
10 g - x
x = 3,4 mg
Za prawidłowo obliczoną sumę mas NaCl w rodzynkach i figach 1 pkt
5 mg + 3,4 mg = 8,4 mg
Za obliczenie jaki % dobowego zapotrzebowania na sól dostarczamy organizmowi 1pkt
0,5 g = 500 mg
500 mg – 100%
8,4 mg - x
x = 1,68 %
Zadanie 20. ( 0 – 5 pkt )
Za napisanie równania reakcji 1 pkt
2 AgNO
3
+ Zn 2 Ag + Zn(NO
3
)
2
Za wyliczenie masy AgNO
3
1 pkt
np.
700 g * 15 %
m
s
= = 105 g
100%
Za obliczenie, że cynk jest w nadmiarze i napisanie wniosku na podstawie otrzymanego wyniku
2 pkt
340g – 65g
105 - x
x = 20,07 g (Zn)
Jeżeli uczeń nie napisze słownego wniosku, ale zrobi odpowiednie obliczenie i poprawnie stosuje je
w dalszej części zadania należy przyznać mu 2 pkt.
Za obliczenie ilości srebra 1 pkt
340g – 216 g
105 - x
x = 66,7 g (Ag)
Strona 3 z 4

Obliczenia mogą być robione innymi metodami – przy poprawnej innej metodzie i obliczeniach
należy przyznać maksymalną liczbę punktów.
Uczeń może wykonać obliczenia z zastosowaniem liczby moli.
Uwaga!
• Podane rozwiązania należy traktować, jako przykładowe.
• Za poprawne rozwiązanie zadań metodą inną niż podana, uczeń otrzymuje
maksymalną liczbę punktów.
• Jeżeli w równaniach reakcji uczeń źle dobierze współczynniki otrzymuje 0 pkt.
• Za błąd rachunkowy przy poprawnym rozumowaniu należy odjąć 1 pkt od
maksymalnej liczby punktów za to zadanie.
• W zadaniach zamkniętych uczeń może się pomylić jeden raz. W sytuacji gdy trzy lub
wszystkie odpowiedzi są w jakikolwiek sposób zaznaczone lub poprawiane, należy
postawić 0 pkt.
• Punktujemy wyłącznie za te równania, które opisane są w kryteriach. Jeżeli uczeń
uzupełni równanie, które nie jest opisane w poleceniu i w kryteriach, nie otrzymuje za
to żadnych dodatkowych punktów.
• Źle zapisane ładunki jonów traktuje się jak zły wzór w równaniu reakcji, uczeń
otrzymuje 0 pkt za to równanie.
• Uczeń może nie pisać jednostek przy obliczeniach, a wpisać je tylko przy wyniku lub
przy odpowiedzi. Jeżeli pisze jednostki w całości obliczeń, to muszą być one
poprawne. W przeciwnym razie odejmujemy 1 pkt od liczby punktów przyznanej za
zadanie (jak za błędne obliczenia).
• Nie stosujemy połówek punktu, nie oceniamy nieczytelnych zapisów oraz notatek
w brudnopisie.
Strona 4 z 4
Wyszukiwarka
Podobne podstrony:
chemia klucz (2) id 112361 Nieznany
chemia klucz id 112358 Nieznany
chemia klucz id 112359 Nieznany
chemia klucz (2) id 112361 Nieznany
chemia pp pr odp klucz(1) id 11 Nieznany
geologia klucz 2 id 189204 Nieznany
chemia zadania 2 id 113035 Nieznany
chemia opracowanie id 112613 Nieznany
chemia tablice id 112030 Nieznany
Chemia 03 id 557778 Nieznany
Chemia 10 3 id 111757 Nieznany
Chemia 11 3 id 111768 Nieznany
Chemia organiczna W 8 id 112721 Nieznany
arkusz zr Chemia tablice id 625 Nieznany (2)
che 2 etap gim 2012 klucz id 11 Nieznany
CHEMIA EGZAMIN 2 id 112139 Nieznany
(CHEMIA WYKLAD 3)id 1241 Nieznany
chemia organiczna id 112638 Nieznany
więcej podobnych podstron