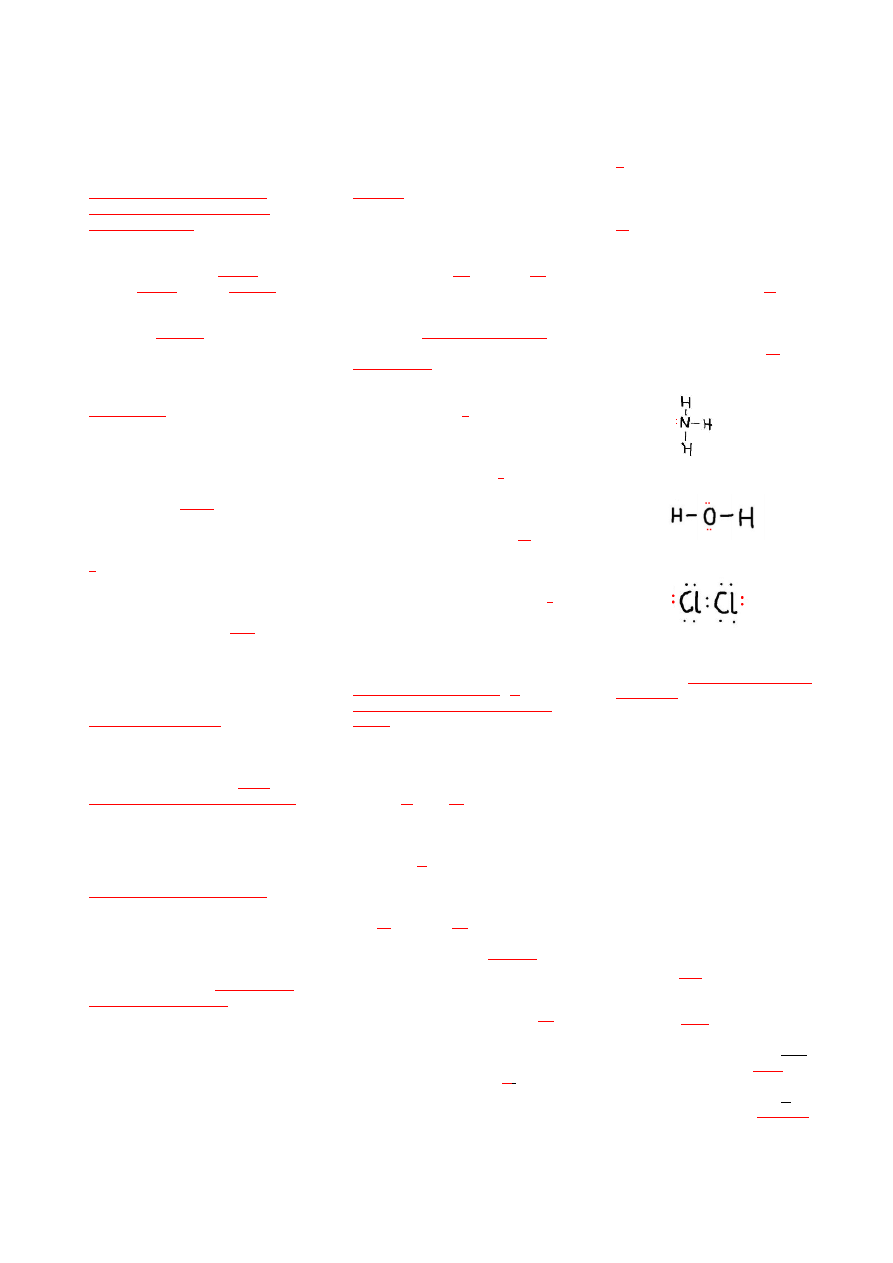
1) Dwa zdania są prawdziwe, wskaż
je:
a) proton składa się z 3 kwarków
d) neutron zawiera tę samą liczbę
kwarków co proton
2) Jaki ładunek elektryczny
charakteryzuje : proton
dodatni
,
elektron
ujemny
, neutron
obojętny
3) Mol jest jednostką: ładunku / masy
/ objętości /
liczności
/ prędkości / nie
jest jednostką
4) Wodór, deuter i tryt zawierają po
jednym protonie w jądrze atomowym.
Jest to prawda
/ każdy zawiera inną
liczbę protonów / nie zawierają
protonów lecz zmienną liczbę
neutronów
5) Wodór, deuter i tryt zawierają
odpowiednio po
1 ,1, 1
protony w
jądrze wpisz liczby
6) Hel zawiera w jądrze atomowym 1 /
2
/ 3 / 4 / 5 / 6 protonów
7) Proporcje protonów do neutronów
w jądrze atomowym mogą być
dowolne. Jest to prawda /
fałsz
/
prawda, ale tylko dla niektórych
pierwiastków
8) Izotopy danego pierwiastka
zawierają tę samą liczbę neutronów /
tę samą liczbę protonów
9) Liczba masowa jest równa: liczbie
neutronów w jądrze atomu / liczbie
protonów w jądrze atomu /
sumie
protonów i neutronów w jądrze atomu
/ różnicy liczb protonów i neutronów
w jądrze atomu
10) Liczba atomowa jest równa:
liczbie neutronów w jądrze atomu /
liczbie protonów w jądrze atomu
/
sumie liczb protonów i neutronów w
jądrze atomu / różnicy liczb protonów
i neutronów w jądrze atomu
11) Masa molowa to: masa cząsteczki
wyrażona w gramach /
stosunek masy
substancji do jej liczności
/ liczba moli
substancji w jednostce masy / takiego
pojęcia nie ma
12) Najbardziej trwałe są jądra
atomów
: najlżejsze
/ najcięższe / o
masie atomowej mniej więcej
izotopów żelaza/niklu
13) Pierwiastek chemiczny jest
substancją złożoną z atomów o
jednakowej liczbie: neutronów /
protonów
/ jednakowej sumie
protonów i neutronów
14) Jaki pierwiastek powstaje po
przyłączeniu protonu do jądra deuteru
2
1
H: wodór / tryt /
hel
/ lit / bor /
He
15) Czym różnią się między sobą
poszczególne izotopy tego samego
pierwiastka:
zawartością neutronów
/
niczym / liczbą protonów w jądrze /
liczbą masową
16) Na orbitalu s może znajdować się
maksymalnie: 0, 1 ,
2
, 3 , 6 , 7 ,
elektronów
17) Na orbitalach p może znajdować
się maksymalnie: 0, 2 , 4 ,
6
, 10 , 13 ,
elektronów
18) Na orbitalach d może znajdować
się maksymalnie: 1 , 2 , 4 , 6 ,
10
, 14 ,
elektronów
19) Ile elektronów w atomie może
posiadać te same liczby kwantowe:
0
,
2 , 6 , 10, 14, wszystkie
20) Zapełnianie orbitali w atomach
kolejnych pierwiastków następuje: w
kolejności alfabetycznej /
w kolejności orbitali s,p,d,f
/
w
kolejności odpowiadającej minimum
energii
/ w kolejności odpowiadającej
maksimum energii
21) Wskaż pierwiastek, którego atom
na orbitalu s posiada 1 elektron: O ,
As , Br ,
Li
, Be ,
Na
22) Wskaż pierwiastek, którego atom
na orbitalu s posiada 1 elektron: P , C ,
Cl , V, Ca ,
K
23) Wskaż pierwiastki, o całkowicie
zapełnionych orbitalach s i p : O , C ,
La ,
Ar
, Ge , Be ,
Ne
24) Spin elektronu to: 1,
+½ , - ½,
+
¾, 2, - ¼, + ¼,
25) Który z pierwiastków
charakteryzuje się wyższym
potencjałem jonizacyjnym: H czy
He
26) Który z pierwiastków
charakteryzuje się wyższym
potencjałem jonizacyjnym:
H
czy
Li
27) Który z pierwiastków
charakteryzuje się większym
powinowactwem do elektronu: O czy
F
28) Który z pierwiastków
charakteryzuje się większym
powinowactwem do elektronu: Na czy
Cl
29) Który z pierwiastków
charakteryzuje się większą
elektroujemnością: Na czy
Cl
30) Który z pierwiastków
charakteryzuje się większą
polaryzowalnością: Na czy
Cs
1) We wzorze Lewisa brakuje 2
kropek. Umieść je we właściwym
miejscu:
2) We wzorze Lewisa brakuje 4
kropek. Umieść je we właściwym
miejscu:
3) We wzorze Lewisa brakuje 4
kropek. Umieść je we właściwym
miejscu:
4) Hybrydyzacja to : przekształcenie
elektronów /
przekształcenie funkcji
orbitalnych
/ zwiększenie liczby
orbitali/ zwiększenie liczby
elektronów w atomie
5) Symbole orbitali hybrydyzowanych
to : ab /
sp
/ xy3 / sdx2 / ps3 /
sp2
/
dc2
6) Dopisz przy cząsteczce rząd
wiązania : N2 =
3
7) Dopisz przy cząsteczce rząd
wiązania : O2 =
2
8) Dopisz przy cząsteczce rząd
wiązania : Cl2 =
1
9) Czy wiązanie π mogą tworzyć
orbitale s ?
NIE
10) Czy wiązanie π mogą tworzyć
orbitale p ?
TAK
11) Które z wiązań tworzą się poza
płaszczyzną cząsteczki ?
π (pi)
12) Które z wiązań tworzą się w
płaszczyźnie cząsteczki ?
σ (sigma)

13) Podaj liczbę wolnych par
elektronowych w cząsteczce CH
4
=
0
14) Podaj liczbę wolnych par
elektronowych w cząsteczce NH
3
=
1
15) Podaj liczbę wolnych par
elektronowych w cząsteczce H
2
O =
2
16) Wskaż właściwą hybrydyzację
orbitali w cząsteczce CH
4
= sp
2
, sp
4
,
sp
3
, sp
2
d
17) Wskaż właściwą hybrydyzację
orbitali w cząsteczce H
2
O =
sp
3
, sp
4
,
sp
2
, sp
2
d
18) Wskaż właściwą hybrydyzację
orbitali w cząsteczce NH
3
= sp
2
,
sp
3
,
s
2
p , sp
2
d
19) Hybrydyzacja sp
2
odpowiada
cząsteczce : liniowej, kwadratowej
płaskiej,
trójkątnej płaskiej
,
tetraedrycznej, bipiramidzie
trygonalnej
20) Hybrydyzacja sp
3
odpowiada
cząsteczce : liniowej, kwadratowej
płaskiej, trójkątnej płaskiej,
tetraedrycznej
, bipiramidzie
trygonalnej
21) Hybrydę sp2 tworzą :
1 orbital s i
2 orbitale p
22) Hybrydę sp3 tworzą :
1 orbital s i
3 orbitale p
23) Orbital molekularny może być :
antywiążący
, nadrzędny ,
wiążący
,
podrzędny, pasmowy, z przerwą
wzbronioną
24) Które z orbitali molekularnych
obsadzane są w pierwszej kolejności :
wiążące
, czy niewiążące
25) Czym powinny charakteryzować
się elektrony w cząsteczce o
właściwościach paramagnetycznych ?
Powinny mieć upożądkowane spiny i
niesparowane elektrony.
26) Czym powinny charakteryzować
się elektrony w cząsteczce o
właściwościach diamagnetycznych ?
Maja sparowane elektrony.
1) Uszereguj wiązania zgodnie z
malejącą energią: (
3
) dyspersyjne, (
1
)
jonowe, (
2
) wodorowe
2) Pomiędzy cząsteczkami
niepolarnymi oddziaływania mają
charakter : wiązania wodorowego /
oddziaływań dyspersyjnych
/
oddziaływań indukowanych dipolami
3) Co powoduje, że temperatura
wrzenia H
2
O jest wyraźnie wyższa niż
temperatury wrzenia H
2
S, H
2
Se, H
2
Te
?
wiązania wodorowe
4) Co powoduje, że temperatura
wrzenia NH
3
jest wyraźnie wyższa niż
temperatury wrzenia PH
3
, AsH
3
?
wiązania wodorowe
5) Wskaż dwa czynniki decydujące o
tym, że lód ma mniejszą gęstość niż
ciekła woda: wiązanie jonowe /
wiązanie kowalencyjne /
hybrydyzacja
sp3
/
wiązanie wodorowe
/ orbital d /
hybrydyzacja orbitali p oraz d
6) Które kryształy topią się w wyższej
temperaturze: molekularne /
jonowe
/
nie ma reguły
7) Plastyczność metali wiąże się
ogólnie z ich dobrą przewodnością
elektryczną. Jest to prawda / fałsz /
nie
ma związku
8) Nośnikami ładunku w
półprzewodniku mogą być:
elektrony /
dziury
/ kationy / aniony
9) W półprzewodniku domieszka
przyjmuje elektrony z pasma
podstawowego. Co jest nośnikiem
ładunku elektrycznego – elektrony /
dziury
/ a może materiał nie
przewodzi prądu ?
10) W półprzewodniku domieszka
oddaje elektrony do pasma
przewodnictwa. Czy półprzewodnik
jest typu:
p (positive) /
n (negative)
/ a może
materiał nie przewodzi prądu ?
11) Kryształ jonowy stopił się. Czy
powstała ciecz może dobrze
przewodzić prąd elektryczny ?
TAK
/
NIE
12) Kryształ molekularny stopił się.
Czy powstała ciecz może dobrze
przewodzić prąd elektryczny ? TAK /
NIE
13) Który z kryształów jest kryształem
kowalencyjnym: kryształ chlorku sodu
/
diament
/ miedź / sód
14) Z czy kojarzą Ci się nazwiska
Schottky oraz Frenkel ?
Schottky – istnienie dzur w paśmie
walencyjnym; Frenkel – defekt w sieci
krystalicznej
15) Co jest nośnikiem ładunku w
stałym elektrolicie ?
jony
16) Spośród wymienionych określeń
układów krystalograficznych 2 są
prawdziwe : prostokątny /
jednoskośny
/
regularny
/ sześcienny /
elementarny / prymitywny / słuszny /
zielony
17) Spośród wymienionych określeń
układów krystalograficznych 2 są
prawdziwe : prostopadły /
rombowy
/
sensowny / sześcienny /
tetragonalny
/
prymitywny / prosty /
rentgenograficzny
18) Spośród wymienionych określeń
układów krystalograficznych 2 są
prawdziwe : kątowy /
trygonalny
/
sensowny /
heksagonalny
/
elementarny / prymitywny / ostry /
Frankla
19) Grafit jest miękki (plastyczny)
ponieważ : jest to mieszanina węgla z
materiałem organicznym
/ atomowi
węgla możemy przypisać
hybrydyzację sp2 / wiązania
kowalencyjne pomiędzy atomami
węgla występują w warstwach
/
pomiędzy atomami węgla występują
na przemian wiązania kowalencyjne i
jonowe
20) Diament jest twardy ponieważ :
jest to węglik krzemu /
atomowi węgla
możemy przypisać hybrydyzację sp3
/pomiędzy atomami węgla występują
na przemian wiązania jonowe i
kowalencyjne /
pomiędzy atomami węgla występują
wyłącznie wiązania kowalencyjne
21) Stały elektrolit jest : metalem,
kryształem molekularnym,
kryształem
jonowym
, stałym przewodnikiem
elektronowym
22) Czy przewodność stałego
elektrolitu : może być lepsza niż
stopionej soli / jest zawsze gorsza niż
stopionej soli
/ stała substancja jonowa nie jest
przewodnikiem
23) Który wzór jest prawidłowy: Pn =
VRT │
PV = nRT
│ PT = nRV │ VT
= nPR

24) Co we wzorze PV = nRT
oznaczają litery: n –
ilość moli
substancji [mol] ,
oraz R –
stała
gazowa
?
25) Co we wzorze PV = nRT
oznaczają litery: T –
temperatura [K]
oraz V –
objętość [m
3
]
?
26) Co we wzorze PV = nRT
oznaczają litery: V -
objętość [m
3
]
oraz P –
cisnienie
[Pa]
?
27) Ciekła substancja zamknięta jest w
częściowo napełnionym naczyniu. Jej
prężność jest proporcjonalna do:
liczby moli fazy ciekłej
/
temperatury
/
objętości naczynia / kształtu naczynia
1) Iloczyn jonowy wody to: Kw =
[H
+
]·[
OH
-
]
2) Co to jest : [H
+
]·[OH
-
] =
K
w
3) pcH =
-log([H
+
])
, uzupełnij
4) pcOH =
-log([OH
-
])
uzupełnij
5) Wskaż słaby kwas: HCl ,
CH
3
COOH
, HNO
3
, HClO
4
6) Napisz przykład soli słabej zasady i
mocnego kwasu
NH
4
Cl
7) Napisz przykład soli mocnej zasady
i słabego kwasu
CH
3
COONa
8) Czy KBr to sól: słabej zasady ,
mocnej zasady
, słabego kwasu ,
mocnego kwasu
9) Czy (NH
4
)
2
SO
4
to sól:
słabej
zasady
, słabego kwasu ,
mocnego
kwasu
, mocnej zasady
10)Czy KCN to sól: słabej zasady ,
słabego kwasu
, mocnego kwasu,
mocnej zasady
11) W roztworze znajduje się NH
4
Cl.
Co należy dodać do roztworu aby
powstał bufor ?
NH
3
*H
2
O
12) W roztworze znajduje się
(NH
4
)
2
SO
4
. Co należy dodać do
roztworu aby powstał bufor
H
2
SO
4
/
NH
3
*H
2
O
13) W roztworze znajduje się
CH
3
COONa. Co należy dodać do
roztworu aby powstał bufor ?
CH
3
COOH
14) W roztworze znajduje się kwas
octowy, CH
3
COOH. Co należy dodać
do roztworu aby powstał bufor?
CH
3
COONa
15) W roztworze znajduje się octan
sodu, CH
3
COONa. Co należy dodać
do roztworu aby powstał bufor ?
CH
3
COOH
16) W roztworze znajduje NH4OH.
Co należy dodać do roztworu aby
powstał bufor ?
NH
4
Cl
17) Jak nazwać reakcję: NH
4
+ + H
2
O
= NH
4
OH + H+ ? Jest to:
hydroliza
,
dysocjacja , zobojętnianie ,
roztwarzanie , rozpuszczanie]
18) Jak nazwać reakcję: CN- + H
2
O =
HCN + OH- ? Jest to:
hydroliza
,
dysocjacja , zobojętnianie ,
roztwarzanie , rozpuszczanie
19) H
2
S jest słabym kwasem. Jak
wpłynie na stężenie jonów S
2-
w jego
roztworze dodanie mocnego kwasu :
zmniejszy
/ zwiększy / nie wpłynie
20) HCN jest słabym kwasem. Jak
wpłynie na stężenie jonów CN
-
w jego
roztworze dodanie mocnej zasady :
zmniejszy /
zwiększy
/ nie wpłynie
21) CH
3
COOH jest słabym kwasem.
Jak wpłynie na stężenie jonów
octanowych w roztworze CH
3
COONa
dodanie mocnego kwasu:
zmniejszy
/
zwiększy / nie wpłynie
22) HNO
2
jest słabym kwasem. Jak
wpłynie na stężenie jonów
azotanowych(III) w roztworze KNO
2
dodanie mocnej zasady : zmniejszy /
zwiększy
/ nie wpłynie
23) Jaki jest odczyn KCl ? kwaśny /
obojętny
/ zasadowy / nie dotyczy
24) Jaki jest odczyn NH
4
NO
3
?
kwaśny
/ obojętny / zasadowy / nie
dotyczy
25) Jaki jest odczyn CH
3
COOK ?
kwaśny / obojętny /
zasadowy
/
niedotyczy
26) Jaki jest odczyn roztworu Na
2
CO
3
? kwaśny / obojętny /
zasadowy
/ nie
dotyczy
27) CaF
2
jest solą słabo
rozpuszczalną. Czego należy dodać do
roztworu pozostającego z nią w
równowadze,
aby zmniejszyć stężenie jonów
fluorkowych w roztworze ?
CaCl
2
;
jonów Ca
2+
28) PbCl2 jest solą słabo
rozpuszczalną. Czego należy dodać do
roztworu pozostającego z nią w
równowadze,
aby zmniejszyć stężenie jonów
ołowiowych w roztworze ?
HCl;
jonów Cl
-
29) BaSO4 jest solą słabo
rozpuszczalną. Czego należy dodać do
roztworu pozostającego z nią w
równowadze,
aby zmniejszyć stężenie jonów baru w
roztworze ?
H
2
SO
4
; jonów SO
4
2-
30) Napisz wyrażenie na iloczyn
rozpuszczalności PbCl
2
L=[Pb
2+
]*[Cl
-
]
2
31) Napisz wyrażenie na iloczyn
rozpuszczalności CaF
2
L=[Ca
2+
]*[F
-
]
2
32) Napisz wyrażenie na iloczyn
rozpuszczalności Cu
2
S
L=[Cu
+
]
2
*[S
2-
]
33) Napisz wyrażenie na iloczyn
rozpuszczalności Fe(OH)
3
L=[Fe
3+
]*[OH
-
]
3
34) CaF
2
jest solą słabo rozpuszczalną
i znajduje się w równowadze z
roztworem. Jakich jonów w roztworze
jest więcej:
fluorkowych
,
wapniowych, jest po równo
35) PbCl
2
jest solą słabo
rozpuszczalną i znajduje się w
równowadze z roztworem. Jakich
jonów w roztworze jest więcej:
chlorkowych
, ołowiowych, jest po
równo
36) CaSO
4
jest solą słabo
rozpuszczalną i znajduje się w
równowadze z roztworem. Jakich
jonów w roztworze jest więcej:
siarczanowych , wapniowych ,
jest po
równo
37) Ag
2
S jest solą słabo rozpuszczalną
i znajduje się w równowadze z
roztworem. Jakich jonów w roztworze
jest więcej: siarczkowych,
srebrowych
, jest po równo
38) AgCl jest solą słabo rozpuszczalną
i znajduje się w równowadze z
roztworem. Jakich jonów w roztworze
jest więcej: chlorkowych, srebrowych,
jest po równo

39) Słabo rozpuszczalny Ca(OH)
2
pozostaje w równowadze z
roztworem. Jak wpłynie na stężenie
jonów wapniowych zmniejszenie pH
roztworu :
zwiększy
/ zmniejszy / nie
wpłynie
40) Słabo rozpuszczalny Fe(OH)
3
pozostaje w równowadze z
roztworem. Jak wpłynie na stężenie
jonów żelazowych wzrost pH
roztworu : zwiększy /
zmniejszy
/ nie
wpłynie
41) Słabo rozpuszczalny Ni(OH)
2
pozostaje w równowadze z
roztworem. Jak wpłynie na stężenie
jonów niklowych wzrost pH roztworu
: zwiększy /
zmniejszy
/ nie wpłynie
1) Reakcja: CaCO
3
(s) = CaO(s) +
CO
2
(g), ΔH = 170 kJ, jest reakcją:
homogeniczną /
heterogeniczną
/
endotermiczną
/ egzotermiczną /
jonową /
cząsteczkową
/ syntezy /
rozkładu
/ wymiany / utleniania-
redukcji
2) Reakcja: C(s) + CO
2
(g) = 2CO(g),
ΔH = 170 kJ, jest reakcją:
homogeniczną /
heterogeniczną
/
endotermiczną
/ egzotermiczną /
jonową /
cząsteczkową
/
syntezy
/
rozkładu / wymiany / utleniania-
redukcji
3) Reakcja: C(s) + O
2
(g) = CO
2
(g),
ΔH = -394 kJ, jest reakcją:
homogeniczną /
heterogeniczną
/
endotermiczną /
egzotermiczną
/
jonową
/ cząsteczkową
/
syntezy
/
rozkładu / wymiany / utleniania-
redukcji
4) Reakcja: N
2
(g) + 3H
2
(g) =
2NH
3
(g), ΔH = -106 kJ, jest reakcją:
homogeniczną
/ heterogeniczną /
endotermiczną /
egzotermiczną
/
jonową /
cząsteczkową
/
syntezy
/
rozkładu / wymiany / utleniania-
redukcji
5) Reakcja: H
2
(g) + Br
2
(g) = 2HBr(g),
ΔH = -106 kJ, jest reakcją:
homogeniczną
/ heterogeniczną /
endotermiczną /
egzotermiczną
/
jonową
/ cząsteczkową
/ syntezy
/
rozkładu / wymiany / utleniania-
redukcji
6) Napisz wyrażenie na stałą
równowagi reakcji: N
2
(g) + 3H
2
(g) =
2NH
3
(g)
K=[NH
3
]
2
/([N
2
]*[H
2
]
3
)
7) Napisz wyrażenie na stałą
równowagi reakcji: H
2
(g) + I
2
(g) =
2HI(g)
K=[HI]
2
/([H
2
]*[I
2
])
8)Napisz wyrażenie na stałą
równowagi
reakcji:2H
2
(g)+O
2
(g)=2H
2
O(g)
K=[H
2
O]
2
/([H
2
]
2
*[O
2
])
9) Napisz wyrażenie na stałą
równowagi reakcji: 2N
2
O(g) = 2N
2
(g)
+ O
2
(g)
K=[N
2
]
2
*[O
2
]/[N
2
O]
2
10) Dana jest reakcja: N
2
(g) + 3H
2
(g)
= 2NH
3
(g). Jak wpływa na jej stan
równowagi wzrost ciśnienia ?
równowaga przesunie się w prawo
czyli w kierunku powstawania
produktów.
11) Dana jest reakcja: 2NH
3
(g) =
N
2
(g) + 3H
2
(g). Jak wpływa na jej stan
równowagi wzrost ciśnienia ?
równowaga przesunie się w lewo w
kierunku powstawania substratów.
12) Dana jest reakcja: C(s) + O2(g) =
CO2(g) +394 kJ. Jak wpływa na jej
stan równowagi wzrost temperatury ?
równowaga reakcji przesunie się w
prawo (bo reakcja endoenergetyczna)
13) Dana jest reakcja: C(s) + CO
2
(g) =
2CO(g) -170 kJ. Jak wpływa na jej
stan równowagi wzrost temperatury ?
równowaga przesunie się w lewo (bo
reakcja egzoenergetyczna)
14) Katalizator:
przyspiesza
osiągnięcie stanu równowagi reakcji
/
zmienia stan równowagi reakcji /
zmienia stałą równowagi reakcji
15) Katalizator:
nie zmienia stanu
równowagi reakcji
/ zmienia stan
równowagi reakcji / zmienia stopień
równowagi reakcji
16) Którego rzędu jest reakcja: 2HI =
H
2
+ I
2
, jeżeli równanie kinetyczne
opisane jest wzorem: r = k[HI]
2
?
drugiego
17) Którego rzędu jest reakcja: 2N
2
O
= 2N
2
+ O2, jeżeli równanie
kinetyczne opisane jest wzorem: r =
k[N
2
O] ?
pierwszego
18) Którego rzędu jest reakcja: 2NO
2
= 2NO + O
2
, jeżeli równanie
kinetyczne opisane jest wzorem: r =
k[NO2]
2
?
drugiego
19) Którego rzędu jest reakcja: 2AB =
A
2
+ B
2
, jeżeli równanie kinetyczne
opisane jest wzorem: r = k[AB]
0
?
zerowego
20) Podaj rząd reakcji dla której
logarytm ze stężenie reagenta
(substratu) zmienia się liniowo w
czasie:
1
21) Ziarna A i B reagują z tlenem z
fazy gazowej. Na ziarnie B tworzy się
stała warstwa produktu, na ziarnie A
nie ma jej. Szybkość reakcji
chemicznej decyduje o szybkości
utleniania ziarna
A
czy B
22) Pewna reakcja chemiczna jest
drugiego rzędu względem reagenta A.
uzupełnij równanie szybkości reakcji:
υ = k·[A]
2
23) Pewna reakcja chemiczna jest
zerowego rzędu względem reagenta A.
uzupełnij równanie szybkości reakcji:
υ = k·[A]
0
24) Jak zależy czas półtrwania
substratu od stałej szybkości reakcji w
której substrat jest zużywany ? Gdy
stała szybkości zwiększa się, to czas
półtrwania
zmniejszy się
25) Podaj rząd reakcji dla której
stężenie reagenta (substratu)
zmniejsza się liniowo w czasie:
0
26) Ziarna A oraz B reagują z tlenem
z fazy gazowej. Na ziarnie B tworzy
się stała warstwa produktu tlenku), na
ziarnie A nie ma jej. Szybkość dyfuzji
decyduje o szybkości utleniania ziarna
A czy
B
27) O szybkości przekształcenia
ziarna decyduje szybkość reakcji
chemicznej. Czy zwiększenie
szybkości reagującego gazu przez
złoże ziaren przyspieszy
przekształcanie ziaren ?
NIE
28) O szybkości przekształcenia
ziarna decyduje szybkość dyfuzji do
granicy (strefy) reakcji. Czy
zwiększenie szybkości reagującego
gazu przez złoże ziaren przyspieszy
przekształcanie ziaren ?
NIE
29) Podaj rząd reakcji dla której
odwrotność stężenie reagenta
(substratu) zmienia się liniowo w
czasie:
2
30) Równanie Arrheniusa to: pV =
nRT /
k = Ae
-Ea/RT
/ pH = -ln(aH+) /
lnk = stała –Ea/RT / Kw = [H+]·[OH-]

1)Układ izolowany to taki układ, który
wymienia z otoczeniem
nic; ani
energię ani materię
2) Układ zamknięty to taki układ,
który wymienia z otoczeniem
energię
3) Układ otwarty to taki układ, który
wymienia z otoczeniem
i materię i
energię
4) Wskaż symbole oznaczające
energię wewnętrzną, liczność oraz
entropię: G , H ,
U
, T ,
S
, P , M ,
n
,
V , F , R
5) Wskaż symbole oznaczające
entalpię, liczność oraz entropię: G ,
H
, U , T ,
S
, P , M ,
n
, V , F , R
6) Wskaż symbole oznaczające
energię wewnętrzną, stałą gazową
oraz entalpię swobodną:
G
, H ,
U
, T ,
S , P , M , n , V ,F
,R
7) Wskaż symbole oznaczające
energię wewnętrzną, ciśnienie i
entalpię: G
, H
,
U
, T , S ,
P
, M , n ,
V , F , R
8) Stan standardowy to:
a) 373 K, 1 atm
b) 1 bar, 298 K
c) 1 bar, 353 K
d) 1 bar, 273 K
e) 101325 Pa, 4 ºC
9) Stan standardowy to:
a) 373 K, 105 Pa
b) 1 bar, 353 K
c) 10
5
Pa, 298 K
d) 101 kPa, 4 ºC
10) Do ogrzania 10 g pewnej
substancji o 5 K potrzeba 100 J. Jakie
jest ciepło właściwe (pojemność
cieplna) substancji (podaj wartość i
wymiar)
c =
Q/(m*
T) = 2000
[J/(kg*K)],
?
11) Do ogrzania 5 g pewnej substancji
o 1 K potrzeba 40 J. Jakie jest ciepło
właściwe (pojemność cieplna)
substancji (podaj wartość i wymiar)
c
=
Q/(m*
T) = 8000 [J/(kg*K)]
?
12) Entropia
a) opisuje rozkład / dystrybucję
energii w układzie
b) podaje zawartość energii w
układzie
c) jest miarą szybkości reakcji
chemicznej
d) wynika ze stałej gazowej
e) nazywana bywa miarą
nieuporządkowania
13) Entalpia
a) jest równa ciepłu reakcji
chemicznej (ze znakiem
przeciwnym) w warunkach
izobarycznych
b) jest równa ciepłu reakcji
chemicznej (ze znakiem przeciwnym)
w warunkach izochorycznych
c) jest miarą całkowitej energii
zawartej w układzie
d) jest stałą szybkości reakcji
chemicznej
14) Entalpia reakcji CH
4
+ 2O
2
= CO
2
+ 2H
2
O(g) wynosi ΔH = -802 kJ.
Ciepło kondensacji 2 moli pary
wodnej wynosi 88 kJ. Ile wynosi
entalpia reakcji CH4 + 2O2 = CO2 +
2H2O(c), ΔH = -890 kJ,
ΔH = -714
kJ
, ΔH = -846 kJ, ΔH = -802 kJ (bez
zmian)
15) Entalpia reakcji ½CH
4
+ O
2
=
½CO
2
+ H
2
O(g) wynosi ΔH = -401 kJ.
Ciepło kondensacji mola pary wodnej
wynosi 44 kJ. Ile wynosi entalpia
reakcji ½CH4 + O2 = ½CO2 +
H2O(c), ΔH = -445 kJ,
ΔH = -357 kJ
,
ΔH = -423 kJ, ΔH = -401 kJ (bez
zmian)
16) Entalpia sublimacji jest:
/różnicą/pierwiastkiem / dzielnikiem /
sumą
/ logarytmem / entalpii topnienia
i parowania
17) Entalpia topnienia jest: /
różnicą
/
pierwiastkiem / dzielnikiem / sumą /
logarytmem/entalpii sublimacji i
parowania
18) Temperatura topnienia substancji :
zależy /
nie zależy
– wskaż, od ilości
substancji
19) Temperatura wrzenia substancji :
zależy /
nie zależy
– wskaż, od ilości
substancji
20) Kalorymetr służy do pomiaru ,
wskaż : temperatury / głębokości
barwy /
efektu cieplnego reakcji
/
szybkości reakcji /
efektu cieplnego
przemiany fazowej
/ ?
21) Jakiego aparatu użyjesz do
pomiaru ciepła spalania
kalorymetr
22) Jednostkami ciepła właściwego są
: J / KJ
-1
/
Jmol
-1
K
-1
/ Jcm
3
K-1 / ºCg
-1
/
Jkg
-1
K
-1
23) Wartość ciepła właściwego
substancji podajemy w następujących
jednostkach : J/ KJ
-1
/ Jg
-1
/ Jg
-1
K
-1
/
ºCg
-1
/
Jmol
-1
K
-1
24) Metodą różnicowej analizy
termicznej określisz: temperaturę
topnienia /
temperaturę przemiany
fazowej
/ ciepło właściwe / entalpię
przemiany fazowej
25) Czy dodawanie reakcji
chemicznych odpowiada dodawaniu
czy odejmowaniu ich entalpii.
odejmowaniu
26) Entalpia topnienia pewnej
substancji jest równa 6,01 kJ/mol. Czy
jest to proces egzotermiczny czy
endotermiczny.
Endotermiczny
27) Entalpia towarzysząca kondensacji
pewnej substancji jest równa -40,7
kJ/mol. Czy jest to proces
egzotermiczny czy endotermiczny.
Egzotermiczny
1) W punkcie potrójnym wykresu
fazowego H
2
O (P,T) współistnieją ze
sobą następujące fazy:
woda, lód, para
2) Linia na wykresie fazowym H
2
O
(P,T) odpowiada współistnieniu
następujących faz: woda
, para, lód
3) Linia na wykresie fazowym H
2
O
(P,T) odpowiada współistnieniu
następujących faz: lód ,
para, woda
4) Linia na wykresie fazowym H
2
O
(P,T) odpowiada współistnieniu
następujących faz:
para , woda, lód
5) Który z parametrów może być
zmieniony w punkcie potrójnym
wykresu fazowego H
2
O (P,T): T / P /
żaden
6) Znany jest tzw. suchy lód, tj. stały
ditlenek węgla. Czy możliwe jest
uzyskanie ciekłego CO
2
:
tak
/ nie
7) Znany jest tzw. suchy lód, tj. stały
ditlenek węgla. Czy możliwe jest
uzyskanie ciekłego CO
2
pod
ciśnieniem
1 bara: tak /
nie
8) Do jakiej fazy może być
skondensowany gazowy CO2 pod
ciśnieniem atmosferycznym (1 bara):
faz gazowa
/ szkło / faza ciekła /
koloid / faza stała
9) Współistnieniu dwóch faz, na
przykład cieczy i pary, ciała stałego i
pary, ciała stałego i cieczy odpowiada
na wykresie fazowym (P,T): punkt /
linia
/ obszar
10) Które parametry mogą być
zmienione na wykresie fazowym (P,T)
gdy w układzie występują dwie fazy –
gaz i ciecz :
temperatura i ciśnienie
11) Które parametry mogą być
zmienione na wykresie fazowym (P,T)
gdy w układzie występują dwie fazy –
gaz i ciało stałe :
temperatura
12) Które parametry mogą być
zmienione na wykresie fazowym (P,T)
gdy w układzie występuje jedna faza :
temperatura i ciśnienie
13) Które parametry mogą być
zmienione na wykresie fazowym (P,T)
gdy w układzie występują trzy fazy :
temperatura i ciśnienie
14) Które parametry mogą być
zmienione na wykresie fazowym (P,T)
gdy w układzie występują dwie fazy –
ciało stałe i ciecz :
ciśnienie
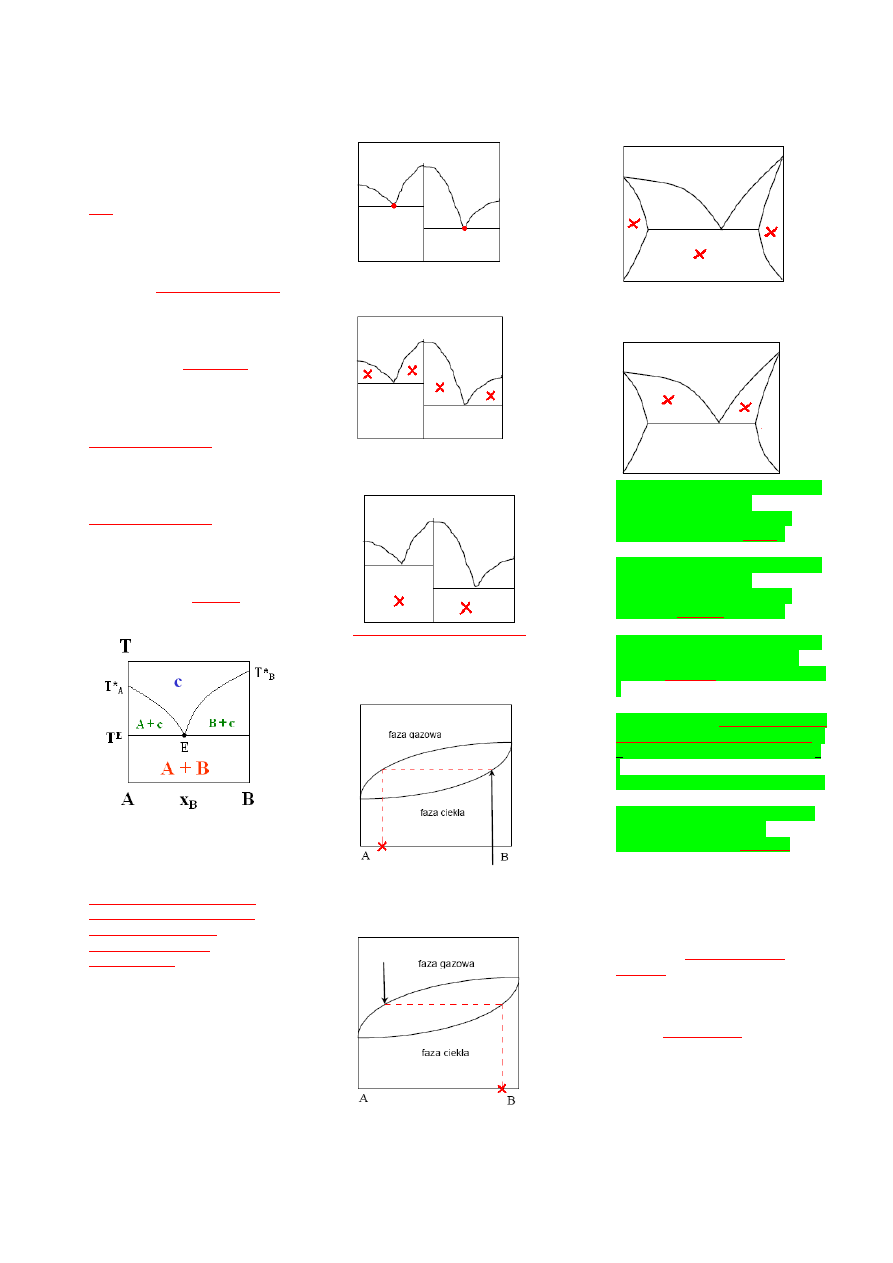
15) Wrysuj w prostokąt poniżej
wykres równowag fazowych prostego,
dwuskładnikowego układu
eutektycznego
A – substancja A w fazie stałej
B – substancja B w fazie stałej
c – ciecz obu substancji
E – punkt eutektyczny
T – temperatura
16) Wskaż na rysunku punkty
eutektyczne
17) Zaznacz ( × ) na rysunku poniżej
obszary współistnienia faz stałych i
ciekłej
18) Zaznacz ( × ) na rysunku poniżej
obszary współistnienia dwóch faz
stałych
19) Zaznacz ( ×) na rysunku poniżej
skład fazy gazowej, odpowiadający
wskazanemu strzałką składowi fazy
ciekłej
20) Zaznacz ( ×) na rysunku poniżej
skład fazy ciekłej, odpowiadający
wskazanemu strzałką składowi fazy
gazowej
21) Zaznacz ( × ) na rysunku poniżej
obszary istnienia roztworów stałych
22) Zaznacz ( × ) na rysunku poniżej
obszary współistnienia roztworów
stałych i fazy ciekłej
23) Która z zależności jest prawdziwa
dla roztworu z dodatnimi
odchyleniami od prawa Raoulta:
[ ai = xi ] / [ai < xi ] / [
ai > xi
]
24) Która z zależności jest prawdziwa
dla roztworu z ujemnymi
odchyleniami od prawa Raoulta:
[ ai = xi ] /
[ai < xi ]
/ [ ai > xi ]
25) Która z zależności jest prawdziwa
dla roztworu spełniającego prawo
Raoulta:
[ ai = xi ]
/ [ai < xi ] / [ ai > xi
]
26) Azeotrop to : {
roztwór o minimum
lub maksimum temperatury wrzenia
} /
{roztwór o równomolowym składzie}
/
{roztwór więcej niż dwuskładnikowy}
27) Azeotrop dodatni charakteryzuje
się najwyższą czy najniższą
temperaturą wrzenia ?
najniższą
28) W rektyfikacji: rozdziela się
azeotrop z minimum temperatury
wrzenia na składniki / wydziela się
azeotrop z minimum temperatury
wrzenia / sączy pod zmniejszonym
ciśnieniem /
stosuje pierścienie
Raschiga
29) Podczas topnienia mieszaniny
eutektycznej temperatura : wzrasta /
maleje /
pozostaje stała
30) W temperaturze krytycznej pod
ciśnieniem krytycznym: istnieją w
równowadze fazy stała, gazowa i
ciekła /

ciecz wrze / gęstość wody jest
największa /
zanika granica faz
pomiędzy fazami gazową i ciekłą
31) Podczas krzepnięcia mieszaniny
eutektycznej temperatura : wzrasta /
maleje /
pozostaje stała
32) Wskaż określenia używane do
opisu właściwości związków
tworzących się w układach
podwójnych :
rozpuszczalny /
kongruentnie topiący
się
/
niekongruentnie topiący się
/
homogeniczny / rektyfikacyjny
1) Uzupełnij wzór:
a
i
= pi/P
0
i
2) Uzupełnij wzór: ai =
pi
/P
0
i
3) Uzupełnij wzór: ai = pi/
P
0
i
4) Cząsteczki substancji A silniej
oddziaływają z cząsteczkami
rozpuszczalnika niż cząsteczki
rozpuszczalnika między sobą. Gdzie
gromadzi się substancja A: w
warstwie powierzchniowej roztworu /
nad roztworem / w głębi roztworu /
wszędzie jednakowo
5) Cząsteczki substancji B słabej
oddziaływają z cząsteczkami
rozpuszczalnika niż cząsteczki
rozpuszczalnika pomiędzy sobą.
Gdzie gromadzi się substancja B:
w
warstwie powierzchniowej roztworu
/
nad roztworem / w głębi roztworu /
wszędzie jednakowo
6) Roztwór tworzą składniki A i B.
Oddziaływania pomiędzy
cząsteczkami A i B są silniejsze niż
pomiędzy samymi cząsteczkami A i
samymi cząsteczkami B. Jak wpływa
to na prężność składników nad
roztworem w porównaniu do roztworu
idealnego: podwyższa ją / nie zmienia
/ obniża / kompensuje wzajemnie /
koryguje o aktywność
7) Roztwór tworzą składniki A i B.
Oddziaływania pomiędzy
cząsteczkami A i B są takie same jak
pomiędzy cząsteczkami A-A i
cząsteczkami B-B. Jak wpływa to na
prężność składników nad roztworem
w porównaniu do roztworu idealnego:
podwyższa ją /
nie zmienia
/ obniża /
kompensuje wzajemnie / koryguje o
aktywność
8) Co jest fazą rozproszoną w
przypadku emulsji ?
ciesz (olej w
wodzie, rozpuszczalnik)
9) Co jest fazą rozpraszającą w
przypadku aerozolu ?
powietrze (gaz)
10) Miarą napięcia powierzchniowego
jest:
praca
/pascal / V·m-2 / gradient
pola
11) Jaki kształt jest optymalny z
punktu widzenia napięcia
powierzchniowego ?
kulisty
12) Ciśnienie osmotyczne związane
jest z :
przenikaniem do roztworu
cząsteczek rozpuszczalnika
/ ciepłem
mieszania substancji rozpuszczonej z
rozpuszczalnikiem / tworzeniem
kompleksów rozpuszczalnika z
substancją rozpuszczoną
13) Ciśnienie osmotyczne związane
jest z : parowaniem rozpuszczalnika
/
przenikaniem do roztworu cząsteczek
rozpuszczalnika
/ rozpuszczaniem w
roztworze osmozy błony
półprzepuszczalnej
14) Ciśnienie osmotyczne związane
jest z : parowaniem rozpuszczalnika /
parowaniem substancji rozpuszczonej
/
przenikaniem do roztworu
cząsteczek rozpuszczalnika
15) Rozmiary cząstek koloidalnych
nie są większe niż (dopisz jednostkę)
1 µm
16) Uzyskiwanie ładunku przez
cząstkę koloidalną : pomaga /
przeszkadza
/ jest obojętne dla
procesów koagulacji / nie dotyczy
procesów koagulacji
17) Roztwór koloidalny jest układem :
jednofazowym /
heterofazowym
/
politropowym / idealnym
18) Stabilizacja koloidów związana
jest z : zamrożeniem stanu równowagi
chemicznej /
adsorpcją jonów na
powierzchni cząstek koloidalnych
/
dysocjacją rozpuszczalnika w pobliżu
powierzchni cząstek koloidalnych /
zależy wyłącznie od rozmiarów
cząstek koloidalnych
19) Stabilizacja koloidów związana
jest z : adsorpcją gazów na
powierzchni cząstek koloidalnych /
adsorpcją substancji powierzchniowo
czynnej na cząstkach koloidalnych /
adsorpcją rozpuszczalnika na
powierzchni cząstek koloidalnych
/
zależy wyłącznie od rozmiarów
cząstek koloidalnych
20) W procesie flotacji wykorzystuje
się : różnice w gęstości roztworów /
środki powierzchniowo czynne
/
elektrody jonoselektywne
21) W procesie flotacji wykorzystuje
się :
adsorpcję na ziarnach materiału
flotowanego środków
powierzchniowo czynnych
/ różnice w
gęstościach względem
rozpuszczalnika materiału
flotowanego i flokulanta /
powinowactwo do mieszadeł ziaren
materiału flotowanego
22) Jeżeli oddziaływania pomiędzy
cząsteczkami cieczy są silne w
porównaniu z oddziaływaniami
pomiędzy cząsteczkami cieczy i
ściankami kapilary to jaki menisk
powstaje ?
wypukły
23) Jeżeli oddziaływania pomiędzy
cząsteczkami cieczy są silne w
porównaniu z oddziaływaniami
pomiędzy cząsteczkami cieczy i
podłożem na którym kładziemy
kroplę, to co dzieje się z kroplą ?
skupi się w jednym miejscu – nie
rozleje się na powierzchni podłoża
(kąt zwilżania będzie duży)
24) Jeżeli oddziaływania pomiędzy
cząsteczkami cieczy są słabe w
porównaniu z oddziaływaniami
pomiędzy cząsteczkami cieczy i
podłożem na którym kładziemy
kroplę, to co dzieje się z kroplą ?
kropla rozleje się na powierzchni
podłoża (kąt zwilżania będzie mały)
25) Jeżeli oddziaływania pomiędzy
cząsteczkami cieczy są słabe w
porównaniu z oddziaływaniami
pomiędzy cząsteczkami cieczy i
ściankami kapilary to jaki menisk
powstaje ?
wklęsły
26) Co oznacza słowo hydrofobowy ?
cząsteczki chemiczne odpychają od
siebie cząsteczki wody – materiał
hydrofobowy to taki który nie jest
niezwilżalny przez wodę.
27) Co oznacza słowo hydrofilowy ?
cząsteczki chemiczne łączą się z
cząsteczkami wody – materiał
hydrofilowy to taki który jest dobrze
zwilżalny przez wodę.
1) Z czym należy kojarzyć pojęcie
”ligand” – z wapnem
hydratyzowanym / solą
nierozpuszczalną
/ kompleksem
/
wartościowością

2) Kompleks w chemii to : roztwór
wieloskładnikowy / osad soli
nieorganicznych /
związek
koordynacyjny
3) Sferę koordynacyjną jonu
centralnego tworzą: orbitale /
ligandy
/
punkty odniesienia spinu / elektrony
4) Liczby koordynacji w związku
kompleksowym to: 1 / 16 /
6
/ 32 /
4
/
7 / 5
5) O wiązaniu koordynacyjnym
decyduje:
wolna para elektronowa
ligandów
/ nadwyżka protonów w
jądrze atomu / dopełnienie do oktetu
elektronów walencyjnych
6) W związkach kompleksowych
wiązanie jon centralny - ligand jest
typu : kowalencyjnego /
typu przekazania elektronów przez
ligandy
/ jonowego / kulombowskiego
/ brak jest wiązania, to tylko efekt
geometryczny
7) Dany jest wzór związku
kompleksowego: [Co(NH
3
)
6
]Cl
3
–
napisz, co jest ligandem
NH
3
8) Dany jest wzór związku
kompleksowego: [Fe(H
2
O)
6
]SO
4
–
napisz, co jest ligandem
H
2
O
9) Dany jest wzór związku
kompleksowego: K
2
PtCl
6
– napisz, co
jest ligandem
Cl
10) Dany jest wzór związku
kompleksowego: Na
2
UBr
6
– napisz,
co jest ligandem
Br
11) Dany jest wzór związku
kompleksowego: [Co(NH
3
)
6
]Cl
3
–
napisz, co jest jonem centralnym
Co
12) Dany jest wzór związku
kompleksowego:
[Fe(H
2
O)
6
]SO
4
– napisz, co
jest jonem centralnym
Fe
13) Związki kompleksowe :
mogą
mieć właściwości paramagnetyczne
/
nie mogą być paramagnetyczne /
pojęcie magnetyzmu nie odnosi się do
związków kompleksowych
14) Związki kompleksowe są barwne
ze względu na :
rozszczepienie
energetyczne orbitali d jonu
centralnego
/ właściwości struktury
liganda / oddziaływania dyspersyjne
kompleksu z cząsteczkami
rozpuszczalnika
15) Wskaż indywidua chemiczne,
które mogą być ligandami : H
+
/
NH
3
/
Fe
3
+
/
H
2
O
/ O
2
/
Ar
/ Mg
2
+
16) Wskaż indywidua chemiczne,
które mogą być ligandami : NH
4
+
/
NH
3
/ Al
3
+
/
CN
-
/ MgO / Pt / Ca
2
+
17) Wskaż indywidua chemiczne,
które mogą być ligandami : Na
+
/
Cl
-
/
Co
3
+
/
H
2
O
/ N
2
/ He /
CN
-
18) Wskaż indywidua chemiczne,
które mogą być jonami centralnymi :
amina / NH
3
/
Fe
3+
/ H
2
O / CH
4
/ Ar /
Fe
2+
/
Cu
2+
19) Wskaż indywidua chemiczne,
które mogą być jonami centralnymi :
kwas szczawiowy / NH
4
OH / N
2
/
Zn
2+
/ CH
4
/ Si /
Fe
2+
/
Co
2+
1)Potencjał jakiego półogniwa
przyjęto za zerowy ? Podaj nazwę
standardowe półogniwo wodorowe
2) Aktywność jonów w standardowym
ogniwie wodorowym wynosi: 0 /
1
/ 2
/ 10 /-1
3) Jaki jest potencjał ogniwa, w
którym przebiega reakcja 2H+ + 2e =
H2, jeśli pH2 = 1 bar a aH+ = 1 ?
Wskaż prawidłową wartość -10 / -1 /
0
/1 / 10 V
4) Które z metali roztwarzać powinny
się w kwasach z wydzieleniem
wodoru:
Zn
,
Sn
, Cu, Au,
Al
5) Na anodzie przebiega reakcja:
redukcji / polaryzacji / depolaryzacji /
utleniania
6) Na katodzie przebiega reakcja:
polaryzacji / utleniania /
redukcji
/
katalizy
7) Reakcja: Fe = Fe
2+
+ 2e przebiega
na: katodzie /
anodzie
/ w kluczu
elektrolitycznym
8) Reakcja: MnO
4
2-
+ 4H
+
= MnO
2
+
2H
2
O – 2e przebiega na:
katodzie
/
anodzie / w kluczu elektrolitycznym
9) Reakcja: Fe
3+
+ e = Fe
2+
przebiega
na:
katodzie
/ anodzie / w kluczu
elektrolitycznym
10) Reakcja NO
3-
+ 4H
+
+ 3e = NO +
2H2O przebiega na:
katodzie
/ anodzie
/ poza elektrodą
11) Reakcja NO + 2H
2
O = NO
3-
+ 4H
+
+ 3e przebiega na: katodzie /
anodzie
/
poza elektrodą
12) Reakcja Cl
-
+ 2OH
-
= ClO
-
+ H
2
O
+ 2e przebiega na: katodzie /
anodzie
/
poza elektrodą
13) Którą z reakcji można powiązać z
ogniwem paliwowym: Ag+ + Cl- =
AgCl / CH4 + Cl2 = CH3Cl + HCl /
CH4 + 2O2 = CO2 + 2H2O
14) Którą z reakcji można powiązać z
ogniwem paliwowym:
2H2 + O2 =
2H2O
/ CO + H2O = CO2 + H2 /
Zn2+ + 4OH- = Zn(OH)4
2-
15) Żelazo pokryte zostało
galwanicznie miedzią. Zarysowanie
powierzchni umożliwi: roztwarzanie
miedzi (Cu2+)
/ roztwarzanie żelaza (do Fe2+)
/
roztwarzanie żelaza (do Fe3+) /
wytrącanie miedzi (Cu) / wytrącanie
żelaza (Fe) – wskaż jedną odpowiedź [
2 pkt ]
16) Żelazo pokryte zostało
galwanicznie cynkiem. Po
zarysowaniu powierzchni nastąpi:
roztwarzanie żelaza (do Fe2+) /
roztwarzanie żelaza (do Fe3+) /
roztwarzanie cynku (Zn2+)
/
wytrącanie żelaza (Fe) / wytrącanie
cynku (Zn) – wskaż jedną odpowiedź
[ 2 pkt ]
17) W półogniwie przebiega reakcja
NO3- + H2O + 2e = NO2- + 2OH-.
Który z czynników wpłynie istotnie na
jego potencjał:
dodatek NaOH
/
dodatek NaCl / dodatek HCl
18) W półogniwie przebiega reakcja
2SO42- + 4H+ + 2e = S2O62- +
2H2O. Który z czynników wpłynie
istotnie na jego potencjał: dodatek
NaOH / dodatek NaCl /
dodatek HCl
19) W półogniwie przebiega reakcja
MnO4- + e = MnO42- . Który z
czynników wpłynie istotnie na jego
potencjał: prężność parcjalna tlenu /
stosunek stężeń wymienionych w
reakcji jonów
/ rodzaj izotopu Mn /
wartościowość elektronu / pH
20) W półogniwie przebiega reakcja
MnO4- + 8H+ + 5e = Mn2+ + 4H2O .
Który z czynników wpłynie istotnie na
jego potencjał:
prężność parcjalna
wodoru / pH roztworu
/
wartościowość elektronu
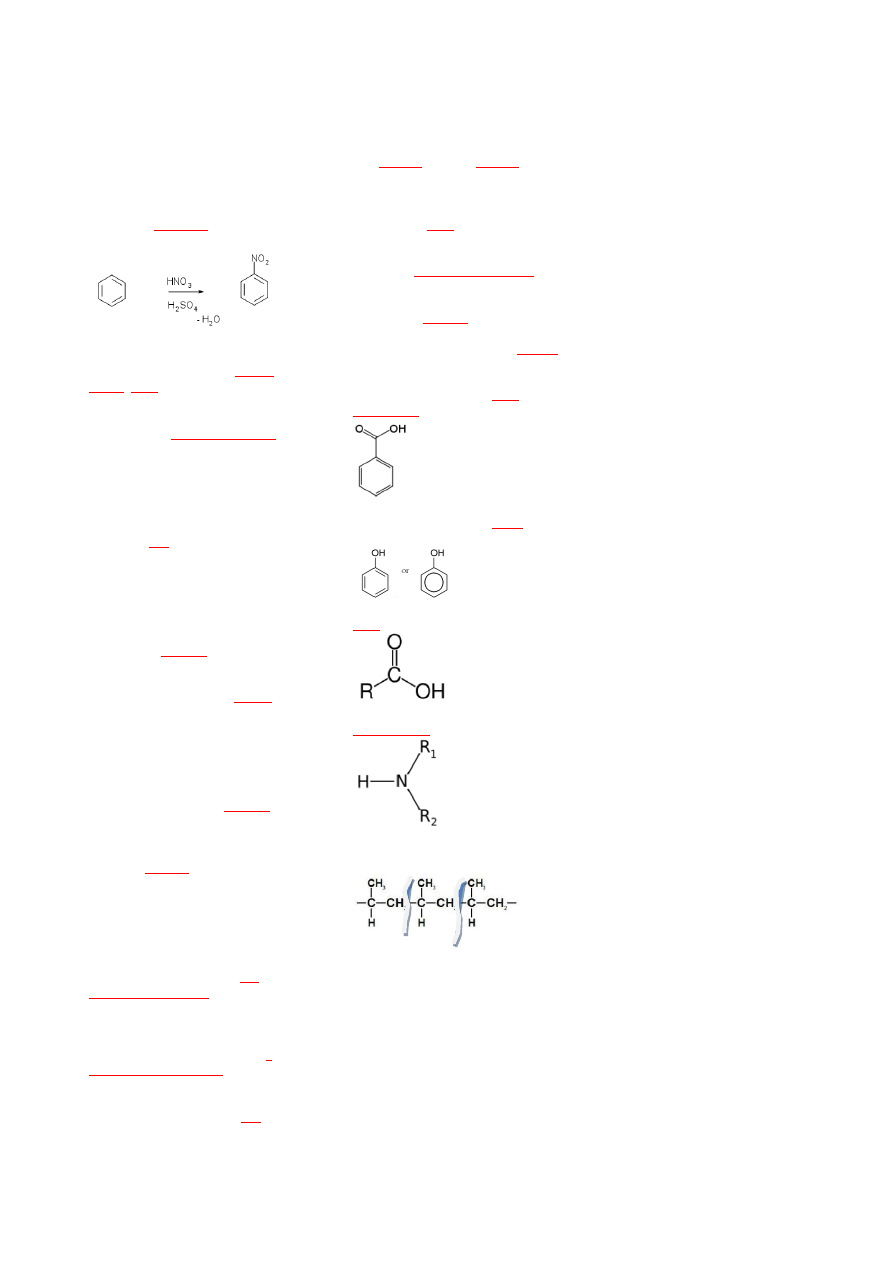
1) Dokończ wzór kwasu
karboksylowego: CH3-CH2-CH2-
COOH
2) Nazwij związek który jest
nitrowany :
BENZEN
3) Wymień pierwiastki wchodzące w
skład polichlorku winylu :
węgiel,
wodór
,
chlor
4) Wymień pierwiastki wchodzące w
skład etanolu :
węgiel, wodór, tlen
5) Alkany to węglowodory :
nasycone;
posiadają conajmniej jedno wiązanie
pojedyńcze miedzy atomami węgla
6) Dokończ wzór alkoholu: CH3-
CH2-CH2-
OH
7) Alkeny to węglowodory :
nienasycone; posiadają conajmniej
jedno wiązanie podwójne pomiedzy
atomami węgla
8) Etan jest :
alkanem
/ alkenem /
alkinem / związkiem aromatycznym
9) Grupa karboksylowa to
COOH
10) Alkiny to węglowodory:
nienasycone; posiadają conajmniej
jedno wiązanie potrójne pomiedzy
atomami węgla
11) Eten jest : alkanem /
alkenem
/
alkinem / związkiem aromatycznym
12) Etyn (acetylen) jest : alkanem /
alkenem /
alkinem
/ związkiem
aromatycznym
13) Węglowodór nasycony to
węglowodór: z pierścieniem
benzenowym / z wiązaniami
podwójnymi / z wiązaniami
potrójnymi / aromatyczny /
bez
wiązań wielokrotnych
/ wyłącznie
niecykliczny
14) Węglowodór nienasycony to :
ester etylowy kwasu octowego /
z
wiązaniami podwójnymi
/ bez wiązań
wielokrotnych
15) Grupa hydroksylowa to
OH
16) Węglowodorem aromatycznym
jest:
naftalen
/ etylen /
chryzen
/
gliceryna / kwas octowy / pirydyna
17) Czy paracetamol zawiera pierścień
benzenowy ?
TAK
18) Czego nie zawiera węglowodór
nasycony :
wiązań wielokrotnych
19) Czego nie zawiera węglowodór
alifatyczny :
np:tlenu
20) Gliceryna to: kwas / eter /
alkohol
/ amina / aminokwas
21) to : toluen / benzen /
kwas
benzoesowy
/ aldehyd benzoesowy
22) to : toluen / benzen /
fenol
/
aldehyd benzoesowy
23) to : monomer / eter / alkohol /
kwas
/ aldehyd
24) Podaj rzędowość tej aminy
drugorzędowa
25) Jest to fragment polimeru, zaznacz
mer na rysunku:
Wyszukiwarka
Podobne podstrony:
CHEMIA EGZAMIN id 112136 Nieznany
chemia fizyczna egzamin id 1122 Nieznany
chemia fizyczna egzamin id 1122 Nieznany
konta egzaminacyjne id 246765 Nieznany
chemia zadania 2 id 113035 Nieznany
algetra EGZAMINY id 57432 Nieznany
chemia opracowanie id 112613 Nieznany
ephl egzamin id 162318 Nieznany
chemia klucz (2) id 112361 Nieznany
Pisma Janowe egzamin id 359103 Nieznany
chemia tablice id 112030 Nieznany
egzamin 2 id 153541 Nieznany
Chemia 03 id 557778 Nieznany
Biotechnologia egzamin id 89038 Nieznany
logika egzamin id 272077 Nieznany
Chemia 10 3 id 111757 Nieznany
Na egzamin id 312078 Nieznany
Chemia 11 3 id 111768 Nieznany
Chemia organiczna W 8 id 112721 Nieznany
więcej podobnych podstron