Układ to fragment rzeczywistości poddany obserwacji bądź rozważaniom teoretycznym i wyodrębniony z niej
fizycznie lub umownie; rozróżnia się układy otwarte (swobodna wymiana energii i materii z otoczeniem), układy
zamknięte (swobodna wymiana energii i brak wymiany materii z otoczeniem) oraz układy izolowane (brak
wymiany energii i materii z otoczeniem)
Otoczenie to rzeczywistośd poza układem
Ciepło Q to jeden z dwóch sposobów przekazywania energii wewnętrzne – polegające na przekazaniu energii
chaotycznego ruchu cząstek w zderzeniach cząstek – wyrażane w dżulach
Praca W to jeden z dwóch sposobów przekazywania energii wewnętrznej – polegająca na przekazaniu energii
przy zmianie parametrów makroskopowych (objętości, położenia itp.) – wyrażana w dżulach
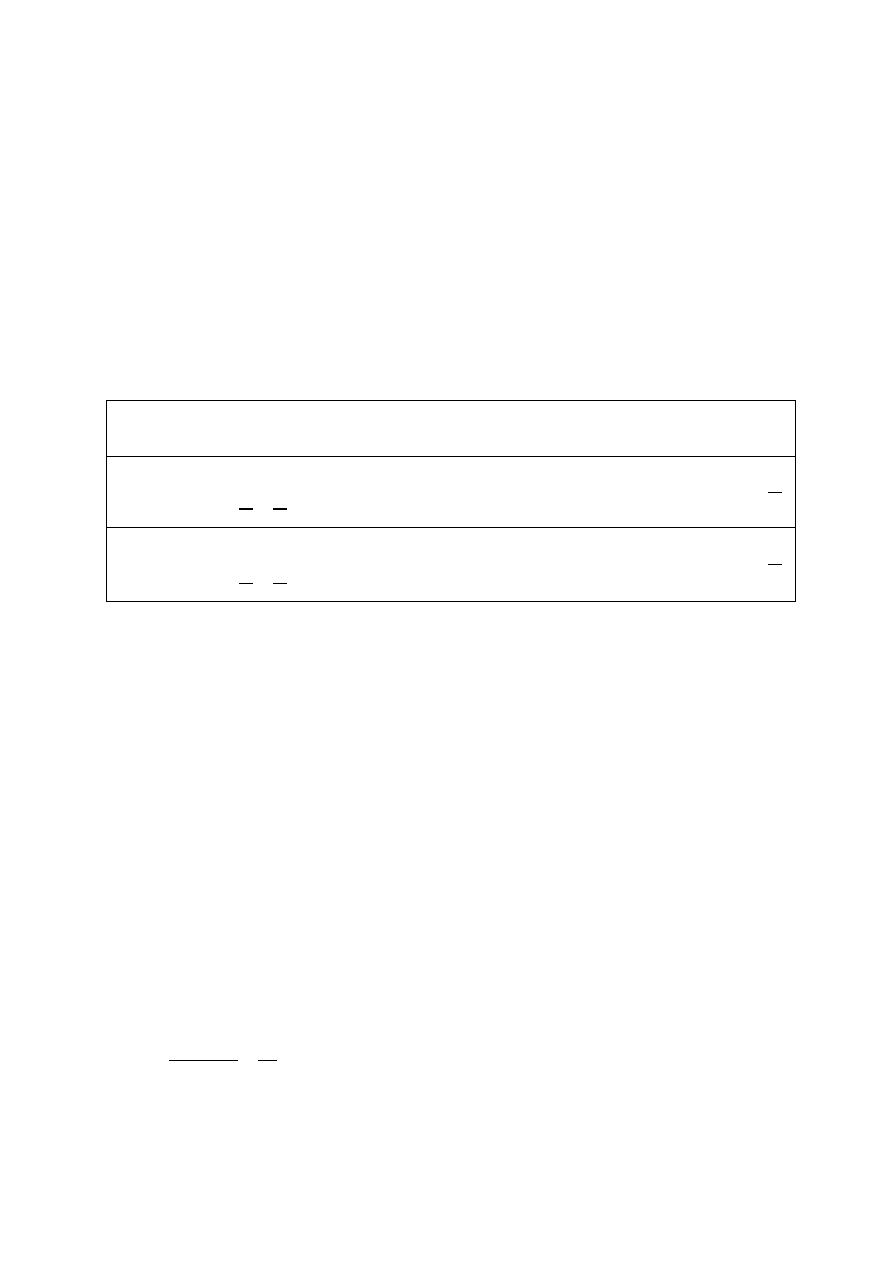
Pierwsza zasada termodynamiki:
Zmiana energii wewnętrznej układu zamkniętego jest równa energii, która przepływa przez jego granice na
sposób pracy lub ciepła
∆𝑈 = 𝑄 + 𝑊
𝑧𝑒𝑤𝑛
= 𝑄 − 𝑊
𝑔𝑎𝑧
przemiany
gazu
prawo
postać pierwszej
zasady
termodynamiki
praca siły
zewnętrznej
ciepło
dostarczone do
układu
zmiana entropii
przemiana
izochoryczna
𝑉 = 𝑐𝑜𝑛𝑠𝑡.
prawo
Charlesa
𝑝
1
𝑇
1
=
𝑝
2
𝑇
2
∆𝑈 = 𝑄
𝑊
𝑧
= 0
𝑄 = 𝑛𝐶
𝑉
∆𝑇
∆𝑆 = 𝑛𝐶
𝑉
ln
𝑇
2
𝑇
1
przemiana
izobaryczna
𝑝 = 𝑐𝑜𝑛𝑠𝑡.
prawo Gay-
Lussaca
𝑉
1
𝑇
1
=
𝑉
2
𝑇
2
∆𝑈 = 𝑄 + 𝑊
𝑧
= 𝑄 − 𝑊
𝑔
𝑊
𝑧
= 𝑝∆𝑉
𝑄 = 𝑛𝐶
𝑝
∆𝑇
∆𝑆 = 𝑛𝐶
𝑝
ln
𝑇
2
𝑇
1
Reakcja egzotermiczna to reakcja chemiczna, która posiada dodatni bilans wymiany ciepła z otoczeniem
(wydziela ciepło do otoczenia) – o entalpii ujemnej
Reakcja endotermiczna to reakcja chemiczna, która posiada ujemny bilans wymiany ciepła z otoczeniem
(pochłania ciepło z otoczenia) – o entalpii dodatniej
Funkcja stanu to w termodynamice funkcja zależna wyłącznie od stanu układu, czyli od aktualnych wartości
jego parametrów – zmiana wartości funkcji stanu zależy jedynie od stanu początkowego i koocowego układu, a
nie od sposobu w jaki ta zmiana została zrealizowana
Energia wewnętrzna U to funkcja stanu będąca równa całkowitej energii układu będącego sumą energii
oddziaływao międzycząsteczkowych i wewnątrzcząsteczkowych układu, a także energii ruchu cieplnego
cząsteczek oraz wszystkich innych rodzajów energii występujących w układzie – wyrażana w dżulach
𝑈 = 𝑇𝑆 − 𝑝𝑉
∆𝑈 = 𝑈
𝑝𝑟𝑜𝑑𝑢𝑘𝑡 ó𝑤
− 𝑈
𝑠𝑢𝑏𝑠𝑡𝑟𝑎𝑡 ó𝑤
= 𝑄 − 𝑝∆𝑉
Entalpia H to funkcja stanu będąca równa sumie energii wewnętrznej (energii potrzebnej do utworzenia
układu) i pracy (energii potrzebnej by w danych warunkach otrzymad miejsce na układ) – wyrażana w dżulach
𝐻 = 𝑈 + 𝑊 = 𝑄 + 𝑝𝑉
∆𝐻 = 𝐻
𝑝𝑟𝑜𝑑𝑢𝑘𝑡 ó𝑤
− 𝐻
𝑠𝑢𝑏𝑠𝑡𝑟𝑎𝑡 ó𝑤
= ∆𝑈 + 𝑝∆𝑉 + 𝑉∆𝑝 = 𝑄 + 𝑉∆𝑝
Entropia S to funkcja stanu będąca miarą nieuporządkowania układu, rośnie wraz ze wzrostem ilości
mikrostanów N – wyrażana w dżulach na kelwin
𝑆 = 𝑘 ln 𝑁
∆𝑆 = 𝑘 ln
𝑁
𝑝𝑟𝑜𝑑𝑢𝑘𝑡 ó𝑤
𝑁
𝑠𝑢𝑏𝑠𝑡𝑟𝑎𝑡 ó𝑤
=
∆𝑄
∆𝑇

Energia swobodna (energia swobodna Helmholtza) F to funkcja stanu będąca równa tej części energii
całkowitej układu, którą można przekształcid na pracę w procesach izotermiczno-izochorycznych – wyrażana w
dżulach
𝐹 = 𝑈 − 𝑇𝑆
∆𝐹 = ∆𝑈 − 𝑇∆𝑆
Entalpia swobodna (energia swobodna Gibbsa) G to funkcja stanu będąca równa tej części energii całkowitej
układu, którą można przekształcid na pracę w procesach izotermiczno-izobarycznych – wyrażana w dżulach
𝐺 = 𝐻 − 𝑇𝑆 = 𝐴 + 𝑝𝑉
∆𝐺 = ∆𝐻 − 𝑇∆𝑆
Energia swobodna i entalpia swobodna określają samorzutnośd reakcji – dla wartości ujemnych proces może
przebiec samorzutnie, dla wartości zerowej proces jest w stanie równowagi, dla wartości dodatnich aby zajśd
musi zostad wymuszony
Prawo Hessa:
Efekt cieplny reakcji w warunkach izobarycznych nie zależy od drogi przemiany, a jedynie od stanu
początkowego i koocowego
Reguła Lavoisiera-Laplace’a:
Efekt cieplny danej reakcji (entalpia) jest równy efektowi cieplnemu reakcji odwrotnej ze znakiem przeciwnym
∆𝐻
1→2
= −∆𝐻
2→1
Wyszukiwarka
Podobne podstrony:
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
ligandy, Studia POLSL, STUDIA, Chemia nieorganiczna, teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
chemia nieorganiczna 5 05 11
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Chemia nieorganiczna zadania 11 Nieznany
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
Chemia nieorganiczna zadania 11
Cwiczenie Chemia 4 (2 11 5 11 2010 r ) id 99837
Chemia 10 3 id 111757 Nieznany
Egzamin chemia nieorganiczna pytania czerwiec 11
Wyklad 2 - Szlachta i arete - 11.10.10 r, Teoria kultury (koziczka)
więcej podobnych podstron