
POLITECHNIKA GDAŃSKA
WYDZIAŁ CHEMICZNY
KATEDRA TECHNOLOGII CHEMICZNEJ
NOWOCZESNE PROCESY UTLENIANIA
INSTRUKCJĘ PRZYGOTOWALI
DR INŻ. ADRIANA ZALESKA
MGR INŻ. MARCIN JANCZAREK
GDAŃSK 2002

2
1. WPROWADZENIE............................................................................................................................................ 2
2. PRZEGLĄD METOD UTLENIAJĄCYCH....................................................................................................... 2
2.1. Mokre utlenianie powietrzem ........................................................................................................................2
2.2. Utlenianie w stanie nadkrytycznym.............................................................................................................. 4
2.3. Utlenianie elektrochemiczne......................................................................................................................... 4
2.4. Utlenianie przy pomocy ozonu i nadtlenku wodoru ..................................................................................... 5
2.5. Reakcja Fentona............................................................................................................................................ 6
2.6. Fotoliza UV .................................................................................................................................................. 7
2.7. Procesy z zastosowaniem O
3
/UV.................................................................................................................. 8
2.8. Utlenianie O
3
/H
2
O
2
/UV ................................................................................................................................ 8
2.9. Degradacja fotokatalityczna w wodnych zawiesinach półprzewodników .................................................... 8
3. REAKTORY....................................................................................................................................................... 9
3.1. Reaktory do utleniania fotolitycznego ......................................................................................................... 9
3.2. Reaktory do utleniania fotokatalitycznego................................................................................................ .. 10
4. OZONOWANIE FENOLU-PODSTAWY TEORETYCZNE............................................................................ 10
5.LITERATURA .................................................................................................................................................... 13
6. OZONOWANIE WODNEGO ROZTWORU FENOLU.................................................................................... 14
6.1. Cel ćwiczenia .............................................................................................................................................. 14
6.2. Aparatura i sprzęt ........................................................................................................................................ 14
6.3. Budowa i działanie aparatury do ozonowania............................................................................................. 14
6.4. Sposób przeprowadzenia pomiarów............................................................................................................ 14
6.5. Analityczna kontrola procesu...................................................................................................................... 17
7. UTLENIANIE WODNEGO ROZTWORU FENOLU METODĄ FENTONA ................................................. 19
7.1. Cel ćwiczenia .............................................................................................................................................. 19
7.2. Aparatura i sprzęt ........................................................................................................................................ 19
7.3. Budowa i działanie aparatury do utleniania metodą Fentona...................................................................... 19
7.4. Sposób przeprowadzenia pomiarów............................................................................................................ 19
7.5. Analityczna kontrola procesu...................................................................................................................... 21
8. FOTOKATALITYCZNA DEGRADACJA FENOLU W WODNEJ ZAWIESINIE TiO
2
.............................. 23
8.1. Cel ćwiczenia .............................................................................................................................................. 23
8.2. Aparatura i sprzęt ........................................................................................................................................ 23
8.3. Budowa i działanie aparatury do utleniania fotokatalitycznego.................................................................. 23
8.4. Sposób prowadzenia pomiarów................................................................................................................... 23
8.5. Analityczna kontrola procesu...................................................................................................................... 25

3
1. WPROWADZENIE
Chemiczne zakłady przemysłowe muszą oczyszczać ścieki zawierające szeroką gamę
zanieczyszczeń począwszy od toksycznych związków organicznych, takich jak związki
aromatyczne (w tym fenol, benzen i jego pochodne), formaldehyd, aminy, aż do związków
nieorganicznych takich jak siarczyny, siarczki, merkaptany, cyjanki oraz metale ciężkie
(np. chrom sześciowartościowy). Ścieki takie charakteryzują się szerokim zakresem stężeń oraz
dużą różnorodnością zanieczyszczeń. Strumień ścieków musi być oczyszczany w możliwie
najtańszy i bezpieczny sposób. Preferowane są metody proste i łatwe do zastosowania
w miejscu powstawania ścieków. Najistotniejszym kryterium wyboru metody, jest oczywiście
spełnienie wymaganych przez prawo norm, którym muszą odpowiadać uzdatnione ścieki.
Jedną z dostępnych obecnie technologii są Nowoczesne Procesy Utleniania (NPU,
ang. AOP – Advanced Oxidation Processes), opierające się na reakcjach z udziałem rodników
hydroksylowych OH
•
. Rodniki hydroksylowe są najsilniejszym utleniaczem, który można
zastosować do oczyszczania wody i ścieków (potencjał utleniający wynosi 2,80 V). Powstają
one miedzy innymi podczas rozkładu ozonu w środowisku wodnym w łańcuchowych reakcjach
rodnikowych, jak również podczas fotolizy nadtlenku wodoru, chloru w środowisku wodnym,
wodnego roztworu Fe(III), podczas reakcji Fentona, lub pod wpływem promieniowania
jonizującego. Rodniki hydroksylowe są mało selektywne i reagują z większością
rozpuszczonych związków organicznych i wieloma nieorganicznymi, przy wysokiej stałej
szybkości reakcji. Celem podwyższenia efektywności w wielu procesach utleniania stosuje się
kilka różnych utleniaczy a reakcje z zastosowaniem rodników OH
•
są tylko jednym z etapów
procesu oczyszczania ścieków [Hoigne 1996]. NPU są istotne dla oczyszczania ścieków,
zanieczyszczonych wód powierzchniowych i gruntowych oraz do produkcji wody ultraczystej
[Braun, 1996].
2. PRZEGLĄD METOD UTLENIAJĄCYCH
Wśród nowoczesnych technologii utleniania wyróżnia się na procesy chemiczne i
fotochemiczne (procesy utleniania indukowane światłem).
Chemiczne metody degradacji:
- mokre utlenianie powietrzem (wet air oxidation - WAO),
- utlenianie w warunkach nadkrytycznych (supercritical water oxidation - SCWO),
- utlenianie elektrochemiczne,
- utlenianie przy pomocy ozonu i nadtlenku wodoru,
- reakcja Fentona
Procesy fotochemiczne wykorzystywane do oczyszczania wody i ścieków:
- fotoliza UV,
- procesy z zastosowaniem UV/H
2
O
2
,
- procesy z zastosowaniem UV/O
3
,
- procesy z zastosowaniem UV/H
2
O
2
/O
3
,
- degradacja fotokatalityczna w wodnych zawiesinach półprzewodników,
- reakcja foto-Fentona,
- procesy z zastosowaniem ultradźwięków [Prousek 1996].

4
2.1. Mokre utlenianie powietrzem
Metoda ta obejmuje utlenianie substancji organicznych lub nieorganicznych w roztworze
wodnym lub zawiesinie przez zastosowanie tlenu lub powietrza w warunkach podniesionej
temperatury i ciśnienia. Typowe warunki dla mokrego utleniania zawierają się w zakresie od
120°C i 2 MPa do 300°C i 10 MPa. Czas prowadzenia procesu wynosi od 15 do 20 min,
a stopień redukcji chemicznego zapotrzebowania tlenu (ChZT) najczęściej od 75% do 90%.
Nierozpuszczalna materia organiczna ulega konwersji do prostszych, rozpuszczalnych
związków organicznych, które są następnie utleniane i ewentualnie przekształcane do CO
2
i H
2
O, bez emisji NO
x
, SO
2
, HCl, dioksyn, furanów, lotnego popiołu, etc. Organiczne związki
azotu są łatwo transformowane do amoniaku, stabilnego w warunkach mokrego utleniania
(Luck, 1996). Mokre metody utleniania proponowano do usuwania ze ścieków glikoli,
detergentów, fenoli, naftoli i ich pochodnych, pestycydów oraz olejów i żywic syntetycznych.
Mokre utlenianie jest atrakcyjną metodą do oczyszczania strumieni ścieków, które są zbyt
rozcieńczone do spalania i zbyt stężone do oczyszczania biologicznego (Zarzycki, 1996).
Mokre utlenianie powietrzem prowadzi się w układzie heterogenicznym gaz-ciecz w
następujących etapach:
a) przenoszenie tlenu z fazy gazowej na granicę fazy gaz-ciecz,
b) przenoszenie tlenu rozpuszczonego z granicy faz gaz-ciecz do masy cieczy
c) reakcja chemiczna pomiędzy tlenem rozpuszczonym a substratami.
Koszt inwestycyjny instalacji do prowadzenie procesu "mokrego utleniania" jest wysoki
w porównaniu do innych metod utleniania. Instalacja oczyszczająca ścieki i/lub półpłynne
odpady ze średnią wydajnością 5-10 m
3
'/h może kosztować kilka mln dolarów amerykańskich.
Analiza kosztów ruchowych instalacji do "mokrego utleniania" wykazuje, że proces jest
efektywny, gdy:
- unieszkodliwia się tą metodą zanieczyszczenia toksyczne i niedegradowalne
konwencjonalnymi metodami, w tym biologicznymi,
- stężenie zanieczyszczeń w odpadach ciekłych lub półpłynnych zawiera się w granicach
1,5%-20% wagowych,
- ilość oczyszczanych ścieków nie jest mniejsza niż 15-20 m
3
/dobę.
W Japonii, w latach 80-tych wprowadzono dwie technologie katalitycznego mokrego
utleniania, polegające na heterogenicznej katalizie z zastosowaniem metali szlachetnych
osadzonych na nośnikach tytanowych lub tytanowo-cyrkonowych. W porównaniu do
standardowych metod mokrego utleniania, w procesach tych można utleniać związki odporne
na rozkład, takie jak kwas octowy i amoniak. Proces NS-LC wykorzystuje katalizatory
Pt-Pd/TiO
2
-ZrO
2
typu "plaster miodu". Typowe warunki reakcji to 220°C oraz ciśnienie 4MPa.
W tych warunkach podczas utleniania związków typu fenol, formaldehyd, kwas octowy,
glukoza, etc, stopień eliminacji osiąga lub nawet przekracza 99%. Dla reakcji prowadzonej w
tych samych warunkach, ale bez katalizatora, stopień eliminacji wynosił od 5-50%.
Druga metoda, proponowana przez firmę Osaka Gas, wykorzystuje katalizatory
sporządzone z mieszaniny metali szlachetnych i nieszlachetnych osadzonych na nośnikach
tytanowych lub tytanowo-cyrkonowych (typu "plaster miodu" lub sfery). Proces zastosowano
do kilku rodzajów ścieków:
- stężone ścieki cyjankowe
- ścieki z procesu zgazowania węgla
- ścieki z pieców koksowniczych
- osad kanalizacyjny (Luck, 1996).

5
2.2. Utlenianie w stanie nadkrytycznym
Utlenianie w wodzie w stanie nadkrytycznym prowadzi się powyżej punktu krytycznego
wody (>22 MPa i 374°C). Podobieństwo utleniania w stanie nadkrytycznym do innych
procesów utleniania na mokro jest jednak tylko formalne, ponieważ powyżej punktu
krytycznego w mieszaninie reakcyjnej mamy do czynienia z procesem jednofazowym, a zatem
kinetyka procesu leży wyłącznie w obszarze kinetyki chemicznej. Woda w stanie
nadkrytycznym zmienia swoje własności jako rozpuszczalnik - z jonowych na niejonowe.
W punkcie nadkrytycznym objętość wody jest 3-krotnie większa niż w warunkach normalnych
(d=0.322 g٠cm
3
), a stała dielektryczna ε wynosi tylko 5,3. W efekcie, w warunkach
prowadzenia procesu utleniania, w temperaturze około 400°C i dla ciśnienia pomiędzy 23-
26 MPa, woda występuje w postaci gęstego gazu. Substancje organiczne, w tym również
węglowodory, oraz tlen cząsteczkowy stają się wzajemnie rozpuszczalne z wodą, podczas gdy
sole nieorganiczne ulegają wytrąceniu z roztworu. Te unikalne właściwości wody w stanie
nadkrytycznym pozwalają na kontakt tlenu i związków organicznych w jednej fazie, w której
następuje gwałtowne i kompletne utlenianie substancji organicznych w temperaturach 550-
650°C. W tych warunkach stopień konwersji może wynosić ponad 99.99% dla
jednominutowego czasu zatrzymania w aparacie. Jest to istotne dla substancji uznanych za
szczególnie niebezpieczne lub uciążliwe dla środowiska z powodu swojej toksyczności przy
jednoczesnej odporności na utlenianie (nitrofenole, chlorowcopochodne alifatyczne i
aromatyczne, polichlorowane bifenyle i dioksyny). Ze względu na stosowane ciśnienia i
temperatury, do budowy reaktorów niezbędne są tworzywa aparaturowe o wysokiej
wytrzymałości oraz odporności korozyjnej. Dotychczas znane jest tylko jedno wdrożenie tej
metody na skalę przemysłową (amerykańska firma Texaco w Austin) (Prousek, 1996;
Zarzycki, 1996).
2.3. Utlenianie elektrochemiczne
Jedną z większych zalet elektrochemii jest to, że na powierzchni elektrod są wytwarzane
i zużywane tylko elektrony, zapewniając tym samym "czyste reagenty" i nie przyczyniając się
do dalszego wzrostu ilości i liczby związków chemicznych w środowisku, co często ma
miejsce w innych procesach. Do wad elektrolitycznego oczyszczania ścieków należy zaliczyć
konieczność rozcieńczania ścieków. Również ekonomia całego procesu ma poważne znaczenie
i musi być brana pod uwagę, kiedy porównuje się tą metodę z innymi, najczęściej tańszymi
sposobami usuwania zanieczyszczeń.
Mechanizm utleniania elektrochemicznego w roztworach wodnych jest bardzo złożony.
Przyjmuje się, że istnieją trzy możliwe mechanizmy przebiegu procesu:
- elektrokoagulacja,
- elektroflotacja,
- elektroutlenianie.
Utlenianie anodowe jest postrzegane jako metoda bezpośrednia uwzględniająca transfer
jednego elektronu z cząsteczki organicznej do elektrody, w wyniku czego powstaje
kationorodnik, który następnie bierze udział w tworzeniu produktu końcowego.
R
R
R
RH
RH
R
H
e
−
→
→
→
•
+
−
•
−
+
•
−
W wyniku rekombinacji rodników utlenianie związków organicznych konkuruje z utlenianiem
innych związków w roztworach, np. powstawanie atomów chloru z jonów chlorkowych:
•
−
−
→
−
Cl
Cl
e

6
Wadą metod elektrochemicznych jest wymóg znacznego przewodnictwa właściwego
roztworu. Większość badań laboratoryjnych prowadzi się w roztworach soli o stężeniu powyżej
0,l mol/dm
3
. Z kolei w praktyce ścieki są mieszane z wodą morską (lub roztworem solanki) i
poddawane elektrolizie z wydzielaniem chloru. Sole magnezowe obecne w wodach morskich
oraz jony hydroksylowe powstające na katodzie prowadzą do powstawania wodorotlenku
magnezu. Wodorotlenek magnezu jest ważnym czynnikiem w procesie flokulacji oraz
sedymentancji rozproszonych cząstek, adsorpcji rozpuszczonych fosforanów i tworzenia
nierozpuszczalnych związków fosforu. Oczyszczanie elektrochemiczne próbuje się zastosować
do ścieków z papierni oraz przemysłu tekstylnego. W przypadku ścieków z przemysłu
papierniczego BZT ulegało redukcji o 70%, zaś chlorowane fenole usunięto w 95% (Prousek,
1996). Nie zaobserwowano natomiast całkowitej mineralizacji związków organicznych. W celu
zwiększenia efektywności procesu należałoby zastosować elektrody o dużej powierzchni, np.
elektrody porowate.
2.4. Utlenianie przy pomocy ozonu i nadtlenku wodoru
W wielu krajach ozon jest najszerzej stosowaną substancją wykorzystywaną do
oczyszczania wody pitnej. Stosuje się go także do utleniania zanieczyszczeń w przypadku
ścieków przemysłowych. Ozon znany jest jako najbardziej selektywny utleniacz. Reakcje
utleniania zapoczątkowane przez ozon w roztworach wodnych są głównie reakcjami
złożonymi. Ozon może reagować z substancjami organicznymi na dwa sposoby: bezpośrednio
lub poprzez rodniki (utleniacz wtórny). Obecność substancji rozpuszczonych ma wpływ na
sposób utleniania i tym samym na otrzymywane produkty końcowe.
W roztworach obojętnych ozon jest nietrwały i szybko ulega rozkładowi w reakcji
łańcuchowej, zapoczątkowanej przez rodniki hydroksylowe:
•
•
+
→
+
HOO
O
O
HO
2
3
W roztworze obojętnym rodniki HOO
•
deprotonują się do anionorodników O
2
•
¯:
−
•
+
•
+
→
2
O
H
HOO
Anionorodnik O
2
•-
reaguje następnie z drugą cząsteczką ozonu w trzystopniowej reakcji,
w wyniku której powstają dwie cząsteczki tlenu i nowy rodnik hydroksylowy, który może
reagować z następną cząsteczką ozonu.
2
3
3
2
O
O
O
O
+
→
+
−
•
−
•
•
+
−
•
→
+
3
3
HO
H
O
•
•
+
→
HO
O
HO
2
3
W roztworach zasadowych jony hydroksylowe reagują z ozonem tworząc anionorodnik O
3
•-
i
rodnik hydroksylowy:
•
−
•
−
+
→
+
OH
O
OH
O
3
3
2
3
O
O
O
+
→
−
•
−
•
−
•
−
•
+
⇔
+
HO
HO
O
H
O
2
Powszechnie wiadomo, że ozon może reagować z substancjami organicznymi różnymi
mechanizmami. Najprostszym z nich jest podstawowa reakcja ozonu z cząsteczką organiczną.
Jednak większość reakcji zachodzi prawdopodobnie pomiędzy substancją organiczną a
rodnikami hydroksylowymi.
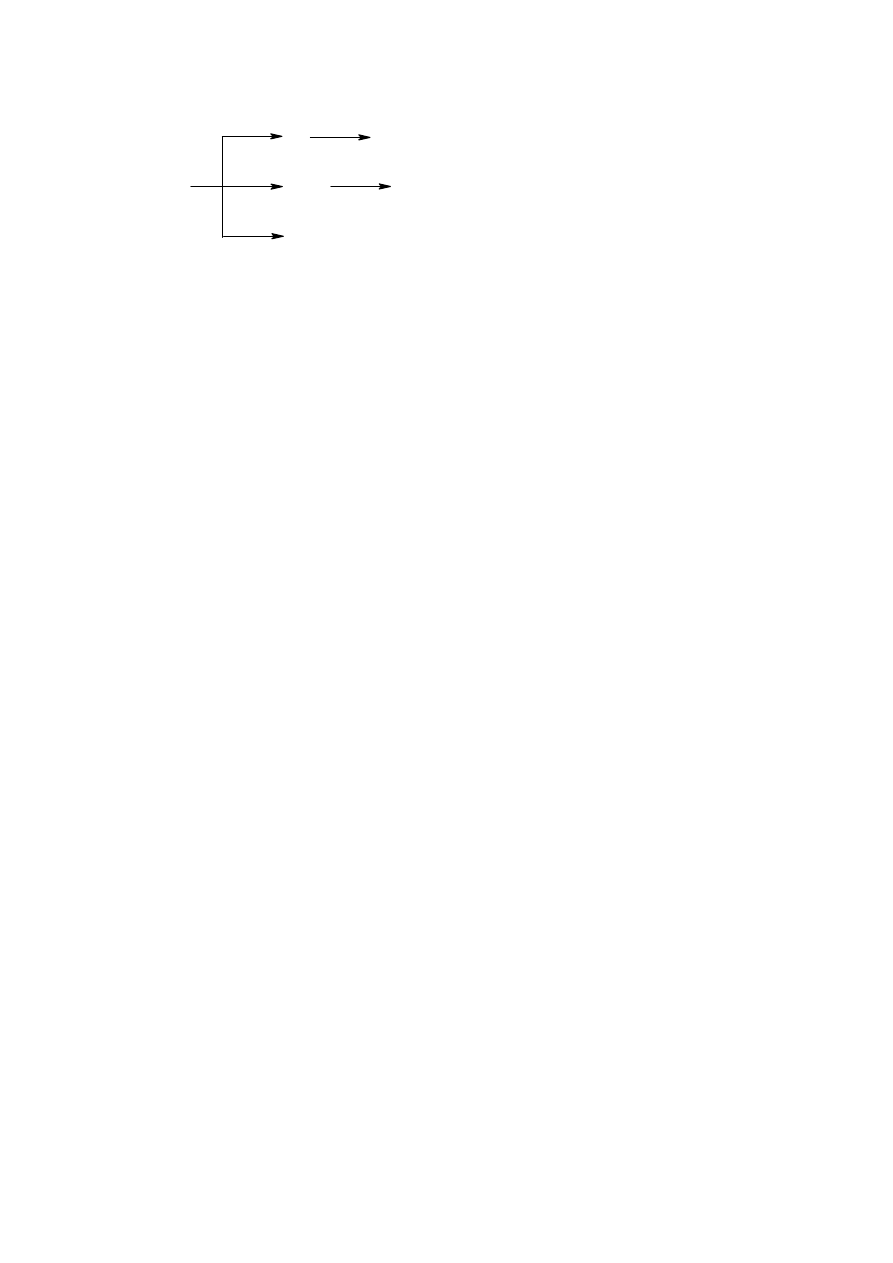
7
RH + HO
.
-H
2
O
R ROO
.
.
O
2
RH R
.
.
+
-OH -
HOR H
.
-H
+
Potencjał utleniania ozonu wynosi 2,07 V, natomiast potencjał utleniania nadtlenku wodoru
wynosi 1,77 V. W związku z tym nadtlenek wodoru jest również stosowany jako utleniacz w
procesach uzdatniania ścieków. Często stosuje się obydwa utleniacze razem. Zastosowanie
nadtlenku wodoru znacznie obniża koszty uzdatniania ścieków w porównaniu z zastosowaniem
samego ozonu. Prawdopodobny mechanizm reakcji przedstawiono poniżej:
+
−
+
⇔
H
HOO
O
H
2
2
−
•
•
−
+
→
+
3
3
O
HOO
O
HOO
Jednocześnie nadtlenek wodoru może również przyspieszać rozkład ozonu w roztworach
alkalicznych. Efekt wzrasta wraz ze wzrostem pH roztworu i stężenia nadtlenku wodoru
[Prousek 1996]. Stosunek H
2
O
2
/O
3
, dla którego najszybciej generowane są rodniki, wynosi
0,35g/g [Roche 1994].
2.5 Reakcja Fentona
Ponad sto lat temu, H.J.H. Fenton odkrył, że pod wpływem rozpuszczalnych związków
żelaza (II) jako katalizatora oraz nadtlenku wodoru wiele substancji organicznych ulega
utlenieniu. Reakcja nie wymaga zastosowania wysokiego ciśnienia, wysokiej temperatury czy
nawet skomplikowanej aparatury. Badania nad mechanizmem utleniania wykazały
powstawanie reaktywnych rodników hydroksylowych poprzez katalityczny rozkład nadtlenku
wodoru w roztworze kwaśnym. W wyniku reakcji Fentona powstaje jon żelazowy, rodnik
hydroksylowy (OH
•
) oraz jon hydroksylowy (OH
-
). Jeżeli w roztworze znajdują się substancje
organiczne, następuje ciąg reakcji:
•
−
+
+
+
+
→
+
HO
OH
Fe
O
H
Fe
3
2
2
2
−
+
+
•
+
→
+
OH
Fe
Fe
HO
3
2
O
H
R
RH
HO
2
+
→
+
•
•
+
+
+
•
+
→
+
2
3
Fe
R
Fe
R
R
H O
ROH H
+
+
+
→
+
2
RH
R
Fe
Fe
R
H
→
+
→
+
+
−
+
+
•
3
2
Efekt utleniający reagentów Fentona silnie zależy od pH roztworu oraz stosunku stężeń H
2
O
2
i
Fe
2+
. Zakres pH, w którym następuje utlenianie, wynosi od 3 do 5, ale optymalna wartość pH
dla reakcji Fentona zawiera się pomiędzy wartością 3 a 4. Natomiast wagowy stosunek ilości
katalizatora do nadtlenku wodoru wynosi 1:5 [Bigda 1995]. Rodniki hydroksylowe mogą być
również generowane w obecności innych kationów metali (Mn
+
), a sam proces przebiega
podobnie jak podczas reakcji Fentona:
•
−
+
+
+
+
→
+
HO
OH
M
O
H
M
)
1
n
(
2
2
n

8
Teoretycznie, wszystkie związki organiczne zawierające wodór mogą być utleniane przez
rodniki hydroksylowe, wytwarzane w reakcji Fentona. Główną zaletą procesu Fentona,
w porównaniu z innymi metodami oczyszczania ścieków, jest brak pozostałości H
2
O
2
w układzie poreakcyjnym oraz katalityczne tylko ilości Fe
2+
stosowane w reakcji. Reakcja
Fentona jest stosowana zarówno do oczyszczania wstępnego, jak też do obniżenia ChZT przed
dalszym biologicznym oczyszczaniem ścieków, lub w celu mineralizacji toksycznych i trudno
biodegradowalnych zanieczyszczeń. Proces Fentona zastosowano do kilku rodzajów ścieków:
• wód procesowych powstających podczas syntezy chemikaliów, leków, insektycydów,
barwników, materiałów wybuchowych (TNT, RDX);
• ścieków z rafinerii;
• ścieków z produkcji polimerów zawierających fenol czy formaldehyd;
• ścieków powstających w przemyśle drzewnym zawierających m.in. krezotole i związki
miedzi;
• ścieków powstających w wyniku oczyszczania gleby [Bigda 1995].
2.6 Fotoliza UV
Prosta fotoliza UV jest pierwszą fotochemiczną metodą zastosowaną do degradacji
zanieczyszczeń. Chociaż bezpośrednie utlenianie za pomocą promieniowania UV jest
proponowane przez bardzo wielu autorów, należałoby wskazać ograniczenia tej metody.
Bezpośrednia degradacja fotochemiczna następuje tylko w przypadku, kiedy światło padające
jest absorbowane przez zanieczyszczenie. Wysoko fluorowane lub chlorowane nasycone
związki alifatyczne mogą być efektywnie eliminowane poprzez homolizę wiązań węgiel-
halogen. Odpowiednie energie wzbudzenia wynoszą < 190 nm dla wiązań C-F i 210-230 nm
dla wiązań C-C1. Fotoliza UV jest wykorzystywana do eliminacji chlorowanych i nitrowanych
związków aromatycznych, fenoli oraz halogenowanych związków alifatycznych. Halogenki
aromatyczne ulegają procesowi znacznie szybciej niż alifatyczne. W porównaniu do innych
metod fotochemicznych, w których generowane są rodniki hydroksylowe, proces jest
selektywny i mało efektywny. Tylko w połączeniu z innymi, dodatkowo zastosowanymi
środkami utleniającymi, jak np. H
2
O
2
, zaobserwowano redukcję ChZT [Prousek,1996].
2.7 Proces z zastosowaniem H
2
O
2
/UV
Utlenianie zanieczyszczeń organicznych przez połączenie metody UV z innymi utleniaczami
(H
2
O
2
, O
3
) zakłada w większości przypadków generowanie i w efekcie reakcje z rodnikami
hydroksylowymi. Mechanizm fotolizy nadtlenku wodoru polega na rozpadzie cząsteczki na
rodniki hydroksylowe, które następnie atakują cząsteczki organiczne:
HO OH hv
HO
−
+
→
•
2
Reakcje rodników hydroksylowych z substancjami organicznymi biegną w kierunku:
• oderwania atomu wodoru (alkany),
O
H
R
RH
HO
2
+
→
+
•
•
• addycji elektrofilowej (alkeny, związki aromatyczne),
X
Ph
HO
PhX
HO
−
−
→
+
•
•
• przeniesienia elektronu
−
+
•
•
+
→
+
HO
RX
RX
HO

9
Zaletą zastosowania H
2
O
2
jako utleniacza, w porównaniu z innymi metodami chemicznego lub
fotochemicznego oczyszczania ścieków, jest jego powszechna dostępność, stabilność
termiczna, całkowita rozpuszczalność w wodzie, oraz znacznie niższy koszt niż w przypadku
zastosowania np. ozonu. Główną wadą wszystkich procesów utleniania degradacyjnego,
opartych na reaktywności rodników hydroksylowych, jest efektywne wychwytywanie rodników
HO
•
przez jony HCO
3
-
i CO
3
2-
, obecne w wodach i ściekach. W efekcie powstają anionorodniki
karboksylowe, również o właściwościach utleniających, ale ich potencjał utleniający jest niższy
od potencjału rodników hydroksylowych. Procesy utleniania wykorzystujące H
2
O
2
w połączeniu z UV mają sprawdzoną efektywność dla wielu związków organicznych
[Prousek, 1996].
2.8. Procesy z zastosowaniem O
3
/UV
Ozonowanie fotolityczne, w którym połączono bezpośrednio efekt fotolizy i ozonowania,
wzmaga ilość generowanych rodników hydroksylowych, ponieważ fotoliza ozonu powoduje
powstawanie H
2
O
2
. W ten sposób połączenie UV z ozonowaniem jest bardziej efektywne niż
suma tych dwóch indywidualnych procesów (efekt synergistyczny). Metoda ta wykorzystywana
jest w przypadku związków odpornych na samo ozonowanie. Jest ona najczęściej stosowaną
metodą NPU dla szerokiej gamy zanieczyszczeń. Proces stosuje się w układzie I lub II-
stopniowym. W układzie jednostopniowym ścieki są jednocześnie poddawane działaniu ozonu i
naświetlane promieniowaniem UV. W układzie II-stopniowym ścieki są poddawane
ozonowaniu w I reaktorze i następnie częściowo już utlenione, wraz z ozonem resztkowym,
przechodzą do II reaktora, gdzie są naświetlane promieniowaniem UV. Wadą metody, jak we
wszystkich metodach wykorzystujących ozon, jest niska rozpuszczalność ozonu w wodzie
i związana z tym słaba wymiana masy, duży koszt generowania ozonu oraz jego korozyjność.
2.9. Utlenianie w układzie O
3
/H
2
O
2
/UV
Rodniki hydroksylowe podczas utleniania zanieczyszczeń za pomocą O
3
/H
2
O
2
/UV
powstają zgodnie z równaniami:
H O
HOO
H
2
2
⇔
+
−
+
2
2
3
O
O
HO
HOO
O
+
+
→
+
−
•
•
−
2
3
2
3
O
O
O
O
+
→
+
−
•
−
•
2
2
3
O
HO
HO
O
H
O
+
+
→
+
−
•
−
•
Dodatkowo rodniki hydroksylowe są generowane w reakcji fotochemicznej. Prowadzone są
pilotowe badania zastosowania tej metody na skalę techniczną.
2.10. Degradacja fotokatalityczna w wodnych zawiesinach półprzewodników
Metodą cieszącą się coraz większym zainteresowaniem jest fotokataliza heterogeniczna z
wykorzystaniem zawiesin półprzewodników. Na powierzchni drobin półprzewodnika zachodzi
fotokatalityczne utlenienie zaadsorbowanej substancji, prowadzące do jej rozpadu. Na przebieg
procesu degradacji ma wpływ szereg czynników Najważniejsze to:

10
- dobór właściwego półprzewodnika,
- odpowiednie przygotowanie jego powierzchni,
- natężenie padającego światła,
- rozpuszczalnik,
- temperatura,
- dodatkowe substancje znajdujące się w roztworze,
- pH roztworu (w przypadku roztworów wodnych), [Zarzycki, 1996].
Generalnie reakcję fotokatalizy z zastosowaniem półprzewodników można przedstawić za
pomocą równania:
półprzewodnik
hv>E
bg
ZWIĄZEK ORGANICZNY
ZAWIERAJĄCY + O
2
CO
2
+ H
2
O +
HETEROATOMY
KWASY
MINERALNE
Większość danych na temat reakcji fotokatalicznych z zastosowaniem zawiesin
półprzewodników dotyczy tlenków metali (TiO
2
, ZnO, SnO
2
, WO
3
) i siarczków, selenków oraz
tellurków metali (CdS, ZnS, CdSe, CdTe). Z przebadanych półprzewodników w reakcji
fotokatalizy TiO
2
wykazał najwyższą aktywność. W dodatku TiO
2
absorbuje tylko UV (E
bg
=
3,2 eV), jest tani, nierozpuszczalny w większości warunków, stabilny fotochemicznie
i nietoksyczny. W reakcjach fotokatalitycznych najczęściej stosuje się dwutlenek tytanu w
formie anatazu. Druga stabilna odmiana dwutlenku tytanu - rutyl, charakteryzuje się mniejszą
bądź brakiem aktywności w reakcja fotokatalitycznych.
Jeżeli półprzewodnik jest naświetlany światłem o dostatecznej energii, to foton (hν) może
wzbudzić elektron (e
-
) z pasma walencyjnego kryształu do pasma przewodnictwa zostawiając
lukę elektronową (dziurę – h
+
).
−
+
+
→
+
e
h
h
TiO
2
2
2
2
ν
TiO
2
może być aktywowany w zakresie promieniowania UV (300-388 nm). Na granicy faz
elektron i dziura mogą brać udział w reakcji redoks z zaadsorbowanymi z roztworu wodnego
cząsteczkami: H
2
O, OH
-
, cząsteczki związków organicznych oraz O
2
. Rodniki hydroksylowe
powstają w reakcji utleniania pomiędzy dziurą (h
+
) oraz H
2
O lub OH
-
.
•
+
+
+
→
HO
H
h
O
H
2
2
2
2
2
Elektron (e
-
) może brać udział w reakcji redukcji z zaadsorbowanym O
2(aq)
generując O
2
-
•
, który
następnie może generować dodatkowy H
2
O
2
.
2
2
2
2
2
2
2
2
2
O
O
H
O
e
H
O
+
→
→
+
•
−
−
Fotokataliza z wykorzystaniem TiO
2
może być stosowana, między innymi, do
detoksykacji niebezpiecznych ścieków, usuwania zanieczyszczeń powietrza oraz oczyszczania
rozlewów olejowych.
3. REAKTORY
3.1. Reaktory do utleniania fotolitycznego
W procesach UV/H
2
O
2
oraz UV/O
3
, jakkolwiek prowadzone są badania ze światłem
słonecznym, jako źródło energii zwykle wykorzystywane jest promieniowanie lamp
rtęciowych. Do wytwarzania rodników hydroksylowych potrzebne są kwanty promieniowania z
krótkofalowego nadfioletu tzw. zakres - UVC (200-280 nm). W reaktorach laboratoryjnych

11
zwykle wykorzystuje się niskociśnieniowe lampy rtęciowe, natomiast średnio-
i wysokociśnieniowe lampy oraz domieszkowane lampy łukowe są często wykorzystywane w
badaniach pilotowych i w reaktorach produkcyjnych. Zwykle projektuje się aparaty z lampą
zanurzoną w mieszaninie reakcyjnej. Podstawowe problemy związane z zaprojektowaniem
odpowiedniego reaktora to: (a) zakres absorpcji promieniowania UV, (b) przeciwdziałanie
zanieczyszczaniu powierzchni lampy, (c) regulacja pH oraz (d) ograniczenia wynikające z
wymiany masy w przypadku reaktorów UV/O
3
typu pęcherzykowego. Jeżeli dodatkowo
zastosujemy reagenty Fentona trzeba wziąć pod uwagę również problem wytwarzania się piany
[Yue, 1996].
3.2. Reaktory do utleniania fotokatalitycznego
Stosuje się dwa modele reaktorów fotokatalitycznych:
• cząstki fotokatalizatora mogą być immobilizowane na nieruchomych elementach typu
siatka z nylonowych włókien lub na ścianach reaktora,
• cząstki fotokatalizatora są rozproszone w reaktorze [Yue, 1996], niekiedy katalizator
osadzony jest na powierzchni pustych, szklanych mikrosfer i w tej postaci zawieszony
w cieczy - ułatwia to m.in. oddzielenie katalizatora po reakcji [Preis, 1996],
Najczęściej używa się reaktorów cylindrycznych lub płaskich płytowych z nieruchomo
osadzonym katalizatorem, np. nylonowe włókna osadzone współosiowo wzdłuż odpowiedniej
lampy lub na płaskiej płycie [Yue, 1996].
W procesie utleniania substancji niebiodegradowalnych w ściekach, nazwanym
CHEMOX™, zastosowano reaktor ze strefą super-burzliwości (Impinging Zone Reactor-IZR)
opracowany przez Uniwersytet w Clausthal (Niemcy). Ścieki kontaktują się z ozonem,
nadtlenkiem wodoru i światłem UV w reaktorze, który pozwala osiągnąć wysoki stopień
wymiany masy i jednocześnie charakteryzuje się niskim zużyciem energii. Mieszanina tlenu i
ozonu jest wtłaczana pod ciśnieniem przez dyszę do reaktora. Tam miesza się z wodą, która jest
pompowana z dużą szybkością w pętlach recyrkulacyjnych. Dwa strumienie ciecz-gaz
zderzają się w rurze centralnej, gdzie jest wytwarzana strefa wysokiej turbulencji. Centralna
rura jest połączona ze zbiornikiem pozwalającym na dłuższy czas reakcji gazu rozpuszczonego
z cząsteczkami w znajdującymi się w fazie ciekłej, zanim oczyszczona faza ciekła opuści
naczynie [Barratt, 1996].
4. OZONOWANIE FENOLU - PODSTAWY TEORETYCZNE
Ozon może reagować z fenolem na dwa sposoby [Langlais 1991]:
• w środowisku kwaśnym lub obojętnym - podczas reakcji zachodzi atak elektrofilowy
utleniacza na fenol, w pozycji orto lub para,
• w środowisku obojętnym lub zasadowym - podczas reakcji następuje atak elektrofilowy
na jon fenolanowy lub reakcja przebiega mechanizmem rodnikowym, inicjowana
zarówno przez grupę hydroksylową, jak i jon fenolanowy.
Fenole łatwo i gwałtownie ulegają utlenianiu przez ozon. Utlenianie fenolu przebiega
wielostopniowo z powstawaniem produktów pośrednich utlenianych do coraz mniej złożonych
związków, niewyczuwalnych organoleptycznie w wodzie. Stopień utleniania fenolu ozonem
jest wprost proporcjonalny do dawki ozonu. W przypadku małych dawek produktami utleniania
fenoli są hydrochinony [Kowal 1996]. Początkowe produkty utleniania wykazują większą
toksyczność od produktu wyjściowego, dlatego musi być dostarczona odpowiednia ilość ozonu
w celu utlenienia pośrednich produktów. Warunki te są bardzo istotne w przypadku

12
konwencjonalnego ozonowania [Langlais 1991].
Podczas rozpadu ozonu pojawiają się następujące produkty (rysunek l) [Langlais 1991]:
• produkty będące rezultatem hydroksylowania pierścienia, takie jak chinony i difenole,
• produkty pochodzące z rozbicia łańcucha, takie jak kwas mukonowy i pochodne,
• końcowe produkty utleniania, takie jak kwas glioksylowy, kwas szczawiowy, kwas
mrówkowy i glioksal.
Produkty takie jak pirokatechina, hydrochinon, pojawiają się na początku przebiegu reakcji i
ich stężenie osiąga maksymalną wartość po około 7,5 min przebiegu procesu. Po około 40 min
reakcji swoje maksymalne stężenie osiągają kwas maleinowy i mukonowy, produkty te ulegają
rozpadowi po około 2 godzinach trwającego procesu. Stężenie produktów końcowych wzrasta
ze zmniejszeniem się stężenia fenolu, osiągają one maksymalne stężenie po około 1,5 godzinie
ozonowania, a nawet po czasie 3 godzin nie zostają całkowicie rozłożone [Trapido 1995].
Do otwarcia pierścienia fenolanowego potrzeba od 4 do 6 moli ozonu na mol fenolu.
Reakcje zachodzące pomiędzy fenolem i ozonem w wodnym roztworze wyglądają następująco:
C
6
H
5
OH ↔ C
6
H
5
O
-
+ H
+
C
6
H
5
OH + OH
-
↔ C
6
H
5
O
-
+ H
2
O
C
6
H
5
O
-
+ O
3
→
Produkty
Proces całkowitego utleniania fenolu można opisać ogólnym równaniem:
C
6
H
5
OH + 14 O
3
→ 6 CO
2
+ 3 H
2
O + 14 O
2
Istotny jest fakt, że zamiast fenolu reaguje z ozonem jon fenolanowy, co ma duży wpływ
na szybkość reakcji [Kowal 1996].
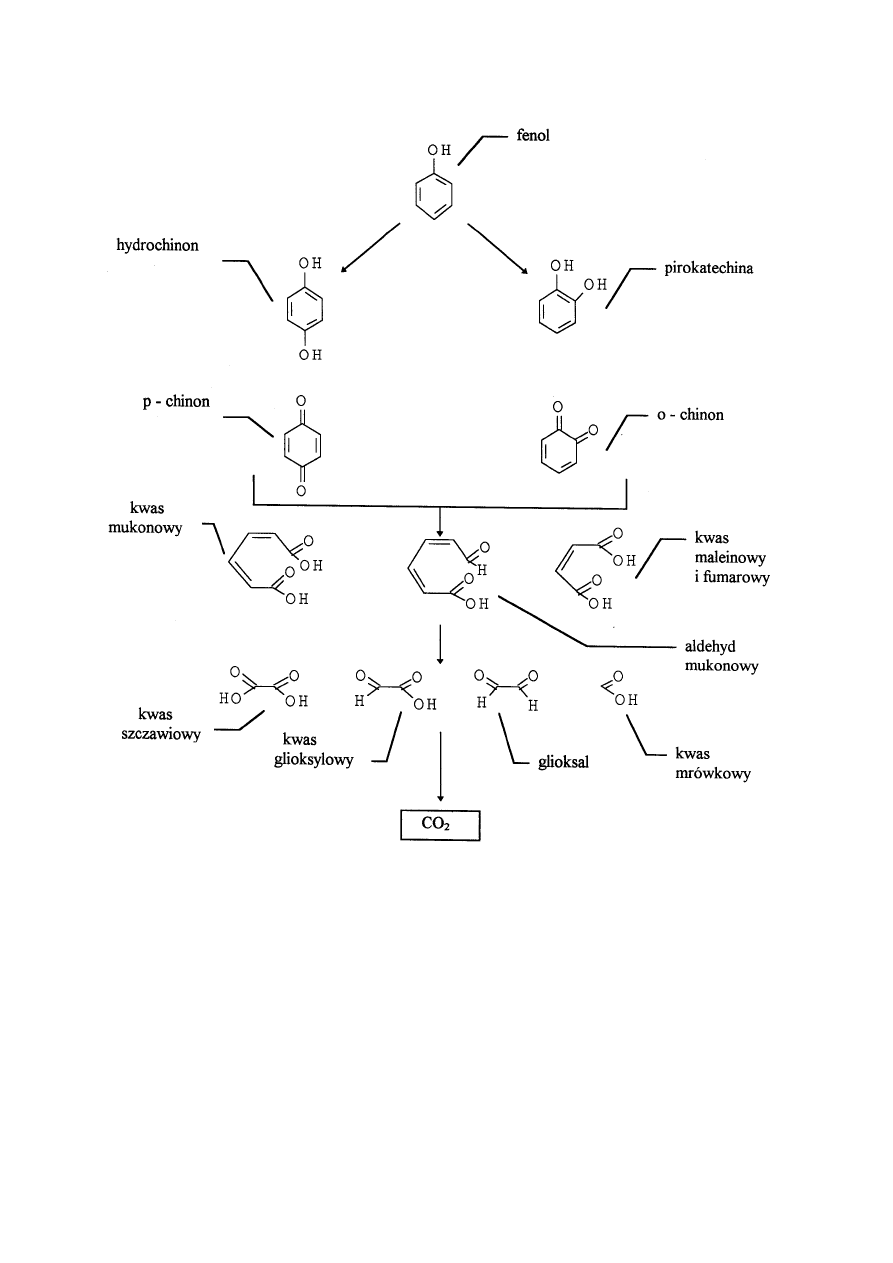
13
Rys. 1.
Schemat rozpadu fenolu uwzględnieniem produktów pośrednich [Langlais 1991].

14
5. LITERATURA
Barrat P.A., Baumgartl A., Hannay N., Vetter M., Xiong F. (1996), CHEMOX™ Advanced
Waste Water Treatment with the Impinging Zone Reactor, „
Oxidation Technologies for
Water and Wastewater Treatment" Goslar, Germany, May 12-15 1996
Bigda R.J., Consider Fenton's chemistry for wastewater treatment,
Chemical Engineering
Progress 12, 62-66 1995
Braun A.M., Oliveros E. (1996), How to evaluate photochemical methods for water
treatment Intemational Conference „Oxidation Technologies for Water and Wastewater
Treatment"
Hoigne J., Intercalibration of OH radical sources and water quality parameters.
Intemational
Conference „Oxidation Technologies for Water and Wastewater Treatment" Goslar,
Germany, May 12-15 J996 Goslar, Germany, May 12-15 1996
Guha AK., Shanbhag P. V., Sirkar K.K., Multiphase ozonołysiis oforganics m wastewater by
a novel membranę reactor, AlChE Joumal 41 (8) (1995)
Kowal AL., Świderska-Bróż M., Oczyszczanie wody, PWN Warszawa (1996)
Langlais B, Reckhow D.A., Brink D.R., Ozone in water treatment. Application and
Engineering, AWWA Research Foundation & Lewis Publisher (1991)
Luck F., A review ofindustrial catałytic wet air Oxidation processes,
Catalysis Today 27, 195
-202 (1996)
Prousek J. (1996), Advanced Oxidation process for water treatment. Chemical process,
Chem. Listy 90, 229-237
Prousek J. (1996), Advanced Oxidation process for water treatment. Photochemical process,
Chem. Listy 90, 307-315
Roche P., Volk C., Carbonnier F., Paillard H.,
Ozone Science & Engineering 16, 135-55
(1994)
Trapido M., Yaressinina Y., Munter R., Ozonation of phenols in wastewater from oil shale
chemical treatment,
Environmental Technology 16 (30), 233-241 (1995)
Zarzycki R., Imbierowicz M., Rogacki G., Filipiak T., Nowoczesne metody
unieszkodliwiania odpadów. Mat. seminarium naukowego "Ochrona środowiska w
przemyśle - techniki i technologie". Łódź, (1996)

15
6. OZONOWANIE WODNEGO ROZTWORU FENOLU
6.1. Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie wydajności generatora ozonu w funkcji napięcia
prądu elektrycznego oraz natężenia przepływu gazu przez reaktor, a następnie zbadanie
kinetyki utleniania roztworu wodnego fenolu w zadanych warunkach procesu.
6.2. Aparatura i sprzęt
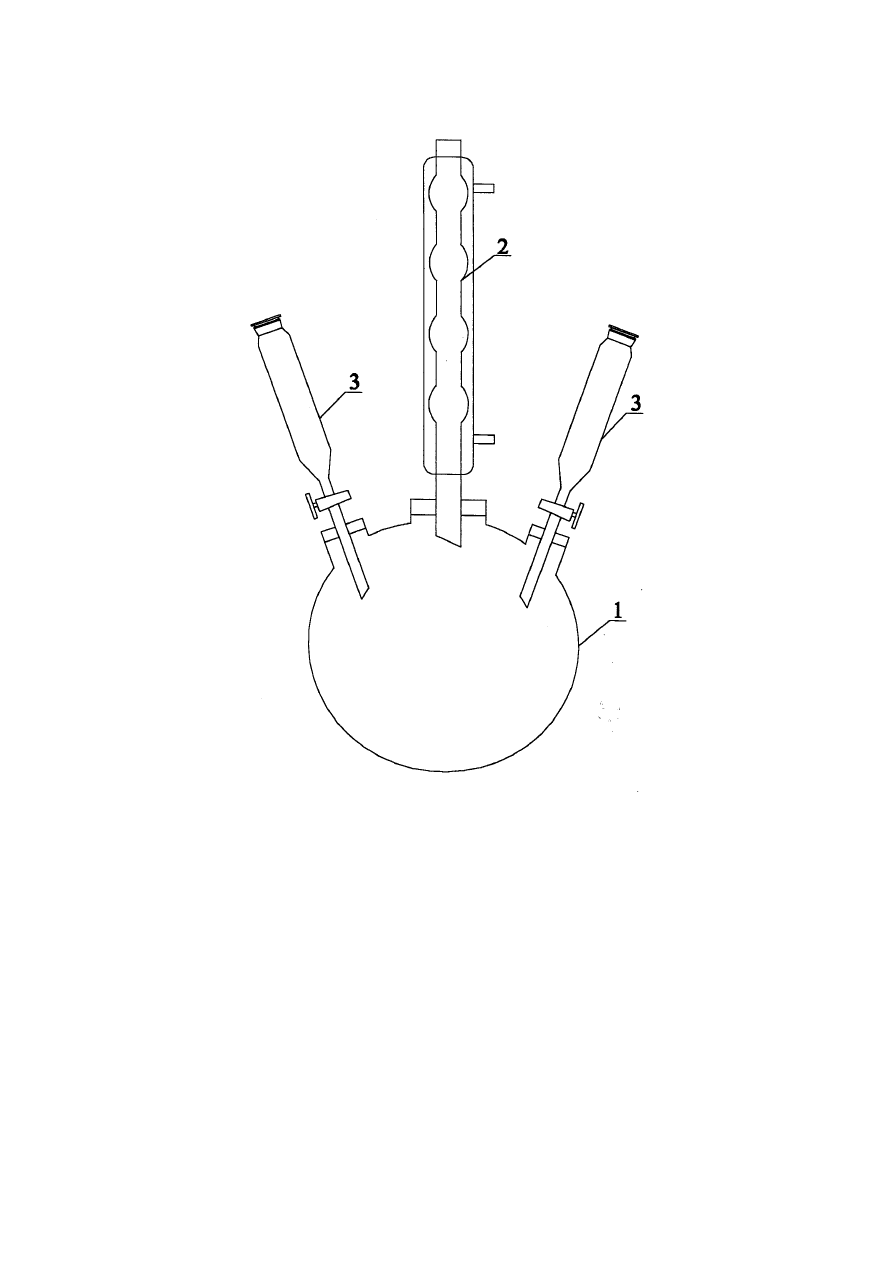
1. Zestaw aparatury do ozonowania według rys. 2
2. Kolorymetr spektralny "Spekol" z przystawką do pomiaru absorpcji
3. pH-metr z rejestratorem
4. Waga analityczna
5. Waga techniczna
6. Szkło i odczynniki
6.3. Budowa i działanie aparatury do ozonowania
Do pomiaru wydajności generatora ozonu oraz badania kinetyki utleniania fenolu
stosuje się zestaw aparatury przedstawiony schematycznie na rys.2. Ozon jest wytwarzany w
generatorze /4/ opartym na cichych wyładowaniach elektrycznych. Wydajność generatora
reguluje się przez zmianę natężenia przepływu gazu. Źródłem powietrza lub tlenu
dostarczanego do ozonatora jest butla /1/. Natężenie przepływu gazu reguluje się za pomocą
reduktora umieszczonego na butli. Chwilowe natężenie przepływu gazu odczytuje się z
rotametru /
2/ zaś całkowita ilość przepuszczonego gazu z licznika /10/. Nawilgocenia gazu
pozbywa się przepuszczając go przez płuczkę z żelem krzemionkowym. Ozonator podłączony
jest do autotransformatora, a napięcie i natężenie prądu pierwotnego mierzy się za pomocą
woltomierza /6/ i amperomierza /
5/. Napięcie wtórne dane jest zależnością (przekładnia
transformatora): U
w
= 36 U
p
. Utlenianie roztworu fenolu prowadzi się w reaktorze /7/
.
Opory przepływu gazu przez aparaturę i reaktor pokonywane są dzięki
podwyższonemu ciśnieniu gazu podawanego z butli, należy jednak uważać aby nie
przekraczały one 0.5x10
5
Pa.
6.4 Sposób przeprowadzenia pomiarów
Badanie wydajności generatora ozonu
Podczas badania wydajności generatora ozonu należy zadbać o czystość doprowadzanego
gazu oraz stałość parametrów procesu (natężenie przepływu gazu, zawartość tlenu w gazie,
napięcie i częstotliwość prądu). Zakłada się, że podczas jednego cyklu pomiarów nie zachodzi
wyraźne zużycie się generatora objawiające się stopniowym spadkiem wydajności wytwarzania
ozonu.
Sposób postępowania przy badaniu wydajności generatora ozonu jest następujący:
a) napełnić płuczki /9/ do 1/3 wysokości roztworem KJ i zamontować w aparaturze,
b) zawór odprowadzający ozon do wyciągu ustawić w pozycji otwartej, zawory
odprowadzające ozon do płuczek i do kolumny barbotażowej w pozycji zamkniętej,
c) ustawić żądany strumień objętości powietrza (tlenu) w przedziale od 60 do 200 dm
3
/h
,
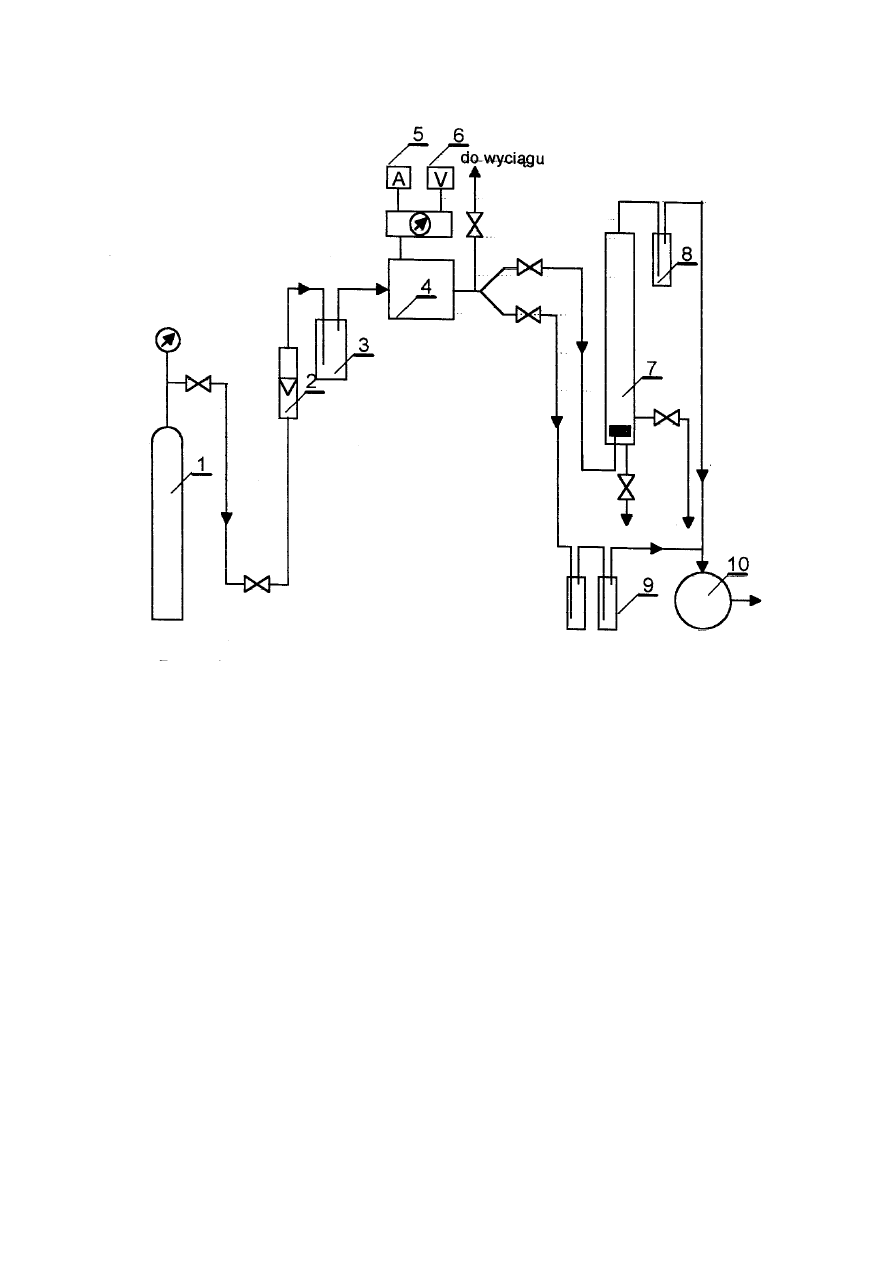
16
Rys. 2.
Schemat zestawu do ozonowania
1 – butla ze sprężonym powietrzem
2 – rotametr
3 – osuszacz gazu
4 – generator ozonu
5 – amperomierz
6 – woltomierz
7 – reaktor
8 – płuczka do pochłaniania nieprzereagowanego O
3
9 – płuczki z roztworem KI
10 – licznik gazowy
17
d) nastawić za pomocą autotransformatora napięcie pierwotne, wskazywane przez
woltomierz/6/; od siedmiu do 10 wartości w przedziale 50-240 V, np.: 60, 90, 110, 150,
180, 210, 230 V,
e) przepuszczać gaz przez generator przez 5 min.,
f) otworzyć zawór doprowadzający ozon do płuczek /
9/ i jednocześnie zamknąć zawór
prowadzący do wyciągu,
g) zanotować stan licznika /6/ i włączyć zegar. Ozonowanie prowadzić przez 5 lub 10 min.
dla kilku wartości strumienia objętości gazu, np.: 60, 90, 120, 150, 180 dm
3
/h,
UWAGA: w czasie pomiarów należy obserwować rotametr /4/ i woltomierz /8/ czy zachowane
są zadane wartości natężenie przepływu gazu i napięcia prądu elektrycznego. Natężenie prądu
w obwodzie pierwotnym nie powinno przekraczać 2 A.
h) po zakończeniu ozonowania zanotować stan licznika /l0/, otworzyć zawór do wyciągu,
zamknąć zawór doprowadzający ozon do płuczek /
9/. W przypadku kontynuowania
pomiaru i skierowania gazu z ozonem do reaktora /7/ otworzyć zawór doprowadzający
ozon do reaktora i zamknąć zawór prowadzący do wyciągu,
i) odłączyć płuczki /
9/ od aparatury i oznaczyć w nich jod. Wyniki pomiarów przedstawić
w tabeli według wzoru:
Tab. l.
Wyniki badania wydajności generatora ozonu
Objętość
przepuszczonego gazu
[dm
3
]
Napięcie
wtórne
[V]
Czas
pomiaru
[min.]
wg licznika
wg
rotametru
Objętość
Na
2
S
2
O
3
............M
[cm
3
]
Zawartość
ozonu w
gazie
[mg/dm
3
]
[% objęt.]
Wydajność
generatora
ozonu
[g/h]
Założony strumień objętości gazu .................... dm
3
/h
Utlenienie roztworu fenolu
Pomiar kinetyki utleniania fenolu w reaktorze poprzedza pomiar wydajności ozonatora
przy zadanych wartościach natężenie przepływu gazu i napięcia prądu zgodnie z procedurą
podaną w poprzednim punkcie.
Sposób przeprowadzania pomiarów jest następujący:
a) napełnić płuczkę /8/ roztworem KJ do 1/3 wysokości,
b) napełnić reaktor
III modelowym roztworem fenolu o stężeniu ok. 50 mg/dm
3
do
objętości 2 dm
3
. Roztwór należy uprzednio przygotować z wody destylowanej i
odpowiedniej ilości fenolu dodając kwas borowy do stężenia 0.05 m (3.1 g kwasu na
dm
3
wody) i doprowadzając odczyn do pH = 9 za pomocą NaOH. Uzyskany układ
buforowy zapewnia utrzymanie środowiska reakcji na poziomie pH =9,
c) badania
można prowadzić również z modelowym roztworem fenolu bez dodatku kwasu
borowego, przy czym wyjściowe pH powinno znajdować się w przedziale 10-12,
d) wykonać pomiar wydajności generatora ozonu,
e) otworzyć zawór doprowadzający ozon do reaktora /7/ i jednocześnie zamknąć zawór
odprowadzający do wyciągu. Uregulować natężenie przepływu gazu z uwagi na zmianę
oporów przepływu. Zakłada się, że aparatura jest w ruchu po wcześniejszym pomiarze
wydajności ozonatora,
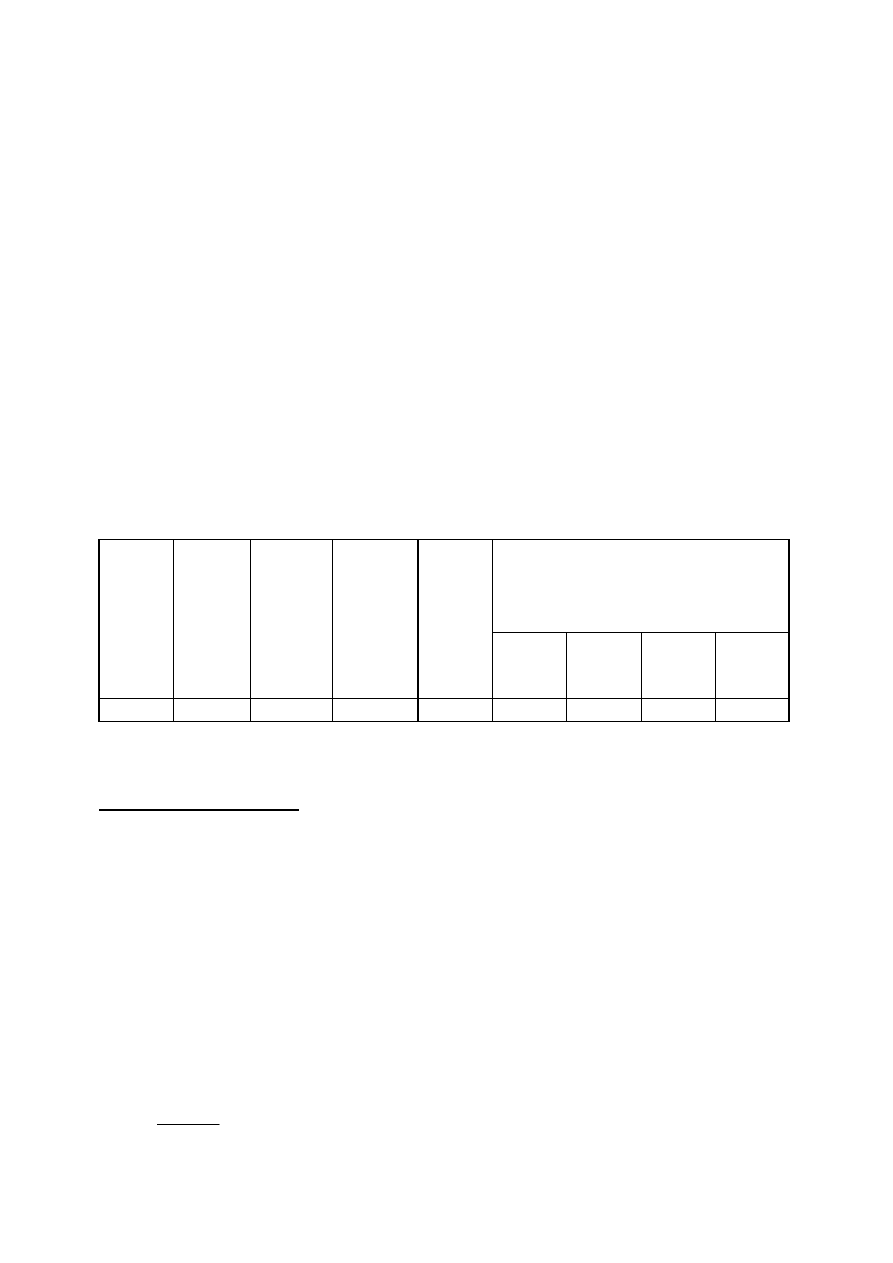
18
f) ozonowanie
prowadzić przez 30 min. pobierając próbki roztworu do kolbek miarowych
o objętości 25 cm
3
co 6 min., z czego 10 cm
3
przeznaczyć do oznaczania fenolu, 10 cm
3
do wyznaczenia pH, a pozostałe 5 cm
3
pozostawić do ewentualnego powtórzenia
któregoś z dwu oznaczeń. Co 5 minut - należy zmienić płuczkę /8/ z roztworem KJ,
g) w celu zakończenia procesu ozonowania należy:
- otworzyć zawór do wyciągu i jednocześnie zamknąć zawór doprowadzający
ozon do reaktora,
- wyłączyć zasilanie generatora ozonu w wysokie napięcie,
- po 2 minutach przerwać przepływ powietrza (tlenu),
- odłączyć ostatnią płuczkę z roztworem KJ /8/ od aparatury i oznaczyć jod
- opróżnić reaktor i przemyć go wodą destylowaną.
Wyniki pomiarów zebrać zestawić w tabeli według wzoru:
Tabela
2. Wyniki pomiarów i obserwacji procesu utleniania fenolu ozonem
natężenie przepływu gazu .......................... dm
3
/h
napięcie ...................................................... V
temperatura ................................................ °C
zawartość O
3
w gazie ................................. mg/dm
3
opory przepływu w gazie ........................... mmHg
Ocena wizualna procesu
Czas
[min.]
Odczyn
pH
Absorba
ncja
Stężenie
fenolu
[mg/dm
3
]
Wykorzy
stanie
ozonu
[%]
barwa
roztworu
wielkość
pęcherzyków
gazu
powstawanie
piany
zmętnienie
roztworu
6.5. Analityczna kontrola procesu
Oznaczanie ozonu w gazie
Stężenie ozonu w gazie oznacza się metodą jodometryczną. Podstawą oznaczania są reakcje:
2 KJ + O
3
+ H
2
O = J
2
+ 2 KOH + O
2
J
2
+ 2 Na
2
S
2
O
3
= 2 NaJ + Na
2
S
4
O
6
Odczynniki:
1. 0,5 N roztwór tiosiarczanu sodowego,
2. kwas siarkowy rozcieńczony 1:4,
3. 1% roztwór skrobi
Wykonanie oznaczenia:
Po przepuszczeniu określonej ilości mieszaniny gazowej, zawartość płuczek zakwasić
rozcieńczonym kwasem siarkowym i odmiareczkować wolny jod roztworem tiosiarczanu
sodowego wobec skrobi jako wskaźnika. Stężenie ozonu w mieszaninie z powietrzem lub
tlenem wyliczyć ze wzoru:
V
f
a
O
⋅
⋅
=
24
]
[
3
[mg O
3
/dm
3
]

19
gdzie:
a - ilość l N Na
2
S
2
O
3
, cm
3
f - współczynnik przeliczenia miana Na
2
S
2
O
3
V - ilość przepuszczonego powietrza, dm
3
Oznaczanie fenolu w ściekach
Oznaczanie fenolu polega na sprzęganiu fenolu z dwuazowaną p-nitroaniliną w roztworze
alkalicznym. Powstający barwny związek oznacza się kolometrycznie (długość fali 480 nm).
Odczynniki:
1. roztwór p-nitroaniliny – 0,69 g p-nitoaniliny rozpuścić w 6,5 cm
3
stężonego (36%) kwasu
solnego na gorąco i rozcieńczyć do objętości l dm
3
wodą destylowaną,
2. roztwór 1 N Na
2
CO
3
- rozpuścić 53,1 g krystalicznej sody w wodzie destylowanej i dopełnić
do kreski w kolbie miarowej o pojemności l dm
3
,
3. 2% roztwór azotynu sodowego.
Wykonanie oznaczenia:
Roztwory do wykonania krzywej wzorcowej w granicach stężeń l - 10 mg fenolu na
l dm
3
roztworu sporządza się następująco: do kolby miarowej o objętości 100 cm
3
wlewa się
określoną ilość wzorcowego roztworu fenolu i dodaje kolejno 15 cm
3
PNA i 4 cm
3
roztworu
azotynu sodowego. Po dokładnym wytrząsaniu i ochłodzeniu dodaje się 30 cm
3
roztworu
węglanu sodowego, uzupełnia się do kreski wodą destylowaną, po czym mierzy na Specolu 11
absorbancję. Dla wyeliminowania wpływu substancji mineralnych i organicznych zawartych w
wodzie wodociągowej roztwory z fenolu należy przygotować w wodzie destylowanej. Stężenie
fenolu w próbkach poreakcyjnych oznacza się jak wyżej pobierając 10 cm
3
roztworu.

20
7. UTLENIANIE WODNEGO ROZTWORU FENOLU METODĄ
FENTONA
7.1. Cel ćwiczenia
Celem ćwiczenia jest zbadanie kinetyki utleniania roztworu wodnego fenolu w zadanych
warunkach procesu Fentona.
7.2. Aparatura i sprzęt
1. Zestaw aparatury do utleniania (rys. 3)
2. Kolorymetr spektralny "Spekol" z przystawką do pomiaru absorpcji
3. pH-metr z rejestratorem
4. Waga analityczna
5. Zestaw aparatury do oznaczania ChZT
6. Szkło i odczynniki
7.3. Budowa i działanie aparatury do utleniania metodą Fentona
Do badania kinetyki utleniania metodą Fentona stosuje się zestaw aparaturowy
przedstawiony schematycznie na rys. 3. Modelowy roztwór ścieków umieszcza się w
trójszyjnej kolbie reakcyjnej /1/, połączonej z chłodnicą zwrotną /2/. Roztwory katalizatora oraz
nadtlenku wodoru umieszczone są w wkraplaczach /3/ i /4/. Zawartość kolby reakcyjnej jest
mieszana mieszadłem magnetycznym.
7.4. Sposób przeprowadzenia pomiarów
Utlenienie roztworu fenolu
Pomiar kinetyki utleniania fenolu metodą Fentona przeprowadza się zgodnie z procedurą:
a) napełnić kolbę reakcyjną /l/ modelowym roztworem fenolu o stężeniu ok. 50 mg/dm
3
do
objętości 1,5 dm
3
. Odczyn roztworu należy uprzednio doprowadzić do pH = 3-4 za
pomocą roztworu kwasu siarkowego. Kwaśny odczyn roztworu zapobiega wytrącaniu
się wodorotlenku żelaza po dodaniu katalizatora,
b) włączyć mieszadło magnetyczne i ustawić żądaną prędkość obrotów,
c) napełnić wkraplacz /2/ roztworem siarczanu żelazawego do objętości 10 cm
3
. Roztwór
katalizatora sporządza się następująco: 4,6 g FeSO
4
·7H
2
O rozpuścić w wodzie
destylowanej, skorygować pH za pomocą kwasu siarkowego do wartości 3-4 i
rozcieńczyć do objętości 100 cm
3
wodą destylowaną,
d) napełnić wkraplacz /3/ 30% roztworem nadtlenku wodoru do objętości 1,5 cm
3
,
e) dodawać równocześnie oba roztwory, intensywnie mieszając,
f) utlenianie
prowadzić przez 30 min., pobierając próbki roztworu do kolbek miarowych o
objętości 25 cm
3
co 10 min., z czego 10 cm
3
przeznaczyć do oznaczania fenolu, 10 cm
3
do wyznaczania ChZT, a pozostałe 5 cm
3
do ewentualnego powtórzenia któregoś z dwu
oznaczeń – uwaga: próbki po pobraniu zalkalizować (za pomocą roztworu NaOH) w
celu zatrzymania reakcji.
21
Rys. 2.
Schemat aparatury do utleniania metodą Fentona
1 - kolba reakcyjna
2 – chłodnica zwrotna
3 – wkraplacze
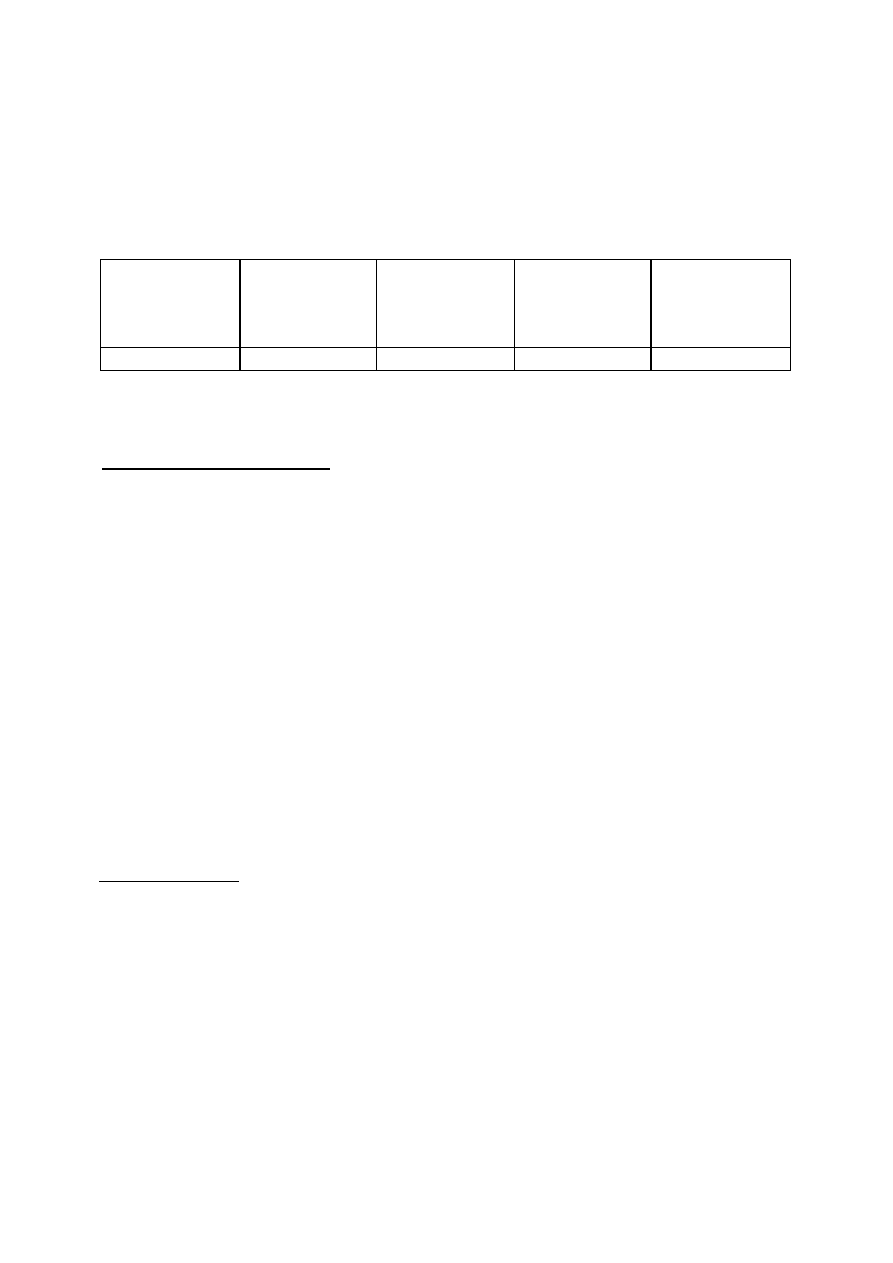
22
Wyniki pomiarów zebrać w tabeli według wzoru:
Tabela 3.
Wyniki pomiarów i obserwacji utleniania fenolu
ilość Fe(NH
4
)
2
(SO
4
)
2
zuzytego do zmiareczkowania próby kontrolnej ............................cm
3
normalność roztworu siarczanu żelazowo-amonowego .................................................... N
objętość próbki ścieków użytej do oznaczania .................................................................. cm
3
Czas utleniania
[min.]
Absorbancja
Stężenie fenolu
[mg/dm
3
]
Ilość siarczanu
żelazawo-
amonowego
[cm
3
]
ChZT
[mg O
2
/dm
3
]
7.5. Analityczna kontrola procesu
Oznaczanie fenolu w ściekach
Oznaczanie fenolu polega na sprzęganiu fenolu z dwuazowaną p-nitroaniliną w
roztworze alkalicznym. Powstający barwny związek oznacza się kolometrycznie (długość fali
480 nm).
Odczynniki:
1. roztwór p-nitroaniliny – 0,69 g p-nitoaniliny rozpuścić w 6,5 cm
3
stężonego (36%) kwasu
solnego na gorąco i rozcieńczyć do objętości l dm
3
wodą destylowaną,
2. roztwór 1N Na
2
CO
3
- rozpuścić 53,1 g krystalicznej sody w wodzie destylowanej i dopełnić
do kreski w kolbie miarowej o pojemności l dm
3
,
3. 2% roztwór azotynu sodowego.
Wykonanie oznaczenia:
Roztwory do wykonania krzywej wzorcowej w granicach stężeń l - 10 mg fenolu na
l dm
3
roztworu sporządza się następująco: do kolby miarowej o objętości 100 cm
3
wlewa się
określoną ilość wzorcowego roztworu fenolu i dodaje kolejno 15 cm
3
PNA i 4 cm
3
roztworu
azotynu sodowego. Po dokładnym wytrząsaniu i ochłodzeniu dodaje się 30 cm
3
roztworu
węglanu sodowego, uzupełnia się do kreski wodą destylowaną, po czym mierzy na Specolu 11
absorbancję. Dla wyeliminowania wpływu substancji mineralnych i organicznych zawartych w
wodzie wodociągowej roztwory z fenolu należy przygotować w wodzie destylowanej. Stężenie
fenolu w próbkach poreakcyjnych oznacza się jak wyżej pobierając 10 cm
3
roztworu.
Oznaczanie ChZT
Chemiczne zapotrzebowanie tlenu oznacza się metodą dwuchromianową. Podstawą
oznaczania są reakcje:
(CHO) + Cr
2
O
7
2-
+ H
+
= 2 Cr
3+
+ CO
2
+ H
2
O
6 Fe
2+
+ Cr
2
O
7
2-
+ 14 H
+
= 6 Fe
3+
+ 2 Cr
3+
+ 7 H
2
O
Odczynniki:
1. Kwas siarkowy z AgSO
4
. Do l dm
3
H
2
SO
4
cz.d.a. (c.wł. 1.84) dodać 11 g AgSO
4
cz.d.a.,
wymieszać, pozostawić odczynnik na 2 dni w celu rozpuszczenia się AgSO
4
,
2. Roztwór wskaźnika ferroiny. Rozpuścić 1,485 g 1,10-fenantrolinyjednowodnej oraz 0,70 g
FeSO
4
· 7 H
2
O w wodzie i rozcieńczyć do 100 cm
3
,
3. Dwuchromian potasowy 0,25 N. Rozpuścić 12,259 g K
2
Cr
2
O
7
ch.cz., wysuszonego
uprzednio w temp. 103°C przez 2 godziny, w wodzie destylowanej i dopełnić do l dm
3
,
4. Roztwór siarczanu żelazawo-amonowego 0,1 N. Rozpuścić 39 g Fe(NH
4
)
2
(SO
4
)
2
·6H
2
O
cz.d.a. w wodzie destylowanej. Dodać 20 cm
3
H
2
SO
4
cz.d.a. (c.wł. 1.84), ostudzić i rozcieńczyć
do l dm
3
. Miano tego roztworu musi być sprawdzone dwuchromianem potasowym w. dniu
oznaczenia. W celu ustalenia normalności rozcieńczyć 10 cm
3
0,25 N roztworu K
2
Cr
2
O
7
do

23
około 100 cm
3
w kolbie stożkowej. Dodać 30 cm
3
stęż. H
2
SO
4
ostudzić. Miareczkować
roztworem siarczanu żelazawo-amonowego, stosując 2-3 krople wskaźnika ferroiny do zmiany
zabarwienia wskaźnika z niebiesko-zielonego na czerwonawo-niebieski. Obliczyć normalność
odczynnika ze wzoru:
2
4
2
4
3
7
2
2
3
)
(
)
(
25
,
0
SO
NH
Fe
cm
O
Cr
K
cm
n
⋅
=
Wykonanie oznaczenia:
W kolbie okrągłodennej umieścić 10 cm
3
próbki rozcieńczonej do 20 cm
3
wodą
destylowaną, wymieszać. Następnie dodać parę kawałków wyprażonego pumeksu i 10 cm
3
0,25 N roztworu K
2
Cr
2
O
7
. Dodać, mieszając, 30 cm
3
odczynnika H
2
SO
4
z AgSO
4
i połączyć
natychmiast kolbę z chłodnicą zwrotną. Ogrzewać kolbę w ciągu 20 min., utrzymując
zawartość w stanie łagodnego wrzenia. Po zakończeniu utleniania kolbę ostudzić i spłukać
wewnętrzną część chłodnicy wodą destylowaną. Dopełnić zawartość kolby do 150 cm
3
wodą
destylowaną, ostudzić do temperatury pokojowej, dodać 2-3 krople wskaźnika ferroiny
i odmiareczkować nadmiar dwuchromianu mianowanym roztworem siarczanu żelazawo-
amonowego. W toku oznaczania należy stale stosować taką samą ilość roztworu ferroiny. Za
końcowy punkt miareczkowania przyjąć ostrą zmianę zabarwienia z niebieskawozielonego
na czerwonawoniebieskawe.
Wykonać równolegle próbę kontrolną, stosując taki sam zestaw odczynników i 20 cm
3
wody
destylowanej. Wartość ChZT obliczyć ze wzoru:
V
n
b
a
X
8000
)
(
⋅
⋅
−
=
[mg/dm
3
ChZTchr.]
gdzie:
a - ilość siarczanu żelazawo-amonowego zużytego do zmiareczkowania próby kontrolnej, cm
3
b - ilość siarczanu żelazawo-amonowego zużytego do zmiareczkowania próbki ścieków, cm
3
n - normalność roztworu siarczanu żelazawo-amonowego
V - objętość próbki ścieków użytej do oznaczania, cm
3

24
8. FOTOKATALITYCZNA DEGRADACJA FENOLU W WODNEJ
ZAWIESINIE DWUTLENKU TYTANU
8.1. Cel ćwiczenia
Celem ćwiczenia jest zbadanie i porównanie aktywności fotokatalitycznej dwóch
odmian dwutlenku tytanu: anatazu i rutylu.
8.2. Aparatura i sprzęt
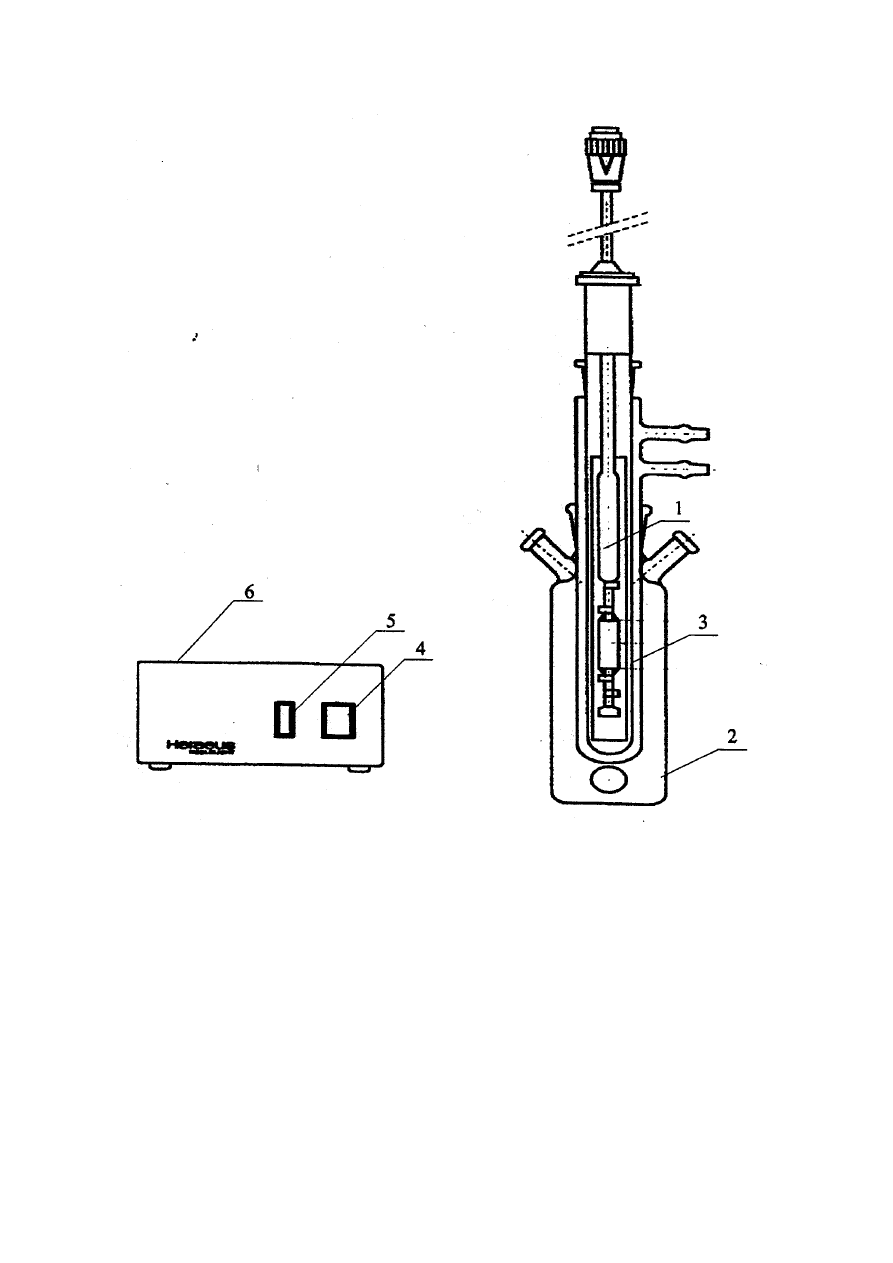
1. Zestaw aparatury do utleniania (rys. 4)
2. Kolorymetr spektralny "Spekol" z przystawką do pomiaru absorpcji
3. pH-metr z rejestratorem
4. Waga analityczna
5. Wirówka
6. Szkło i odczynniki
8.3. Budowa i działanie aparatury do utleniania fotokatalitycznego
Do badania kinetyki utleniania fenolu stosuje się zestaw aparatury przedstawiony na
rys.4. Źródłem promieniowania UV jest średniociśnieniowa lampa rtęciowa /1/ (150 W) firmy
Heraeus umieszczona centralnie w szklanym reaktorze /2/. Lampa umieszczona jest w osłonie
kwarcowej z płaszczem chłodzącym /3/. Lampę UV uruchamiamy włącznikiem /4/ oraz /5/
umieszczonymi na zasilaczu /6/. Badany roztwór mieszany jest podczas utleniania za pomocą
mieszadła magnetycznego. Próbki badanego roztworu pobieramy przez króćce /7/ za pomocą
specjalnie przygotowanego próbnika.
8.4. Sposób prowadzenia pomiarów
Fotokatalityczna degradacja fenolu w układzie UV/TiO;
Sposób przeprowadzenie pomiarów jest następujący:
a) napełnić reaktor modelowym roztworem fenolu o stężeniu 50 mg/dm
3
do objętości
1 dm
3
,
b) do roztworu fenolu dodać katalizator (dwutlenek tytanu w formie anatazu lub rutylu) w
ilości 0.5 g/dm
3
,
c) lampę rtęciową wraz z kwarcową obudową umieścić w reaktorze,
d) włączyć mieszadło magnetyczne i ustawić żądaną prędkość obrotów,
e) otworzyć zawór doprowadzający wodę do płaszcza chłodzącego lampy UV,
f) szczelnie
osłonić powierzchnię reaktora folią aluminiową,
g) włączyć lampę UV ustawiając włącznik /4/ w pozycji "l" i przytrzymując włącznik 151
pozycji "start" przez 30 s,
h) utlenianie prowadzić przez 30 min. pobierając próbki roztworu o objętości 15 cm
3
co
10min, z czego 10 cm
3
przeznaczyć do oznaczania fenolu, a pozostałe 5 cm
3
do
wyznaczenia pH,
i) w celu zakończenia procesu utleniania należy;
• wyłączyć lampę UV ustawiając włącznik /4/ w pozycji "O",
• zamknąć zawór doprowadzający wodę do płaszcza chłodzącego lampy.
25
Rys. 4
Schemat aparatury do utleniania fotokatalitycznego
1 – lampa rtęciowa średniociśnieniowa
2 – reaktor
3 – kwarcowa osłona z płaszczem chłodzącym
4 – włącznik A
5 – włącznik B
6 – zasilacz
Wyszukiwarka
Podobne podstrony:
Podstawy technologii chemicznej nowoczesne procesy utleniania
w8 Procesy utleniania i redukcji
PROCESY UTLENIANIA I REDUKCJI dgfd
Procesy utleniania-utlenianie ksylenów, Uczelnia PWR Technologia Chemiczna, Semestr 5, Technologia C
ćw B Procesy utleniania-utlenianie ksylenów, Uczelnia PWR Technologia Chemiczna, Semestr 5, Technolo
Procesy utleniania i redukcji, LICEUM różne, CHEMIA
PROCESY UTLENIANIA I REDUKCJI 2
Procesy utleniania węglowodorów alkiloaromatycznych w fazie ciekłej
PROCESY UTLENIANIA I REDUKCJI
W14S-Procesy utlenienia-redukcji, chemia, szkolka
PRACA PRZEJŚCIOWA OPTYMALIZACJA PROCESÓW ENERGETYCZNYCH POPRZEZ ZASOTOWANIE NOWOCZESNYCH ALGORYTMÓW
więcej podobnych podstron