LIPIDY OSOCZA
1. Triacyloglicerole
2. Cholesterol wolny i zestryfikowany
3. Fosfolipidy
4. Wolne kwasy tłuszczowe
Transport lipidów w środowisku wodnym (we krwi) jest możliwy po ich połączeniu się z
białkami (apoproteinami) w związki wielkocząsteczkowe zwane lipoproteinami.
LIPOPROTEINY
sferyczne cząstki
- niestechiometryczne kompleksy białkowo-lipidowe
- rdzeń - triacyloglicerole i estry cholestrolu
- powierzchnia – cząsteczki amfipatycznych lipidów (fosfolipidy i cholesterol wolny)
i białek
oddziaływania pomiędzy cząsteczkami
– niekowalencyjne
- wiązania wodorowe
- siły van der Waalsa
następuje wymiana lipidów i apoprotein pomiędzy lipoproteinami osocza oraz
pomiędzy lipoproteinami i błonami komórkowymi
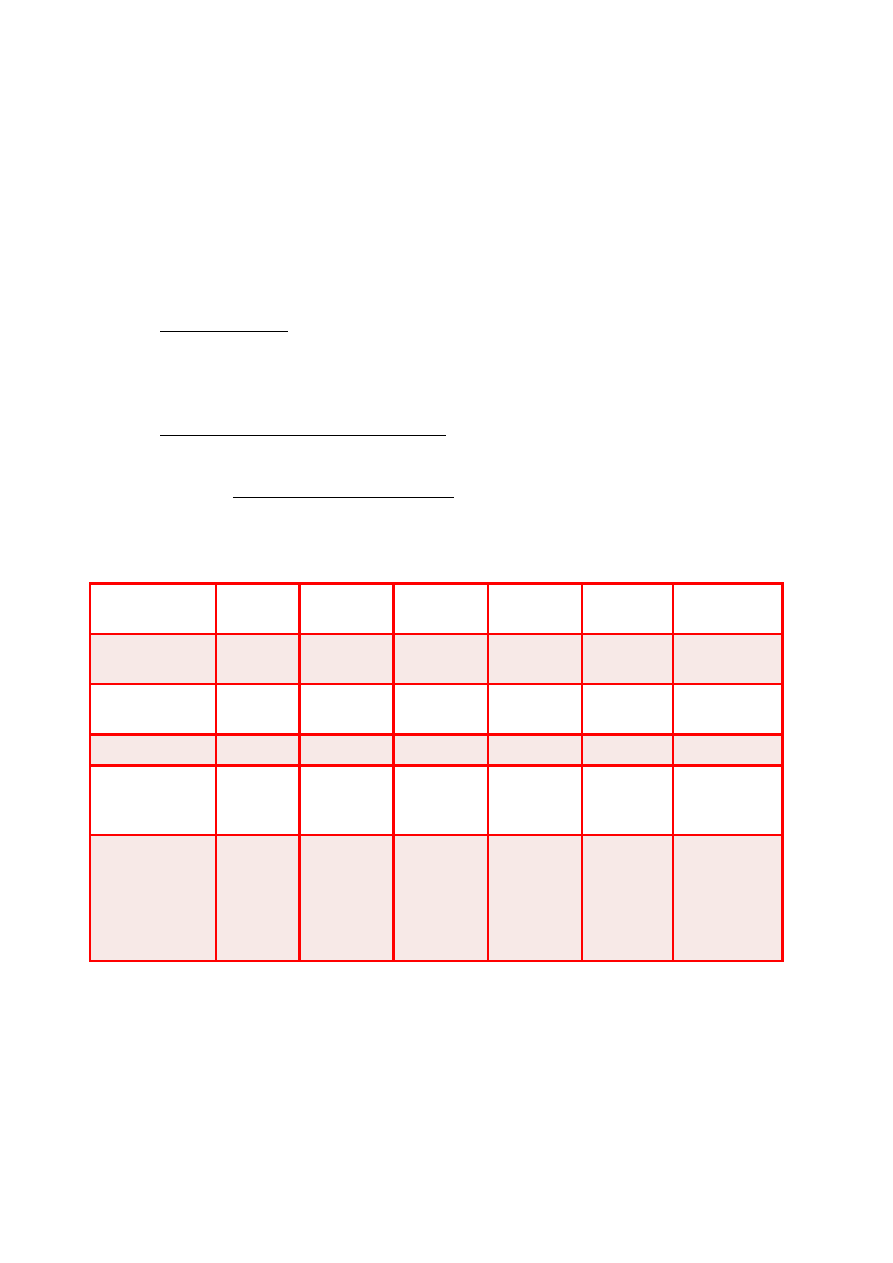
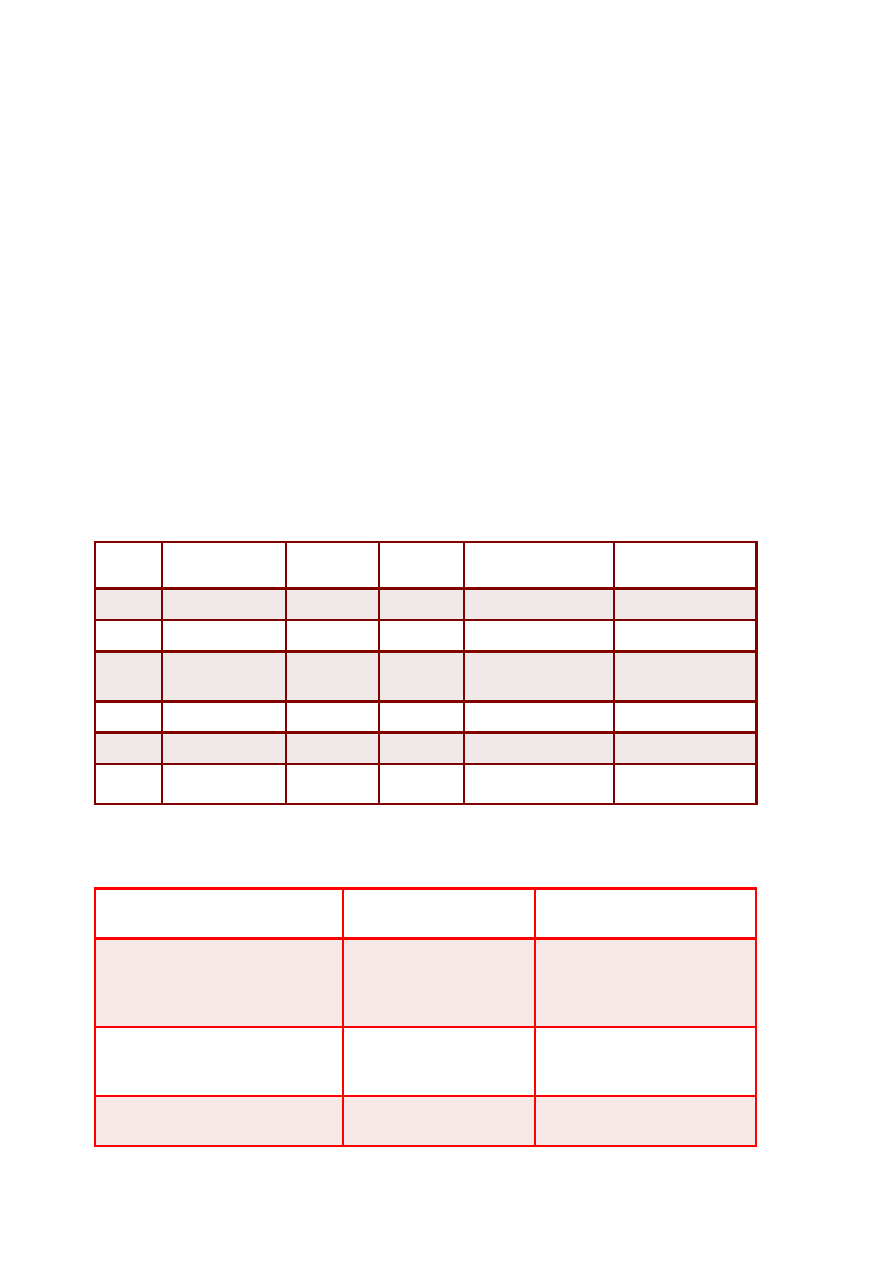
PODZIAŁ LIPOPROTEIN
Klasa/
Parametr
ChM
VLDL
IDL
LDL
HDL
Lp(a)
Gęstość
[g/mL]
<0,95
0,95-
1,006
1,006-1,019
1,019-
1,063
1,063-1,210
1,040-
1,130
Ruchliwość w
EF
start
prebeta
1
prebeta
2
beta
alfa
prebeta
Ś
rednica [nm]
>70
26-70
22-24
19-23
4-10
26-30
G ówne lipi
ł
dy egzogenne
TAG
endogenne
TAG
endogenne
TAG, estry
cholesterolu
estry
cholesterolu
fosfolipidy
estry
cholesterolu,
fosfolipidy
G ówne bia ka
ł
ł
A-I
B-48
C-I
C-II
C-III
E
B-100
C-I
C-II
C-III
E
B-100
E
B-100
A-I
A-II
E
(a)
B-100
Podział uwzględniający różnice gęstości poszczególnych frakcji lipoproteinowych –
uzyskany metodą ultrawirowania
chylomikrony: 0,98 g/mL
lipoproteiny o bardzo małej gęstości (VLDL): <1,006 g/mL
lipoproteiny o pośredniej gęstości (IDL): 1,006- 1,019 g/mL
lipoproteiny o małej gęstości (LDL): 1,019-1,063 g/mL
lipoproteiny o dużej gęstości (HDL): 1,063-1,21 g/mL
Lp(a) – 1,040-1,130 g/mL
1

Podział uzyskany podczas elektroforezy (agaroza; pH 8,6):
α
-lipoproteiny (HDL)
pre-
β
-lipoproteiny (VLDL, IDL, Lp(a))
β
-lipoproteiny (LDL)
chylomikrony (ChM)
CHEMICZNY SKŁAD (%)PRAWIDŁOWYCH LIPOPROTEIN
Frakcja/
Skład (%)
ChM
VLDL
IDL
LDL
HDL
Triacyloglicerole
80-90
50-70
20-25
5-10
3-5
Cholesterol wolny
1-3
7-10
7-10
5-8
3-5
Estry cholesterolu
2-5
4-13
10-12
40-45
15-20
Fosfolipidy
3-7
15-20
15-20
20-22
20-30
Białka (apoproteiny)
1-2
8-12
18-20
20-25
45-55
APO(LIPO)PROTEINY
Apoproteina
Masa
cząsteczkowa
[Da]
Miejsce
syntezy
Stężenie w osoczu [g/L]
AI
28 300
Jelito, wątroba
1,0-1,2
AII
17 000
Wątroba, jelito
0,3-0,5
AIV
46 000
Wątroba, jelito, płuca,
śledziona
0,16
B-48
265 000
Jelito
B-100
550 000
Wątroba
0,7-1,0
CI
6500
Wątroba, jelito
0,04-0,06
CII
8800
Wątroba, jelito
0,03-0,05
CIII
8900
Wątroba, jelito
0,12-0,14
D
20 000
Mózg, wątroba, nerki, komórki
endothelium
E-2, E-3, E-4
39 000
Wątroba, mózg, płuca,
śledziona, mięśnie
0,025-0,100
Apoproteina
Funkcja
AI
Aktywator LCAT, ligand receptora HDL, rola strukturalna w HDL-ach
AII
Rola strukturalna, kofaktor HTGL, inhibitor LPL
2

AIV
Transport zwrotny cholesterolu, aktywator LCAT i LPL
B-48
Rola strukturalna
B-100
Ligand receptora apo B/E, rola strukturalna
CI
Kofaktor LCAT
CII
Aktywator LPL
CIII
Inhibitor apo-CII
D
Transport lipidów
E-2, E-3, E-4
Ligand receptora apo B/E i receptora LRP, transport cholesterolu
ENZYMY METABOLIZMU LIPOPROTEIN
Lipaza lipoproteinowa (LPL)
glikoproteina (55 000)
hydrolaza acyloglicerolu
występuje w: tkance tłuszczowej, mięśniach szkieletowych, mięśniu sercowym,
płucach, wątrobie, śledzionie
związana z powierzchnią komórek – głównie śródbłonka naczyniowego (za
pośrednictwem siarczanu heparanu)
aktywność w tkankach zależy od czasu jaki upłynął od posiłku oraz od wydzielania
hormonów (gł. insuliny)
- duża aktywność w tkance tłuszczowej po posiłku
- duża aktywność w mięśniach w okresie poresorpcyjnym
wstrzyknięcie heparyny powoduje:
- uwolnienie LPL do krwi
- zmianę wykorzystania kwasów tłuszczowych przez narządy
aktywatory: apo CII (na czczo na HDL-ach) i fosfolipidy (wiążą apo CII z
lipoproteiną)
Wątrobowa lipaza lipoproteinowa (HTGL/HL)
glikoproteina
syntetyzowana w wątrobie
wiąże się z powierzchnią śródbłonka w zatokach wątroby
hydrolizuje triacyloglicerole w:
- IDL-ach
- remnantach chylomikronów
- HDL (przekształca HDL
2
w HDL
3
)
Acylotransferaza acylo-CoA:cholesterol (ACAT)
enzym mikrosomalny
katalizuje reakcję estryfikacji cholesterolu w obecności CoA i ATP
inhibitory:
- kwasy żółciowe
- czynniki blokujące grupy sulfhydrylowe
3

wykazuje swoistość w stosunku do różnych kwasów tłuszczowych – szybkość
estryfikacji maleje w zależności od rodzaju kwasu w kolejności:
oleinian>palmitynian>stearynian>linoleinian
aktywność ACAT zależy od zawartości cholesterolu w komórce
Hydrolaza estrów cholesterolu (esteraza cholesterolowa)
w wątrobie, ścianie naczyniowej, nabłonku jelitowym, korze nadnerczy i jajnikach
(synteza hormonów steroidowych)
katalizuje odwracalną reakcję estryfikacji cholesterolu i hydrolizy estrów cholesterolu:
estry cholesterolu + H
2
O cholesterol wolny + kwas tłuszczowy
Acylotransferaza lecytyna:cholesterol (LCAT)
sekrecyjny enzym osocza
synteza w wątrobie
związana z frakcją HDL
katalizuje reakcję:
lecytyna + cholesterol ester cholesterolu + lizolecytyna
powstają głównie estry cholesterolu i nienasyconych kwasów tłuszczowych (kwasu
linolowego, oleinowego, arachidonowego)
aktywator: AI (CI)
BIAŁKO PRZENOSZĄCE ESTRY CHOLESTEROLU (CETP)
glikoproteina
posiada domeny wiążące triacyloglicerole, estry cholesterolu, fosfolipidy
synteza – wątroba, nadnercza, trzustka, mięśnie, tkanka tłuszczowa, jelito cienkie,
serce i nerki
odpowiada za transfer:
- estrów cholesterolu pomiędzy lipoproteinami osocza i ich wymianę na triacyloglicerole
(100%)
- fosfolipidów (w ok. 30%)
BIAŁKO PRZENOSZĄCE FOSFOLIPIDY (PTP)
odpowiedzialne za 70 % transferu fosfolipidów pomiędzy lipoproteinami osocza:
- z lipoprotein bogatych w TAG na HDL-e
- z HDL
3
na VLDL-e i LDL-e
- z CETP z HDL na inne lipoproteiny
RECEPTORY UCZESTNICZĄCE W PRZEMIANACH LIPOPROTEIN OSOCZA
receptor dla remnantów (LRP)
- w wątrobie
- rozpoznaje apo E
receptor dla LDL (receptor apo B100/E)
- w wielu komórkach organizmu
4
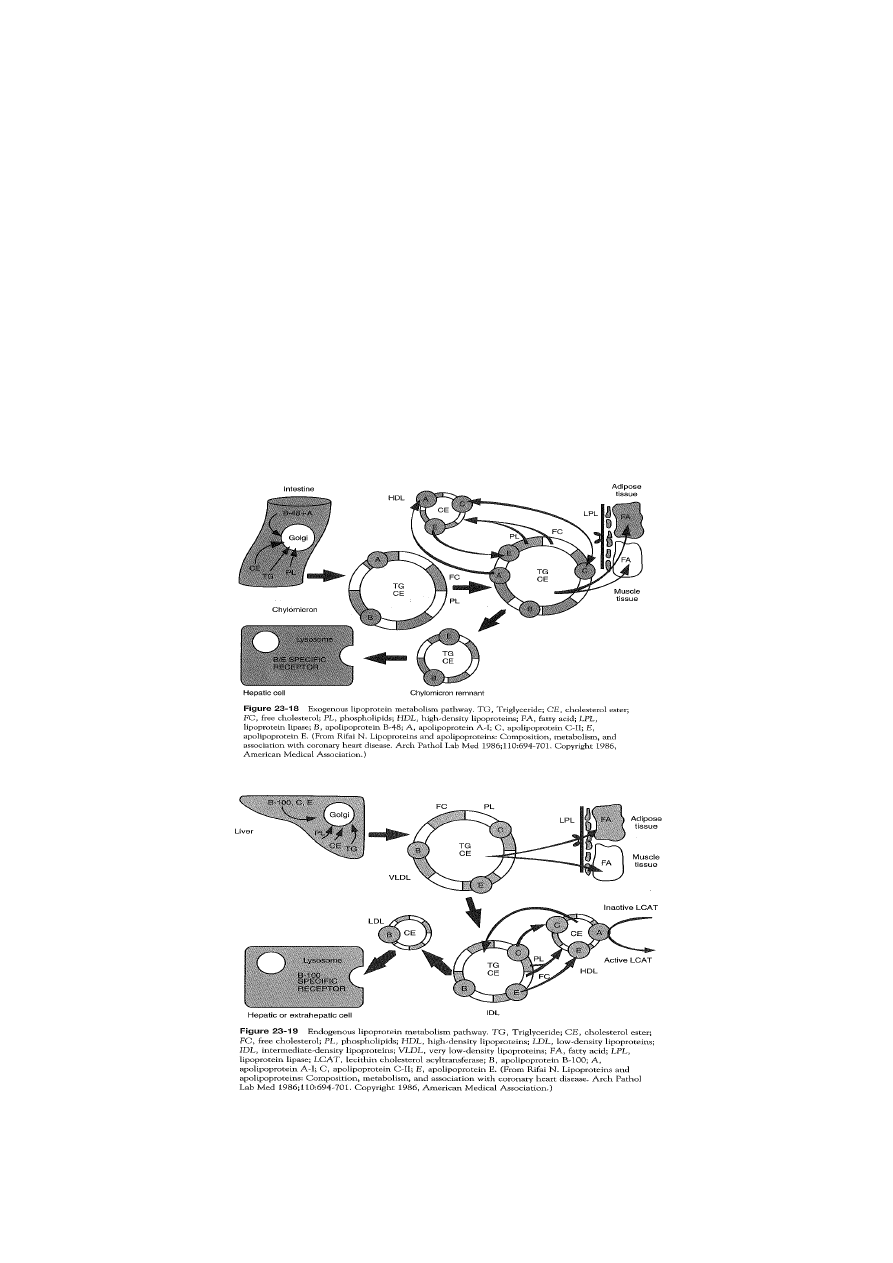
- rozpoznaje apo B100 i apo E
- jego synteza jest ściśle uzależniona od zapotrzebowania komórki na cholesterol i
zawartości w niej estrów cholesterolu
receptor SR-B1 (receptor zmiatający B1)
- w wątrobie i tkankach steroidogennych wiąże HDL za pośrednictwem apo AI i estry
cholesterolu są dostarczane do komórek
- w pozostałych tkankach pośredniczy w przenoszeniu cholesterolu z komórek do
HDL
3
(zwrotny transport choleterolu)
transportery kasetowe wiążące ATP: ABCA1 i ABCG1
- rodzina białek transportujących z towarzyszącą hydrolizą ATP w celu związania
substratu (co umożliwia jego transport przez błonę)
- ABCG1 – pośredniczy w transporcie cholesterolu z komórek do HDL-i (np. z
makrofagów)
- ABCA1 – preferencyjnie ułatwia wypływ cholesterolu i fosfolipidów do cząstek
pre
β
-HDL lub apo AI przekształcanych następnie w dyskoidalne HDL i HDL
3
5
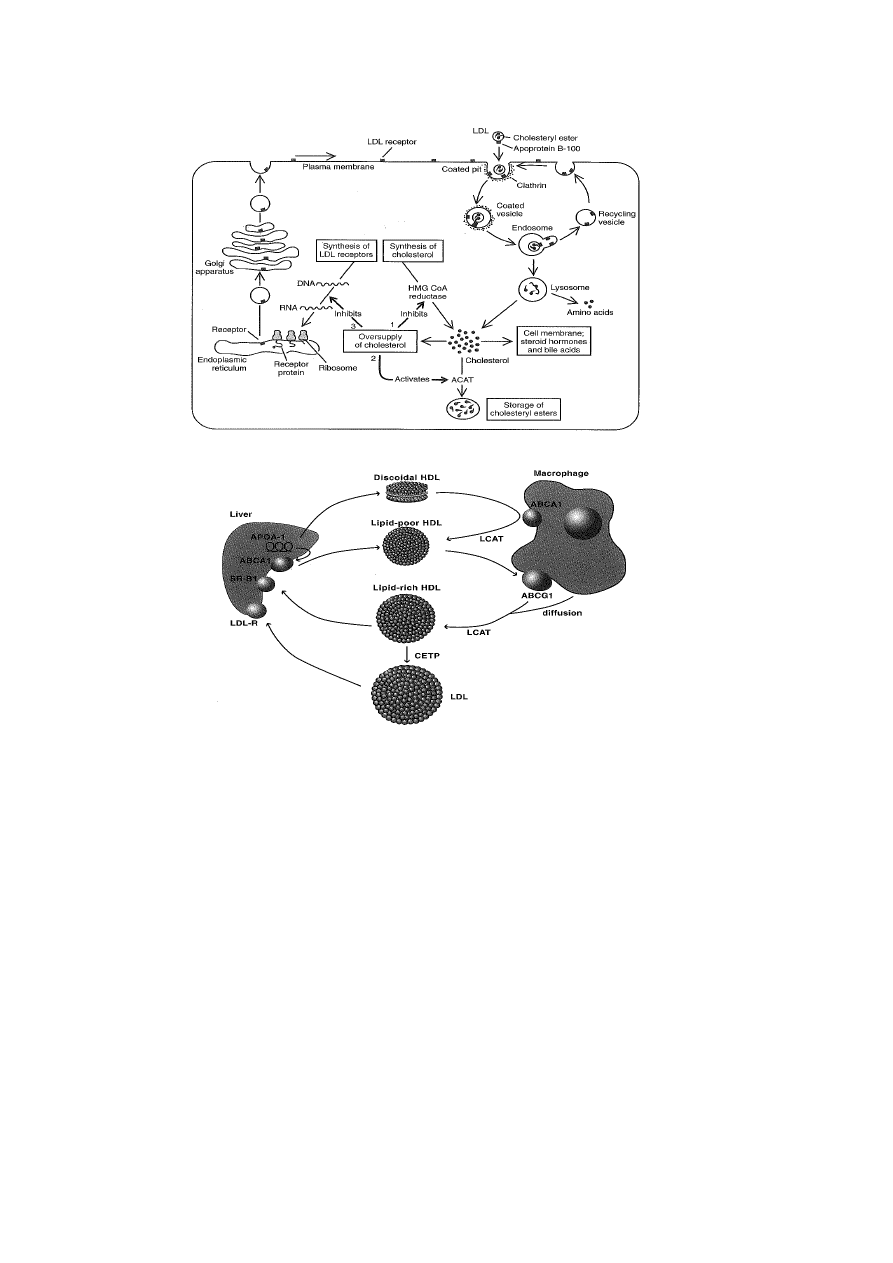
LIPOPROTEINA (a)
glikoproteina, białko ostrej fazy, zmodyfikowana cząstka LDL
apo (a) i apo B100 – połączone mostkiem dwusiarczkowym
apo (a) – peptyd sygnałowy, domena proteazowa i struktury obwarzankowe (kringles)
utrzymywane przez 3 wiązania dwusiarczkowe (podobne struktury są w
plazminogenie, protrombinie, tkankowym i urokinazowym aktywatorze
plazminogenu)
zakres stężeń w osoczu 1-100 mg/dL (prawidłowe nie powinno przekraczać 30
mg/dL)
podobieństwo budowy apo (a) do plazminogenu może hamować procesy fibrynolizy
(działanie prozakrzepowe)
pobudza regenerację i naprawę uszkodzonych naczyń
apo (a) występuje w izoformach:
- F (fast) – o ruchliwości elektroforetycznej większej niż apo B100
- B – o ruchliwości elektroforetycznej zbliżonej do apo B100
- S1, S2, S3, S4 (slow) o ruchliwości elektroforetycznej mniejszej niż apo B100
u osób z małym stężeniem Lp(a) przeważają duże izoformy apo (a) S3 i S4
u osób ze zwiększonym stężeniem Lp(a) przeważają izoformy małe F, B, S1, S2
6
Lp(a) nasila chemotaksję monocytów do blaszki miażdżycowej i aktywację płytek
krwi
Lp(a) jest pobierana przez receptory typu „scavenger”
LIPOPROTEINA X (LpX)
u pacjentów z cholestazą wątrobową
budowa – liposomy:
- podwójna warstwa fosfolipidowa (gł. lecytyny) – 66%
- wolny cholesterol – 25%
- białka (1/2 albumina) – 5%
nie wykazuje właściwości aterogennych
LIPOPROTEINA
β
-VLDL
powstaje w osoczu:
- podczas stosowania diety bogatotłuszczowej
- w otyłości brzusznej
- w insulinooporności
- cukrzycy typu 2
- gdy wytwarzana jest izoforma apo E2
gęstość <1,006 g/mL (VLDL)
ruchliwość elektroforetyczna b-lipoprotein (LDL)
zawartość
- 40% TAG + ok. 35% cholesterolu
aterogenna
ZMODYFIKOWANE LDL
utlenione LDL – retencja LDL i zaburzenie równowagi prooksydacyjno-
antyoksydacyjnej
- mm-LDL (wczesna faza modyfikacji)
- ox-LDL (późna faza modyfikacji)
insulinooporność i cukrzyca – podwyższone stężenia glukozy
- gli-LDL
- glioksy-LDL
7
APOPROTEINA E (Apo E)
chylomikrony, VLDL, IDL, HDL
rozpoznawana przez receptory: LRP i B/E
osłania apo AI
nasila aktywność białka CETP
wykazuje polimorfizm (3 allele w jednym locus + modyfikacja potranslacyjna)
6 fenotypów: apo E 2/2, apo E 3/2, apo E 3/3, apo E 4/2, apo E4/3, apo E 4/4
Poszczególne izoformy wykazują różną siłę wiązania z receptorami LRP:
izoforma apo E2
– wykazuje mniejsze powinowactwo do receptora LRP -> zmniejsza się zawartość
cholesterolu w komórkach wątroby -> zwiększa się ilość receptorów B/E
izoforma apo E4
- wykazuje większe powinowactwo do receptora LRP -> zwiększa się zawartość
cholesterolu w komórkach wątroby -> zmniejsz się ilość receptorów B/E
- bierze udział w patomechanizmie choroby Alzheimera (powstają kompleksy apo E4 i
peptydu powstającego z białka prekursorowego amyloidu)
DYSLIPIDEMIE / DYSLIPOPROTEINEMIE
Klasyfikacja hiperlipoproteinemii według Fredricksona
Typ
Wygląd surowicy
CH
TAG
EF
ChT/TAG
I
mleczna
N/↑
↑↑↑
ChM
< 0,2
IIa
klarowna
↑↑↑
N
nadmiar LDL
> 1,5
IIb
klarowna,
opalizująca
↑↑
↑↑
nadmiar
LDL i VLDL
> 1,5
III
mętna
↑↑
↑↑
IDL
ok.1
IV
mętna
N/↑
↑↑↑
nadmiar VLDL
< 0,2
V
mleczna
↑↑
↑↑↑
ChM i nadmiar VLDL
0,15-0,6
KLASYFIKACJA HIPERLIPIDEMII
(wg Europejskiego Towarzystwa Miażdżycowego)
CH
mmol/L (mg/dL)
TAG
mmol/L (mg/dL)
Hipercholesterolemia izolowana:
- łagodna
- umiarkowana
- znaczna
5,2-6,5 (200-250)
6,5-7,8 (250-300)
> 7,8 (> 300)
<1,7 (150)
<1,7 (150)
<1,7 (150)
Hipertriglicerydemia izolowana:
- umiarkowana
- znaczna
<5,2 (200)
<5,2 (200)
2,3-4,6 (200-400)
>4,6 (>400)
Hiperlipidemia mieszana:
- umiarkowana
5,2-6,5 (200-250)
>7,8 (>300)
2,3-4,6 (200-400)
>4,6 (400)
8

- znaczna
HIPERCHOLESTEROLEMIA
Klasyfikacja
genetyczna
Pierwotna przyczyna
Zaburzenia metaboliczne
Typ
Pospolita hiper-
cholesterolemia
liczne czynniki genetyczne/
środowiskowe
nadprodukcja LDL i obniżony
katabolizm
IIa
Rodzinna złożona
hipelipidemia
nieznana
nadprodukcja apo B frakcji
VLDL i LDL
IIa
Rodzinna hiper-
cholesterolemia
liczne mutacje powodujące
upośledzenie funkcji lub brak
receptora komórkowego dla
LDL
upośledzony katabolizm LDL
i nadprodukcja LDL
IIa
HIPERTRIGLICERYDEMIA
Klasyfikacja
genetyczna
Pierwotna przyczyna Zaburzenia metaboliczne
Typ
Pospolita hiper-
triglicerydemia
czynniki genetyczne/
środowiskowe
nadprodukcja VLDL
IV
Rodzinna złożona
hiperlipidemia
nieznana
nadprodukcja apo B frakcji
VLDL i LDL
IV
Rodzinna
hipertriglicerydemi
a
nieznana
nadprodukcja TAG frakcji
VLDL i/lub upośledzony
katabolizm
IV
HIPERLIPIDEMIA MIESZANA
Klasyfikacja
genetyczna
Pierwotna przyczyna
Zaburzenia metaboliczne
Typ
Rodzinna złożona
hiperlipidemia
nieznana
nadprodukcja apo B frakcji
VLDL i LDL
IIb
Rodzinna hiper-
cholesterolemia
liczne mutacje powodujące
upośledzenie funkcji lub brak
receptora komórkowego dla
LDL
upośledzony katabolizm
LDL i nadprodukcja LDL
IIb
Rodzinna hiper-
triglicerydemia
nieznana
nadprodukcja TAG frakcji
VLDL i/lub upośledzony
katabolizm
IV
Zespół hiper-
chylomikronemii
brak/niedobór LPL lub jej
aktywatora apo CII
upośledzony katabolizm
ChM, czasem wtórne
upośledzone usuwanie
VLDL
I lub V
9

INNE RODZAJE KLASYFIKACJI DYSLIPIDEMII
pierwotne i wtórne
jednogenowe,wielogenowe, złożone
PIERWOTNE DYSLIPIDEMIE
Związane z zaburzeniami transportu lipidów egzogennych
sitosterolemia (zwiększone wchłanianie steroli roślinnych)
abetalipoproteinemia (brak syntezy VLDL i ChM)
choroba Andersona (brak syntezy ChM)
rodzinna hipertriglicerydemia (chylomikronemia) związana z niedoborem LPL
rodzinna hipertriglicerydemia (chylomikronemia) związana z niedoborem apo CII
hiperlipidemia typu III (rodzinna dysbetalipoproteinemia) – izoforma apo E2 + inne
przyczyny
Związane z zaburzeniami transportu lipidów endogennych
złożone hiperlipidemie (złożone podłoże genetyczne) – izoforma apo E4 (najczęściej)
rodzinna złożona hiperlipidemia (nasilona sekrecja apo B100 i synteza VLDL w
wątrobie, wzrost aktywności apo CIII + inne)
rodzinna hipercholesterolemia (upośledzona funkcja receptora dla LDL )
rodzinny defekt apoproteiny apo B100
dyslipidemia z nadprodukcją Lp(a)
hipobetalipoproteinemia
brak aktywności lipazy wątrobowej
Związane z zaburzeniami drogi transportu zwrotnego cholesterolu do wątroby
rodzinna hipoalfalipoproteinemia
brak apo AI
zmieniona budowa apo AI
choroba tangierska (mutacje genu transportera ABCA-1)
upośledzenie aktywności LCAT
hiperalfalipoproteinemia związana z niedoborem CETP
brak apo AII
Przyczyna
Podwyższona frakcja lipoprotein
HDL
Endokrynna, metaboliczna
- cukrzyca
LDL i/lub VLDL/ChM
↓
- niedoczynnośc tarczycy
LDL i/lub VLDL/ChM/IDL
↓
- choroba Cushinga
LDL i/lub VLDL
N
- akromegalia
VLDL
?
Nerkowa
- niewydolność nerek
IDL lub VLDL
↓
- zespó nerczycowy
ł
LDL i/lub VLDL/ChM
↓
W ątrobowa
- cholestaza
LDL (LpX)
↓
- alkoholizm
VLDL, ChM
N
10

Przyczyna
Podwyższona frakcja lipoprotein
HDL
Immunologiczna:
- toczeń rumieniowaty
ChM lub IDL
N
- gammapatie monoklonalne
LDL i/lub VLDL/ChM lub IDL
↓
Leki:
-
β
-blokery
VLDL, LDL
↓
- tiazydy
LDL i/lub VLDL
N/↓
- glikokortykoidy
VLDL i/lub ChM z/bez LDL
N/↓
- estrogeny
VLDL/ChM
N
- gestageny
LDL i VLDL
↓
WSKAZANIA DO PRZEPROWADZENIA BADAŃ LIPIDOWYCH
ocena ryzyka wieńcowego
pierwotne dyslipoproteinemie (objawy: żółtaki, obwódka starcza, zmętnienie rogówki,
barwnikowe zwyrodnienie siatkówki, hepatosplenomegalia)
wtórne dyslipoproteinemie
wyjaśnienie etiologii ostrego zapalenia trzustki
profilaktyka
kontrola leczenia obniżającego stężenie tłuszczów (dietetycznego, farmakologicznego)
i leczenia chorób wywołujących wtórne hipercholesterolemie
MATERIAŁ DO BADAŃ LIPIDOWYCH
krew żylna – krótkotrwały ucisk stazy
pacjent minimum 12-14 godzin na czczo (bez głodówek)
ostatni posiłek przed badaniem – z małą ilością tłuszczu, bez alkoholu (szczególnie
ważne podczas oznaczania stężenia TAG)
w ciągu 24 godzin przed pobraniem krwi nie wykonywać żadnej ciężkiej pracy
fizycznej
surowica lub osocze wersenianowe (1 mg EDTA na 1 mL krwi)
przechowywanie materiału – w szczelnie zamkniętych probówkach:
- do 4 dni w lodówce
- w temp. -20°C do 6 miesięcy
- w temp. -70°C do roku
Test zimnej flotacji
ocena wyglądu surowicy/osocza (na czarnym tle)
- mętny wygląd – zależy od nadmiaru TAG (VLDL lub ChM)
do wąskiej probówki nalewamy 2-5 mL surowicy i wstawiamy do lodówki na 12-18
godzin
wynik:
- gęsty kożuszek - kożuszek
- mętna
11

na powierzchni
- mętna surowica surowica
- przejrzysta surowica
↑ChM - typ I ↑ ChM typ V ↑ VLDL – typ IV/IIB
↑ VLDL
OZNACZANIE CHOLESTEROLU CAŁKOWITEGO
Metody kolorymetryczne (chemiczne)
! Krew nie może być zhemolizowana – hemoliza wpływa na stężenie cholesterolu w osoczu
(zwiększa)!
w osoczu in vitro:
ChW : ChE = 1 : 3
w erytrocytach
ChW : ChE = 4 : 1
Bilirubina w stężeniu powyżej 10 mg% wpływa na oznaczenie cholesterolu – przyjmuje się
poprawki zależne od stężenia bilirubiny:
- przy stężeniu bilirubiny >5mg% na każdy 1 mg% należy dodać 2,5 mg% cholesterolu
Metody kolorymetryczne oznaczania cholesterolu dzielimy na:
jednostopniowe – reakcja barwna(rutynowe)
wielostopniowe
- czterostopniowe
ekstrakcja cholesterolu
zmydlanie
izolowanie
reakcja barwna
- trzystopniowe
ekstrakcja cholesterolu
zmydlanie
reakcja barwna
EKSTRAKCJA
Cholesterol jest związany z lipoproteinami – należy go z tych połączeń wyekstrahować
mieszaniną odczynników:
etanolu i eteru – całkowita ekstrakcja cholesterolu
etanolu i acetonu
metanolu i chloroformu (mieszanina Folcha)
ZMYDLANIE
Hydroliza estrów cholesterolu za pomocą alkoholowego roztworu KOH (na ciepło) –
uzyskanie postaci wolnej cholesterolu
IZOLOWANIE
najczęściej strącanie digitoniną
- powstają digitonidy
- stosunek molekularny cholesterolu do digitoniny 1:1
- podczas strącannia stosuje się nadmiar digitoniny (10:1)
- przed reakcją barwną należy pozbyć się digitonidów (pirydyną lub CH
3
COOH
REAKCJE BARWNE
A. Reakcja Liebermanna – Burcharda - najstarsza
do roztworu dodaje się mieszaninę bezwodnika CH
3
COOH i stężonego H
2
SO
4
12

Roztwór: cholesterol w chloroformie, kwasie octowym, dioksanie lub bezpośrednio
próbka surowicy/osocza
reakcja L-B nie jest swoista dla cholesterolu – z odczynnikiem reagują także
bilirubina, witaminy, inne steroidy.
B. Kwas p-toluenosulfonowy
z bezwodnikiem CH
3
COOH, CH
3
COOH lodowatym i H
2
SO
4
C. Reakcja z FeCl
3
, CH
3
COOH lodowatym i H
2
SO
4
Referencyjna metoda oznaczania cholesterolu całkowitego
Metoda Abell-Kendalla (chemiczna 3-stopniowa):
ekstrakcja: mieszanina alkoholu etylowego i eteru
zmydlanie : alkoholowy roztwór KOH
reakcja barwna: Libermanna-Burcharda
Metody enzymatyczne
HYDROLIZA
esteraza cholesterolowa
cholesterol zestryfikowany + H
2
O cholesterol + RCOOH
UTLENIENIE
oksydaza cholesterolowa
cholesterol + O
2
∆
4- cholestenon + H
2
O
2
OZNACZANIE
elektroda tlenowa – oznaczanie tlenu zużytego w tej reakcji
spektrofotometrycznie – pomiar powstałego D4- cholestenonu (l
max
- 240 nm)
reakcja Hanztscha – katalaza + metanol
- metanol utlenia się do aldehydu mrówkowego, który w obecności acetyloacetonu i
amoniaku daje barwny kompleks 3,5-diacetylo-1,4dihydrolutydyny (405-415 nm)
reakcja Trindera - kolorymetrycznie w obecności peroksydazy z 4-aminoantypiryną
w obecności fenolu (500-550 nm)
4-aminoantypiryna + fenol = odczynnik Trindera
peroksydaza
H
2
O
2
+ fenol + 4-aminoantypiryna barwnik chinoiminowy + 2H
2
O
Metoda CHOD-PAP = oksydaza + odczynnik
cholesterolowa Trindera
test optyczny
katalaza
H
2
O
2
+ etanol aldehyd octowy + 2H
2
O
dehydrogenaza aldehydu octowego
aldehyd octowy + NADP
+
kwas octowy + NADPH+H
+
13

Interferencje – metody enzymatyczne oznaczania cholesterolu
Interferują związki barwne lub uczestniczące w reakcji utleniania:
bilirubina o stężeniu powyżej 5 mg/dL (85,5
µ
mol/L) - dodaje się oksydazę bilirubiny
kwas askorbinowy
hemoglobina – stosuje się pomiar bichromatyczny
inne sterole zawierające grupę –OH (np. sitosterol) mogą reagować z zastosowanymi
odczynnikami
Oznaczanie estrów cholesterolu
ChT – ChW = ChE
ChT – cholesterol całkowity
ChW – cholesterol wolny (oznaczony bez etapu zmydlania)
ChE – estry cholesterolu
Metoda rozcieńczeń izotopowych z wykorzystaniem spektrometrii masowej
metoda definitywna oznaczania cholesterolu (ID/MS)
Ch + Ch znakowany (1:1) -> hydroliza estrów -> ekstrakcja
z przekształceniem cholesterolu w etery (analiza GC/MS)
oblicza się stosunek cholesterolu znakowanego do nieznakowanego i stężenie
cholesterolu w próbce
bardzo wysoka czułość i precyzja
Zakresy wartości prawidłowych stężeń cholesterolu całkowitego
zakres wartości prawidłowych trudny do zdefiniowania (odbiega od zakresu wartości
pożądanych = nie powodujących wzrostu ryzyka choroby niedokrwiennej serca)
- duża zmienność biologiczna (wiek, płeć, dieta, wahania
sezonowe, dobowe, faza cyklu menstruacyjnego, ciąża, zawał mięśnia sercowego,
zabiegi chirurgiczne)
- duża częstość hipercholesterolemii
- długi okres latencji do klinicznych objawów następstw hipercholesterolemii
zakłada się zakres wartości pomiędzy 10 i 90 percentylem
Wiek
Stężenie cholesterolu całkowitego
[mg/dL]
[mmol/L]
> 40 r. ż.
< 240
< 6,2
30-40 r. ż.
< 220
< 5,7
20-30 r. ż.
< 200
< 5,2
< 20 r. ż.
< 170
< 4,4
> 1 r. ż.
< 225
< 5,8
< 1 r. ż.
< 190
< 5,0
Przelicznik [mg/dL] na [mmol/L]: 0,026
14
Nieprawidłowe stężenia cholesterolu całkowitego
Wartości podwyższone:
pierwotne hipercholesterolemie
wtórne hipercholesterolemie - w przebiegu:
- przewlekła niewydolność nerek
- zespół nerczycowy
- przewlekłe choroby wątroby i dróg żółciowych (szczególnie pierwotna żółciowa
marskość wątroby)
- niedoczynność tarczycy
- cukrzyca (źle wyrównana)
leki: gestageny (doustne środki antykoncepcyjne), glikokortykoidy, leki moczopędne
złe nawyki żywieniowe
Wartości obniżone:
poniżej 140 mg/dL (3,6 mmol/L)
ciężkie choroby wyniszczające (nowotwory, przewlekłe zakżenia, operacje, urazy
wielonarządowe)
nadczynność tarczycy
niewydolność wątroby
głodzenie
OZNACZANIE STĘŻENIA TRIACYLOGLICEROLI (TAG)
Metody kolorymetryczne (chemiczne)
EKSTRAKCJA
odczynnikiem Bloora (etanol:eter etylowy; 3:1 v/v)
- ekstrakcji ulegają także fosfolipidy
- suszenie ekstraktu i ważenie
ADSORPCJA
usuwanie fosfolipidów – adsorpcja mieszaniną albuminy i zeolitu
usuwanie glukozy – adsorpcja mieszaniną Ca(OH)
2
i CuSO
4
ZMYDLANIE
etanolowym roztworem KOH
następuje uwolnienie glicerolu
REAKCJA BARWNA
glicerol utlenia się pod wpływem kwasu nadjodowego do formaldehydu
formaldehyd kondensuje z acetonem w obecności amoniaku – powstaje kompleks
barwny: 3,5-diacetylo-1,4-dihydrolutydyna (405 nm)
Metody fluorymetryczne
3,5-diacetylo-1,4-dihydrolutydyna (DDL) – może być oznaczana metodą
fluorymetryczną
Metody enzymatyczne
HYDROLIZA
lipaza
triacyloglicerol + 3H
2
O glicerol + 3 kwasy tłuszczowe
OZNACZANIE GLICEROLU
z wykorzystaniem testu optycznego
1.
kinaza glicerolowa
15

glicerol + ATP
glicerolofosforan + ADP
dehydrogenaza glicerolofosforanowa
glicerolofosforan + NAD
+
fosfodihydroksyaceton + NADH+H
+
2.
kinaza glicerolowa
glicerol + ATP
glicerolofosforan + ADP
kinaza pirogronianowa
ADP + fosfoenolopirogronian
pirogronian + ATP
LDH
pirogronian + NADH+H
+
mleczan + NAD
+
z wykorzystaniem pomiaru kolorymetrycznego
1.
kinaza glicerolowa
glicerol + ATP
glicerolofosforan + ADP
dehydrogenaza glicerolofosforanowa
glicerolofosforan + NAD
+
fosfodihydroksyaceton + NADH+H
+
diaforaza
NADH+H
+
+ barwnik tetrazoliowy formazan + NAD
+
Pomiar: 500 nm
2.
kinaza glicerolowa
glicerol + ATP
glicerolofosforan + ADP
oksydaza glicerolofosforanowa
glicerolofosforan + O
2
fosfodihydroksyaceton + H
2
O
2
peroksydaza
H
2
O
2
+ fenol + 4-aminoantypiryna barwnik chinoiminowy + 2H
2
O
Pomiar: 500-550 nm (metoda z odczynnikiem Trindera, PAP)
Reakcja Trindera - kolorymetrycznie w obecności peroksydazy z 4-aminoantypiryną w
obecności fenolu (500-550 nm)
4-aminoantypiryna + fenol = odczynnik Trindera
Interferencje – metody enzymatyczne oznaczania TAG
endogenny glicerol – w prawidłowych warunkach w niewielkich ilościach
(równowartość ok. 10 mg/dL TAG)
zwiększenie stężenia glicerolu:
- cukrzyca
- stres (emocjonalny)
- dożylne podawanie leków zawierających glicerol
- przedłużone przechowywanie w temperaturze >-20°C
16

Metoda stałego odcinka czasu (fixed time method)
- oparta na rożnicy wartości pomiarów w dwóch punktach czasowych
- pozwala na eliminację błędu wynikającego z obecności glicerolu
Zakres wartości prawidłowych stężeń TAG
50 -180 mg/dL (0,55-2,0 mmol/L)
Przelicznik z [mg/dL] na [mmol/L]: 0,0114
Nieprawidłowe stężenia TAG
Wartości podwyższone:
pierwotne hipertriglicerydemie
wtórne hipertriglicerydemie – w przebiegu:
- cukrzyca
- dna moczanowa
- choroba Cushinga
- gammapatie monoklonalne
- toczeń rumieniowaty układowy
- choroby spichrzania glikogenu
- ciąża
- skłonność: otyłość, nadużywanie alkoholu, dieta bogatowęglowodanowa
leki: blokery receptorów b, tiazydy, glikokortykoidy, estrogeny (doustne leki
antykoncepcyjne)
Oznaczanie stężenia cholesterolu frakcji HDL
Metody strąceniowe
precypitacja lipoprotein VLDL, IDL, Lp(a), LDL, ChM
- za pomocą polianionów (heparyna, siarczan dekstranu, fosforowolframian)
reagujących z dodatnio naładowanymi grupami lipoprotein
- w obecności kationów dwuwartościowych reakcja ulega przyśpieszeniu
- precypitacja 10-15 minut -> wirowanie 45 000g; 1 minuta lub 1500g; 30 minut
w supernantancie: cholesterol HDL (oznaczany metodą enzymatyczną)
Najczęściej stosowane mieszaniny polianionów z dwuwartościowymi kationami:
heparyna z Mn
+2
siarczan dekstranu z Mg
+2
(najlepszy przy wysokich stężeniach TAG)
kwas fosforowolframowy z Mg
+2
glikol polietylenowy 20 000 (wytrąca także HDL
2
)
!Gdy stężenie TAG>400 mg/dL precypitacja jest utrudniona – należy zastosować
wirowanie, filtrację lub rozcieńczenie badanej próbki osocza!
Metody bezpośrednie
Oznaczenie cholesterolu we frakcji HDL – metodą enzymatyczną z zastosowaniem:
przeciwciał poliwalentnych przeciwko apo-B
czynników kompleksujących
- cyklodekstryna – opłaszcza lipoproteiny (głównie z apo-B, HDL
są opłaszczone w niewielkim stopniu) = osłania cholesterol we frakcjach poza HDL
przed enzymami uczestniczącymi w reakcji
- specyficzny detergent usuwa cyklodekstrynę z frakcji HDL
17
Oznaczanie stężenia cholesterolu frakcji LDL
Metody pośrednie
1. Wzór Friedewalda
– oznaczenie stężenia cholesterolu całkowitego (ChT), triacylogliceroli (TAG), cholesterolu
frakcji HDL (Ch-HDL)-> podstawienie do wzoru:
TAG
Ch-LDL = ChT – Ch-HDL –
[mg/dL]
5
TAG
Ch-LDL = ChT – Ch-HDL –
[mmol/L]
2,2
Wzór Friedewalda nie powinien być stosowany, gdy:
stężenie TAG przekracza 300 mg/dL (400 mg/dL)
surowica zawiera znaczące ilości chylomikronów
- nie zostały pobrane na czczo
- u pacjentów z dysbetalipoproteinemią
2. Oznaczanie lipoprotein
β
- metoda ultrawirowania z precypitacją polianionami
(metoda referencyjna)
- osocze wersenianowe (2 mL) z roztworem burowym o gęstości 1,006 g/mL (1 mL)
poddajemy wirowaniu (105 000 x g, 18 godzin, 10°C)
- uzyskujemy rozdział:
VLDL,
β
-VLDL, ChM (warstwa flotująca)
osocze
LDL, HDL (infranatant) + Lp(a), IDL
- infranatant - mieszany, rekonstytuowany do znanej objętości
- oznaczenie cholesterolu w infranatancie
- obliczenie stężenia cholesterolu frakcji LDL i VLDL:
[Ch-LDL] = [Ch frakcji o gęstości >1,006 g/mL] – [Ch-HDL]
[Ch-VLDL] = [ChT] - [Ch frakcji o gęstości >1,006 g/mL]
3. Elektroforeza lipoprotein
metoda półilościowa
pozwala uwidocznić różnice w szybkości wędrówki lipoprotein (wskazuje na
zmiany lub defekty genetyczne nie dające się ocenić innymi metodami) – np. szerokie
pasmo
β
, odpowiadające flotującym b-lipoproteinom jest charakterystyczne dla
hipelipidemii typu III.
nośnik: bibuła, octan celulozy, agaroza, żel poliakrylamidowy
barwienie:
- czerwień olejowa O w 40-55% etanolu (najczęściej stosowana)
- czerń sudanowa B
- czerń amidowa
18
(lub) wytrącenie w żelu za pomocą polianionów
ocena densytometryczna
Metody bezpośrednie
selektywna precypitacja z:
- siarczanem poliwinylu
- heparyną w niskim pH
metody wykorzystujące mieszaninę przeciwciał poliklonalnych przeciwko apo-AI i
apo-E związanych z żywicą, które wiążą i usuwają VLDL, IDL, HDL
metody z homogennymi reagentami - pomiar stężenia cholesterolu LDL (metodą
enzymatyczną) po zamaskowaniu cholesterolu związanego z frakcjami innymi niż
LDL (przeciwciała poliklonalne przeciwko apo-AI i apo-E)
Zakresy wartości stężeń cholesterolu frakcji HDL i LDL
Ryzyko choroby
wieńcowej
Cholesterol LDL
Cholesterol HDL
[mg/dL]
[mmol/L]
[mg/dL]
[mmol/L]
Kobiety
normalne
< 160
< 4,2
> 65
> 1,7
podwyższone
> 180
> 4,7
< 45
< 1,2
Mężczyźni
normalne
< 160
< 4,2
> 55
> 1,5
podwyższone
> 180
> 4,7
< 35
< 0,9
Wartości docelowe leczenia hipolipemicznego
Wynik badania
Ryzyko zawału
Docelowa wartość cholesterolu
LDL
Rozpoznana choroba
wieńcowa
Bardzo wysokie
< 100 mg/dL
Cholesterol > 300 mg/dL i
więcej niż jeden dodatkowy
czynnik ryzyka
Wysokie
< 130 mg/dL
Cholesterol 200-300 mg/dL i
jeden dodatkowy czynnik
ryzyka
Dość duże
< 155 mg/dL
Czynniki wpływające na stężenia cholesterolu frakcji LDL i HDL
LDL
HDL
Aktywność fizyczna
↓
↑
19
Brak aktywności fizycznej
↑
↓
Glikokortykoidy, androgeny,
β
-blokery, leki moczopędne
↑
↓
Estrogeny
N/↑
↑
Gestageny
↑
↓
Czynniki ryzyka choroby wieńcowej
palenie papierosów
nadciśnienie
hipercholesterolemia
niskie stężenie cholesterolu HDL
płeć męska (w okresie pomenopauzalnym ryzyko u kobiet jest takie samo jak u
mężczyzn)
cukrzyca
wczesna choroba wieńcowa u bliskich krewnych
choroba naczyń obwodowych i mózgowych u krewnych
otyłość
Układ odniesienia dla wyników laboratoryjnych
interpretacja stężeń lipidów i frakcji lipoproteinowych – ocena ryzyka zagrożenia
miażdżycą i chorobą niedokrwienna serca (wartości decyzyjne)
zalecane wartości decyzyjne: cholesterol całkowity < 200 mg/dL
Poziom
LDL
[mg/dL]
HDL
[mg/dL]
kobiety
HDL
[mg/dL]
mężczyźni
Pożądany
< 135
> 66
> 58
Graniczny
135-175
66-42
58-35
Wysokiego
ryzyka
> 175
< 42
< 35
Lipidowe czynniki ryzyka choroby wieńcowej
cholesterol całkowity / cholesterol HDL > 5
cholesterol LDL / cholesterol HDL > 4
duże stężenie TAG przy niskim stężeniu cholesterolu HDL
obecność małych gęstych LDL
Oznaczanie apolipoprotein
Metody:
radioimmunologiczne
immunoenzymatyczne
immunodyfuzja radialna (metoda referencyjna)
immunoturbidymetryczne
Zakresy wartości prawidłowych stężenia apolipoprotein
20

Apoproteina
Zakres normy [mg/dL]
Apo B100
50-130
Apo CI
110-205
Apo E
3-5
Apo CII
3-8
OZNACZANIE STĘŻENIA FOSFOLIPIDÓW
Metody chemiczne
I. 1. Ekstrakcja – odczynnikiem Bloora (etanol + eter etylowy), eterem naftowym,
izopropanolem, odczynnikiem Folcha (chloroform + metanol)
2. Hydroliza – uwolnienie fosforu i utlenienie fosforu organicznego do nieorganicznego
(HClO
4
, HNO
3
+ H
2
O
2
)
3. Reakcja barwna – reakcja fosforu nieorganicznego z molibdenianem amonu ->
fosfomolibdenian amonu -> reakcja z Zn
+2
do błękitu molibdenowego (660 nm)
II. 1. Wytrącanie fosfolipidów z białkami (TCA)
2. Utlenienie fosforu organicznego do fosforu nieorganicznego (HClO
4
)
3. Reakcja barwna
Metody enzymatyczne
lecytyna – główny fosfolipid osocza
fosfolipazy
- A
1
– uwalnia resztę acylową w pozycji
α
- A
2
– uwalnia resztę acylową w pozycji
β
- C – uwalnia resztę fosfocholiny
- D – uwalnia resztę choliny
1.
fofataza alkaliczna
fosfocholina + H
2
O cholina + P
i
kinaza choliny
cholina + ATP
fosfocholina + ADP
kinaza pirogronianowa
ADP + fosfoenolopirogronian
pirogronian + ATP
LDH
pirogronian + NADH+H
+
mleczan + NAD
+
2.
oksydaza choliny
cholina + 2O
2
+ H
2
O
betaina + H
2
O
2
H
2
O
2
+ fenol + 4-aminoantypiryna barwnik chinoiminowy + 2H
2
O
Pomiar: 500-550 nm (metoda z odczynnikiem Trindera, PAP)
Znaczenie kliniczne oznaczania fosfolipidów
zakres wartości prawidłowych w osoczu
21

- fosfor fosfolipidów 6-11 mg/dL
- stężenie fosfolipidów 150-300 mg/dL
- stosunek cholesterol/fosfolipidy ≈ 0,98 (wzrasta z wiekiem do ok. 1,4)
zwiększone stężenie fosfolipidów
- miażdżyca naczyń
- niewydolność wątroby
- cukrzyca
oznaczanie lecytyny w płynie owodniowym – ocena dojrzałości układu
oddechowego płodu
- stężenie > 5,1 mg/dL – prawidłowe dojrzewanie
- stężenie 4,7-5,1 mg/dL – zaburzenia dojrzewania
OZNACZANIE WOLNYCH KWASÓW TŁUSZCZOWYCH (WKT)
ocena poheparynowej aktywności lipolitycznej osocza (aktywność LPL)
znaczenie w hiperlipoproteinemii typu I i V
metoda miareczkowa
- ekstrakcja izopropanolem i heptanem
- miareczkowanie mianowanym roztworem NaOH wobec
wskaźnika (błękit tymolowy)
prawidłowe stężenie WKT w surowicy: 0,2-0,8 mmol/L
zwiększone stężenie WKT: cukrzyca, głodzenie, adrenalina, hormon wzrostu
22
Wyszukiwarka
Podobne podstrony:
LIPIDY I LIPOPROTEINY OSOCZA(1)
LIPIDY I LIPOPROTEINY OSOCZA(1)
lipidy2 2
Lipidy do wywieszenia
lipidy skrot
Biochemia 4 Lipidy
Lipidy Teoria 14
Lipidy w kosmetyc1
lipidy izoprenowe id 269491 Nieznany
ch zywnosci wyklad 4 lipidy low
Lipidy 6
2 Lipidy
lipidy - podział i metabolizm, Technologia żywności i żywienia człowieka, Biochemia
lipidy, Lekarski, FARMAKOLOGIA, 2. semestr, 2sem
biochemia lipidy
więcej podobnych podstron