
Konkursy w województwie podkarpackim w roku szkolnym 2009/2010
....................................
kod pracy ucznia
.............................................
pieczątka nagłówkowa szkoły
KONKURS PRZEDMIOTOWY CHEMICZNY
DLA UCZNIÓW GIMNAZJUM
ETAP SZKOLNY
Drogi Uczniu,
Witaj w pierwszym etapie konkursu chemicznego. Przeczytaj uważnie instrukcję i postaraj
się prawidłowo odpowiedzieć na wszystkie pytania.
1. Arkusz liczy 9 stron i zawiera 19 zadań.
2. Przed rozpoczęciem pracy sprawdź, czy Twój test jest kompletny.
Jeśli zauważysz usterki, zgłoś je Komisji konkursowej.
3. W czasie rozwiązywania zadań możesz korzystać z tablicy układu
okresowego pierwiastków i tablicy rozpuszczalności wybranych
wodorotlenków i soli.
4. Zadanie czytaj uważnie i ze zrozumieniem.
5. Rozwiązania i odpowiedzi zapisz w miejscu na to przeznaczonym
przy każdym zadaniu. Staraj się, aby Twoje odpowiedzi były pre-
cyzyjne i jednoznaczne.
6. W rozwiązaniach zadań rachunkowych przedstaw tok rozumowa-
nia prowadzący do ostatecznego wyniku oraz pamiętaj o jednost-
kach.
7. Pisz czytelnie. Używaj długopisu/pióra z czarnym lub granatowym
tuszem/atramentem.
8. Nie używaj korektora, a błędne zapisy wyraźnie przekreśl.
9. Pamiętaj, że zapisy w brudnopisie nie podlegają ocenie.
10. W przypadku testu wyboru podane są cztery odpowiedzi, z których
tylko jedna jest poprawna. Wybierz ją i wpisz znak X zaznaczając
odpowiednią literę w teście.
11. Jeśli zmienisz swoją decyzję, otocz błędną odpowiedź kółkiem
i zaznacz poprawną.
Pracuj samodzielnie.
Powodzenia!
Czas pracy:
60 minut
Liczba punktów
możliwych
do uzyskania:
40
Konkursy w województwie podkarpackim w roku szkolnym 2009/2010
Zadanie 1. (0 - 2)
Liczba atomowa pierwiastka jest cztery razy większa od liczby atomowej berylu, a liczba ma-
sowa jego izotopu jest równa liczbie atomowej selenu.
Podaj liczbę masową izotopu, liczbę atomowa i symbol tego pierwiastka.
liczba masowa …………… liczba atomowa ……………. symbol pierwiastka ……………
Zadanie 2 (0 – 2)
W celu usunięcia tlenku azotu(II) z gazów spalinowych stosuje się dwie reakcje chemiczne.
Można je zapisać słownie:
1. tlenek azotu(II) + tlenek węgla(II)
→
azot + tlenek węgla(IV)
2. tlenek azotu(II)
azot + tlen
⎯
⎯
⎯
→
⎯
r
katalizato
Posługując się podziałem reakcji chemicznych typowym dla chemii nieorganicznej, uzu-
pełnij poniższe zdania wpisując ich typ. Nazwę typu reakcji wybierz ze zbioru: synteza,
analiza, wymiana
Reakcja 1 to reakcja ……………………………………………………….……, zaś reakcja 2 to re-
akcja ……………………………………………………………………………………………………...
Zadanie 3 (0 – 2)
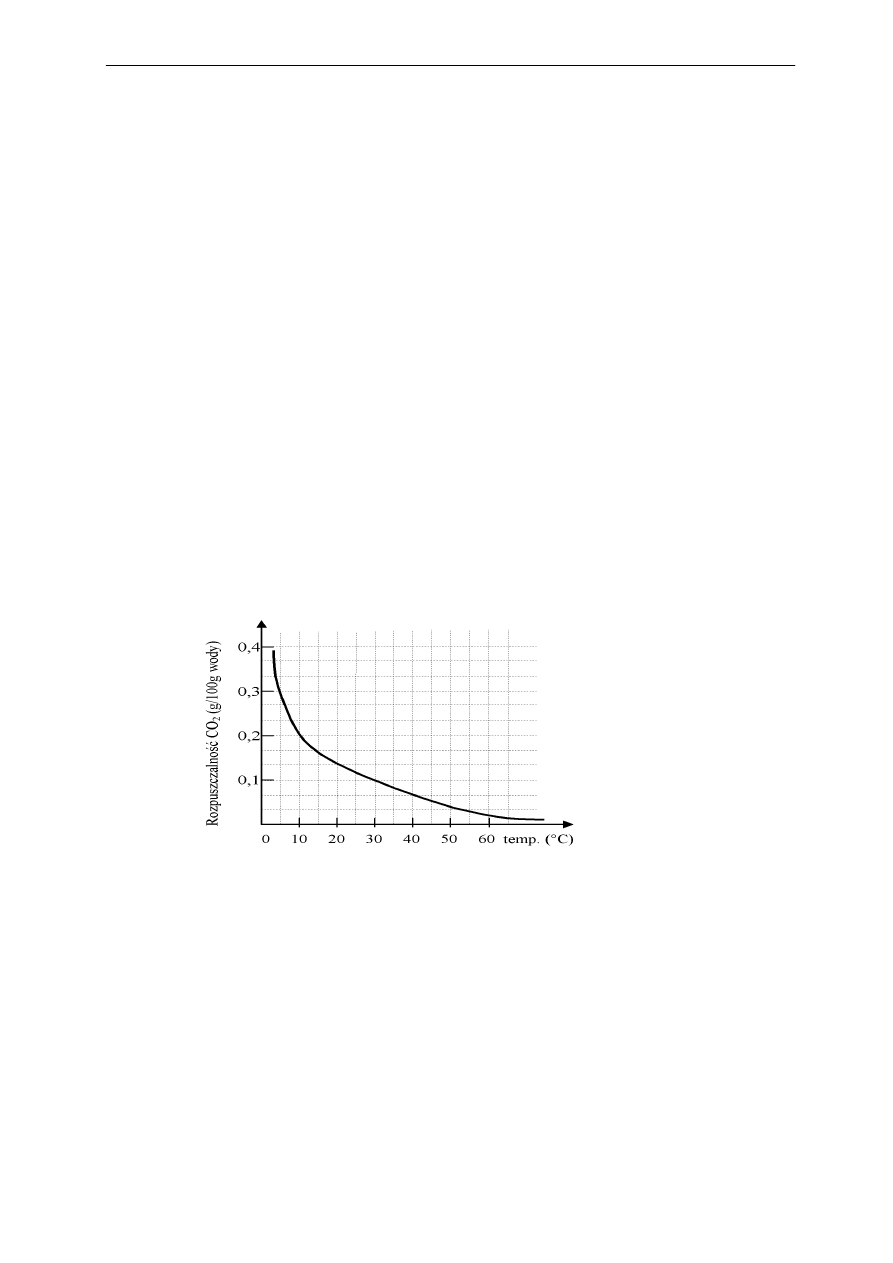
Poniższy wykres przedstawia zależność rozpuszczalności tlenku węgla(IV) w wodzie od tempe-
ratury. Na jego podstawie odpowiedz na poniższe pytania.
1. Jak zmienia się rozpuszczalność tlenku węgla(IV) ze wzrostem temperatury?
Odp. …………………………………………………………………......................................
2. 100 g wody o temperaturze 5°C nasycono tlenkiem węgla (IV).
Ile gramów CO
2
wydzieli się w postaci gazu, gdy ten roztwór ogrzejemy do tempera-
tury 30°C?
…………………………………………………………………………………………………
Odp. …………………………………………………………………………………………..
Strona 2 z 9

Konkursy w województwie podkarpackim w roku szkolnym 2009/2010
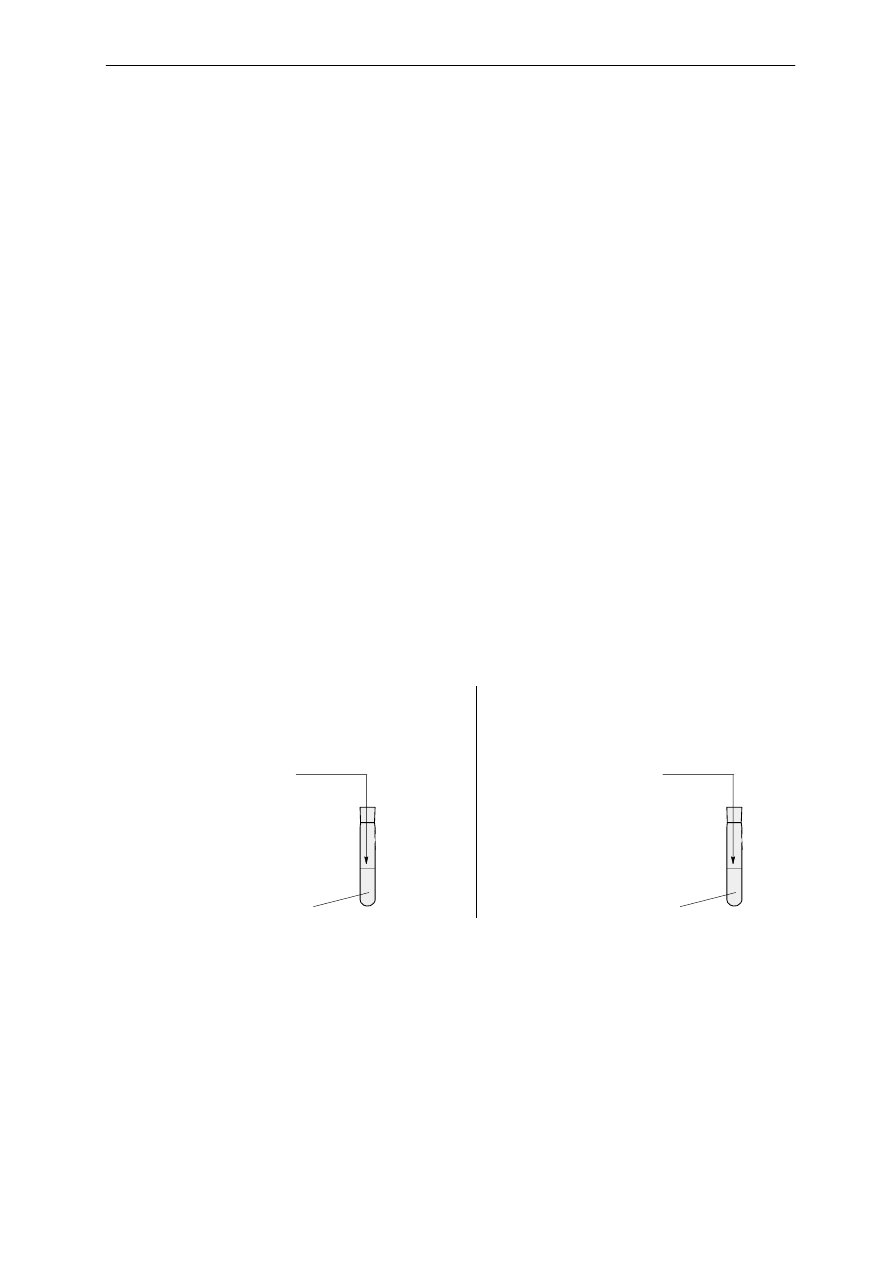
Informacja do zadań 4, 5, 6
Wykonano doświadczenie, którego przebieg ilustruje schemat:
roztwór nasycony
250g wody
o temperaturze 20
0
C
80g chlorku sodu
Przeanalizuj to doświadczenie, a następnie wykonaj zadania 4, 5, 6
Zadanie 4 (0 – 2)
Jakiego rodzaju mieszaninę otrzymano?
…………………………………………………………………………………………………
Jakiego rodzaju jest to roztwór?
…………………………………………………………………………………………………
Zadanie 5 (0 – 2)
Oblicz rozpuszczalność chlorku sodu w temperaturze 20
0
C.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Odp. ……………………………………………………………………………………………
Zadanie 6 (0 – 2)
Oblicz stężenie procentowe otrzymanego roztworu nasyconego.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Odp. ……………………………………………………………………………………………
Zadanie 7 (0 – 2)
W wyniku reakcji 2 cząsteczek pewnego węglowodoru o wzorze C
x
H
y
z 13 cząsteczkami tlenu
powstało 10 cząsteczek pary wodnej oraz 8 cząsteczek tlenku węgla(IV).
Napisz równanie tej reakcji chemicznej oraz podaj wzór sumaryczny i nazwę badanego
gazu.
Równanie reakcji: ……………………………………………………………………………
Wzór sumaryczny i nazwa gazu: ………………………………………………………….....
Strona 3 z 9

Konkursy w województwie podkarpackim w roku szkolnym 2009/2010
Zadanie 8 (0 – 1)
Wskaż, które z poniższych stwierdzeń nie dotyczy wodoru.
A) stanowi 21% powietrza,
B) jest bezbarwnym gazem,
C) pali się niebieskim płomieniem,
D) jest najlżejszą substancją.
Zadanie 9 (0 – 2)
W kopalniach węgla często dochodzi do wybuchu metanu.
Podaj właściwość chemiczną metanu, która jest przyczyną wybuchów ……………………….
Wymień jedną właściwość fizyczną, która powoduje, że tak trudno jest wykryć ulatniający się
metan. …………………………………………………………………………………………...
Zadanie 10 (0 – 4)
Przeprowadzono kolejno cztery doświadczenia:
1. Spalono wstążkę magnezową w powietrzu.
2. Otrzymaną substancję wprowadzono do wody.
3. Do otrzymanego w doświadczeniu 2 roztworu dolewano nadmiar kwasu solnego.
4. Roztwór, który powstał w reakcji 3 zmieszano z roztworem fosforanu(V) sodu. Otrzymano
biały osad.
Napisz w formie cząsteczkowej równania trzech kolejnych reakcji chemicznych, które
przebiegały w doświadczeniach 1,2,3.
1. ………………………………………………….................................................................
2. ………………………………………………….................................................................
3. …………………………………………………………………………………………….
Napisz w formie jonowej skróconej równanie reakcji przebiegającej w doświadczeniu 4.
………………………………………………………………………………………………..
Zadanie 11 (0 – 4)
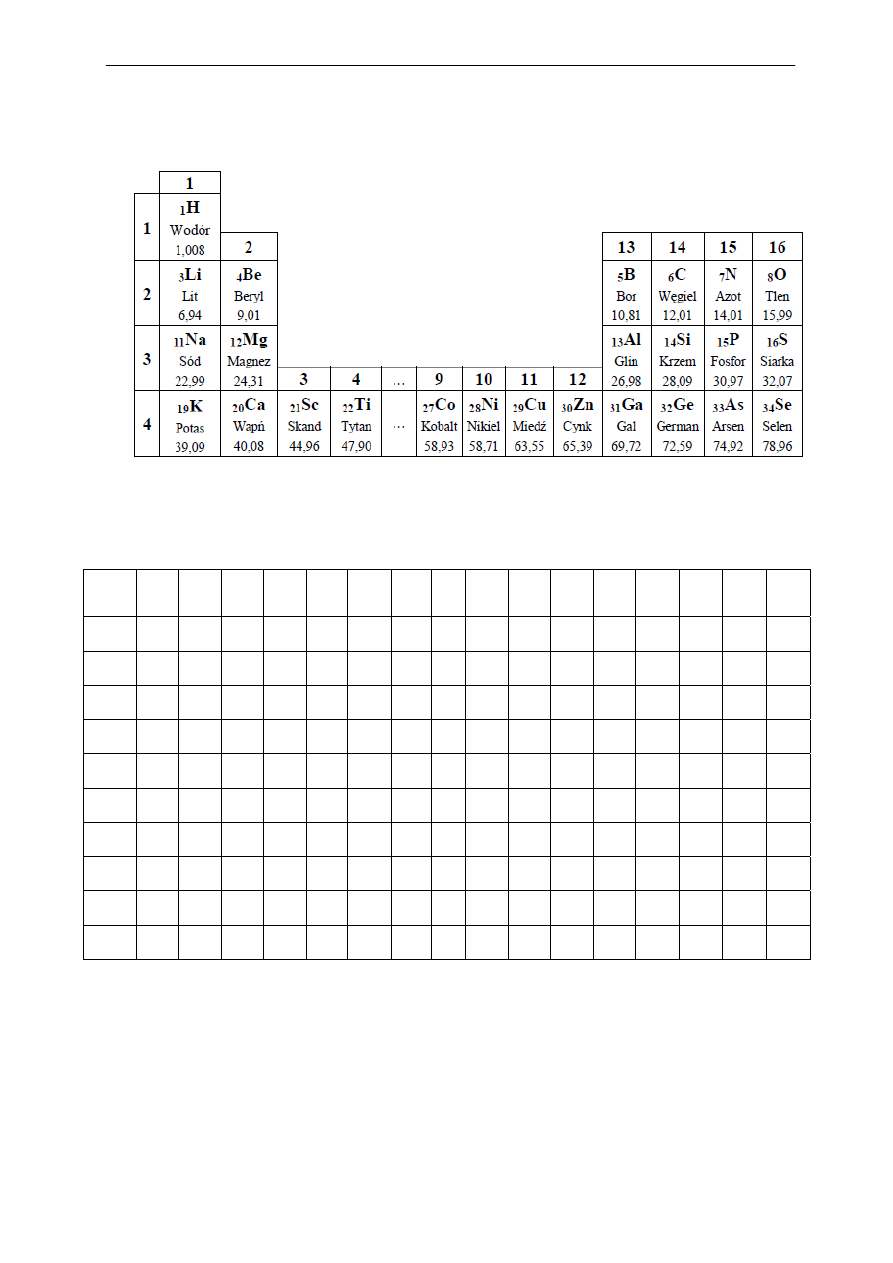
Na podstawie analizy informacji zawartych w tablicy rozpuszczalności:
a) podaj wzory sumaryczne dwóch siarczków nierozpuszczalnych w wodzie.
.................................................................................................................................................
b) podaj wzór soli ołowiu(II) rozpuszczalnej w wodzie. …………………………………
c) napisz wzory dwóch wodorotlenków o wzorze ogólnym Me(OH)
2
praktycznie nieroz-
puszczalnych w wodzie.
.................................................................................................................................................
d) podaj wzór krzemianu metalu trójwartościowego nierozpuszczalnego w wodzie.
…………………………………………………………………………………………………
Strona 4 z 9
Konkursy w województwie podkarpackim w roku szkolnym 2009/2010
Zadanie 12 (0 – 1)
Kwas krzemowy to substancja galaretowata, praktycznie nierozpuszczalna w wodzie.
Wskaż zestaw substratów pozwalający otrzymać kwas krzemowy.
A. SiO
2
+ H
2
O C. SiO
2
+ NaOH
B. Na
2
SiO
3
+ HCl D. Na
2
SiO
3
+ CaCl
2
Zadanie 13 (0 – 2)
Napisz w formie cząsteczkowej równania reakcji tlenku fosforu(V) z wodą i z zasadą sodową.
Równanie reakcji z wodą:
…………………………………………………………………………………………………………
Równanie reakcji z zasadą sodową:
………………………………………………………………………………………………………….
Zadanie 14 (0 – 4)
Zaprojektuj doświadczenia, których celem jest otrzymanie wodnych roztworów wodorotlenku
sodu i wodorotlenku wapnia.
a) Uzupełnij schematyczne rysunki tych doświadczeń, wpisując wzory lub symbole od-
czynników potrzebnych do ich przeprowadzenia. Odczynniki wybierz spośród substan-
cji, których wzory i symbole podano poniżej.
Na, KOH, NaCl, CaO, CaCO
3
, H
2
O
Probówka A
Otrzymywanie roztworu wodorotlenku sodu
.................................
.......................
Probówka B
Otrzymywanie roztworu wodorotlenku wapnia
.................................
.......................
b) Napisz w formie cząsteczkowej równania reakcji chemicznych, które zachodzą podczas
tych doświadczeń.
Probówka A …………………………………………………………………………………………..
Probówka B ……………………………………………………………………………………..……
Strona 5 z 9

Konkursy w województwie podkarpackim w roku szkolnym 2009/2010
Zadanie 15 (0 – 2)
Poniżej opisano dwie reakcje chemiczne.
A. Węglan wapnia ogrzany do temperatury około 900
0
C rozkłada się na tlenek wapnia i tlenek
węgla(IV). Przerwanie ogrzewania powoduje zaprzestanie rozkładu związku
B. Tlenek wapnia energiczne reaguje z wodą, przy czym wydziela się ciepło. Naczynie, w którym
zachodzi reakcja, nagrzewa się.
Na podstawie powyższego opisu określ typ reakcji A i typ reakcji B ze względu na ich efekt
energetyczny.
Typ reakcji A ………………………………………………………………………………………..
Typ reakcji B …………………………………………………………………………………………
Informacja do zadań 16, 17, 18
Ropa naftowa – mieszanina jednorodna węglowodorów ciekłych, stałych i gazowych, jest
cennym surowcem energetycznym. W Bóbrce koło Krosna możemy zwiedzać założoną przez
Ignacego Łukasiewicza, pierwszą w Polsce i świecie „kopalnię” ropy naftowej.
Zadanie 16 (0 – 1)
Do produktów bezpośrednio otrzymanych z ropy naftowej nie należą;
A. benzyna i nafta
B. nafta i asfalt
C. olej napędowy i benzyna
D. koks i gaz świetlny
Zadanie 17 (0 – 1)
Z jednej tony ropy naftowej otrzymano 0,2 tony benzyny. Jaki procent ropy naftowej stanowi
benzyna?
A. 10 %
B. 15 % C. 20 % D. 25 %
Zadanie 18 (0 – 2)
W skład benzyny otrzymanej w procesie destylacji frakcyjnej ropy naftowej wchodzi między
innymi węglowodór, którego model przedstawiono poniżej.
a) Podaj nazwę i wzór sumaryczny tego węglowodoru.
model węglowodoru wzór sumaryczny nazwa
atom węgla atom wodoru
b) Określ wartość współczynników stechiometrycznych w równaniu reakcji spalania całko-
witego heptanu – jednego ze składników benzyny.
C
7
H
16
+ ........ O
2
Æ ...... CO
2
+ ....... H
2
O
Strona 6 z 9

Konkursy w województwie podkarpackim w roku szkolnym 2009/2010
Zadanie 19 (0 – 2)
Wpisz znak X w odpowiednie pola obok podanych zdań, wskazując, czy zdania te są
prawdziwe, czy fałszywe.
PRAWDA FAŁSZ
1. Wzór ogólny alkenów to C
n
H
2n
.
2. Dwa różne węglowodory o wzorze C
4
H
10
stanowią parę izomerów.
3. Węglowodory o wzorach C
3
H
8
i C
4
H
8
należą do tego samego szeregu
homologicznego.
4. Cząsteczka węglowodoru łańcuchowego o wzorze C
6
H
10
posiada jedno
wiązanie podwójne
Strona 7 z 9

Konkursy w województwie podkarpackim w roku szkolnym 2009/2010
BRUDNOPIS
Strona 8 z 9
Konkursy w województwie podkarpackim w roku szkolnym 2009/2010
Fragment układu okresowego pierwiastków.
Tabela rozpuszczalności wybranych wodorotlenków i soli.
Na
+
K
+
NH
4
+
Mg
2+
Ca
2+
Sr
2+
Ba
2+
Ag
+
Cu
2+
Zn
2+
Al
3+
Mn
2+
Fe
2+
Fe
3+
Pb
2+
Sn
2+
OH
-
r r r s s s r n n n n n n n s n
Cl
-
r r r r r r r n r r r r r r s r
Br
-
r r r r r r r n r r r r r r s r
S
2-
r r r o o o o n n n o n n n n n
SO
3
2-
r r r s s s s s s s o s s o s o
SO
4
2-
r r r r s s n s r r r r r o n r
NO
3
-
r r r r r r r r r r r r r r r o
PO
4
3-
r r r s n n n n s s s s s s n o
CO
3
2-
r r r s n n n n s s o s s o n o
SiO
3
2-
r r o n n o n n n n n n n n n o
r - substancja dobrze rozpuszczalna
s - substancja słabo rozpuszczalna (osad wytrąca się ze stężonego roztworu)
n - substancja praktycznie nierozpuszczalna
o - substancja w roztworze wodnym nie istnieje
x - związek nie istnieje
Strona 9 z 9
Wyszukiwarka
Podobne podstrony:
chemia test(2) id 113159 Nieznany
chemia zadania 2 id 113035 Nieznany
chemia opracowanie id 112613 Nieznany
Higiena test id 201631 Nieznany
chemia klucz (2) id 112361 Nieznany
chemia tablice id 112030 Nieznany
Anestezjologia test id 63585 Nieznany
analityczna test id 59602 Nieznany (2)
Chemia 03 id 557778 Nieznany
lp test id 273381 Nieznany
Chemia 10 3 id 111757 Nieznany
prawo test 1[1] id 388104 Nieznany
Chemia 11 3 id 111768 Nieznany
Chemia organiczna W 8 id 112721 Nieznany
arkusz zr Chemia tablice id 625 Nieznany (2)
MIkro test! id 300686 Nieznany
A, TEST 3 id 49155 Nieznany (2)
EZNiOS Log 12 13 w2 test id 166 Nieznany
botanika test 2 id 92334 Nieznany (2)
więcej podobnych podstron