
Wyznaczanie ciepła parowania i ciepła topnienia
Przyrządy:
1. Kalorymetr.
2. Naczynie aluminiowe.
3. Dwie grzałki o różnej mocy.
4. Woltomierz.
5. Amperomierz.
6. Waga laboratoryjna.
7. Termometr.
Przebieg czynności:
I. Wyznaczanie ciepła parowania
1. Ustawić zakres pomiarowy woltomierza na
~
V
750
oraz amperomierza na
~
A
20
.
2. Napełnić wodą aluminiowe naczynie do zaznaczonego poziomu. Wyznaczyć łączną
masę naczynia i wody
1
w
n
m
+
.
3. Zawiesić grzałkę o większej mocy na stojaku i zanurzyć ją w naczyniu tak, aby jej
ebonitowy uchwyt nie dotykała ścianek naczynia. Podłączyć grzałkę do prądu.
Doprowadzić wodę do wrzenia.
4. Gdy woda zacznie wrzeć włączyć stoper i przez
minut
10
=
t
kontynuować proces
wrzenia. W tym czasie odczytać wskazania woltomierza
1
U
i amperomierza
1
I
.
5.
Wyłączyć zasilanie grzałki
i wyjąć ją z naczynia. Wyznaczyć ponownie masę
naczynia z wodą
1
w
n
m
+
′
. Obliczyć masę
1
p
m pary wodnej powstałej w procesie
wrzenia
1
1
1
w
n
w
n
p
m
m
m
+
+
′
−
=
.
6. Wykonać czynności opisane w punktach 2–5 podłączając drugą grzałkę, o mniejszej
mocy.
7. Obliczyć ciepło parowania wody
(
)
2
1
2
2
1
1
p
p
m
m
t
I
U
I
U
R
−
−
=
.
Otrzymaną wartości ciepła parowania R z wartością tablicową
.
abl
t
R
8. Dla obu grzałek obliczyć:
– ciepło pobrane przez wodę o masie
na przejście w stan gazowy
p
m
R
m
Q
p
w
=
,
– ciepło pobrane przez otoczenie w wyniku strat cieplnych na ściankach naczynia
(
)
(
)
[
]
R
m
m
t
I
U
I
U
Q
p
p
o
2
1
2
2
1
1
2
1
+
−
+
=
,
– ciepło oddane przez grzałkę

UIt
Q
g
=
,
– wydajność grzałki w procesie wrzenia
g
w
Q
Q
=
η
.
II. Wyznaczanie ciepła topnienia
1. Wyznaczyć masę
k
m wewnętrznej części kalorymetru, wraz z pokrywką i
mieszadełkiem.
2. Nalać zimnej wody do wysokości ¼ kalorymetru. Następnie dolać do ½ wysokości
kalorymetru wody gorącej (z poprzedniej części ćwiczenia). Włożyć do kalorymetru
mieszadełko i przykryć go pokrywką. Wyznaczyć masę
w
k
m
+
kalorymetru z wodą.
Umieścić kalorymetr w osłonie zewnętrznej i zmierzyć temperaturę początkową wody
i kalorymetru
4
T
.
3. Odczytać temperaturę w zamrażalniku lodówki
1
T
. Wyjąć z zamrażalnika ilość lodu
wskazaną przez prowadzącego zajęcia i wrzucić go do kalorymetru. Włożyć do
kalorymetru mieszadełko i zamknąć go pokrywką. Przykryć kalorymetr płytką
ebonitową.
4. Mieszając wodę doprowadzić do stopienia lodu.
5. Wyznaczyć temperaturę końcową
3
T oraz masę kalorymetru z wodą i lodem
l
w
k
m
+
+
.
6. Na podstawie wcześniejszych pomiarów obliczyć masę wody
w
m oraz masę
wrzuconego lodu
l
m .
7. Wyznaczyć ciepło topnienia lodu
(
)(
)
(
)
(
2
3
1
2
3
4
T
T
c
T
T
c
m
T
T
c
m
c
m
L
w
l
l
k
k
w
w
−
−
−
−
)
−
+
=
i porównać otrzymaną wartość ciepła topnienia z wartością tablicową.
8. Obliczyć ciepła występujące w równaniu bilansu cieplnego:
(
1
2
1
T
T
c
m
Q
l
l
−
=
)
)
)
)
− ciepło pobrane przez lód w trakcie jego ogrzewania,
L
m
Q
l
=
2
− ciepło pobrane przez lód w trakcie jego topnienia,
− ciepło pobrane przez wodę powstałą z lodu w trakcie jej
ogrzewania,
(
2
3
3
T
T
c
m
Q
w
l
−
=
(
3
4
4
T
T
c
m
Q
w
w
−
=
− ciepło oddane przez wodę,
(
3
4
5
T
T
c
m
Q
k
k
−
=
− ciepło oddane przez kalorymetr.
i na ich podstawie wykonać wykres bilansu cieplnego dla ciepła topnienia.
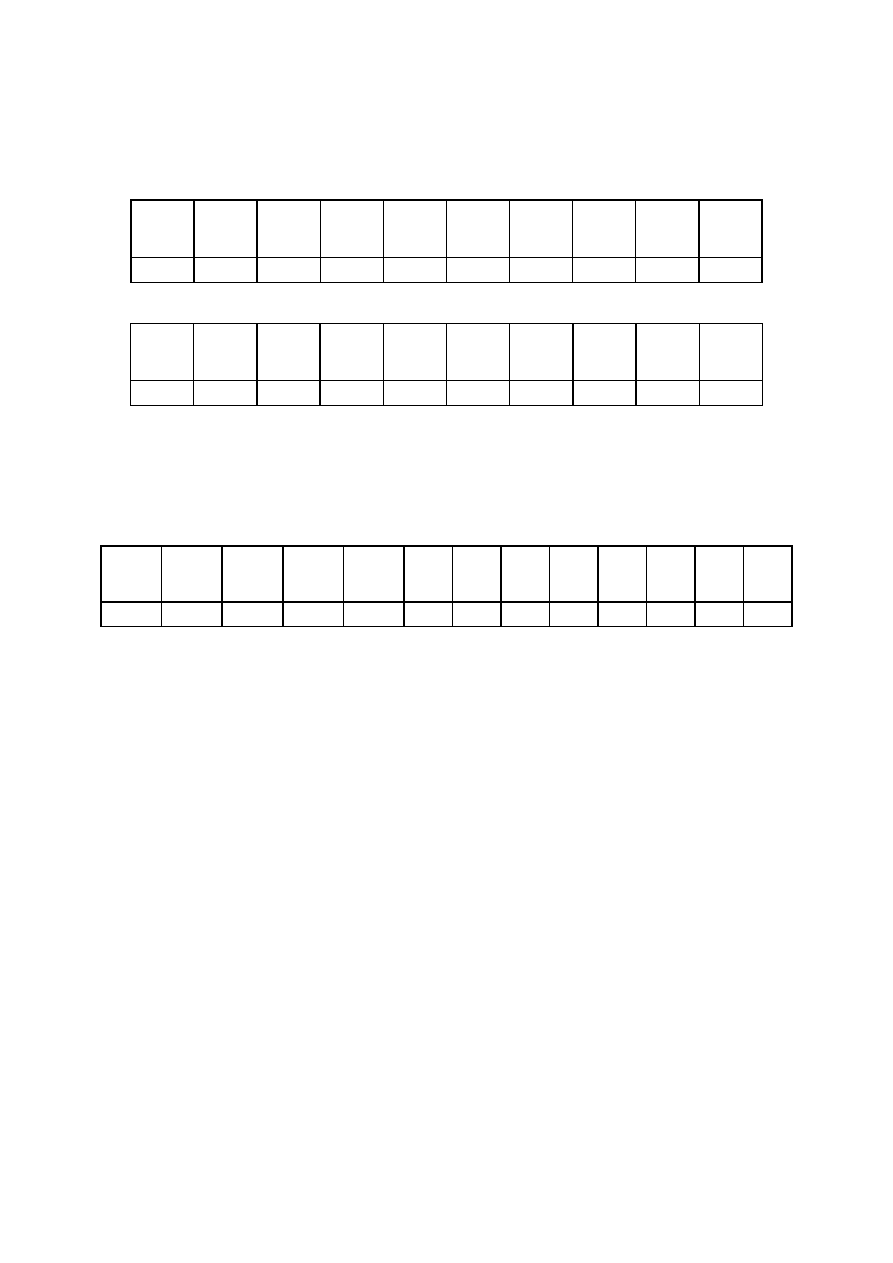
Tabele pomiarowe:
I. Wyznaczanie ciepła parowania
Większa grzałka:
1
w
n
m
+
1
w
n
m
+
′
1
p
m
t
1
U
1
I
1
w
Q
1
o
Q
1
g
Q
1
η
[kg] [kg]
[kg]
[s]
[V]
[A]
[J]
[J]
[J]
Mniejsza grzałka:
2
w
n
m
+
2
w
n
m
+
′
2
p
m
t
2
U
2
I
2
w
Q
2
o
Q
2
g
Q
2
η
[kg] [kg]
[kg]
[s]
[V]
[A]
[J]
[J]
[J]
cal/g
...
J/kg
...
=
=
R
cal/g
...
J/kg
...
tabl
=
=
R
II. Wyznaczanie ciepła topnienia
k
m
w
k
m
+
l
w
k
m
+
+
w
m
l
m
4
T
1
T
3
T
1
Q
2
Q
3
Q
4
Q
5
Q
[kg] [kg] [kg] [kg] [kg] [ºC]
[ºC] [ºC]
[J]
[J] [J]
[J]
[J]
cal/g
...
J/kg
...
=
=
L
cal/g
...
J/kg
...
tabl
=
=
L
Wyszukiwarka
Podobne podstrony:
Ciepło topnienia i parowania - Sprawozdanie, Akademia Morska, I semestr, FIZYKA, Fizyka - Laboratori
Mech- Wyznaczanie ciepła topnienia lodu(1), Sprawozdania - Fizyka
Wyznaczanie ciepła topnienia lodu, Emilia Wieteska
spraw, 24, Wyznaczanie ciepla topnienia lodu
Mech- Wyznaczanie ciepła topnienia lodu, Sprawozdania - Fizyka
wyznaczanie ciepła topnienia lodu
fizyka, Ciepło topnienia lodu 2 (inne spr.), Temat ćwiczenia nr 32:Wyznaczanie ciepła topnienia lodu
Wyznaczanie ciepła topnienia lodu ćw nr 11, PWSZ Krosno budownictwo, Fizyka
WYZNACZANIE CIEPLA TOPNIENIA LODU, Sprawozdania
C1- Wyznaczanie ciepła topnienia lodu przy pomocy kalorymetru. sprawozdanie, Sprawozdania
Wyznaczanie ciepła topnienia lodu przy pomocy kalorymetru, Studia, Pracownie, I pracownia
Wyznaczanie ciepła topnienia lodu, topnienie lodu
C1 - Wyznaczanie ciepła topnienia lodu metoda kalorymetryczn, Sprawozdania
wyznaczanie ciepła topnienia lodu, Sprawozdania
wyznaczanie ciepla topnienia lodu, Budownictwo PG, Semestr 2, Fizyka, Laborki Fizyka, Laborki - chom
Wyznaczanie ciepła topnienia lodu, Sprawozdania - Fizyka
więcej podobnych podstron