
Strona 1
Chemia ogolna2
2006-06-12 14:22:13
http://www.dami.pl/~chemia/wyzsza/rozdzial_VIII/elektrolity3.htm
POLSKIE WWW
ŚWIATOWE WWW
Układ okresowy
Powłoki
Obliczenia
Definicje
Linki do tematu
Równowagi w wodnych roztworach
elektrolitów
Chemia ogólna
POWRÓT
Mieszaniny buforowe
Tutaj kliknij
Wiadomo
ś
ci ogólne
Mechanizm działania roztworów buforowych
Przykłady oblicze
ń
z roztworami buforowymi
Wiadomości ogólne
S
ą
to roztwory, których warto
ść
pH po dodaniu mocnych kwasów albo zasad, jak i po rozcie
ń
czeniu wod
ą
zmienia si
ę
nieznacznie.
Roztworami buforowymi s
ą
najcz
ęś
ciej wodne roztwory słabych kwasów albo zasad i ich odpowiednich soli o
zbli
ż
onych st
ęż
eniach.
Rol
ę
mieszanin buforowych spełniaj
ą
równie
ż
roztwory wodorosoli np. NaHCO
3
, NaH
2
PO
4
lub Na
2
HPO
4
.
Według teorii Bronsteda i Lowry'egobuforami s
ą
zatem roztwory słabych kwasów i sprz
ęż
onych z nimi zasad (np. CH
3
COOH i
CH
3
COO
-
, HCOOH i HCOO
-
, HCO
3
-
i CO
2
2-
, H
2
PO
4
-
i HPO
4
2-
lub HPO
4
2-
i PO
4
3-
) albo roztwory słabych zasad i sprz
ęż
onych z
nimi kwasów (np. NH
3
i NH
4
+
).
Roztwory buforowe charakteryzuj
ą
sie okre
ś
lonym st
ęż
eniem jonów wodorowych i słu
żą
do utrzymania stałej kwasowo
ś
ci
roztworów oraz do jej kontroli.
Cech
ą
charakterystyczn
ą
roztworów buforowych jest:
praktycznie stałe st
ęż
enie jonów wodorowych podczas rozcie
ń
czania roztworu
niewielka zmiana st
ęż
enia jonów wodorowych po dodaniu do roztworu niewielkich ilo
ś
ci mocnego kwasu lub mocnej
zasady - mniejszych ni
ż
st
ęż
enie składników buforu (kwasowo
ść
roztworu buforowego nie powinna zmieni
ć
si
ę
wi
ę
cej ni
ż
o jednostk
ę
pH).
Roztwory buforowe odgrywaj
ą
wa
ż
n
ą
rol
ę
w procesach biochemicznych organizmów ro
ś
linnych i zwierz
ę
cych, zapewniaj
ą
c
ś
ci
ś
le
okre
ś
lon
ą
kwasowo
ść ś
rodowiska, zmienn
ą
w bardzo w
ą
skim tylko zakresie (soki komórkowe, krew, limfa, itp).
Warto
ść
pH mo
ż
e ulega
ć
w organizmie tylko nieznacznym zmianom. Małe przekroczenie pH w kierunku kwasowo
ś
ci czy
zasadowo
ś
ci, powoduje
ś
mier
ć
. Stan, w którym równowaga kwasowo-zasadowa ma tendencje do przesuniecia sie w stron
ę
warto
ś
ci pH ni
ż
szego od normalnego, nazywa si
ę
kwasic
ą
, a stan w którym istnieje tendencja przeciwn
ą
, okre
ś
la zasadowic
ę
.
Przykłady warto
ś
ci pH dla niektórych płynów ustroju wynosz
ą
:
łzy, pot,
ś
lina - ok. 7
krew - 7,36 - 7,43
mocz 5 - 7
sok
ż
oł
ą
dkowy 0,8 - 0,98
osocze -
ś
rednio 7,4
pokarm kobiety - 6,8
Bufory maj
ą
równie
ż
znaczenie w chemii analitycznej oraz w wielu procesach technologicznych (np. fermentacja, galwaniczne
pokrycia metaliczne, itp.)
Przykładem roztworu buforowego s
ą
roztwory;
bufor octanowy: CH
3
COOH, CH
3
COONa w zakresie pH = 3,5 - 6
bufor amonowy: NH
3
* H
2
O, NH
4
Cl w zakresie pH = 8 - 11
bufor fosforanowy: KH
2
PO
4
, K
2
HPO
4
w zakresie pH = 5,5 - 8
bufor boranowy: H
3
BO
3
, Na
2
B
4
O
7
w zakresie pH = 7 - 9
Pojemność buforowa
Działanie buforuj
ą
ce roztworu buforowego jest ograniczone, a skuteczno
ść
tego działania zale
ż
y od st
ęż
enia substancji
składowych. Miar
ą
zdolno
ś
ci roztworu buforowego do przeciwdziałania wpływom zmieniaj
ą
cym jego pH jest
zdolno
ść
buforowa,
wyra
ż
ona zwykle liczb
ą
moli mocnego kwasu lub zasady, która wprowadzona do 1 dm
3
roztworu buforowego zmienia jego pH o
jedno
ść
.

Strona 2
Chemia ogolna2
2006-06-12 14:22:13
http://www.dami.pl/~chemia/wyzsza/rozdzial_VIII/elektrolity3.htm
Pojemno
ść
buforowa jest wprost proporcjonalna do st
ęż
enia roztworu buforowego. Optymalne działanie buforuj
ą
ce wykazuje
bufor, w którym st
ęż
enie kwasu (zasady) jest w przybli
ż
eniu równe st
ęż
eniu soli. W takich warunkach bufory s
ą
najmniej wra
ż
liwe
na dodatek mocnego kwasu lub zasady.
Mechanizm działania roztworów buforowych
Mechanizm działania roztworów buforowych wyja
ś
nimy na przykładzie buforu octanowego.
Po dodaniu do roztworu kwasu octowego soli tego kwasu, np. octanu sodowego CH
3
COONa, który jako sól jest całkowicie
zdysocjowany na jony CH
3
COO
-
i Na
+
, wzrasta w roztworze st
ęż
enie jonów octanowych. Z zale
ż
no
ś
ci okre
ś
laj
ą
cej stał
ą
dysocjacji kwasu octowego
K
HA
= [H
+
] * [CH
3
COO
-
] / [CH
3
COOH] = const (t=const)
wynika, i
ż
w stałej temperaturze ze wzrostem st
ęż
enia jonów CH
3
COO
-
maleje st
ęż
enie jonów H
+
, poniewa
ż
stała dysocjacji K
HA
nie mo
ż
e ulec zmianie. Mówimy,
ż
e w obecno
ś
ci octanu sodowego dysocjacja kwasu octowego zostaje cofni
ę
ta.
Zatem kwas octowy CH
3
COOH w buforze octanowym wyst
ę
puje praktycznie bior
ą
c w postaci niezdysocjowanych cz
ą
steczek i
spełnia rol
ę
donora protonów, a octan sodowy w postaci jonów Na
+
i CH
3
COO
-
, przy czym jony CH
3
COO
-
jako zasada
anionowa, s
ą
akceptorami protonów.
Donor protonów CH
3
COOH, chroni roztwór przed zmian
ą
pH podczas dodawania do układu zasady. Dodawana do buforu mocna
zasada np. OH
-
, jest zoboj
ę
tniana przez kwas octowy zgodnie z równaniem.
CH
3
COOH + OH
-
<=> CH
3
COO
-
+ H
2
O
W reakcji powstaje bardzo słabo zdysocjowany kwas octowy CH
3
COOH i pH roztworu praktycznie nie zmienia si
ę
. W ten sposób
układ jest buforowany obustronnie, czyli jest chroniony przed zmian
ą
pH zarówno podczas dodawania kwasu jak i zasady.
Po rozwi
ą
zaniu powy
ż
szego równania dla H
3
O
+
otrzymujemy
[H
3
O
+
] = K
HA
* [CH
3
COOH] / [CH
3
COO
-
]
gdzie: K
HA
- stała dysocjacji
Zale
ż
no
ść
ta wskazuje,
ż
e st
ęż
enie jonów hydroniowych H
3
O
+
zale
ż
y od stałej K
HA
i od stosunku st
ęż
enia niezdysocjowanego
kwasu octowego do st
ęż
enia jonów octanowych.
W celu uzyskania wyra
ż
enia opisuj
ą
cego wykładnik st
ęż
enia jonów wodorowych w roztworze buforowym, logarytmujemy
powy
ż
sze równanie i zmieniamy znaki na przeciwne po obu stronach znaku równo
ś
ci
-lg[H
3
O
+
]= -lgK
HA
- lg([CH
3
COOH] / [CH
3
COO
-
])
Poniewa
ż
-lg[H
3
O
+
] = pH oraz -lgK
HA
= pK
HA
, gdzie pK
HA
jest wykładnikiem stałej dysocjacji kwasu octowego. Ostatecznie
otrzymamy równanie na pH:
pH = pK
HA
- lg(C
kw
/ C
soli
)
Równanie nosi nazw
ę
równania Hedersona-Hasselbalcha i słu
ż
y do obliczania pH roztworu składaj
ą
cego si
ę
z roztworu słabego
kwasu i jego soli z mocn
ą
zasad
ą
Dla roztworów buforowych składaj
ą
cych si
ę
z roztworów wodnych słabych zasad i ich soli z mocnymi kwasami równanie
Hedersona-Hasselbalcha ma posta
ć
:
pH = pK
w
- pK
BOH
+ lg(C
zasady
/ C
soli
)
Przykładem takiego roztworu buforowego jest bufor amonowy: NH
3
* H
2
O, NH
4
Cl
Skuteczność buforowania
Z wyra
ż
enia
[H
3
O
+
] = K
HA
* [CH
3
COOH] / [CH
3
COO
-
]
i dla buforu octanowego, wida
ć
,
ż
e skuteczno
ść
buforu zale
ż
y od st
ęż
enia substancji buforowych; dziesi
ę
ciokrotne rozcie
ń
czenie
buforu zmniejsza 10 razy ilo
ść
kwasu lub zasady, jak
ą
mozna doda
ć
do litra buforu bez wywołania zmiany pH wi
ę
kszej ni
ż
żą
dana warto
ść
.
A jak b
ę
dzie zmienia
ć
si
ę
pH roztworu buforowego w zale
ż
no
ś
ci od składu mieszanin buforowych?
Z powyzszego równania wynika,
ż
e je
ż
eli [CH
3
COOH] i [CH
3
COO
-
] s
ą
sobie równe, jak w równomolowej nieszaninie CH
3
COOH i
CH
3
COONa, wtedy warto
ść
st
ęż
enia jonów [H
3
O
+
] równa jest wła
ś
nie K
HA
i st
ą
d pH = 4,7. Mieszanina CH
3
COOH i CH
3
COONa

Strona 3
Chemia ogolna2
2006-06-12 14:22:13
http://www.dami.pl/~chemia/wyzsza/rozdzial_VIII/elektrolity3.htm
w stosunku 1 : 5 ma st
ęż
enie jonów [H
3
O
+
] = 1/5K
HA
i pH = 5,4, natomiast mieszanina w stosunku 5 : 1 ma st
ęż
enie jonów
[H
3
O
+
] = 5K
HA
i pH = 4,0. Dobieraj
ą
c odpowiedni stosunek CH
3
COOH do CH
3
COONa mo
ż
na otrzymywa
ć
dowolne st
ęż
enie
jonów wodorowych w tym zakresie.
Podobnie mo
ż
na post
ę
powa
ć
z innymi roztworami buforowymi.
Przykłady obliczeń z roztworami buforowymi
Przykład 1
Oblicz st
ęż
enie jonów wodorowych i wykładnik st
ęż
enia jonów wodorowych w roztworze buforowym zawieraj
ą
cym 0,1 mola
kwasu octowego i 0,1 mola octanu sodowego w 1 dm
3
roztworu. Wartos
ć
stałej dysocjacji kwasu octowego K
HA
= 1,8*10
-5
. Jak
zmieni si
ę
w tym buforze wykładnik st
ęż
enia jonów wodorowych, je
ż
eli wprowadzi si
ę
do roztworu: a) 0,01 mola HCl i b) 0,01
mola NaOH?
Rozwi
ą
zanie
Wykładnik st
ęż
enia jonów wodorowych obliczamy z równania.
pH = pK
HA
- lg(C
kw
/ C
soli
)
pK
HA
= lgK
HA
= lg(1,8 * 10
-5
) = 4,74
pH = 4,74 - lg(0,1 / 0,1) = 4,74 - 0 = 4,74
Dodanie do roztworu 0,01 mola mocnego kwasu (HCl) sprawi, ze praktycznie prawie wszystkie jony wodorowe tego kwasu
przereaguj
ą
z jonami octanowymi z utworzeniem słabo zdysocjowanego kwasu octowego, przy czym wykładnik jonów
wodorowych ulegnie tylko nieznacznej zmianie;
pH = 4,74 - lg(0,1 + 0,01/ 0,1 - 0,01) = 4,74 - 0,09 = 4,65
Dodanie do roztworu 0,01 mola mocnej zasady (NaOH) spowoduje utworzenie soli w reakcji kwasu octowego z zasad
ą
, czyli
powstanie nowej ilo
ś
ci jonów octanowych, co wywoła tylko nieznaczn
ą
zmian
ę
wykładnika jonów wodorowych
pH = 4,74 - lg(0,1 - 0,01/ 0,1 + 0,01) = 4,74 - 0,09 = 4,83
Przykład 2
Oblicz st
ęż
enie i wykładnik st
ęż
enia jonów wodorowych w roztworze buforowym zawieraj
ą
cym 0,1 mola amoniaku i 0,1 mola
chlorku amonowego w 1 dm
3
roztworu. Warto
ść
stałej dysocjacji amoniaku K
BOH
= 1,8 * 10
-5
. Jak zmieni si
ę
wykładnik jonów
wodorowych w tym buforze, je
ż
eli do roztworu wprowadzi si
ę
; a) 0,01 mola KOH i b) 0,01 mola HCl?
Rozwi
ą
zanie
Podobnie jak dla roztworów buforowych zawieraj
ą
cych słabe kwasy i ich sole,równie
ż
i w tym przypadku punktem wyj
ś
cia jest
równanie stałej dysocjacji amoniaku w wodnym roztworze:
[OH
-
] = K
BOH
* [NH
3
] / [NH
4
+
]
gdzie: K
BOH
- stała dysocjacji
[OH
-
] = K
BOH
* [C
zasady
] / [C
soli
]
Poniewa
ż
z iloczynu jonowego wody wynika,
ż
e st
ęż
enie jonów wodorotlenowych mo
ż
emy obliczy
ć
z równania;
[OH
-
] = K
w
/ [H
3
O
+
]
gdzie K
w
- stała dysocjacji wody
to korzystaj
ą
c z wcze
ś
niejszego równania, zlogarytmowaniu tego równania stronami i zmianie znaków na przeciwne po obu
stronach równo
ś
ci otrzymamy zale
ż
no
ś
ci;
pH = pK
w
- pK
BOH
+ lg(C
zasady
/ C
soli
)
Po podstawieniu warto
ś
ci liczbowych z zadania i uwzgl
ę
dnieniu,
ż
e K
w
= 1,00 * 10
-14
otrzymamy;
pH = 14 - 4,74 + lg(0,1 / 0,1) = 14 - 4,74 - 0 = 9,26
Dodanie do roztworu 0,01 mola KOH spowoduje reakcj
ę
;
NH
4
+
+ OH
-
---> NH
3
+ H
2
O
przy czym wykładnik st
ęż
enia jonów wodorowych ulegnie nieznacznej zmianie:
Strona 4
Chemia ogolna2
2006-06-12 14:22:13
http://www.dami.pl/~chemia/wyzsza/rozdzial_VIII/elektrolity3.htm
pH = 14 - 4,74 + lg(0,1 + 0,01/ 0,1 - 0,01) = 14 - 4,74 + 0,09 = 9,35
Po dodaniu do roztworu buforowego 0,01 mola kwasu solnego nast
ą
pi zoboj
ę
tnienie równowa
ż
nej ilo
ś
ci amoniaku z utworzeniem
soli amonowej. wykładnik st
ęż
enia jonów wodorowych wynosi w tym przypadku;
pH = 14 - 4,74 + lg(0,1 - 0,01/ 0,1 + 0,01) = 14 - 4,74 - 0,09 = 9,17
Przykład 3
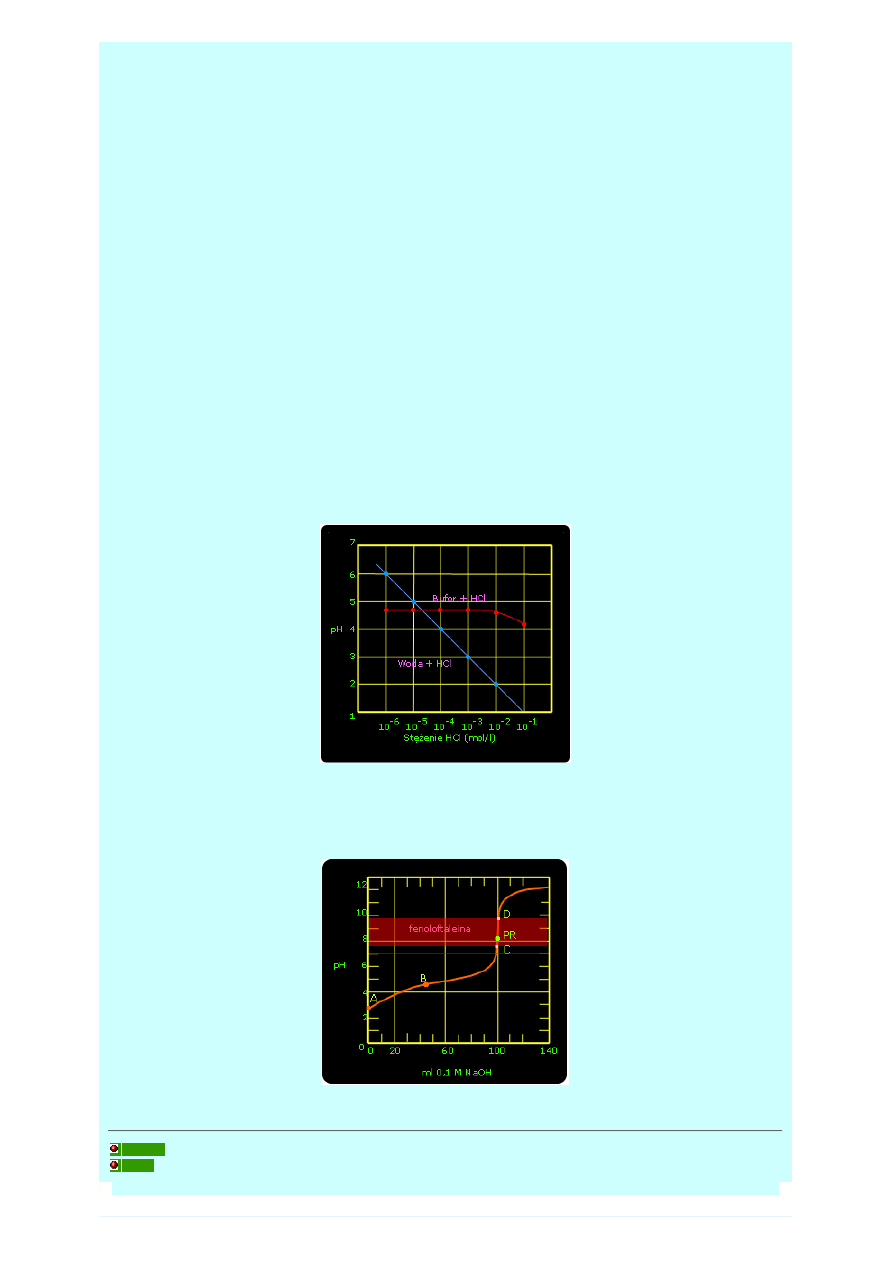
Efekt dodawania kwasu solnego do wody i dwóch roztworów buforowych
bufor nr1 to (C
kwasu
/ C
soli
= 0,1 / 0,1)
bufor nr 2 to (C
kwasu
/ C
soli
= 0,2 / 0,2)
St
ęż
enie HCl
mol
pH dla wody pH dla buforu 1 pH dla buforu 2
0
7
4.74
4.74
0.000001
6
4.74
4.74
0.00001
5
4.74
4.74
0.0001
4
4.74
4.74
0.001
3
4.74
4.74
0.01
2
4.66
4.70
0.1
1
2.72
4.27
Dopiero kiedy st
ęż
enie kwasu solnego ma warto
ść
0,01 mola daje si
ę
zauwa
ż
y
ć
zmiany pH. W przypadku buforu 1 te zmiany s
ą
wi
ę
ksze jak dla buroru 2. Spowodowane jest to inn
ą
warto
ś
ci
ą
pojemno
ś
ci buforowej roztworów. Bufor 2 ma wi
ę
ksz
ą
pojemno
ść
buforow
ą
i w zakresie st
ęż
e
ń
0,01 i mniejszych lepiej chroni roztwór przed zmianami pH podczas dodawania kwasu.
Przebieg zmian pH ilustruje poni
ż
szy rysunek.
Zjawisko buforowania roztworów wyst
ę
puje podczas miareczkowania słabych kwasów mocn
ą
zasad
ą
i słabych zasad mocnym
kwasem. Przykładem mo
ż
e by
ć
miareczkowanie kwasu octowego CH
3
COOH mocn
ą
zasad
ą
tj. wodorotlenkiem sodowym
NaOH. W czasie miareczkowania powstaje sól CH
3
COONa, która razem z obecnym w roztworze kwasem octowym CH
3
COOH
jest klasycznym roztworem buforowym.
Wi
ę
cej o miareczkowaniu w kolejnym dziale
Miareczkowanie
POWRÓT
DALEJ

Strona 5
Chemia ogolna2
2006-06-12 14:22:13
http://www.dami.pl/~chemia/wyzsza/rozdzial_VIII/elektrolity3.htm
Liczby kwantowe/ Wi
ą
zania chemiczne/ Stany skupienia/ Energetyka/ Elektrolity/ Koloidy/
Biocz
ą
steczki/
Spis tre
ś
ci serwisu - liceum/ Kontakt z autorem strony/
ă
Copyright - "CHEMIA OGÓLNA - 2002 - 2006"
Wyszukiwarka
Podobne podstrony:
Chemia labolatorium, Mieszanina buforowa, Mieszanina buforowa - stosowana w celu wytworzenia właściw
chemia, Mieszaniny buforowe, ĆWICZENIE 8
ćw06 Mieszaniny buforowe2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Obliczanie pH roztworów mocnych oraz słabych kwasów i zasad oraz mieszanin buforowych, UWM Weterynar
w06 Mieszaniny buforowe- c, St˙˙enie jon˙w hydroniowych wywiera wp˙yw na stan r˙wnowagi chemicznej w
Ustalanie składu mieszanki betonowej1
Napęd mieszadła ślimakowego projekt, OBL
5 MIESZANKA BETONOWA
Napęd mieszadła ślimakowego projekt, 3
ARTYKUL Mieszanki niezwiazane na podbud
mieszanka liter trudnych
Deklinacja mieszana(1), Studia, Polonistyka
Buforowość gleby, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Ochrona i rekultywacja gleb
40 Bernady (2), Mieszanka WIŚ, Fizyka Wiś Iś
Mieszanie nawozów
więcej podobnych podstron