
Pierwsza zasada
termodynamiki
2.2.1. Doświadczenie Joule’a i jego konsekwencje
2.2.2. Ciepło, pojemność cieplna – sens i obliczanie
2.2.3. Praca – sens i obliczanie
2.2.4. Energia wewnętrzna oraz entalpia
2.2.5. Konsekwencje I zasady termodynamiki
2.2.6. Obliczenia zmian energii wewnętrznej oraz entalpii

W
Q
U
el
el
W
Q
dU
Doświadczenie Joule'a (1843)
Doświadczenie Joule'a (1843)
Wykład z Chemii Fizycznej str. 2.2 / 2
2.2. I zasada termodynamiki
Pierwsza zasada termodynamiki
Zasada zachowania energii

Wykład z Chemii Fizycznej str. 2.1 / 3
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
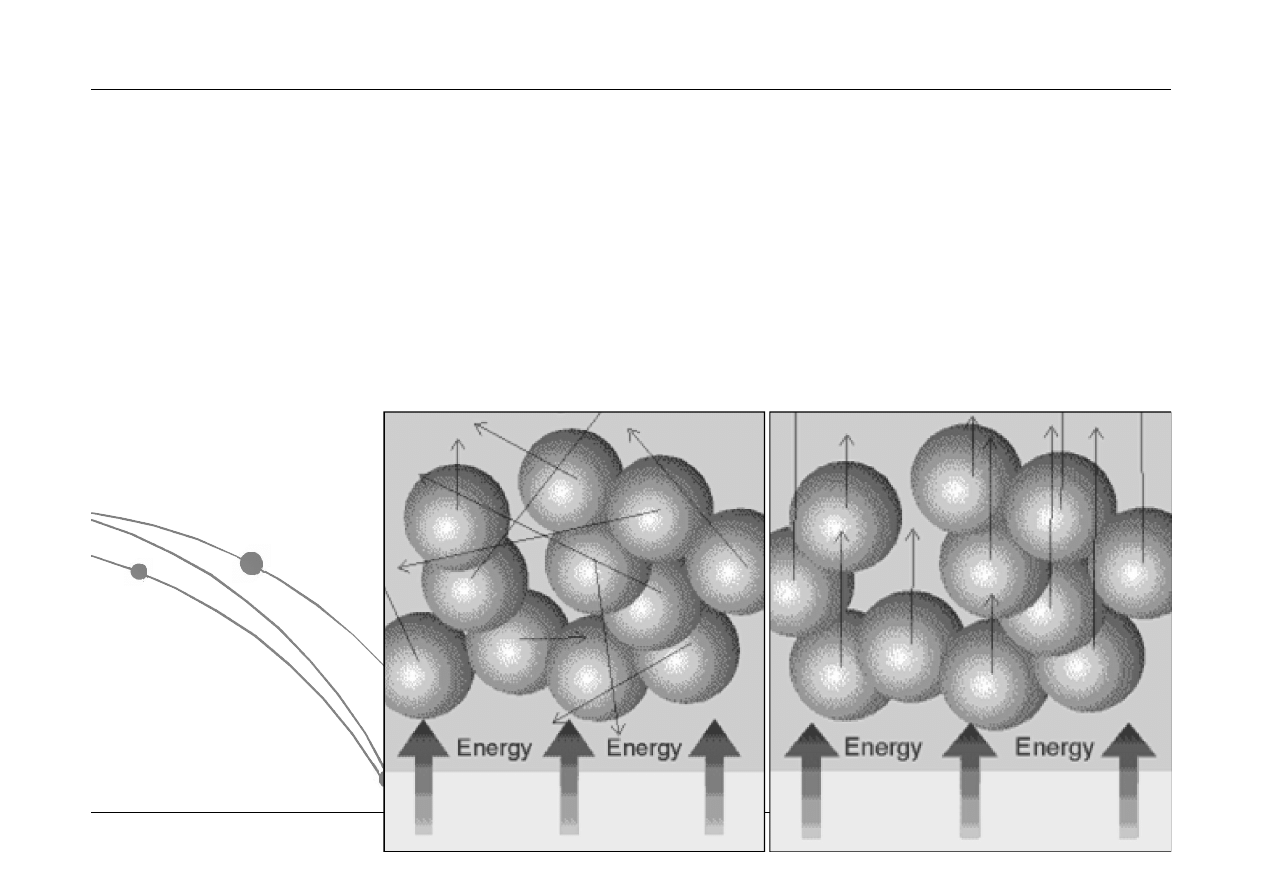
W skład energii wewnętrznej układu wchodzą:
energia kinetyczna ruchu postępowego i obrotowego drobin
energia ruchu drgającego atomów w drobinie
energia potencjalna w polu wzajemnego przyciągania się drobin
energia stanów elektronowych
energia chemiczna, związana z możliwością przebudowy drobin
energia jądrowa
E
E
E
U
u
k
p
Całkowita energia układu
termodynamicznego jest równa sumie
makroskopowej energii kinetycznej,
makroskopowej energii potencjalnej i
reszty nazwanej energią wewnętrzną
Energia wewnętrzna
Na ogół wystarcza znajomość przyrostów
energii podczas przemian termodyna-
micznych, a nie całkowitej energii układu.
Stan odniesienia, dla którego energia
wewnętrzna ciała jest przyjmowana jako
równa zeru, można przyjąć dowolnie.
W obliczeniach dotyczących fizycznych
przemianach termodynamicznych nie ma
potrzeby uwzględniania tych składników
energii wewnętrznej, które nie ulegają zmianie
podczas analizowanego procesu, np. energii
jądrowej i energii chemicznej.
Wykład z Chemii Fizycznej str. 2.2 / 4
2.2. I zasada termodynamiki
Pierwsza zasada termodynamiki – fizyczny ciepła i pracy
Ciepło i praca
Ciepło i praca są sposobami przekazywania, a nie rodzajami energii.
Jeżeli jedyną przyczyną przepływu pewnej ilości energii pomiędzy układem a otoczeniem jest
różnica temperatur, to tę energię nazywamy energią przekazaną na sposób ciepła, lub w skrócie
ciepłem. Jeżeli całkowity skutek przepływu pewnej ilości energii pomiędzy układem a otoczeniem
może być sprowadzony do pionowego przemieszczenia jakiegoś ciężaru, to tę ilość energii
nazywamy energią przekazaną na sposób pracy mechanicznej, lub skrótowo pracą mechaniczną.
Interpretacja molekularna ciepła i pracy
Wymiana ciepła
Układ
Otoczenie
Wymiana pracy
Ciepło jest formą wymiany energii
poprzez bariery wywołującą
zmiany temperatury
Wykład z Chemii Fizycznej str. 2.2 / 5
2.2. I zasada termodynamiki
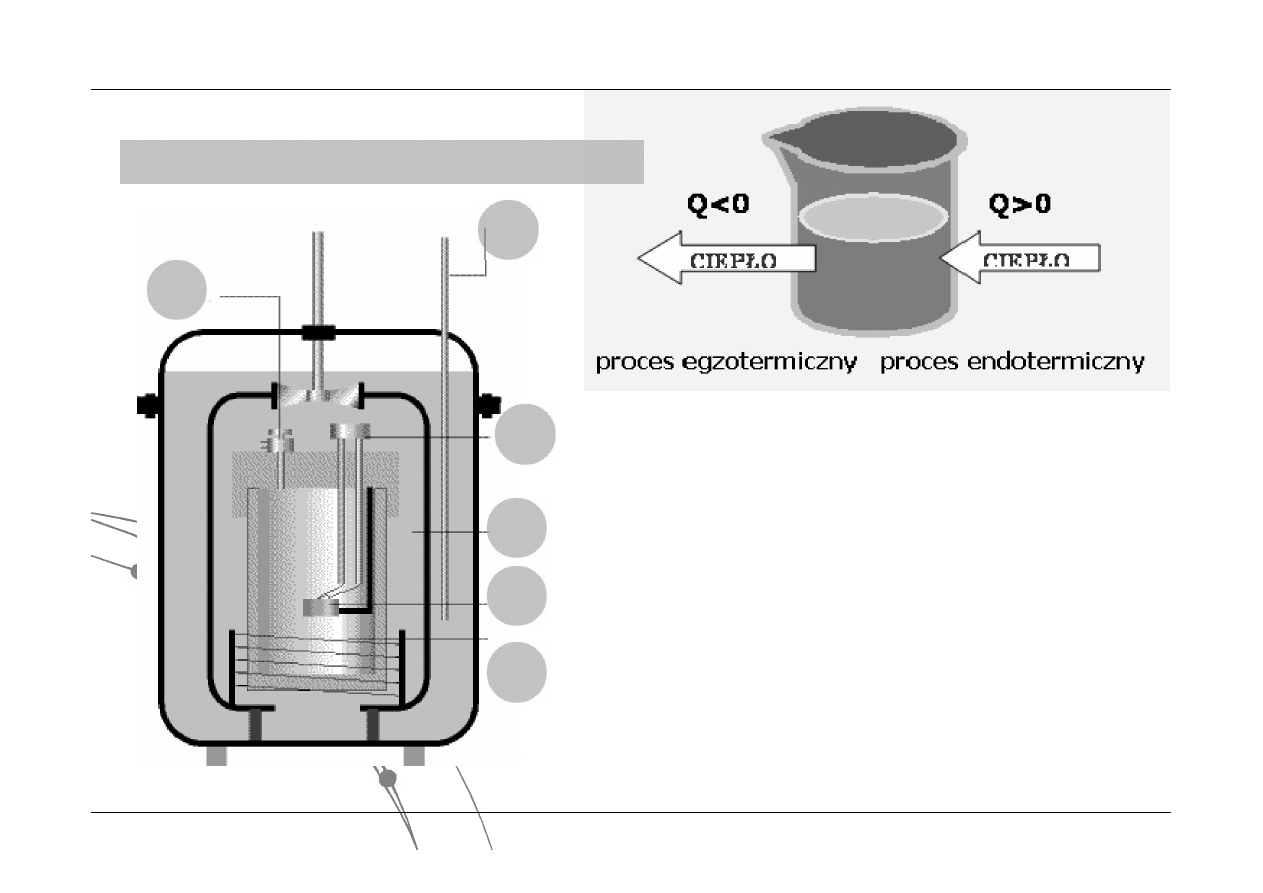
Pierwsza zasada termodynamiki – pomiar ciepła
Kalorymetr adiabatyczno-izochoryczny
1 – wlot tlenu
2 – termometr oporowy
3 – przewody zapłonowe
4 – płaszcz wodny
5 – próbka
6 – grzejnik
1
2
3
4
5
6
Wykład z Chemii Fizycznej str. 2.2 / 6
2.2. I zasada termodynamiki
Pierwsza zasada termodynamiki – rodzaje ciepła
Ciepło wymiany
T
m
C
Q
Pojemność cieplna
C
dt
dQ
2
1
T
T
CdT
Q
ilość ciepła wymieniona podczas zmiany temperatury jednostkowej ilości
układu o jeden stopień
K
mol
J
C
C
V
P
,
K
g
J
c
c
V
P
,
P
P
c
M
C
V
V
c
M
C
Interpretacja
molekularna
pojemności cieplnej
Wykład z Chemii Fizycznej str. 2.2 / 7
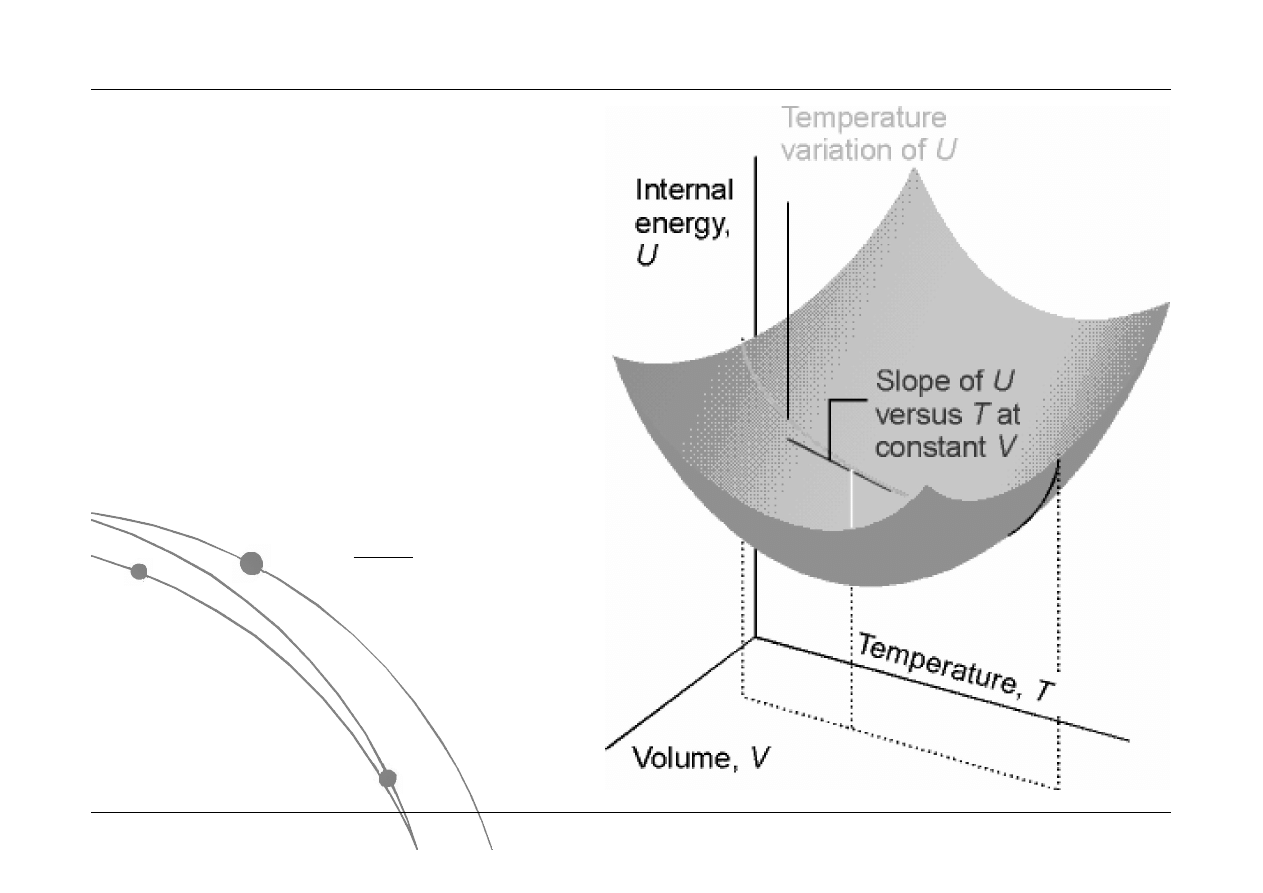
2.2. I zasada termodynamiki
Pierwsza zasada termodynamiki – pojemność ciepła
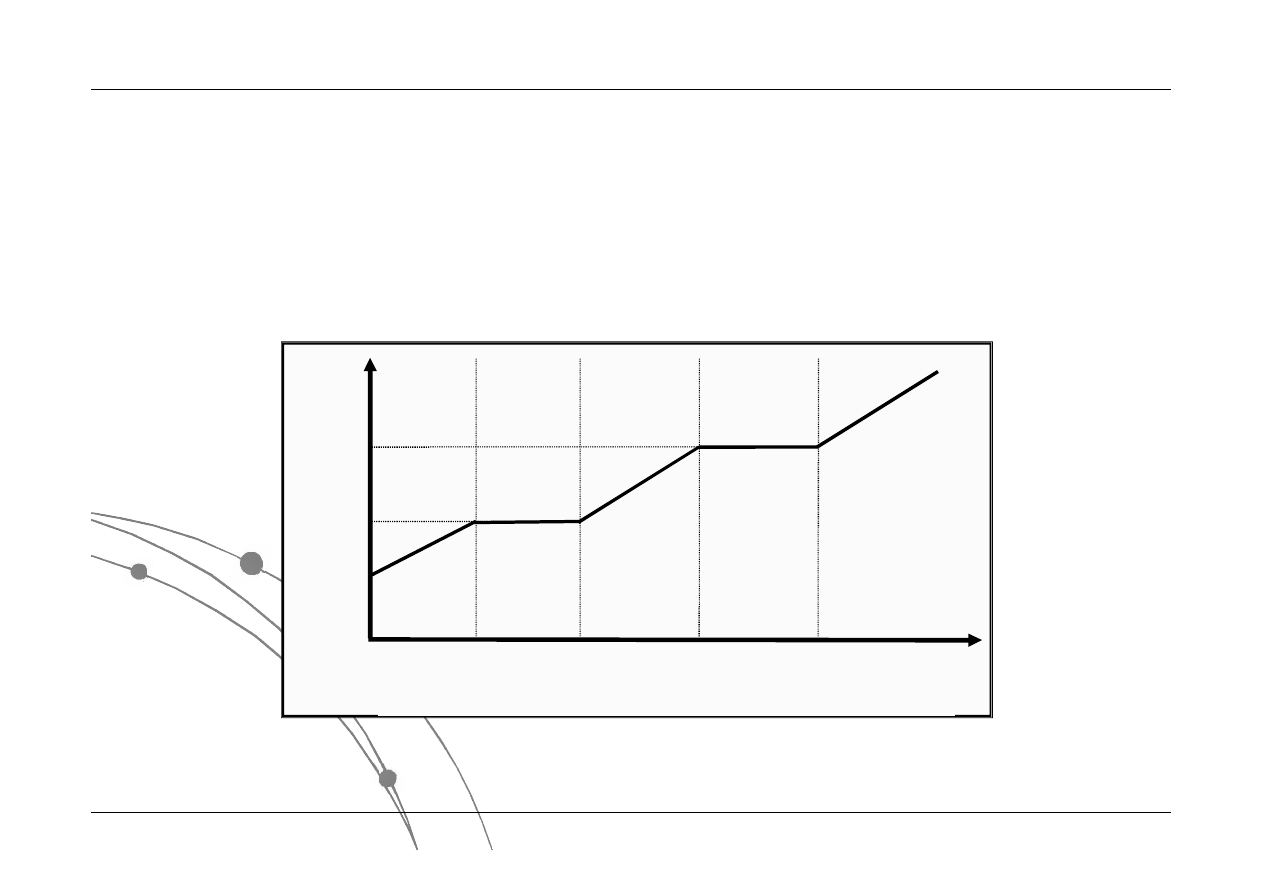
Nachylenie krzywej w dowolnym
punkcie jest równe wartości
pochodnej cząstkowej:
V
V
T
U
C
Wykład z Chemii Fizycznej str. 2.2 / 8
2.2. I zasada termodynamiki
Pierwsza zasada termodynamiki – rodzaje ciepła
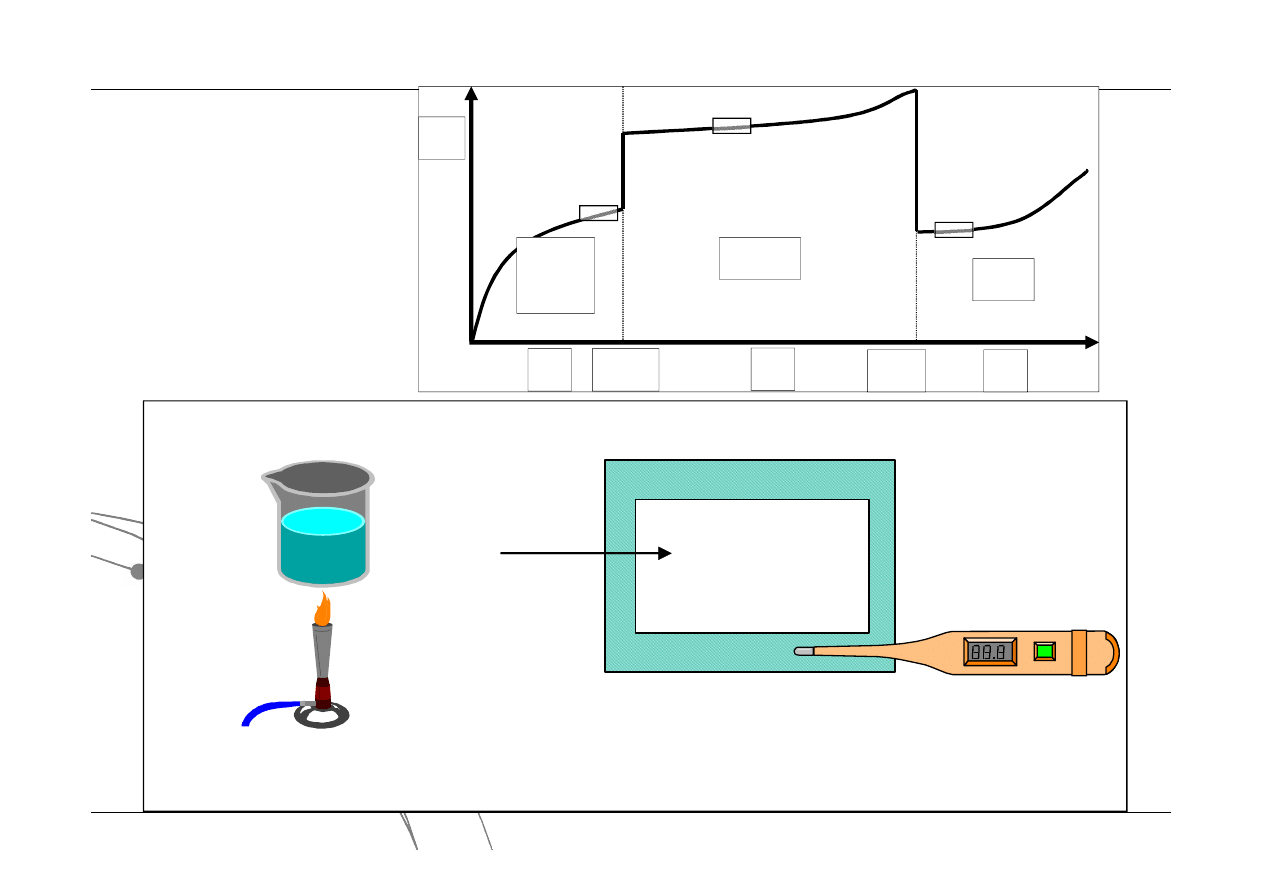
Ciepło przemiany
m
C
Q
topnienie
krystalizacja
parowanie
skraplanie
sublimacja
resublimacja
T
par
T
Ciało
stałe
Ciecz
Gas
T
krys
czas ogrzewania lub ilość dostarczonego ciepła
Zmiany temperatury w trakcie przemian fazowych:
Wykład z Chemii Fizycznej str. 2.2 / 9
2.2. I zasada termodynamiki
Pierwsza zasada termodynamiki – rodzaje ciepła
T
2
T
krys
T
1
T
3
T
par
C
P
Ciało
stałe
Ciecz
Gas
Zmiany pojemności
cieplnej w trakcie
przemian fazowych:
reakcja
Inicjowanie
Temp.
Bomba kalorymetyryczna
Proces izobaryczny
Proces izochoryczny
C
P
C
V
Warunki pomiaru ciepła
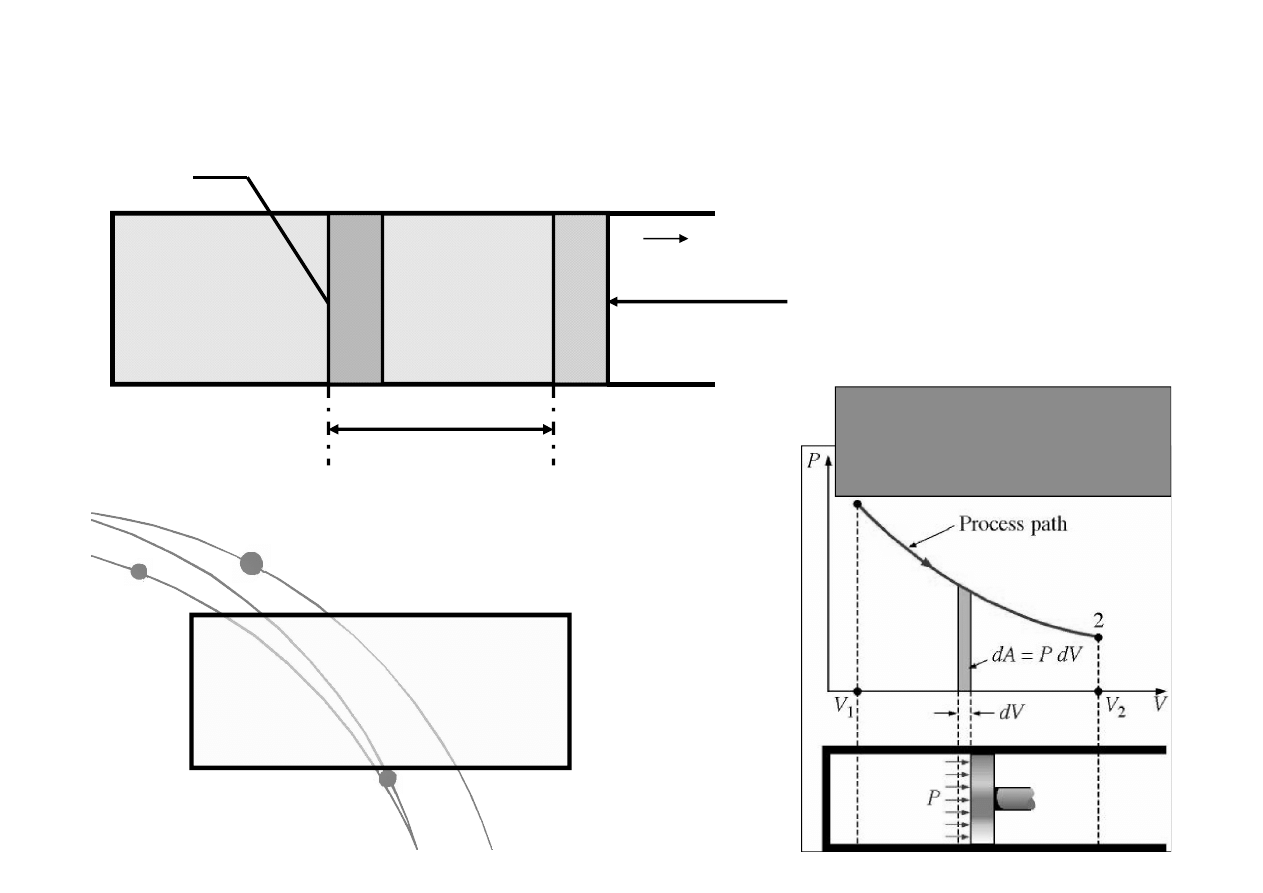
Praca objętościowa przeciwko
Praca objętościowa przeciwko
ciśnieniu zewnętrznemu
ciśnieniu zewnętrznemu
dl
A
F
z
= P
z
·A
dV
P
dl
F
dW
z
z
obj
dV=Adl
droga
z
obj
dV
P
W
trzeba znać funkcję p(V,T)
Interpretacja graficzna
skutków pracy pod
wpływem ciśnienia
Rodzaje pracy
Rodzaje pracy
Praca
Siła
uogólniona
Droga
uogólniona
Praca
elementarna
objętościowa
ciśnienie (P)
objętość (V)
-PdV
elektryczna
siła
elektromotoryczna
(E)
ładunek
(Q)
-EdQ
powierzchniowa
napięcie
powierzchniowe
()
powierzchnia
(A)
-dA
Wykład z Chemii Fizycznej str. 2.2 / 11
2.2. I zasada termodynamiki
Pierwsza zasada termodynamiki
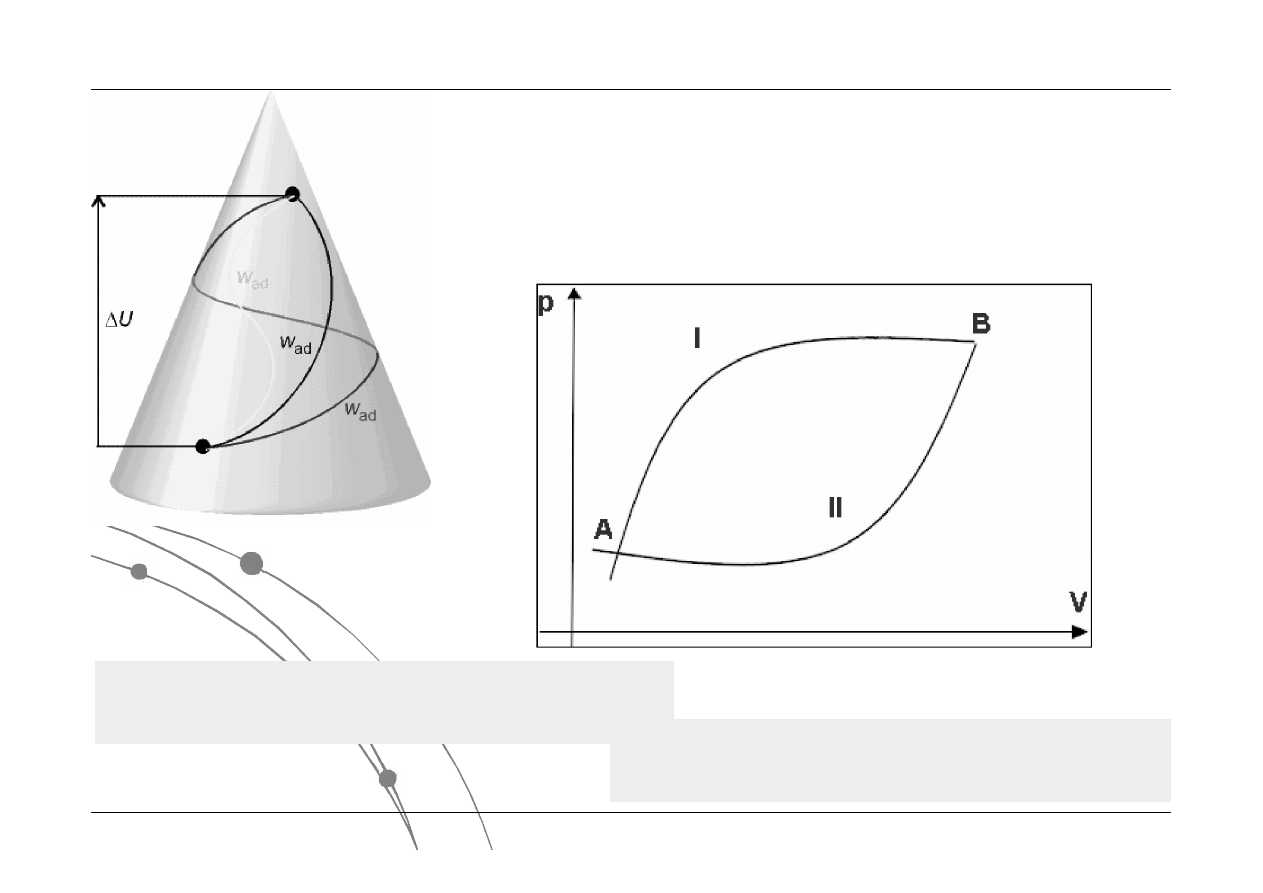
el
el
W
Q
dU
Energia wewnętrzna
jest funkcją stanu.
Wykład z Chemii Fizycznej str. 2.2 / 12
2.2. I zasada termodynamiki
Pierwsza zasada termodynamiki
Czy zmiana energia wewnętrzna,
ciepło i praca są funkcjami stanu?
Wielkość wykonanej pracy zależy od
drogi – nie jest funkcją stanu
Wielkość wymienionego ciepła zależy
od drogi – nie jest funkcją stanu
ENERGIA WEWNĘTRZNA
ENERGIA WEWNĘTRZNA
Zdolność układu do wykonywania
pracy lub oddania ciepła
Wykład z Chemii Fizycznej str. 2.2 / 13
2.2. I zasada termodynamiki
Konsekwencje pierwszej zasady termodynamiki
Energia wewnętrzna każdej fazy wewnętrznie zrównoważonej jest
ekstensywną funkcją niezależnych parametrów stanu (x
1
, x
2
, ... x
k
)
k
j
j
x
,
,x
x
U
U
2
1
i
i
U
U
Energia wewnętrzna układu jest sumą energii wewnętrznych faz
k
i
i
i
dx
x
U
dU
i
j
x
1
Zmiana energii wewnętrznej układu
w wyniku przemiany elementarnej
Zmiana energii wewnętrznej
układu w wyniku przemiany
skończonej A B
k
i
B
A
i
i
A
B
dx
x
U
U
U
U
i
j
x
1
ENERGIA WEWNĘTRZNA
ENERGIA WEWNĘTRZNA
)
,
,
(
V
T
U
U
v
V
C
T
U
,
V
r
V
T
Q
U
,
,
,
,
V
T
T
p
T
p
V
U
Zdolność układu do wykonywania
pracy lub oddania ciepła
Wykład z Chemii Fizycznej str. 2.2 / 14
2.2. I zasada termodynamiki
Konsekwencje pierwszej zasady termodynamiki
d
U
dV
V
U
dT
T
U
dU
V
T
T
V
,
,
,
ENTALPIA
Zdolność układu do wymiany ciepła –
zasobność cieplna
• Przeprowadzając przemianę termodynamiczną w warunkach
izochorycznych wymiana ciepła jest w jednoznaczny sposób skorelowana
ze zmianą energii wewnętrznej oraz temperatury.
• Ciała stałe i ciecze w znacznej liczbie przemian nie zmieniają swej
objętości. Warunki izochoryczne są, zatem zapewnione przez naturę tych
układów. Nawet przeprowadzając na nich przemiany w warunkach
izobarycznych, izochoryczność jest również spełniona.
• Gazy już takiej cechy nie posiadają i w warunkach izobarycznych
podczas wymiany ciepła i zmiany temperatury zachodzi proces sprężania
lub rozprężania. Oznacza to wykonanie pracy na otoczeniu lub na układzie.
•Zmiany energii wewnętrzne nie odpowiadają wówczas zmierzonemu
efektowi cieplnemu – jest on pomniejszony o wielkość wykonanej pracy.
Innymi słowy dostarczając ciepło temperatura nie rośnie tak bardzo jak w
przemianie izochorycznej.
W warunkach izobarycznych to zmiana entalpii jest miarą wymienionego
ciepła.
• Entalpia jest funkcją stanu.
Jaki jest sens wprowadzania nowej wielkości termodynamicznej?
Wykład z Chemii Fizycznej str. 2.2 / 15
2.2. I zasada termodynamiki
Konsekwencje pierwszej zasady termodynamiki
)
,
,
(
p
T
U
pV
U
H
df
d
H
dp
p
H
dT
T
H
dH
p
T
T
p
,
,
,
P
p
C
T
H
,
p
r
p
T
Q
H
,
,
,
,
p
T
T
V
T
V
p
H
ENTALPIA
Wykład z Chemii Fizycznej str. 2.2 / 16
2.2. I zasada termodynamiki
Konsekwencje pierwszej zasady termodynamiki
p
v
p
v
p
Q
Q
T
C
C
nRT
V
P
W
H
U
)
(
O ile różni się energia wewnętrzna od entalpii ?
Wykład z Chemii Fizycznej str. 2.2 / 17
2.2. I zasada termodynamiki
Konsekwencje pierwszej zasady termodynamiki
Podczas reakcji
)
(
3
4
2
)
(
2
)
(
3
2
)
(
3
staly
gaz
korubnd
SO
Al
SO
O
Al
)
(RT
n
Q
Q
p
V
∆n=0-3=-3
kJ
Q
V
572
298
314
.
8
)
3
(
579000
Wykład z Chemii Fizycznej str. 2.2 / 18
2.2. I zasada termodynamiki
Konsekwencje pierwszej zasady termodynamiki
Przykład
w T=298K i pod ciśnieniem 1 atm wydzieliło się 579kJ.
Obliczyć ciepło tej reakcji w stałej objętości.
Wyszukiwarka
Podobne podstrony:
2 Bilans energii Pierwsza zasada termodynamiki
2 Bilans energii Pierwsza zasada termodynamiki
Pierwsza zasada termodynamiki
Pierwsza zasada termodynamiki
Pierwsza zasada termodynamiki
3 PIERWSZA ZASADA TERMODYNAMIKI
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
I zasada Termodynamiki
Praca absolutna, ciepło właściwe, I zasada termodynamiki
18 entropia i II zasada termodynamiki
16 I zasada termodynamiki
I Zasada Termodynamiki rozszerzenie id 208487
zasada termodynamiki Nernsta (twierdzenie Nernsta)
16Pierwsza zasada termodynamiki
II Zasada Termodynamiki
więcej podobnych podstron