Postępy Biochemii 59 (1) 2013
83
Kamil Frankowski
Emilia Wilmowicz
Agata Kućko
Magdalena Sidłowska
Jacek Kęsy
Jan Kopcewicz
Katedra Fizjologii Roślin i Biotechnologii, Uni-
wersytet Mikołaja Kopernika, Toruń
Katedra Fizjologii Roślin i Biotechnologii,
Uniwersytet Mikołaja Kopernika, ul. Lwowska
1, 87-100 Toruń; tel.: (56) 611 44 61, faks: (56)
611 47 72, e-mail: emwil@umk.pl
Artykuł otrzymano 18 września 2012 r.
Artykuł zaakceptowano 14 grudnia 2012 r.
Słowa kluczowe: kwas abscysynowy, biosyn-
teza, katabolizm, regulacja metabolizmu
Wykaz skrótów: ABA — kwas abscysynowy;
AAO — oksydaza aldehydu ABA; CYP707A
— monooksygenaza cytochrom P450; DXP —
5-fosforan 1-deoksyksylulozy; DXS — syntaza
DXP; NCED — dioksygenaza 9-cis-epoksyka-
rotenoidów; NSY — syntaza neoksantyny; ZEP
— epoksydaza zeaksantyny
Podziękowania: Praca częściowo sfinanso-
wana z Programu Wieloletniego MRiRW nr
149/2011.
Metabolizm kwasu abscysynowego
WPROWADZENIE
K
was abscysynowy (ABA, ang.
abscisic acid) jest jednym z fitohormonów warunkujących
prawidłowy przebieg procesów wzrostu i rozwoju roślin, m. in. dojrzewanie i kiełko-
wanie nasion, otwieranie i zamykanie aparatów szparkowych, kwitnienie oraz odpowiedzi
na czynniki stresowe. W regulacji większości tych procesów istotną rolę odgrywa odpowied-
ni poziom endogennego ABA. Jego zawartość w poszczególnych tkankach jest wypadkową
tempa biosyntezy, oksydacyjnego rozkładu i tworzenia nieaktywnych pochodnych (najczę-
ściej estrowych). Postęp w badaniach dotyczących metabolizmu ABA był stosunkowo po-
wolny. Dopiero zastosowanie nowoczesnych technik biologii molekularnej pozwoliło na
zidentyfikowanie większości genów kodujących enzymy zaangażowane w regulację jego
biosyntezy i przyczyniło się do zrozumienia mechanizmów działania tego hormonu.
BIOSYNTEZA ABA
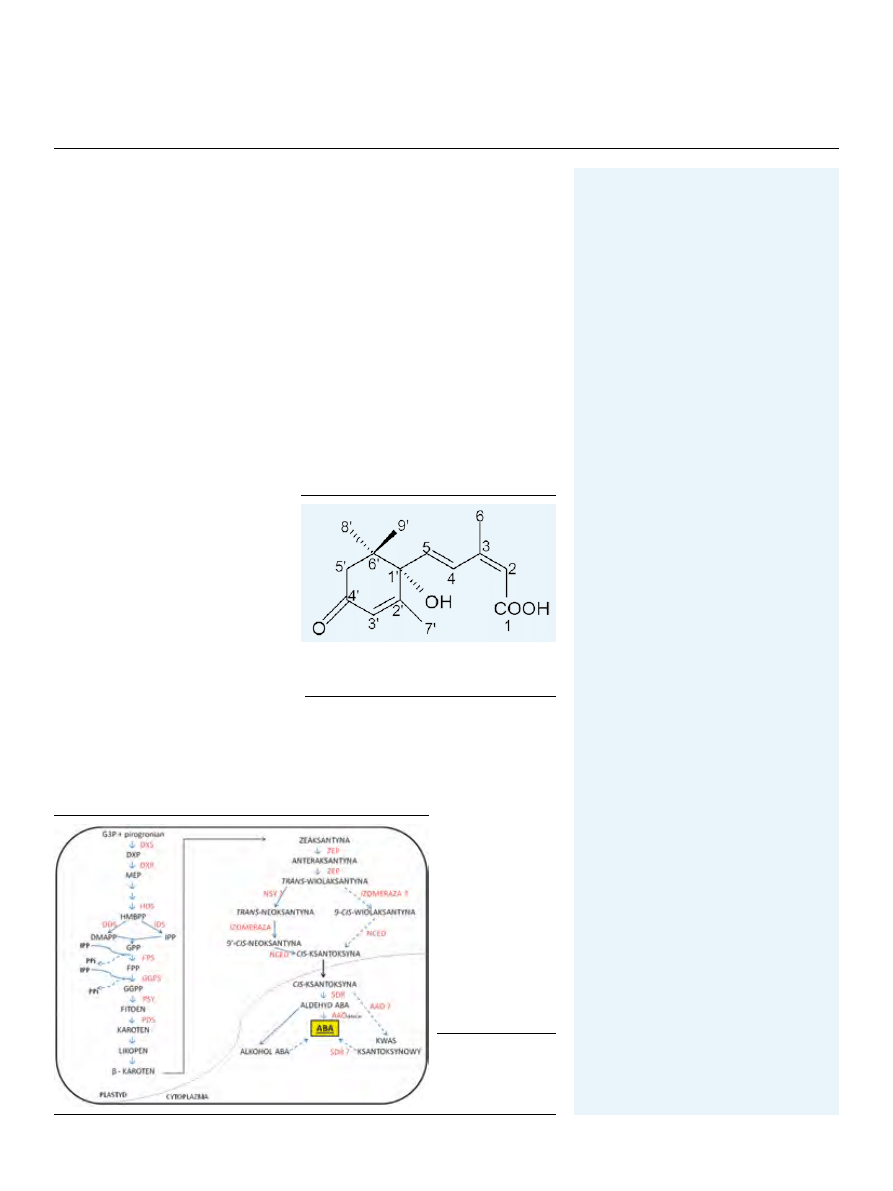
ABA zaliczany jest do seskwiterpenów (C
15
) posiadających dwa centra asyme-
trii. Ze względu na występowanie pierwszego z nich przy C1’ wyróżnia się dwa
enancjomery: (+)-ABA i (-)-ABA. Drugie centrum asymetrii stanowi łańcuch
2,4-pentadienowy, w którym grupa karboksylowa może występować w pozycji
cis lub trans. W roślinach dominującą formą ABA jest izomer (+)-2-cis-4-trans
ABA (Ryc. 1) [1].
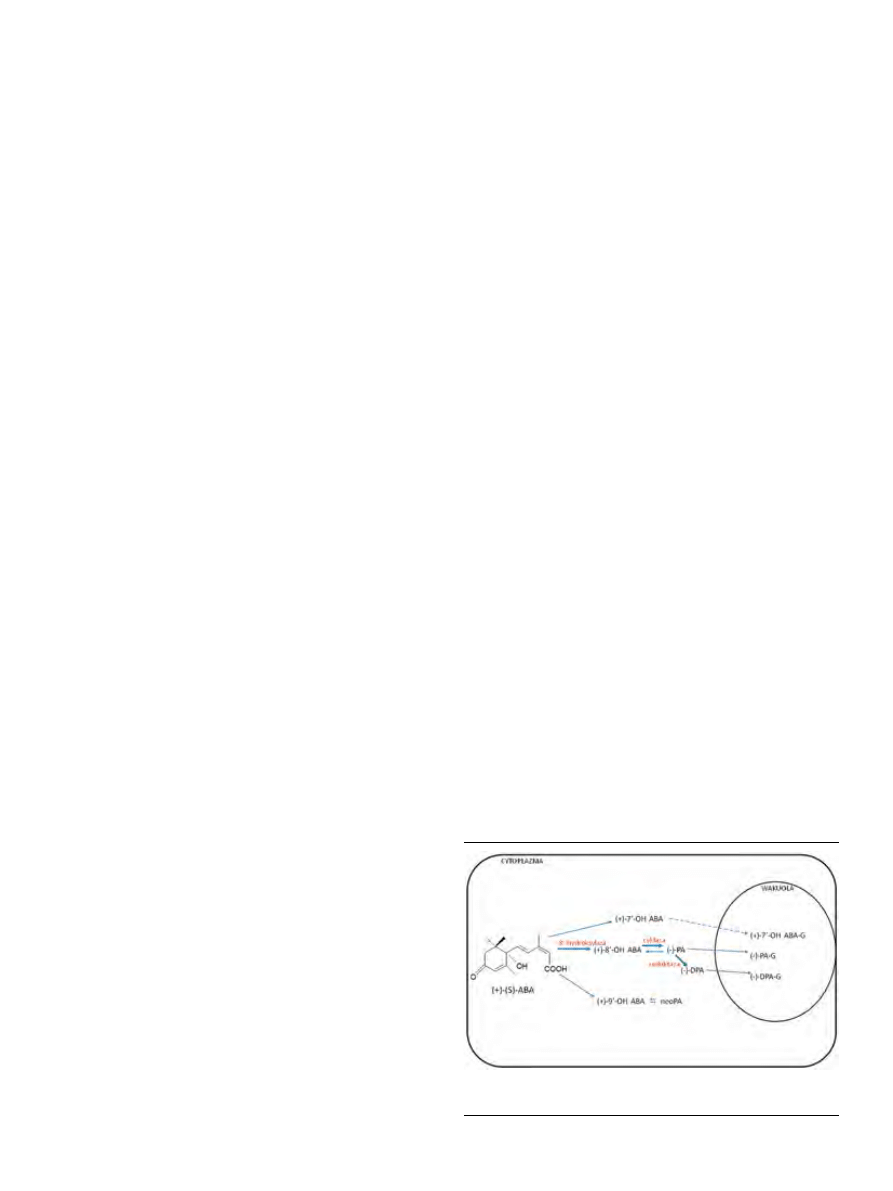
Prekursorem ABA, podobnie jak in-
nych izoprenoidów, jest pirofosforan
izopentenylu (IPP, ang. isopenthenyl
pyrophosphate). Do niedawna uważa-
no, że wszystkie izoprenoidy powsta-
ją na drodze przemian kwasu mewa-
lonowego (MVA, ang. mevalonic acid).
Obecnie wiadomo, że IPP może rów-
nież powstawać wskutek przemian
fosforanu metylerytritolu, zwanych
szlakiem MEP (ang. methylerythritiol
phosphate pathway), Rohmera, fosfora-
nu deoksyksylulozy (DOXP, ang. de-
oxyxylulose phosphate pathway) lub niemewalonianowym [2,3]. W odróżnieniu od
wielu eubakterii i alg, gdzie IPP jest syntetyzowany wyłącznie z MEP, u roślin
wyższych funkcjonują obydwa szlaki, MEP i MVA [2]. W cytoplazmie IPP jest
syntetyzowany z kwasu mewalonowego, natomiast w plastydach z fosforanu
metylerytritolu. W biosyntezie ABA u roślin kluczową rolę odgrywa szlak fosfo-
ranu deoksyksylu-
lozy (Ryc. 2).
5-fosforan 1-de-
o k s y k s y l u l o z y
(DXP, ang. 1-de-
oxyxylulose 5-pho-
sphate) powstaje
w plastydach z
pirogronianu
i
aldehydu
3-fos-
foglicerynowego
(G3P) przy udziale
Rycina 1. Struktura kwasu abscysynowego (izomer
(+)-2-cis-4-trans ABA). Szczegółowy opis w tekście (wg
[1] zmodyfikowane).
Rycina 2. Szlak biosynte-
zy kwasu abscysynowe-
go. Szczegółowy opis w
tekście (wg [6,8,9] zmo-
dyfikowane).

84
www.postepybiochemii.pl
syntazy DXP (DXS, ang. DXP synthase). Następnie, DXP w
reakcji katalizowanej przez reduktoizomerazę DXP (DXR,
ang. DXP reductoisomerase) ulega konwersji do 4-fosforanu
2-metylerytritolu (MEP, ang. 2-methylerythritol 4-phosphate),
z którego w serii dalszych przemian powstaje 4-pirofosforan
hydroksymetylbutenylu (HMBPP, ang. hydroxymethylbute-
nyl 4-diphosphate). Związek ten, może być przekształcony
w IPP przez syntazę pirofosforanu izopentenylu (IDS, ang.
isopenthyl diphosphate syntase) lub w jego izomer — pirofos-
foran dimetyloallilu (DMAPP, ang. dimethylallyl diphospha-
te) przy udziale syntazy izopentenylu dimetyloallilu (DDS,
ang. dimethylallyl diphosphate synthase). IPP i DMAPP są wy-
korzystywane do syntezy terpenoidów o większych masach
cząsteczkowych [2,3]. W wyniku kondensacji IPP z DMAPP
powstaje pirofosforan geranylu (GPP, ang. geranyl pyropho-
sphate, C
10
), a dołączanie kolejnych cząsteczek IPP prowadzi
do powstania odpowiednio pirofosforanu farnezylu (FPP,
ang. farnesyl pyrophosphate, C
15
) i pirofosforanu geranylo-
geranylu (GGPP, ang. geranylgeranylo pyrophosphate, C
20
).
W reakcji katalizowanej przez syntazę fitoenu (PSY, ang.
phytoene synthase) dwie cząsteczki GGPP kondensując ze
sobą tworzą fitoen (C
40
), z którego w obecności desaturazy
fitoenu (PDS, ang. phytoene desaturase) powstaje ζ-karoten.
W dalszych etapach ζ-karoten jest przekształcany kolejno
w likopen, β-karoten i ostatecznie zeaksantynę, która jest
bezpośrednim prekursorem ABA. Przy udziale epoksyda-
zy zeaksantyny (ZEP, ang. zeaxanthin epoxidase) powstaje
trans-wiolaksantyna, która ulega konwersji do 9-cis-wio-
laksantyny lub 9’-cis-neoksantyny [2,4]. W powstawanie
cis-izomerów wiolaksantyny i neoksantyny są prawdopo-
dobnie zaangażowane dwa enzymy: syntaza neoksantyny
(NSY, ang. neoxanthin synthase) oraz izomeraza [4,5]. Ostat-
nim etapem biosyntezy ABA zachodzącej w plastydach jest
przekształcenie 9-cis-wiolaksantyny i 9’-cis-neoksantyny
w cis-ksantoksynę przez dioksygenazę 9-cis-epoksykaro-
tenoidową (NCED, ang. 9-cis-epoxycarotenoid dioxygenases).
Prawdopodobnie cis-ksantoksyna migruje z plastydów do
cytoplazmy, gdzie ulega dalszym przemianom prowadzą-
cym do powstania ABA [2,6-9].
W cytoplazmie ksantoksyna ulega konwersji do alde-
hydu abscysynowego, który jest następnie utleniany do
ABA. Reakcje te są katalizowane przez dehydrogenazę/
reduktazę alkoholową (SDR, ang. short-chain dehydrogenase/
reductase) oraz oksydazę aldehydu abscysynowego (AAO,
ang. abscisic aldehyde oxidase) [10]. W badaniach prowadzo-
nych na dojrzewających owocach awokado wykazano, że
cis-ksantoksyna może być również przekształcona w kwas
ksantoksynowy, z którego powstaje ABA. Dodatkowo, w
przypadku braku możliwości przemiany aldehydu abscy-
synowego w ABA przez niektóre mutanty, zostaje on zre-
dukowany do alkoholu abscysynowego, z którego następ-
nie powstaje ABA. Opisane różnice dotyczące powstawania
ABA wynikają prawdopodobnie z miejsca jego biosyntezy
oraz stadium rozwojowego rośliny.
ENZYMY ZAANGAŻOWANE W BIOSYNTEZę ABA
Pierwszym zidentyfikowanym enzymem bezpośrednio
zaangażowanym w biosyntezę ABA była epoksydaza zeak-
santyny. Geny kodujące ten enzym zidentyfikowano m. in.
u A. thaliana, Nicotiana blumbaginifolia i Oryza sativa [4]. ZEP
koduje białko podobne do monooksygenaz wiążących FAD,
których kofaktorem jest ferredoksyna. Sekwencje podobne
do monooksygenaz są niezbędne dla aktywności ZEP [11],
gdyż mutacje w ich obrębie prowadzą do akumulacji ze-
aksantyny i obniżenia poziomu ABA, a mutanty charakte-
ryzują się zaburzonym turgorem i wytwarzają nasiona ze
zniesionym stanem spoczynku.
Gen kodujący syntazę neoksantyny (NSY), enzym katali-
zujący reakcję przekształcania wiolaksantyny w neoksanty-
nę, dotychczas zidentyfikowano jedynie u pomidora i ziem-
niaka [12]. Ze względu na podobieństwo NSY do cyklazy
β-likopenu (LCYb, ang. lycopene β-cyclase) zaangażowanej w
przekształcanie tego związku w β-karoten, jak również za-
obserwowanej in vitro zdolności konwersji wioloksantyny
w neoksantynę przyjmuje się, że enzym ten może wykazy-
wać dwojaką aktywność [13]. U A. thaliana sklonowano gen
ABA4, którego produkt jest prawdopodobnie bezpośrednio
zaangażowany w tworzenie izomerów neoksantyny [4].
Niemniej jednak, dane te muszą zostać zweryfikowane.
NCED, kodujący kluczowy enzym w regulacji biosyntezy
ABA, po raz pierwszy zidentyfikowano w genomie mutan-
ta kukurydzy viviparous14 i oznaczono jako VP14 (Tab. 1)
[14]. Sekwencje kodujące NCED zidentyfikowano również
u innych gatunków roślin, m. in. Phaseolus vulgaris, Vigna
unguiculata, Persea americana, Lycopersicon esculentum [15].
U A. thaliana poznano aż 9 genów NCED, z których jedy-
nie 5 (At-NCED2, 3, 5, 6, 9) koduje produkty zaangażowa-
ne w biosyntezę ABA [16]. Jak wykazano, ekspresja genów
NCED jest skorelowana z endogennym poziomem ABA
[17]. Pokazano również, że rekombinowane białko VP14 jest
specyficzne względem izomerów cis epoksyksantofili (9-cis-
-wiolaksantyny i 9’-cis-neoksantyny), a ich przekształcenie
w ksantoksynę wymaga obecności tlenu i jonów żelaza [14].
Dla aktywności katalitycznej NCED istotne są również czte-
ry ewolucyjnie zachowywane reszty His. Mimo że białka
Tabela 1. Mutanty biosyntezy kwasu abscysynowego.
Enzym
Gatunek
Mutant
ZEP
A. thaliana
aba1, npq2, los6
N. plumbaginifolia
aba2
O. sativa
osaba1
NCED
Z. mays
vp14
L. esculentum
notabilis
A. thaliana
nced3
SDR1
A. thaliana
aba2, gin1, isi4, sis4
AAO
A. thaliana
aba3, aao3
H. vulgare
nar2a
L. esculentum
flacca
N. plumbaginifolia
aba1
L. esculentum
sitiens
Sulfuraza MoCo
N. plumbaginifolia
aba1
H. vulgare
nar2A
Postępy Biochemii 59 (1) 2013
85
NCED zawierają sekwencje skierowujące je do plastydów,
to jednak, ze względu na specyficzne potranslacyjne mo-
dyfikacje, charakteryzują się one zróżnicowaną lokalizacją
wewnątrz tych organelli [18]. U A. thaliana NCED2, 3 i 6 zlo-
kalizowano zarówno w stromie, jak i błonach tylakoidów.
NCED5 występuje wyłącznie jako białko błonowe, a NCED9
jest rozpuszczalnym białkiem stromy. Takie rozmieszczenie
poszczególnych izoform tego enzymu może być wynikiem
zróżnicowanej funkcji, jaką pełnią te białka na poszczegól-
nych etapach wzrostu i rozwoju roślin.
U A. thaliana enzym katalizujący reakcję powstawania
aldehydu ABA z cis-ksantoksyny jest kodowany przez po-
jedynczy gen AtABA2. AtABA2 należy do rodziny dehy-
drogenaz/reduktaz SDR zależnych od NAD i podobnie jak
one, ma budowę multimeryczną [10].
W genomie rzodkiewnika pospolitego zidentyfikowano
4 sekwencje kodujące oksydazy aldehydu ABA (AAO1-4)
[19]. Jak dotąd wykazano, że jedynie AAO3 koduje funk-
cjonalny enzym uczestniczący w przekształcaniu aldehydu
ABA w kwas abscysynowy. Niemniej jednak, w organizmie
A. thaliana musi funkcjonować również inna oksydaza, gdyż
mutanty aao3 kiełkują w podobnym czasie do roślin typu
dzikiego. AAO do swojej aktywności wymaga obecności
kofaktora MoCo (ang. molybdenum cofactor) [10]. Mutacje
w genach kodujących enzymy zaangażowane w syntezę
MoCo — sulfurazy MoCo (AtABA3 u A. thaliana, FLACCA
u pomidora i ABA1 u tytoniu) — skutkują deficytem ABA
[20].
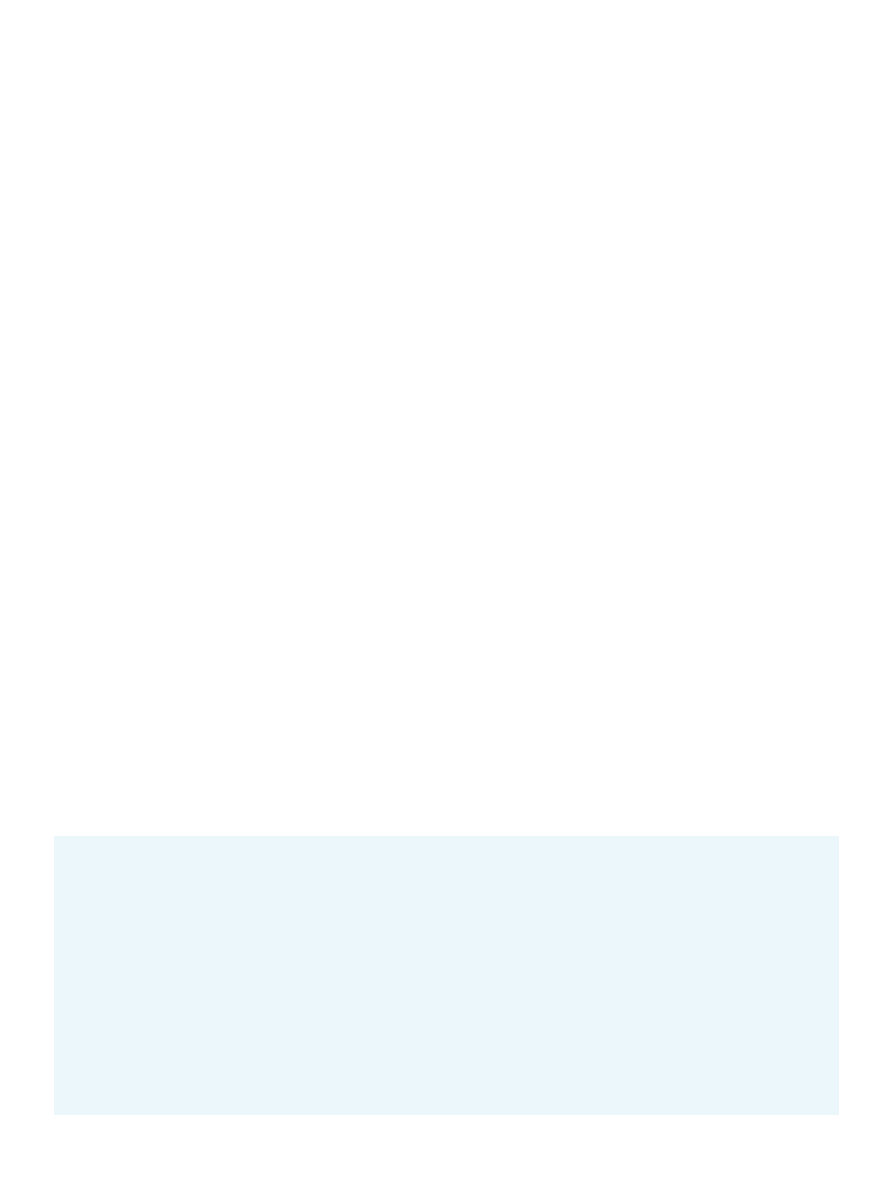
KATABOLIZM ABA
Katabolizm ABA u roślin wyższych polega na jego nie-
odwracalnej degradacji wskutek hydroksylacji lub tworze-
niu nieaktywnych połączeń, np. z glukozą [1]. Hydroksy-
lacji może ulegać jedna z grup metylowych w pozycji C7’,
C8’ lub C9’. Dominującym kierunkiem przemian jest two-
rzenie hydroksylowej pochodnej przy węglu C8’ (8’-OH
ABA). Reakcja ta jest katalizowana przez 8’-hydroksylazę
ABA (monooksygenaza cytochrom P450), która u A. thaliana
jest kodowana przez 4 geny CYP707A [21]. Powstała 8’-hy-
droksy pochodna ABA zachowuje znaczącą aktywność fi-
zjologiczną [1]. W warunkach laboratoryjnych wykazano,
że CYP707A jest zaangażowane w powstawanie wyłącznie
8’-OH ABA oraz że, 98% tego związku ulega spontanicznej
izomeryzacji do kwasu fazeinowego (PA, ang. phaseic acid).
Nie można jednak wykluczyć, iż konwersja 8’-OH ABA in
vivo wymaga aktywności enzymatycznej [21]. PA w obecno-
ści reduktazy PA (ang. phaseic acid reductase) jest przekształ-
cany w kwas dihydrofazeinowy (DPA, ang. dihydrophaseic
acid), z którego ostatecznie powstaje kwas epi-dihydrofa-
zeinowy (epi-DPA). PA oraz DPA charakteryzują się niską
aktywnością biologiczną i są uważane za nieaktywne me-
tabolity ABA, gdyż białka wiążące ABA (ang. ABA binding
proteins) z jabłka oraz warstwy aleuronowej ziarniaków
pszenicy nie są zdolne do ich wiązania [22]. 7’-OH ABA i
9’-OH ABA (oraz jego izomer neoPA) są najrzadziej spoty-
kanymi hydroksylowymi pochodnymi ABA u roślin [23]. O
ile 7’-OH ABA występuje u licznych gatunków roślin, m.
in. Pisum sativum, Solanum lycopersicum, Hordeum vulgare i
A. thaliana, to obecność 9’-OH ABA i neoPA potwierdzono
jedynie w nasionach Brassica napus (Ryc. 3) [24].
Inaktywacja ABA może również zachodzić wskutek
tworzenia połączeń z glukozą (ABA-GE) [25]. Podobnym
przemianom mogą także podlegać 8’-OH ABA, PA, DPA i
epi-DPA. Reakcja powstawania ABA-GE jest katalizowana
przez glukozylotransferazę (AOG, ang. glucosylotransfera-
se), która wykazuje szeroką specyficzność substratową w
porównaniu do innych enzymów metabolizmu ABA. Jak
wykazano u pomidora, AOG preferencyjnie tworzy połą-
czenia glukozy z 2-trans-ABA, natomiast znacznie rzadziej
z naturalnym 2-cis-ABA [26]. Jako substraty enzym ten
może również wykorzystywać analogi ABA, tj. (-)-R-ABA
lub kwas cynamonowy. Nie pośredniczy jednak w gluko-
zylacji PA i DPA, co może wskazywać na istnienie innego
mechanizmu [27]. Pochodne ABA gromadzą się w waku-
olach komórek starzejących się roślin i nie wykazują istotnej
aktywności fizjologicznej [28]. Dotąd, molekularny mecha-
nizm transportu ABA-GE, jak i samego ABA przez błony
plazmatyczne (tonoplast i ER) nie został w pełni wyjaśniony
[25]. Niemniej jednak, ABA-GE może przemieszczać się do
ER (np. w odpowiedzi na dehydratację), gdzie przy udziale
β-glukozydaz następuje uwolnienie aktywnego hormonu.
Transport ABA-GE w soku ksylemowym stanowi również
istotny element przemieszczania nieaktywnego hormonu
na duże odległości [25,29].
REGULACJA METABOLIZMU ABA
Dane dotyczące regulacji metabolizmu ABA pochodzą
głównie z badań poziomu transkrypcji genów kodujących
enzymy zaangażowane w proces jego syntezy i degradacji.
Aktywność tych genów zmienia się pod wpływem różnych
czynników wewnętrznych i środowiskowych, a endogenny
poziom ABA jest wypadkową tempa jego syntezy oraz kata-
bolizmu. Nadrzędną rolę w regulacji biosyntezy ABA przy-
pisuje się NCED, którego ekspresja jest ściśle skorelowana
z poziomem hormonu [6]. Z kolei, kluczowym enzymem
regulującym jego katabolizm jest 8’-hydroksylaza ABA [21].
Kontrola poziomu ABA nie jest ograniczona jedynie do tych
specyficznych etapów jego metabolizmu. W nasionach i
siewkach A. thaliana wykazano, że nadekspresja innych ge-
nów kodujących enzymy szlaku MEP (np. DXS, PSY, ZEP)
prowadzi do wzmożonej akumulacji tego hormonu.
Rycina 3. Metabolizm kwasu abscysynowego. Szczegółowy opis w tekście (wg
[2,27] zmodyfikowane).

86
www.postepybiochemii.pl
Czynniki abiotyczne (np. susza, zasolenie, zacienienie,
chłód) w różny sposób modyfikują aktywność genów/en-
zymów uczestniczących w metabolizmie ABA [30-33]. U
A. thaliana wskutek dehydratacji podnosi się poziom eks-
presji AtNCED3, AAO3, AtABA3 i AtZEP [25]. Po poda-
niu glukozy następuje wzrost aktywności transkrypcyjnej
genów AtABA2, AtZEP, AAO3, SDR1 i skorelowanej z nią
akumulacji ABA. Podobne efekty obserwowano również u
kukurydzy, pomidora, awokado i fasoli. Stres osmotyczny
indukuje również ekspresję wszystkich genów CYP707A.
Dodatkowo, aktywność transkrypcyjna CYP707A3 jest re-
gulowana przez gibereliny i brassinolid, wskazując na po-
tencjalne miejsce oddziaływania tych hormonów. Podczas
dojrzewania i kiełkowania nasion zarodek podlega proce-
som dehydratacji i uwodnienia, którym towarzyszą zmia-
ny zawartości ABA. U A. thaliana poziom ABA w zarodku
osiąga maksymalną wartość w kilka dni po zapyleniu (~10
dni), przy czym nie jest on syntetyzowany de novo, a pocho-
dzi z rośliny macierzystej [25]. Z kolei, synteza tego hormo-
nu de novo determinuje przejście nasion w stan spoczynku.
Jak dotąd, nie ustalono czy ABA transportowany z rośliny
macierzystej jest niezbędny do rozwoju nasion czy stanowi
tylko sygnał inicjujący syntezę ABA w zarodku. Natomiast,
warunkiem inicjacji kiełkowania nasion jest zahamowanie
biosyntezy ABA oraz aktywacja jego katabolizmu [34,35].
Jak wykazano u A. thaliana, podczas pierwszych 6 godzin
imbibicji wzrasta ekspresja CYP707A2, która jest skorelowa-
na ze spadkiem ilości ABA i podniesieniem poziomu PA.
Podobny efekt obserwowano u H. vulgare, L. sativa i Pinus
strobus [36]. Z kolei, CYP707A3 i CYP707A1 są zaangażo-
wane nie tylko w sam proces kiełkowania nasion, ale także
wczesne etapy rozwoju siewki [21]. Regulacja biosyntezy
ABA w zarodku może odbywać się na wielu poziomach,
np. u tytoniu — poprzez regulację ekspresji NtZEP, u po-
midora — LeNCED1, a u rzodkiewnika — poprzez AtZEP,
AtNCED5 i 6 [10,25].
Mechanizm regulacji ekspresji genów zaangażowanych
w biosyntezę ABA jest nie tylko charakterystyczny dla po-
szczególnych organów i stadiów rozwojowych rośliny, ale
jest także specyficzny gatunkowo. U A. thaliana aktywność
transkrypcyjna ZEP utrzymuje się na niskim poziomie,
a susza i zasolenie silnie stymulują jego ekspresję [31]. W
odróżnieniu od rzodkiewnika, u tytoniu i pomidora stres
osmotyczny nie podnosi poziomu transkryptu tego genu.
Wydaje się, że w tkankach fotosyntetyzujących (bogatych
w epoksykarotenoidy) ekspresja ZEP nie ma wpływu na
tempo biosyntezy ABA, podczas gdy w korzeniach (niski
poziom epoksykarotenoidów) może być czynnikiem limi-
tującym ten proces [7]. ABA może również sam regulować
swój endogenny poziom, na który wpływ ma stabilność
transkryptów genów zaangażowanych w jego metabolizm
(np. AAO3, AtABA3, AtNCED3) [21]. Wykazano że, podanie
ABA stymuluje ekspresję ZEP i AAO3 u A. thaliana, nato-
miast u jęczmienia podnosi syntezę 8’-hydroksylazy ABA.
W mechanizmie adaptacyjnym roślin na stres wzrasta po-
ziom ABA wskutek jego syntezy i/lub uwalniania z nieak-
tywnych połączeń (wzrost aktywności β-D-glukozydazy).
Ten podwyższony poziom hormonu jest sygnałem, który
na zasadzie pętli pozytywnego sprzężenia zwrotnego sty-
muluje swoją dalszą biosyntezę [25].
EFEKTY FIZJOLOGICZNE ABA
Efekty fizjologiczne wywoływane przez ABA wynikają
z jego wpływu na przepuszczalność błon komórkowych i
subkomórkowych, a także na zdolność do modyfikacji eks-
presji genów [2,37,38]. ABA jest zaliczany do grupy inhibi-
torów wzrostu i rozwoju roślin, gdyż w wielu procesach
jest antagonistą auksyn, giberelin i cytokinin [40]. Pełni on
istotną rolę w regulacji wszystkich faz rozwojowych ro-
ślin, m. in.: embriogenezy, spoczynku nasion, kiełkowaniu,
grawitropizmie korzeni, kwitnieniu, dojrzewaniu nasion i
owoców, starzeniu i odrzucaniu organów oraz zamykaniu
aparatów szparkowych [9,16,41-44]. ABA jest również waż-
nym hormonem stresowym uczestniczącym w adaptacji ro-
ślin do zmieniających się warunków środowiskowych, jak:
długotrwałe zacienienie, podtopienie, zasolenie czy chłód
[7,30-33,45-47].
Kwas abscysynowy może w dwojaki sposób wpływać
na rozwój zarodka. W początkowym etapie embriogenezy
stymuluje jego wzrost i dojrzewanie, a w późniejszych sta-
diach hamuje ten proces, przeciwdziałając aktywności gibe-
relin [16,34,40,48]. Podwyższony poziom ABA warunkuje
również stan spoczynku nasion. Mechanizm ten najlepiej
poznano w ziarniakach zbóż, u których ABA hamuje wy-
twarzanie α-amylazy w warstwie aleuronowej. W procesie
tym istotne jest zablokowanie przekształcania ABA w kwas
fazeinowy (PA), co potwierdzono w badaniach z zastoso-
waniem fluridonu (inhibitor syntezy karotenoidowych pre-
kursorów ABA). Z kolei, warunkiem niezbędnym do inicja-
cji kiełkowania nasion jest spadek poziomu ABA wskutek
zahamowania jego biosyntezy de novo oraz zwiększenia
tempa katabolizmu (wzrost ekspresji genów CYP707A).
Wyniki badań prowadzonych na fotoperiodycznie wraż-
liwych gatunkach roślin potwierdziły również zaangażo-
wanie ABA w regulację indukcji kwitnienia. Hormon ten
jest uważany za inhibitor tego procesu, zarówno u roślin
długo-, jak i krótkodniowych. Niemniej jednak, u pewnych
gatunków roślin, w warunkach niepełnej indukcji, ABA
może stymulować kwitnienie. Dotychczas, nie określono
szczegółowego mechanizmu działania tego hormonu, gdyż
jest on wypadkową stopnia indukcji generatywnej, warun-
ków środowiskowych oraz interakcji z innymi fitohormona-
mi (m. in. giberelinami, etylenem) [42,43].
W aktywnych metabolicznie tkankach niekorzystne
czynniki środowiskowe mogą powodować dehydratację
komórek. Za utrzymanie osmotycznej homeostazy w ro-
ślinie odpowiedzialny jest m. in. ABA, który reguluje roz-
warcie aparatów szparkowych [37,44]. Aktywuje on szybkie
oraz wolne kanały jonowe transportujące Cl
-
na zewnątrz
komórki, co prowadzi do depolaryzacji błony cytoplazma-
tycznej i aktywacji kanałów K
+
. Wypływ Cl
-
i K
+
z komór-
ki powoduje spadek turgoru komórek szparkowych i za-
mknięcie aparatów szparkowych. Dotychczas przyjmowa-
no, że aktywacja kanałów anionowych przez ABA jest ele-
mentem wystarczającym do prawidłowego działania pomp
protonowych oraz depolaryzacji błon cytoplazmatycznych.
Jednakże, na podstawie badań prowadzonych na mutancie
ost2 (ang. open stomata2) A. thaliana wykazano, że aktywacja
kanałów anionowych, poza ABA, wymaga również obniże-

Postępy Biochemii 59 (1) 2013
87
nia aktywności specyficznej H
+
-ATPazy (AHA1) [49]. Do-
kładna rola ABA w tym procesie nie jest jednak znana.
PODSUMOWANIE
Skomplikowany szlak biosyntezy kwasu abscysynowe-
go sprawia, że mechanizmy regulujące jego zawartość w
komórce nie są w pełni poznane. Biosynteza ABA zacho-
dzi w plastydach i cytoplazmie, chociaż jego metabolity
występują również w innych przedziałach komórkowych
(m. in. wakuolach, ER) i mogą stanowić formę transpor-
tową hormonu (np. ABA-GE). Przedstawiona w niniejszej
pracy wielopoziomowa regulacja biosyntezy ABA wynika
z udziału tego hormonu w kontroli wielu procesów fizjo-
logicznych: od kiełkowania nasion, kwitnienie, po reakcje
roślin na bodźce środowiskowe. Dodatkowo, w procesy te
wpisują się oddziaływania z innymi hormonami oraz au-
toregulacja. Z pewnością poznanie tych złożonych współ-
zależności przyczyni się do wyjaśnienia mechanizmów, za
pomocą których rośliny kontrolują poziom tego hormonu
i reagują na zmieniające się warunki w sposób czasowo i
przestrzennie specyficzny.
PIŚMIENNICTWO
1. Kitahata N, Asami T (2011) Chemical biology of abscisic acid. J Plant
Res 124: 549-557
2. Hauser F, Waadt R, Schroeder JI (2011) Evolution of abscisic acid syn-
thesis and signaling mechanisms. Curr Biol 21: 346-355
3. Marciniak K, Kęsy J, Tretyn A, Kopcewicz J (2012) Gibereliny — struk-
tura, biosynteza i dezaktywacja u roślin. Postepy Biochem 58: 14-25
4. North HM, De Almeida A, Boutin JP, Frey A, To A, Botran, Sotta B,
Marion-Poll A (2007) The Arabidopsis ABA-deficient mutant ba4 dem-
onstrates that the major route for stress-induced ABA accumulation is
via neoxanthin isomers. Plant J 50: 810-824
5. Wasilewska A, Vlad F, Sirichandra C, Redko Y, Jammes F, Valon C, dit
Frey NF, Leung J (2008) An update on abscisic acid signaling in plants
and more. Mol Plant 1: 1-19
6. Endo A, Sawada Y, Takahashi H, Okamoto M, Ikegami K, Koiwai H,
Seo M, Toyomasu T, Mitsuhashi W, Shinozaki K, Nakazono M, Ka-
miya Y, Koshiba T, Nambara E (2008) Drought induction of Arabidop-
sis 9-cis-epoxycarotenoid dioxygenase occurs in vascular parenchyma
cells. Plant Physiol 147: 1984-1993
7. Ikegami K, Okamoto M, Seo M, Koshiba T (2009) Activation of abscisic
acid biosynthesis in the leaves of Arabidopsis thaliana in response to wa-
ter deficit. J Plant Res 122: 235-243
8. Hu B, Wan X-R, Liu X-H, Guo D-L, Li L (2010) Abscisic acid (ABA)-
mediated inhibition of seed germination involves a positive feedback
regulation of ABA biosynthesis in Arachis hypogaea L. African J Biotech
9: 1578-1586
9. Kanno Y, Jikumaru Y, Hanada A, Nambara E, Abraham SR, Kamiya
Y, Seo M (2010) Comprehensive hormone profiling in developing Ara-
bidopsis seeds: examination of the site of abscisic acid biosynthesis, ab-
scisic acid transport and hormone interactions. Plant Cell Physiol 51:
1988-2001
10. Seiler C, Harshavardhan VT, Rajesh K, Reddy PS, Strickert M, Rol-
letschek H, Scholz U, Wobus U, Sreenivasulu N (2011) ABA biosynthe-
sis and degradation contributing to ABA homeostasis during barley
seed development under control and terminal drought-stress condi-
tions. J Exp Bot 62: 2615-2632
11. Kuczyńska P, Latowski D, Niczyporuk S, Olchawa-Pajor M, Jahns P,
Gruszecki WI, Strzałka K (2012) Zeaxanthin epoxidation — an in vitro
approach. Acta Biochim Pol 59: 105-107
12. Ruiz-Sola MÁ, Rodríguez-Concepción M (2012) Carotenoid biosyn-
thesis in Arabidopsis: a colorful source: The Arabidopsis Book, (red) The
American Society of Plant Biologists, str. 158
13. Clotault J, Peltier D, Berruyer R, Thomas M, Briard M, Geoffriau E
(2008) Expression of carotenoid biosynthesis genes during carrot root
development. J Exp Bot. 59: 3563-3573
14. Messing SA, Gabelli SB, Echeverria I, Vogel JT, Guan JC, Tan BC, Klee
HJ, McCarty DR, Amzel LM (2010) Structural insights into maize vi-
viparous14, a key enzyme in the biosynthesis of the phytohormone
abscisic acid. Plant Cell 22: 2970-2980
15. Sun L, Sun Y, Zhang M, Wang L, Ren J, Cui M, Wang Y, Ji K, Li P, Li Q,
Chen P, Dai S, Duan C, Wu Y, Leng P (2011) Suppression of 9-cis-epo-
xycarotenoid dioxygenase, which encodes a key enzyme in abscisic
acid biosynthesis, alters fruit texture in transgenic tomato. Plant Phy-
siol 158: 283-298
16. Finkelstein R, Reeves W, Ariizumi T, Steber C (2008) Molecular aspects
of seed dormancy. Annu Rev Plant Biol 59: 387-415
17. Guo DL, Liang JH, Li L (2009) Abscisic acid (ABA) inhibition of lateral
root formation involves endogenous ABA biosynthesis in Arachis hy-
pogaea L. Plant Growth Regul 58: 173-179
18. Chen HC, Hwang SG, Chen SM, Shii CT, Cheng WH (2011) ABA-me-
diated heterophylly is regulated by differential expression of 9-cis-epo-
xycarotenoid dioxygenase 3 in lilies. Plant Cell Physiol 52: 1806-1821
19. Zdunek-Zastocka E (2008) Molecular cloning, characterization and
expression analysis of three aldehyde oxidase genes from Pisum sati-
vum L. Plant Physiol Biochem 46: 19-28
20. Huang PM, Chen JY, Wang SJ (2009) Tissue-specific regulation of rice
molybdenum cofactor sulfurase gene in response to salt stress and
ABA. Acta Physiol Plant 31: 545-551
21. Okamoto M, Tanaka Y, Abrams SR, Kamiya Y, Seki M, Nambara E
(2009) High humidity induces abscisic acid 8’-hydroxylase in stomata
and vasculature to regulate local and systemic abscisic acid responses
in Arabidopsis. Plant Physiol 149: 825-834
22. Sannohe Y, Gomi S, Murata T, Ohyama M, Yonekura K, Kanegae M,
Koga J (2011) A new glycosylated dihydrophaseic acid from cacao
germs (Theobroma cacao L.). Biosci Biotechnol Biochem. 75: 1606-1607
23. Suttle JC, Abrams SR, De Stefano-Beltrán L, Huckle LL (2012) Chemi-
cal inhibition of potato ABA-8’-hydroxylase activity alters in vitro and
in vivo ABA metabolism and endogenous ABA levels but does not
affect potato microtuber dormancy duration. J Exp Bot 63: 5717-5725
24. Jadhav AS, Taylor DC, Giblin M, Ferrie AM, Ambrose SJ, Ross AR,
Nelson KM, Irina Zaharia L, Sharma N, Anderson M, Fobert PR,
Abrams SR (2008) Hormonal regulation of oil accumulation in Brassica
seeds: metabolism and biological activity of ABA, 7’-, 8’- and 9’-hydro-
xy ABA in microspore derived embryos of B. napus. Phytochemistry
69: 2678-2688
25. Seo M, Koshiba T (2011) Transport of ABA from the site of biosynthe-
sis to the site of action. J Plant Res 124: 501-507
26. Wang X, Wang Z, Dong J, Wang M, Gao H (2009) Cloning of a 9-cis-
-epoxycarotenoid dioxygenase gene and the responses of Caragana
korshinskii to a variety of abiotic stresses. Genes Genet Syst 84: 397-405
27. Hanada K, Hase T, Toyoda T, Shinozaki K, Okamoto M (2011) Origin
and evolution of genes related to ABA metabolism and its signaling
pathways. J Plant Res 124: 455-465
28. Todoroki Y, Aoyama H, Hiramatsu S, Shirakura M, Nimitkeatkai H,
Kondo S, Ueno K, Mizutani M, Hirai N (2009a) Enlarged analogues of
uniconazole, new azole containing inhibitors of ABA 8’-hydroxylase
CYP707A. Bioorg Med Chem Lett 19: 5782-5786
29. Jang F, Hartung W (2007) Long-distance signalling of abscisic acid
(ABA): the factors regulating the intensity of the ABA signal. J Exp
Bot 59: 37-43
30. Fujita M, Fujita Y, Takahashi F, Yamaguchi-Shinozaki K, Shinozaki K
(2009) Stress physiology of higher plants: cross-talk between abiotic
and biotic stress signaling, W: Hirt H (red) Plant stress biology: from
genomics to systems biology. Wiley, New Jersey, str. 67-89
31. Fujita Y, Fujita M, Shinozaki K, Yamaguchi-Shinozaki K (2011) ABA-
-mediated transcriptional regulation in response to osmotic stress in
plants. J Plant Res 124: 509-525
32. Fujita Y, Fujita M, Yamaguchi-Shinozaki K, Shinozaki K (2009) Trans-
cription factors involved in the crosstalk between abiotic and biotic
88
www.postepybiochemii.pl
stress-signaling networks. W: Yoshioka K, Shinozaki, K. (red) Signal
crosstalk in plant stress responses. Wiley- Blackwell, str. 43-58
33. Fujita Y, Nakashima K, Yoshida T, Katagiri T, Kidokoro S, Kanamori
N, Umezawa T, Fujita M, Maruyama K, Ishiyama K, Kobayashi M,
Nakasone S, Yamada K, Ito T, Shinozaki K, Yamaguchi-Shinozaki K
(2009) Three SnRK2 protein kinases are the main positive regulators of
abscisic acid signaling in response to water stress in Arabidopsis. Plant
Cell Physiol 50: 2123-2132
34. Chen H, Zhang J, Neff MM, Hong SW, Zhang H, Deng XW, Xiong
L (2008) Integration of light and abscisic acid signaling during seed
germination and early seedling development. Proc Natl Acad Sci USA
105: 4495-4500
35. Tsai AY, Gazzarrini S (2012) Overlapping and distinct roles of AKIN10
and FUSCA3 in ABA and sugar signaling during seed germination.
Plant Signal Behav 7: 1238-1242
36. Takezawa D, Komatsu K, Sakata Y (2011) ABA in bryophytes: how a
universal growth regulator in life became a plant hormone? J Plant Res
124: 437-453
37. Kim JM, To TK, Nishioka T, Seki M (2010) Chromatin regulation func-
tions in plant abiotic stress responses. Plant Cell Environ 33: 604-611
38. Kim TH, Böhmer M, Hu H, Nishimura N, Schroeder JI (2010) Guard
cell signal transduction network: advances in understanding abscisic
acid, CO
2
, and Ca
2+
signaling. Annu Rev Plant Biol 61: 561-591
39. Sato A, Sato Y, Fukao Y, Fujiwara M, Umezawa T, Shinozaki K, Hibi
T, Taniguchi M, Miyake H, Goto DB,Uozumi N (2009) Threonine at
position 306 of the KAT1 potassium channel is essential for channel
activity and is a target site for ABA-activated SnRK2/OST1/SnRK2.6
protein kinase. Biochem J 424: 439-448
40. Drechsel G, Raab S, Hoth S (2010) Arabidopsis zinc-finger protein 2 is a
negative regulator of ABA signaling during seed germination. J Plant
Physiol 167: 1418-1421
41. Fujii H, Verslues PE, Zhu JK (2007) Identification of two protein ki-
nases required for abscisic acid regulation of seed germination, root
growth, and gene expression in Arabidopsis. Plant Cell 19: 485-494
42. Wilmowicz E, Frankowski K, Glazińska P, Kęsy J, Wojciechowski W,
Kopcewicz J (2011) Cross talk between phytohormones in the regula-
tion of flower induction in Pharbitis nil. Biologia Plantarum. 55: 757-760
43. Wilmowicz E, Kęsy J, Kopcewicz J (2008) Ethylene and ABA interac-
tions in the regulation of flower induction in Pharbitis nil. J Plant Phy-
siol 165: 1917-1928
44. Acharya BR, Assmann SM (2009) Hormone interactions in stomatal
function. Plant Mol Biol 69: 451-462
45. Fujii H, Zhu JK (2009) Arabidopsis mutant deficient in 3 abscisic acid-ac-
tivated protein kinases reveals critical roles in growth, reproduction,
and stress. Proc Natl Acad Sci USA 106: 8380-8385
46. Urano K, Maruyama K, Ogata Y, Morishita Y, Takeda M, Sakurai N,
Suzuki H, Saito K, Shibata D, Kobayashi M, Yamaguchi-Shinozaki
K, Shinozaki K (2009) Characterization of the ABA regulated global
responses to dehydration in Arabidopsis by metabolomics. Plant J 57:
1065-1078
47. Khandelwal A, Cho SH, Marella H, Sakata Y, Perroud PF, Pan A, Qua-
trano RS (2010) Role of ABA and ABI3 in desiccation tolerance. Science
327: 546
48. Bu Q, Li H, Zhao Q, Jiang H, Zhai Q, Zhang J, Wu X, Sun J, Xie Q,
Wang D, Li C (2009) The Arabidopsis RING finger E3 ligase RHA2a is
a novel positive regulator of abscisic acid signaling during seed ger-
mination and early seedling development. Plant Physiol 150: 463-481
49. Merlot S, Leonhardt N, Fenzi F, Valon C, Costa M, Piette L, Vavasseur
A, Genty B, Boivin K, Muller A, Giraudat J, Leung J (2007) Constitutive
activation of a plasma membrane H
+
-ATPase prevents abscisic acid-
mediated stomatal closure. EMBO J 26: 3216-3226
Abscisic acid metabolism
Kamil Frankowski, Emilia Wilmowicz
, Agata Kućko, Magdalena Sidłowska, Jacek Kęsy,
Jan Kopcewicz
Chair of Plant Physiology and Biotechnology, Nicolaus Copernicus University, 1 Lwowska St., 87-100 Toruń, Poalnd
e-mail: emwil@umk.pl
ABSTRACT
Abscisic acid is one of the plant hormones that determines normal growth and development, i.e. seeds ripening and germination, stomata
opening and closure, flowering and stress responses. An appropriate level of endogenous ABA plays a key role in the regulation of most of
these processes. Its content in a particular tissue is a balance between the rate of its biosynthesis, oxidative degradation and formation of inac-
tive derivatives (mainly ester). The progress on ABA metabolism was relatively slow in the past. Application of modern molecular biology
methods let the most of genes encoding enzymes involved in the regulation of ABA metabolism be identified and contributed to the under-
standing of its action.
Wyszukiwarka
Podobne podstrony:
HYDROLOGIA 07 id 207788 Nieznany
2003 07 Szkola konstruktorowid Nieznany
2006 07 podkarpackie IIIetapid Nieznany (2)
hih kolo kolo2 07 id 709394 Nieznany
I CSK 304 07 1 id 208210 Nieznany
Fizjologia Cwiczenia 07 id 1743 Nieznany
05 med dosw 4 2013id 5960 Nieznany (2)
III CSK 302 07 1 id 210245 Nieznany
02 07 azbestid 3506 Nieznany (2)
1 rok mgr22,02,2013id 9707 Nieznany
03 PO Geometria 2013id 4609 Nieznany (2)
lo orm2 07 06 kp1 Nieznany
G2 PB 02 B Rys 3 07 id 185395 Nieznany
07 zadanieid 7022 Nieznany (2)
Bazy danych w03 07 id 81702 Nieznany
05 PO Filtracja 2013id 5967 Nieznany (2)
07 2id 6696 Nieznany (2)
CwiczenieArcGIS 07 id 125941 Nieznany
lo orm2 07 02 kp2 Nieznany
więcej podobnych podstron