
MED. DOŚW. MIKROBIOL., 2013, 65: 285 - 295
Charakterystyka Clostridium tetani i laboratoryjna diagnostyka tężca
Characteristics of Clostridium tetani and laboratory diagnosis of tetanus
Karolina Śmietańska, Natalia Rokosz-Chudziak, Waldemar Rastawicki
Zakład Bakteriologii, Narodowy Instytut Zdrowia Publicznego
– Państwowy Zakład Higieny w Warszawie
Clostridium tetani to beztlenowe bakterie powszechnie występujące w przyro-
dzie, wywołujące u ludzi chorobę zwaną tężcem. Dzięki zdolności wytwarza-
nia form przetrwalnikowych bakterie te potrafią przetrwać w niekorzystnych
warunkach środowiska. Do zakażenia laseczkami tężca u ludzi dochodzi
w przypadku zanieczyszczenia rany. Możemy wyróżnić kilka postaci tężca:
miejscowy, uogólniony i noworodkowy. Diagnostyka tężca opiera się głównie
na objawach klinicznych (bolesne skurcze mięśni, tułowia, uogólnione skurcze
z łukowatym wygięciem ciała) jak również na badaniach laboratoryjnych.
Przedstawiony artykuł poglądowy stanowi krótkie kompedium wiedzy na
temat laseczek C. tetani oraz diagnostyki zakażeń wywoływanych przez te
drobnoustroje u ludzi.
Słowa kluczowe: Clostridium tetani, tężec, epidemiologia tężca, diagnostyka tężca
ABSTRACT
The causative agent of tetanus is the obligate anaerobic bacterium - Clostridium tetani.
These bacteria form endospores that are able to survive long periods of exposure to air and
other adverse environmental conditions.
Infection generally occurs through wound con-
tamination. We can distinguish several forms of tetanus: generalized, local and neonatal.
Diagnosis of tetanus is based primarily on the patient’s clinical symptoms (muscle cramps,
painful back muscle spasms, generalized contractions of the arcuate curvature of the body)
as well as on microbiological diagnosis. This article is a brief review of C. tetani and diag-
nosis of infections caused by these organisms in humans.
Key words: Clostridium tetani, tetanus, epidemiology of tetanus, diagnosis of tetanus

K. Śmietańska, N. Rokosz, W. Rastawicki
286
Nr 4
WPROWADZENIE
Tężec jest zakaźną chorobą układu nerwowego człowieka wywoływaną przez Gram-
-dodatnie laseczki Clostridium tetani. Do głównych czynników wirulencji C. tetani należą
toksyny zwane tetanolizyną i tetanospazminą. Drobnoustrój ten występuje głównie w glebie,
kurzu, wodzie jak również w przewodzie pokarmowym zwierząt (9, 19, 22). Laseczki C.
tetani należą do bakterii beztlenowych i posiadają zdolność wytwarzania przetrwalników,
dzięki którym mogą przetrwać w niekorzystnych warunkach środowiska (19, 22).
Głównymi wrotami zakażenia laseczkami C. tetani są otarcia, skaleczenia, zmiażdżenia
i rozległe oparzenia. Już niewielkie przerwanie ciągłości skóry może wystarczyć do wniknię-
cia bakterii do organizmu człowieka. Możliwe jest również zakażenie się laseczkami tężca
podczas porodu w niehigienicznych warunkach. Nie zanotowano bezpośredniego zakażenia
się człowieka od człowieka (15, 22). Głównymi objawami tężca są skurcze mięśni, które
prowadzą do szczękościsku, zwanego uśmiechem sardonicznym, oraz napadowego pręże-
nia ciała. Ostra postać tężca może być przyczyną niewydolności oddechowej i w efekcie
doprowadzić do śmierci (9).
Najlepszym sposobem zapobiegania tężcowi są obowiązkowe szczepienia ochronne
dzieci i młodzieży. Tężec, mimo rozwoju medycyny i istnienia skutecznych szczepionek,
nadal jest bardzo groźną chorobą, mogącą stanowić bezpośrednie zagrożenie życia. Szacu-
je się, że na świecie ok. milion osób rocznie umiera z powodu tężca, z czego ok. 400 tys.
stanowią noworodki (9, 13).
CHARAKTERYSTYKA DROBNOUSTROJU
Clostridium tetani to bezwzględnie beztlenowe, urzęsione Gram-dodatnie laseczki sze-
roko rozpowszechnione w środowisku, głównie w glebie, kurzu i w nawozie. Stanowią one
naturalną florę bakteryjną układu pokarmowego zwierząt i ludzi (30). Pomimo, iż laseczki
C. tetani są wrażliwe na działanie promieni słonecznych, potrafią przetrwać w niekorzyst-
nych warunkach środowiska wytwarzając przetrwalniki. Bakterie te są oporne na działanie
wysokich temperatur (75-80°C) oraz środków dezynfekujących (24). Zgodnie z przyjętą
taksonomią, należą one do rzędu Clostridiales, rodziny Clostridiaceae, rodzaju Clostridium
(20). Wielkość drobnoustrojów wynosi około 0,5-2 µm x 2-18 µm (24, 30). W stanie wy-
suszonym przetrwalniki C. tetani mogą przetrwać nawet kilka lat. Formy wegetatywne są
mniej odporne na działanie czynników fizykochemicznych i giną w temperaturze 50°C (7).
PATOGENEZA ZAKAŻENIA LASECZKAMI CLOSTRIDIUM TETANI
Laseczki Clostridium tetani nie należą do inwazyjnych bakterii i namnażają się głównie
w miejscu wtargnięcia do organizmu ich przetrwalników (9, 22). Do zakażenia dochodzi
najczęściej w wyniku zanieczyszczenia rany pourazowej, pooperacyjnej bądź w miejscu
wkłucia igły po iniekcji. Może także dojść do zakażenia endogennego z jelita grubego
(30). Najważniejszymi czynnikami wirulencji C. tetani są dwie toksyny: tetanolizyna i te-
tanospazmina (7, 9, 22, 24, 30, 31). Tetanolizyna jest wrażliwą na tlen hemolizyną, która
serologicznie jest podobna do streptolizyny O Listeria monocytogenes oraz hemolizyn C.

Charakterystyka C. tetani i laboratoryjna diagnostyka tężca
287
Nr 4
perfringens (24). Aktywność tej toksyny jest hamowana przez tlen i cholesterol obecny w su-
rowicy. Tetanospazmina to kodowana plazmidowo, ciepłowrażliwa białkowa neurotoksyna,
będąca głównym czynnikiem chorobotwórczości tych bakterii (9, 24, 30). Ze względu na
fakt, iż plazmid na którym znajduje się gen kodujący toksynę jest niekoniugujący, istnieją
nietoksyczne szczepy C. tetani, które nie mają zdolności do wytwarzania tetanospazminy
(9, 24). Tetanospazmina jest toksyną typu A-B, wytwarzaną w stacjonarnej fazie wzrostu
i uwalnianą w czasie lizy laseczek (22, 24). Toksyna ta, w trakcie uwalniania z komórek
jest przekształcana w formę czynną przez własną endogenną proteazę, która rozcina te-
tanospazminę będącą peptydowym łańcuchem, na dwie podjednostki: lekką (łańcuch A)
i ciężką (łańcuch B) (9, 24, 30). Oba łańcuchy pozostają jednak ze sobą połączone mostkami
dwusiarczkowymi i wiązaniami niekonwalencyjnymi. Łańcuch B wiąże się z receptorem
błonowym neuronu, natomiast peptydowy łańcuch A wnika do obwodowych nerwów ru-
chowych i przemieszcza się wzdłuż włókien aksonów do ośrodkowego układu nerwowego,
gdzie umiejscawia się w pęcherzykach synaptycznych neuronów wstawkowych, hamując
uwalnianie glicyny - neuroprzekaźnika blokującego wydzielanie acetylocholiny (9, 30).
W wyniku tego, dochodzi do równoczesnego skurczu par mięśni – prostowników i zginaczy,
prowadząc do porażenia spastycznego, który jest dominującym objawem tężca. Wiązanie
tetanospazminy z neuronami motorycznymi jest nieodwracalne (9, 24).
OBJAWY KLINICZNE TĘŻCA
Okres inkubacji choroby może wynosić od 3 do 50 dni, przy czym najczęściej trwa
3-14 dni (3, 19, 24, 32). Okres ten jest wprost proporcjonalny do odległości pierwotnie
zakażonej rany od centralnego układu nerwowego (24). W zależności od czasu, który upły-
nął od zakażenia, który jest często trudny do uchwycenia, objawy tężca są zróżnicowane
(31). Stwierdzono, że im krótszy jest okres wylęgania choroby, tym rokowanie jest gorsze.
Początkowe objawy tężca mogą przypominać grypę: wzmożona potliwość, gorączka, po-
gorszenie samopoczucia, bóle głowy, niepokój (19). Wyróżnić można postać uogólnioną
tężca, występującą u około 80% pacjentów, u których doszło do zakażenia laseczkami C.
tetani oraz postać miejscową (9). U większości pacjentów z tężcem uogólnionym występuje
skurcz mięśni żuchwy (szczękościsk). Następuje również porażenie nerwu twarzowego VII,
prowadzące do skurczu mięśni mimicznych twarzy i występowania charakterystycznego
„sardonicznego uśmiechu” (9, 15, 22, 24). Innymi objawami tej postaci we wczesnej fazie
choroby są: ślinotok, wzmożona potliwość, częsta irytacja i utrzymujący się skurcz mięśni
pleców (opistotonus) (15, 24). Skurcze dużych grup mięśni, zwłaszcza grzbietu i karku,
mogą powodować napady prężeń, które często są bardzo bolesne i trwają od 5 do 10 se-
kund (9). Prężenia, które są charakterystyczne dla tężca uogólnionego, mogą występować
spontaniczne lub mogą je wywoływać bodźce zewnętrzne (dźwięk, światło, dotyk) (15).
W tężcu uogólnionym może dojść do zapalenie płuc, obrzęku mięśni, zapalenia mięśnia
sercowego oraz zaburzenia pracy serca (9, 22, 24).
Inną, łagodną postacią tężca, jest tężec miejscowy, który pojawia się w okolicy zakażenia.
Dochodzi wówczas do napięcia mięśni okolicy zranienia, np. kończyny dolnej lub górnej.
Postać ta rzadko prowadzi do zgonu i trwa zazwyczaj kilka tygodni (9, 15, 24). Postacią
tężca miejscowego, o bardzo złym rokowaniu, jest tężec głowy (24).

K. Śmietańska, N. Rokosz, W. Rastawicki
288
Nr 4
Szczególną postacią choroby jest tężec noworodkowy, do którego dochodzi przy bra-
ku przestrzegania podstawowych zasad higieny podczas porodu. Najczęściej występuje
w wyniku zakażenia kikuta pępowiny i może doprowadzić do postaci uogólnionej (9, 24).
Zakażenie tężcem u niemowląt objawia się wysoką gorączką i trudnością w ssaniu (charak-
terystyczny rybi pyszczek jako wynik skurczu mięśni ust), napadowe drgawki z bezdechem
(9, 27, 28). W 90% przypadków tężca noworodkowego dochodzi do zgonu (24). Noworodki,
które przeżyły infekcje wywołane C. tetani, zazwyczaj są upośledzone umysłowo bądź
mają problemy neurologiczne (28). Zakażenia te występują najczęściej w krajach o niskim
poziomie sanitarno-higienicznym (24).
W celu określenia stopnia ciężkości tężca, Ablett (1) opracował dla lekarzy klasyfikację,
która opisuje stopień nasilenia objawów klinicznych:
I. Łagodny: łagodny do umiarkowanego szczękościsk, uogólniona spastyczność, bez
dolegliwości oddechowych, bez prężeń, z małą dysfagią.
II. Umiarkowany: umiarkowany szczękościsk, dobrze zaznaczona sztywność, łagodne do
średnich ale krótkie skurcze (prężenia), średni wysiłek oddechowy, ze zwiększoną czyn-
nością oddechową, przyspieszenie akcji serca >30 uderzeń na minutę, łagodna dysfagia.
III. Ciężki: ciężki szczękościsk, uogólniona spastyczność, prężenie przy wywoływaniu
odruchów, zwiększona czynność oddechowa, przyspieszenie akcji serca powyżej 40
uderzeń na minutę, ataki bezdechu, ciężka dysfagia, tachykardia (powyżej 120 uderzeń
na minutę).
IV. Bardzo ciężki: stopień III z gwałtownymi zaburzeniami ze strony układu autonomicz-
nego, obejmującymi układ sercowo-naczyniowy. Ciężkie nadciśnienie i tachykardia na
zmianę z hipotensją i bradykardią.
Stopień ciężkości tężca według klasyfikacji Abletta powinien być oceniany przez lekarza
codziennie, gdyż z czasem pojawiają się nowe objawy wegetatywne i wynik w skali Abletta
ulega wówczas zmianie (1, 8, 32). Rokowanie w przypadku tężca zależy od nasilenia czyn-
ników prognostycznych, tj. czasu jaki upłynął od momentu wystąpienia objawów, miejsca
zranienia oraz nasilenia prężeń, nasilenia tachykardii oraz wzrostu ciepłoty ciała. Bardzo
ważne w rokowaniu tężca jest ustalenie czasu pomiędzy pierwszymi objawami choroby
a wystąpieniem pierwszego napadu prężeń (15). Lekarze mogą się posługiwać klasyfikacją
opracowaną przez Dakar bądź klasyfikacją Philipsa, które mają na celu ustalenie rokowania
dla pacjenta w zależności od czasu inkubacji choroby oraz objawów klinicznych (9, 34).
Obowiązkiem placówki, która zdiagnozuje przypadek zachorowania na tężec jest zgłoszenie,
rejestracja oraz hospitalizacja pacjenta (15).
LECZENIE TĘŻCA
Zgodnie z Ustawą z dnia 30 grudnia 2008r. o zapobieganiu oraz zwalczaniu zakażeń
i chorób zakaźnych u ludzi Dz. U. Nr. 234 poz. 1570, tężec należy do chorób zakaźnych,
podlegających obowiązkowi zgłoszenia (35). Leczenie tężca powinno obejmować trzy etapy:
zatrzymanie dalszego wnikania laseczek C. tetani (opracowanie rany), przeciwdziałanie
rozprzestrzenianiu się neurotoksyn po organizmie (bierna immunizacja ludzką immunoglo-
buliną przeciwtężcową), zabezpieczenie przed kolejnym zakażeniem (szczepienie toksoidem
tężcowym) oraz ewentualne podanie antybiotyku (9, 19, 22, 24).
Charakterystyka C. tetani i laboratoryjna diagnostyka tężca
289
Nr 4
Zakażoną ranę należy oczyścić chirurgicznie a miejsce wniknięcia laseczek tężca należy
jak najszybciej przemyć wodą utlenioną lub 1% roztworem jodu (2, 5, 11, 23, 24). Neutra-
lizowanie wolnej toksyny odbywa się poprzez podanie surowicy przeciwtężcowej w ilości
od 3 do 6 tys. jednostek (4, 9). Antytoksyna tężcowa ma zdolność zobojętniania toksyny
tężcowej i powinna być podana w jak najkrótszym czasie od zakażenia (19). Gdy ludzka
surowica jest niedostępna, podaje się odpornościową surowicę końską (ATS) w ilości 50 tys.
jednostek, która jest tańsza ale bardziej anafilaktogenna (31). Równocześnie z uodparnianiem
biernym, powinien rozpocząć się proces uodporniania czynnego, poprzez podanie szcze-
pionki przeciwtężcowej. W przypadku ekspozycji na zakażenie C. tetani należy wzmocnić
odporność, po rozważeniu historii szczepień, natury rany i warunków zranienia oraz stanów
alergicznych pacjenta. Ranę można uważać za „tężcorodną”, gdy doszło do jej ekspozycji
na zanieczyszczenie bakteryjne, gdy od zranienia upłynęło więcej niż 24 godziny, gdy rana
zawierała zniszczone tkanki oraz gdy nie może być dokładnie opracowana chirurgicznie.
Jeżeli rana nie spełnia uprzednio wymienionych kryteriów jest uważana za mało „tężcorodną”
(19). Ponadto istnieją ustalone wytyczne dotyczące swoistego zapobiegania tężcowi u osób
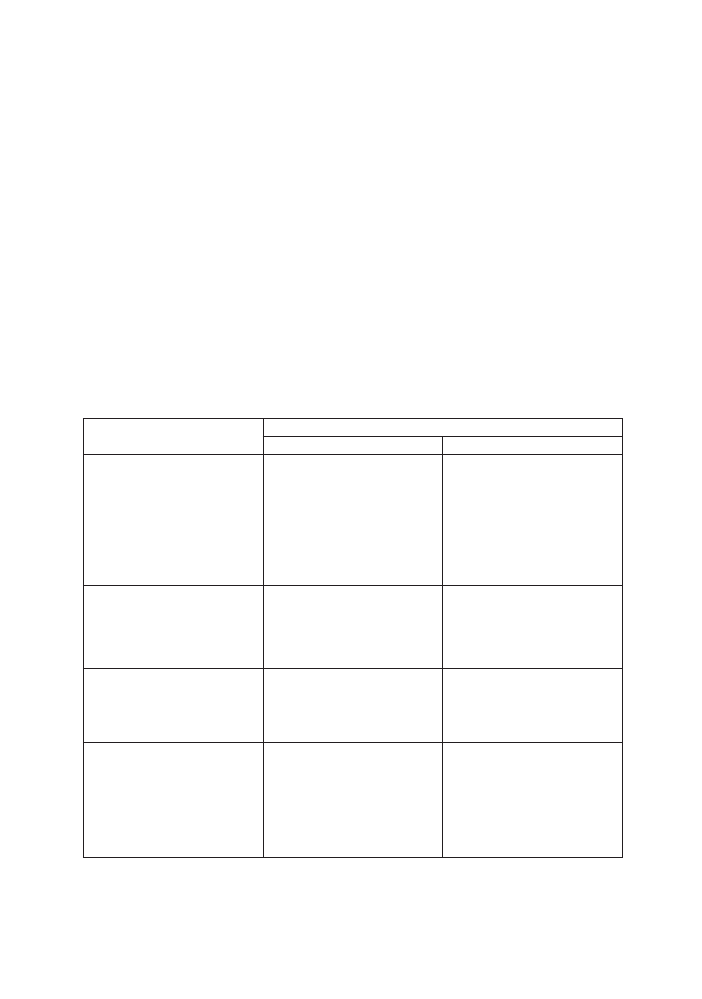
zranionych (Tabela I) (10, 38).
Tabela I. Szczepienia przeciw tężcowi u osób zranionych.
Historia szczepień pacjenta
Ryzyko wystąpienia tężca
NISKIE
WYSOKIE
Nieszczepieni lub
niekompletnie szczepieni lub
historia szczepień niepewna.
Szczepionka tężcowo-błonicza
lub tężcowa, następnie
kontynuować kolejne dawki
szczepienia podstawowego
według schematu 0; 1; 6
miesiąc
Szczepionka tężcowo-błonicza
lub tężcowa
i antytoksyna (LIT-swoista
immunoglobulina 250/500
j.m) następnie kontynuować
kolejne dawki szczepienia
podstawowego według
schematu 0; 1; 6 miesiąc
Szczepienie podstawowe lub
przypominające – ostatnia
dawka więcej niż 10 lat temu.
Szczepionka tężcowo-
błonicza lub tężcowa, jedna
przypominająca dawka.
Szczepionka tężcowo-
błonicza lub tężcowa, jedna
przypominająca dawka
i antytoksyna (LIT-swoista
immunoglobulina 250/500j.m).
Szczepienie podstawowe lub
przypominające – ostatnia
dawka 5-10 lat temu.
Szczepionka tężcowo-
błonicza lub tężcowa, jedna
przypominająca dawka.
Szczepionka tężcowo-
błonicza lub tężcowa, jedna
przypominająca dawka.
Szczepienie podstawowe lub
przypominające – ostatnia
dawka mniej niż 5 lat temu.
Nie wymaga szczepień
Nie wymaga szczepień,
ewentualnie przy szczególnie
wysokim ryzyku należy
rozważyć szczepienie
szczepionką tężcowo-
błoniczą lub tężcową, jedna
przypominająca dawka.

K. Śmietańska, N. Rokosz, W. Rastawicki
290
Nr 4
W leczeniu łagodnych postaci tężca można stosować antybiotykoterapię, np. poprzez
podanie metronidazolu lub tetracykliny (9). Nie zaleca się podawania penicyliny, gdyż an-
tybiotyk ten jest antagonistą kwasu g-aminomasłowego (GABA) i może nasilić wystąpienie
prężeń (22, 24).
W celu obniżenia wzmożonej pobudliwości nerwowo- mięśniowej oraz napięcia mięśni
najczęściej stosowanym lekiem jest diazepam, który działa uspokajająco oraz zmniejsza
napięcie mięśniowe (4, 9). Podając podpajęczynówkowo baklofen możliwe jest kontrolo-
wanie prężeń, jednak trzeba mieć na uwadze, że odpowiedź na tą samą dawkę leku może
być różna u różnych pacjentów (9). Wzmożoną pobudliwość nerwowo-mięśniową leczy się
podając benzodwuazepinę, chloropromazynę i krótko działające barbiturany (4, 9).
EPIDEMIOLOGIA TĘŻCA
Tężec stanowi jeden z ważniejszych problemów zdrowotnych krajów Afryki, Azji
i Ameryki Południowej (7, 9, 13, 18, 19). W Stanach Zjednoczonych, dzięki powszechnie
stosowanym szczepieniom, corocznie notuje się poniżej 40 przypadków tężca. Zachorowa-
nia dotyczą głównie osób starszych, w wieku powyżej 65 r.ż. (9, 12, 24). Według raportu
ECDC z 2012 roku, który obejmuje lata 2006-2010, liczba zachorowań na tężec w krajach
europejskich jest niska (12). Zakażeniom najczęściej ulegają rolnicy, osoby powyżej 60.
roku życia oraz noworodki. Najwięcej zachorowań odnotowuje się w okresie od czerwca
do października. Przykładowo, w 2010 roku na terenie Europy odnotowano łącznie 130
przypadków zachorowań na tężec w 12 krajach, w tym 74 przypadki zostały potwierdzone
(12). Najwięcej zachorowań na tężec odnotowano w takich krajach jak: Włochy - 57, Polska
- 16, Francja - 15 (12). W Polsce, w latach 2002-2012, odnotowano kilkanaście przypadków
tężca, z czego kilka zakończyło się zgonem. Zapadalność na tężec w Polsce w przeciągu
tych 10 lat utrzymywała się w zakresie od 0,036 do 0,079 na 100 tys. mieszkańców. Od
kilkunastu lat w naszym kraju nie odnotowano zachorowań szpitalnych, a ostatni przypadek
zgonu noworodka, wywołanego przez laseczkę tężca, był w 1984 roku (38).
Szacuje się, że rocznie na świecie na tężec choruje milion osób, z czego 30-50% umiera
(9). Znacznie większa jest śmiertelność wśród noworodków (w 80-90 % przypadkach) (18, 24).
Wysoki stopień zaszczepienia dzieci i młodzieży w wielu krajach świata przeciw tężcowi
sprawia, że choroba ta u osób w tych grupach wieku została niemal całkowicie wyelimi-
nowana, a nieliczne zachorowania występują u osób w starszych grupach wieku. Tężec nie
jest chorobą, którą można wyeliminować ze środowiska i zagrożenie ludzi nieszczepionych
będzie występować zawsze w wypadku urazów z przerwaniem ciągłości powłok i zanie-
czyszczeniem rany (38).
SZCZEPIENIA OCHRONNE
Szczepienia ochronne są koniecznym warunkiem utrzymania lub dalszego zmniejszenia
zachorowalności na tężec (32, 38). Profilaktyka przeciwtężcowa w Polsce prowadzona jest
zgodnie z Rozporządzeniem Ministra Zdrowia dotyczącym Programu Szczepień Ochronnych
na dany rok. Aktualny program dotyczący szczepień przeciw tężcowi na 2013 rok podany
jest w komunikacie Głównego Inspektora Sanitarnego (10, 27, 28) (Tabela II). Poza szcze-
Charakterystyka C. tetani i laboratoryjna diagnostyka tężca
291
Nr 4
pieniami indywidualnymi niezwykle istotne są również szczepienia ochronne przeciwko
tężcowi osób mających kontakt z glebą, jak również pracowników zatrudnionych przy
usuwaniu odpadów komunalnych i nieczystości ciekłych lub konserwacji urządzeń służą-
cych do tego celu (29). Zalecane jest również, aby osoby podróżujące do krajów o wysokiej
zachorowalności na tężec zadbały o szczepienia przypominające przeciwko tężcowi, jeśli
od ostatniego szczepienia minęło 10 lat (28).
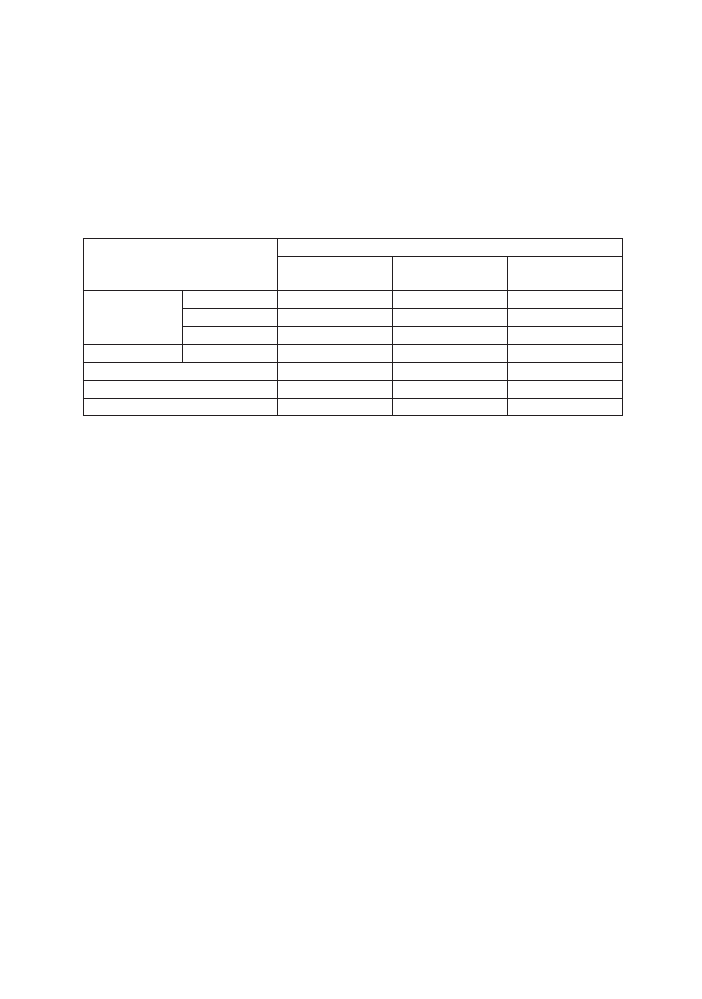
Tabela II. Program Szczepień Ochronnych w Polsce na 2013 rok.
Wiek
Szczepienie przeciwko tężcowi
Szczepienie
podstawowe
Szczepienie
uzupełniające
Szczepienie
przypominające
1 rok życia
2 miesiąc
+
3 - 4 miesiąc
+
5 - 6 miesiąc
+
2 rok życia
16 -18 miesiąc
+
6 rok życia
+
14 rok życia
+
19 rok życia
+
Na rynku farmaceutycznym dostępne są różne szczepionki zawierające anatoksynę
tężcową, zwaną toksoidem tężcowym (szczepienia.pl; wakcynologia). Można wyróżnić
szczepionki monowalentne (T, TT), szczepionki skojarzone dwuwalentne (DT lub Td) oraz
szczepionki skojarzone trójwalentne (DTP). Szczepionki skojarzone mogą być pełnokomór-
kowe oraz bezkomórkowe (acelularne) (18, 27).
Szczepionki podawane dzieciom należą do szczepionek skojarzonych. Dostępne są naj-
częściej w połączeniu ze szczepionką przeciwko błonicy oraz przeciwko błonicy i krztuścowi
lub szczepionką błoniczą dla dorosłych (18, 27, 28). Dostępne są również szczepionki DTP
skojarzone z komponentami Haemophilus influenzae typu b, poliomyelitis, WZW typu B
(18, 27). Szczepionki monowalentne (T) stosowane są u dzieci z przeciwwskazaniami do
szczepień szczepionkami skojarzonymi oraz osób zranionych ze wskazaniami induwidu-
alnymi, u których ostatnia dawka szczepionki była podana nie wcześniej niż po 5 latach
od ostatniego szczepienia. Dzieci w wieku 6 lat z przeciwwskazaniami do szczepienia
szczepionką przeciw krztuścowi, osoby w wieku 14 lat oraz powyżej 19 r.ż. są szczepione
szczepionkami skojarzonymi dwuwalentnymi. U dzieci w wieku 16-18 miesięcy oraz 2, 3,
4, 5 i 6 lat podawana jest zazwyczaj szczepionka skojarzona DTP (18, 19, 27).
Niemowlęta otrzymują podskórnie bądź domięśniowo pierwsze trzy dawki szczepienia
podstawowego od 2 miesiąca życia, w odstępach 6-8 tygodniowych skojarzoną szczepionką
DTP. Następnie w 16-18 miesiącu życia, podawana jest szczepionka uzupełniająca oraz
w 6, 14 i 19 roku życia dawka przypominająca. Po okresie 10 lat od ostatniego szczepienia
przypominającego, zaleca się doszczepienie w celu utrzymania ochronnego poziomu prze-
ciwciał przeciwko tężcowi (27, 28).
DTPa to szczepionka przeciwko błonicy, tężcowi i krztuścowi (bezkomórkowa), zale-
cana do podawania dzieciom o masie ciała poniżej 2500 gramów, które urodziły się przed
37 tygodniem ciąży (10). DTPw jest pełnokomórkową szczepionką przeciwko błonicy,
tężcowi i krztuścowi, stosowaną w większości przypadków, natomiast dTpa to szczepionka

K. Śmietańska, N. Rokosz, W. Rastawicki
292
Nr 4
zawierająca toksoid tężcowy, ze zmniejszoną dawką toksoidu błoniczego, zawierająca bez-
komórkowy składnik krztuśca, przeznaczona dla młodzieży i dorosłych oraz Td - adsorbo-
wana szczepionka tężcowo-błonicza zawierająca zmniejszoną dawkę toksoidu błoniczego
przeznaczona dla młodzieży i dorosłych (16, 19, 27).
Niepożądane odczyny miejscowe oraz odczyny ogólne po szczepieniu występują rzadko
(18). Po podaniu szczepionki skojarzonej DTP może u niektórych osób wystąpić niepożądany
odczyn poszczepienny (NOP). Zwykle jest on miejscowy, objawiający się zaczerwienieniem
w miejscu iniekcji lub podskórnymi zgrubieniami. Do ogólnych objawów NOP należy stan
podgorączkowy, bóle głowy, pogorszenie samopoczucia (28).
DIAGNOSTYKA LABORATORYJNA
Podstawą diagnostyki tężca są głównie badania lekarskie, ponieważ diagnostyka labo-
ratoryjna tężca nie jest powszechnie stosowana (7, 24, 30).
Pobranie odpowiedniej próbki materiału klinicznego do hodowli jest utrudnione ze
względu na fakt, iż zakażenie może być wywołane przez niewielką liczbę laseczek. Trzeba
mieć na uwadze również to, że bakterie te bardzo wolno rosną na podłożach hodowlanych
i eksponowane na tlen szybko giną (30).
W preparacie mikroskopowym dominują Gram-dodatnie laseczki. W starszych ho-
dowlach laseczki tracą jednak zdolność do utrzymywania barwnika, dlatego mogą one
wybarwiać się Gram-ujemnie lub Gram-zmiennie (7, 30). Ułożenie zarodników w komórce
jest cechą charakterystyczną dla danego gatunku. W obrazie mikroskopowym widoczne
są jako zaokrąglony biegun zawierający spory przypominający „pałeczkę dobosza” (24).
Hodowla C. tetani musi być prowadzona w warunkach bezwzględnie beztlenowych,
ponieważ laseczki tężca nie posiadając cytochromów ani oksydazy cytochromowej nie mogą
wykorzystać tlenu atmosferycznego, jako ostatecznego akceptora wodoru (18). Najczęściej
do hodowli C. tetani stosuje się podłoża agarowe z dodatkiem krwi, co umożliwia ocenę
właściwości hemolitycznych posiewanych bakterii (7, 30). Laseczki tężca intensywnie
namnażają się w warunkach ściśle beztlenowych na pożywce Tarozzi-Wrzoska wydzielając
charakterystyczny nieprzyjemny zapach (21, 22). W temperaturze 37˚C na agarze Zeissle-
ra laseczki tężca rosną w postaci wzrostu pełzającego (około 2 dni), widoczna jest strefa
hemolizy typu β, a kolonie są szare, o matowej powierzchni i nieregularnych brzegach
(21). W bulionie odżywczym bakterie te rosną wolno, widoczne jest jednolite zmętnienie.
Możliwe jest również umieszczenie podłóż z hodowlą laseczek w aparacie próżniowym,
w którym ciśnienie powietrza nie może przekraczać 3-15mm Hg (21, 22).
W testach biochemicznych C. tetani wykazują niską aktywność, nie fermentują cukrów,
nie ścinają mleka, nie wytwarzają lipazy oraz lecytynazy. Laseczki tężca nie wykazują ak-
tywności katalazowej (katalaza jest enzymem rozkładającym H
2
O
2
) i nie redukują azotanów.
Mogą wytwarzać siarkowodór i indol oraz posiadają zdolność do hydrolizy żelatyny. Proces
hydrolizy zachodzi jednak kilka dni (30, 33). W diagnostyce tężca można wykorzystać
również komercyjne testy API (14).
Złotym standardem w diagnostyce tężca jest test neutralizacji toksyny tężcowej wy-
konywany in vivo na myszach (6). Ma on na celu wykazanie obecności samej toksyny
tężcowej w surowicy krwi zakażonego człowieka. Próbkę materiału klinicznego do badań

Charakterystyka C. tetani i laboratoryjna diagnostyka tężca
293
Nr 4
należy pobrać przed podaniem surowicy przeciwtężcowej. Test neutralizacji wykonywany
jest jednak tylko w nielicznych ośrodkach referencyjnych (24).
W diagnostyce tężca wykorzystywane są również najnowsze techniki biologii moleku-
larnej (PCR, RT PCR, PFGE). Najczęściej poszukuje się fragmentów genów kodujących
toksynę C. tetani np. gen TeTx (3, 7, 14, 26).
Obecnie w laboratoriach diagnostycznych do monitorowania poziomu przeciwciał po-
szczepiennych przeciwko tężcowi stosowane są testy serologiczne (ELISA) (6, 36, 45). Na
rynku dostępne są komercyjne zestawy ELISA, takie jak: anti-tetanus toxoid ELISA firmy
Euroimmun (Niemcy), Tetanus ELISA IgG Testkit firmy Genzyme Virotech (Niemcy),
Serion
ELISA classic Tetanus IgG firmy Verion\Serion (Niemcy), Tetanus Toxoid IgG Antibody
ELISA Test Kit firmy GenWay Biotech, Inc. (USA), Anti-Tetanus Toxin IgG Assay firmy
Scimedx Corporation (USA), zestaw VaccZyme™ Tetanus toxoid IgG firmy The Binding
Site (Włochy), Tetanus toxin IgG ELISA firmy DRG International Inc. (USA), Tetanus
–Ab ELISA firmy IBL International GmbH (USA), Tetanus Toxoid IgG ELISA firmy DE-
MEDITEC Diagnostics GmbH (Niemcy) oraz dwa zestawy Clostridium tetani IgG ELISA
i Clostridium tetani 5S IgG ELISA firmy NovaTec Immunodiagnostica GmbH (Niemcy)
(25, 36, 45). Większość producentów testów ELISA, zgodnie z danymi dostępnymi w zagra-
nicznych publikacjach oraz z wytycznymi Światowej Organizacji Zdrowia (WHO) podaje,
iż poziom poszczepiennych tężcowych przeciwciał klasy IgG mieszczący się w zakresie
0,1 – 0,5 IU/ml uważany jest za krótkotrwałą ochronę poszczepienną, a poziom przeciwciał
powyżej wartości 0,51 świadczy o pełnej ochronie poszczepiennej (37, 45). Badania pozio-
mu poszczepiennych przeciwciał klasy IgG dla toksyny tężcowej komercyjnym zestawem
ELISA wykonywane są między innymi w Zakładzie Bakteriologii NIZP-PZH w Warszawie.
PIŚMIENNICTWO
1. Ablett JJL. Analysis and main experiences in 82 patients treated in the Leeds Tetanus Unit. In:
Ellis M, ed. Symposium on Tetanus in Great Britain. Boston Spa, UK: National Lending Library,
1967; 1-10.
2. Ahmadsyah I, Salim A. Treatment of tetanus: an open study to compare the efficacy of procaine
penicillin and metronidazole. Br Med J 1985; 291: 648–50.
3. Akbulut D, Grant K.A, McLauchlin J. Improvement in laboratory diagnosis of wound botulism
and tetanus among injecting illicit-drug users by use of Real-Time PCR assays for neurotoxin
gene fragments. J Clin Microbiol 2005, 43: 4342-8.
4. Alfery DD, Rauscher LA. Tetanus: a review. Crit Care Med 1979; 7:176-81.
5. Attygale D, Rodrigo N. New trends in management of tetanus. Expert Rev Anti-Infect 2004; 2:
73-84.
6. Aybay C, Karakus R, Gundogdu AG. Development of diagnostic and screening ELISA system
for measuring tetanus antitoxin levels. Turk J Med Sci 2003; 33: 289-94.
7. Campbell JJ, Lam TM, Huynh TL i inni. Microbiologic characterization and antimicrobial suscep-
tibility of Clostridium tetani isolated from wounds of patients with clinically diagnosed tetanus.
Am J Trop Med Hyg 2009; 80: 827-31.
8. Chandrasekaran VP, Appachi M, Mohanasundaram P, Kumar TS. Outcome of Tetanus. National
J Emerg Med 2012; 1: 1-6.
9. Cook T.M, Protheroe R.T, Handel J.M. Tetanus: a review of the literature. Brit J Anaesth 2001;
87: 477-87.

K. Śmietańska, N. Rokosz, W. Rastawicki
294
Nr 4
10. Dziennik Urzędowy Ministra Zdrowia. Warszawa dnia, 30 października 2012r. Poz. 78 Komunikat
Głównego Inspektora Sanitarnego z dnia 29 października 2012 w sprawie Programu Szczepień
Ochronnych na rok 2013.
11. Edmondson RS, Flowers MW. Intensive care in tetanus: management, complications and mortality
in 100 cases. Br Med J 1979;1: 1401–4.
12. Europejskie Centrum do Spraw Zapobiegania i Kontroli Chorób (ECDC). Annual Epidemio-
logical Report 2012. Reporting on 2010 surveillance data and 2011 epidemic intelligence data.
Sztokholm: ECDC; 2013.
13. Farrar JJ, Yen LM, Cook T i inni. Tetanus. Neurological Aspects of Tropical Disease. Neurol
Neurosurg Psych 2000; 69; 292-301.
14. Jiang, Dongneng, Xiaoyun Pu, Jiehong Wu i inni. Rapid, sensitive, and specific detection of
Clostridium tetani by loop-mediated isothermal amplification assay. J Mikrobiol Biotechnol
2013, 23: 1-6.
15. Kłapeć T, Stroczyńska-Sikorska M. Tężec-choroba wciąż aktualna w Polsce. Medycyna Ogólna
2010; 16: 340-6.
16. Kroger AT, Sumaya CV, Pickering LK. Recommendations of the Advisory Committee on Im-
munization Practices (ACIP). W: Morbidity and Mortality Weekly Report 2011; 60: 1–60.
17. Krok milowy w walce z tężcem. W: Portal UNICEF. (www.unicef.pl.) (16.05.2013r.).
18. Kuszewski K. Szczepionka przeciwko tężcowi. W: Wakcynologia. Red. Magdzik W, Naruszewicz-
-Lesiuk D, Zieliński A. Alfa-Medica Press, Bielsko-Biała 2007, 452-5.
19. Kuszewski K. Tężec. W: Choroby zakaźne i pasożytnicze-epidemiologia i profilaktyka. Wydanie
VI. Red. Magdzik W, Naruszewicz-Lesiuk D, Zieliński A. Alfa-Medica Press, Bielsko-Biała, 2007,
291-4.
20. Ludwig W, Schleifer K-H, Whitman WB. Taxonomic outline of the phylum Firmicutes. W: Ber-
gey’s Manual of Systematic Bacteriology: Volume 3: The Firmicutes. Red. De Vos P, Boone D
R, Garrity GM, Castenholz RW, Brenner DJ, Krieg NR, Staley JT. Springer Science+Business
Media, NewYork, 2009. 825.
21. Markey B, Leonard F, Archambault M, Cullinane A, Maguire D. Clinical Veterinary Microbiology.
Elsevier Ltd., 2013, 220-1.
22. Melville S. Clostridia: diarrheal disease, tissue infection, botulism, and tetanus. W: Mechanisms
of Microbial Disease. Red. Engleberg NC, DiRita V, Dermody TS. Lippincott Williams & Wilkins,
Baltimore 2007; 234-5.
23. Murphy TV, Slade BA, Broder KR i inni. Prevention of Pertussis, Tetanus, and Diphtheria Among
Pregnant and Postpartum Women and Their Infants. Recommendations of the Advisory Committee
on Immunization Practices (ACIP) Recommendations and Reports 2008; 57: 1-47.
24. Murray PR, Rosenthal KS, Pfaller MA. Clostridium. W: Mikrobiologia. Red. Wyd. Polskiego:
Przondo-Modarska A, Martirosian G, Szkaradkiewicz A, Elsevier Urban & Partner, Wrocław
2011, 371-3.
25. Perry AL, Hades AJ, Cox HA i inni. Comparison of five commercial anti-tetanus toxoid immu-
noglobulin G enzyme-linked immunosorbent assays. Clin Vacc Immun 2009; 16: 1837-9.
26. Plourde-Owobi L, Seguin D, Baudin MA i inni. Molecular characterization of Clostridium tetani
by pulsed-field gel electrophoresis and colony PCR. App Environ Microbiol 2005, 71: 5604-6.
27. Portal „Szczepienia.info”; adres źródłowy: www.szczepienia.pzh.gov.pl (29.11.2013r.).
28. Portal Wakcynologiczny „Wydział Szczepień”; adres źródłowy: rwww.wydzialszczepien.pl
(29.11.2013r.).
29. Rozporządzenie Ministra Zdrowia z dnia 28.11.2005 r, w sprawie wykazu stanowisk pracy
oraz szczepień ochronnych wskazanych do wykonania pracownikom podejmującym pracę lub
zatrudnionych na tych stanowiskach. Dz.U.250, poz 2113.
30. Szarapińska-Kwaszewska J. Beztlenowe laseczki-Clostridium. W: Diagnostyka bakteriologiczna.
Red. Szewczyk EM. Wydawnictwo Naukowe PWN, Warszawa 2006, 161-2.

Charakterystyka C. tetani i laboratoryjna diagnostyka tężca
295
Nr 4
31. Szenborn L. Profilaktyka tężca po zranieniu. Medycyna Praktyczna, 2012. adres źródłowy: www.
mp.pl (29.11.2013r.).
32. Taylor AM. Tetanus. Contin Educ Anaesth Crit Care Pain 2006; 6: 101-4.
33. Temaru E, Shimura S, Karasawa T. Letters to the Editor Clostridium tetani is a phospholipase
(letcithinase)-producing bacterium. J Clin Mikrobiol 2005, 43: 2024-5.
34. Thwaites CL, Yen LM, Glover C i inni. Predicting the clinical outcome of tetanus: the tetanus
severity score. Trop Med Inter Health 2006; 11: 279- 87.
35. Ustawa z dnia 30 grudnia 2008r. o zapobieganiu oraz zwalczaniu zakażeń i chorób zakaźnych
u ludzi. Dz.U.Nr.234 poz. 1570.
36. van Hoeven KH, Dale C, Foster O i inni. Comparison of three enzyme-linked immunosorbent
assays for detection of immunoglobulin G antibodies to tetanus toxoid reference standards and
the impact on clinical practice. Clin Vaccine Immunol 2008; 15: 1751-4.
37. World Health Organization. State of the world’s vaccines and immunization. Publication WHO/
GPV/96.04. Geneva, (1996).
38. Zieliński A: Tężec w Polsce w 2010 roku. Przegląd Epidemiol 2002; 56: 335-8.
Otrzymano: 29 XI 2013 r.
Adres Autora: 00-791 Warszawa, ul. Chocimska 24, Zakład Bakteriologii Narodowego Instytutu
Zdrowia Publicznego - Państwowego Zakładu Higieny w Warszawie

Wyszukiwarka
Podobne podstrony:
05 PO Filtracja 2013id 5967 Nieznany (2)
05 1 2013id 5606 Nieznany (2)
2014 Matura 05 04 2014 odpid 28 Nieznany (2)
713[05] Z1 03 Wykonywanie izola Nieznany (2)
05 Zas i koszty [tryb zgodnosci Nieznany
05 Culture and cognitionid 5665 Nieznany
Cw 05 Pomiar punktu Curie ferro Nieznany
05 metoda dobrego startu cwicz Nieznany
1 rok mgr22,02,2013id 9707 Nieznany
03 PO Geometria 2013id 4609 Nieznany (2)
05 Dobor nastaw regulatora w ko Nieznany (2)
07 05 2013 odwiert (1)id 6788 Nieznany
713[05] Z1 06 Wykonywanie posad Nieznany (2)
312[01] 05 092 CZERWIEC 2009 id Nieznany (2)
02 WAI protokoly 2013id 3829 Nieznany (2)
713[05] Z2 04 Wykonywanie oklad Nieznany
713[05] Z1 08 Wykonywanie posad Nieznany
więcej podobnych podstron