
1
2
3
26.
a, c, d, e
2
za wybranie 4 podpunktów – 2 pkt
za wybranie 3 podpunktów – 1 pkt
27.
a) opis obserwacji – 1 pkt
4
Na powierzchni p∏ytki pojawi∏ si´ srebrzystoszary nalot.
napisanie równania reakcji – 1 pkt
2 Ag
+
+ Cu
$
2 Ag + Cu
2+
b) obliczenie moli miedzi – 1 pkt
n
Cu
2+
= 0,2 mola + 0,1 mola (powstaje w reakcji)
obliczenie st´˝enia – 1 pkt
[Cu
2+
] = 3 mol/dm
3
28.
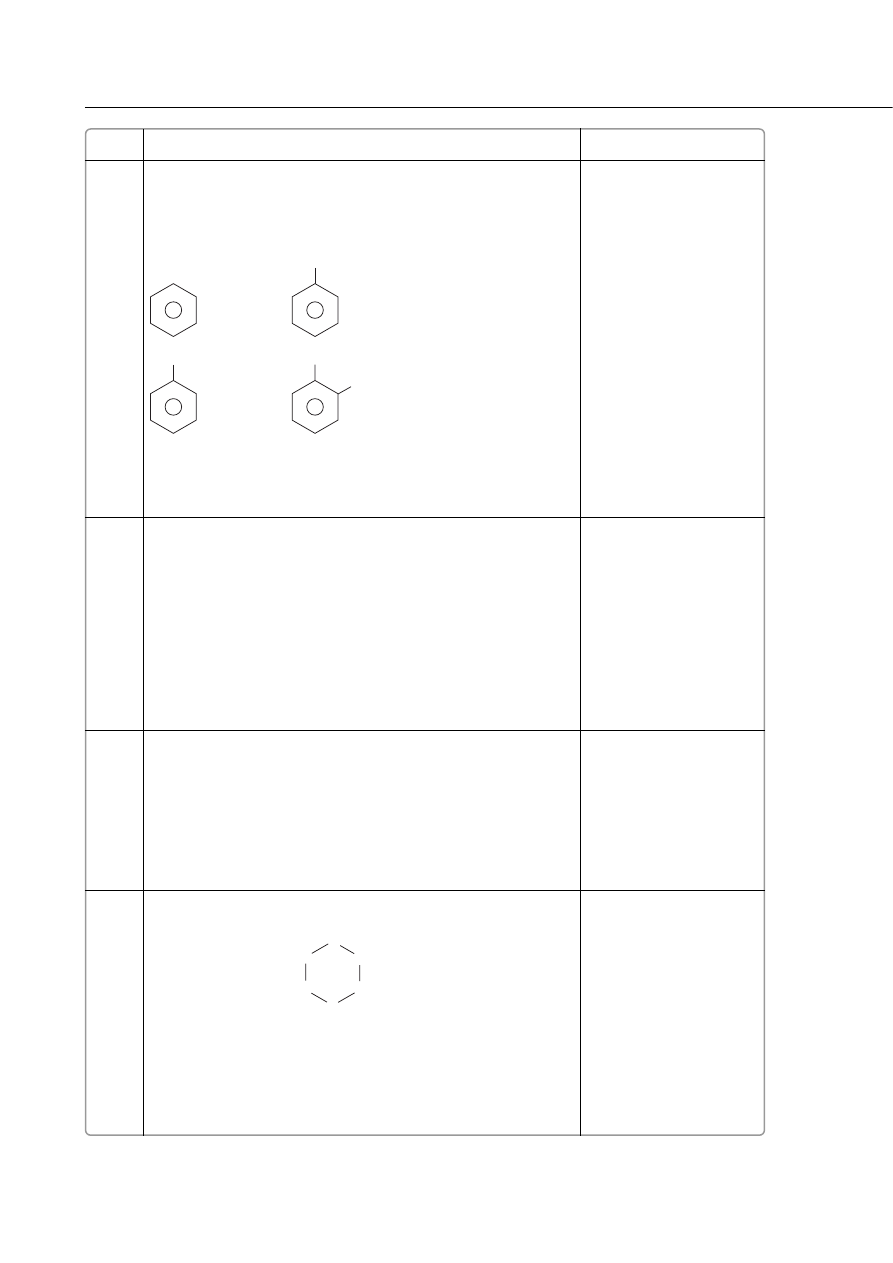
Opis wykonania doÊwiadczenia:
8
1. Papierkiem wskaênikowym badamy odczyn roztworu w´glanu
sodu. – 1 pkt
2. Do w´glanu sodu dodajemy kwas solny. – 1 pkt
Obserwacje:
1. Papierek zabarwi∏ si´ na kolor niebieski (szaroniebieski). – 1 pkt
2. Wydziela si´ bezbarwny gaz. – 1 pkt
Wnioski:
1. Odczyn roztworu Na
2
CO
3
jest zasadowy w wyniku hydrolizy
soli mocnej zasady i s∏abego kwasu. – 1 pkt
2. Kwas solny wypiera s∏aby kwas w´glowy, który rozk∏ada si´
na wod´ i tlenek w´gla(IV). – 1 pkt
napisanie równania reakcji – 2 x 1 pkt:
1. CO
3
2–
+ H
2
O
$
HCO
3
–
+ OH
–
2. CO
3
2–
+ 2 H
+
$
H
2
O + CO
2
29.
napisanie równania reakcji – 1 pkt
4
2 Na + 2 H
2
O
$
2 NaOH + H
2
obliczenie st´˝enia molowego [OH
–
] – 2 pkt
obliczenie pH roztworu – 1 pkt
n
NaOH
= 0,1 mola
$
[OH
–
] = 0,1
$
pOH = 1, pH = 13
30.
podanie wzoru: CH
3
—CHBr—CH
2
Br – 1 pkt
2
podanie nazwy: 1,2-dibromopropan – 1 pkt
4
■
C H E M I A – Z A K R E S R O Z S Z E R Z O N Y
w w w. o p e r o n . p l
Modele odpowiedzi i schemat punktowania
Arkusz II
Nr
zadania
Modele odpowiedzi
Suma punktów
1
2
3
31.
a) napisanie równania reakcji – 3 x 1 pkt
7
okreÊlenie 3 typów reakcji – 2 pkt
okreÊlenie 2 typów reakcji – 1 pkt
b) podanie 3 nazw produktów – 2 pkt
podanie 2 nazw produktów – 1 pkt
C
2
H
5
OH + HNO
3
$
C
2
H
5
ONO
2
+ H
2
O
typy reakcji: 1. substytucja (nitrowanie);
2. substytucja (nitrowanie); 3. estryfikacja
nazwy: 1. nitrobenzen; 2.
orto-nitrofenol; 3. azotan(V) etylu
32.
a) napisanie równania reakcji – 3 x 1 pkt
5
Ca + 2 H
2
O
$
Ca(OH)
2
+ H
2
CaO + H
2
O
$
Ca(OH)
2
Ca
2
+ 2 H
2
O
$
Ca(OH)
2
+ C
2
H
2
b) obliczenie moli wody – 1 pkt
n
Ca
= 0,1
n
CaO
= 0,2
n
CaO
= 0,3
n
H
2
O
= 2 · 0,1 + 0,2 + 2 · 0,3 = 1 mol
obliczenie masy wody – 1 pkt
m
H
2
O
= 18 g
33.
a) napisanie równania reakcji – 2 x 1 pkt
4
Fe + 2 HCl
$
FeCl
2
+ H
2
2 Fe + 3 Cl
2
$
2 FeCl
3
b) obliczenie st´˝eƒ – 2 x 1 pkt
m
FeCl
2
= 12,7 g
C
%
= 6,35%
n
FeCl
3
=
n
Fe
= 0,1
C
%
= 8,1%
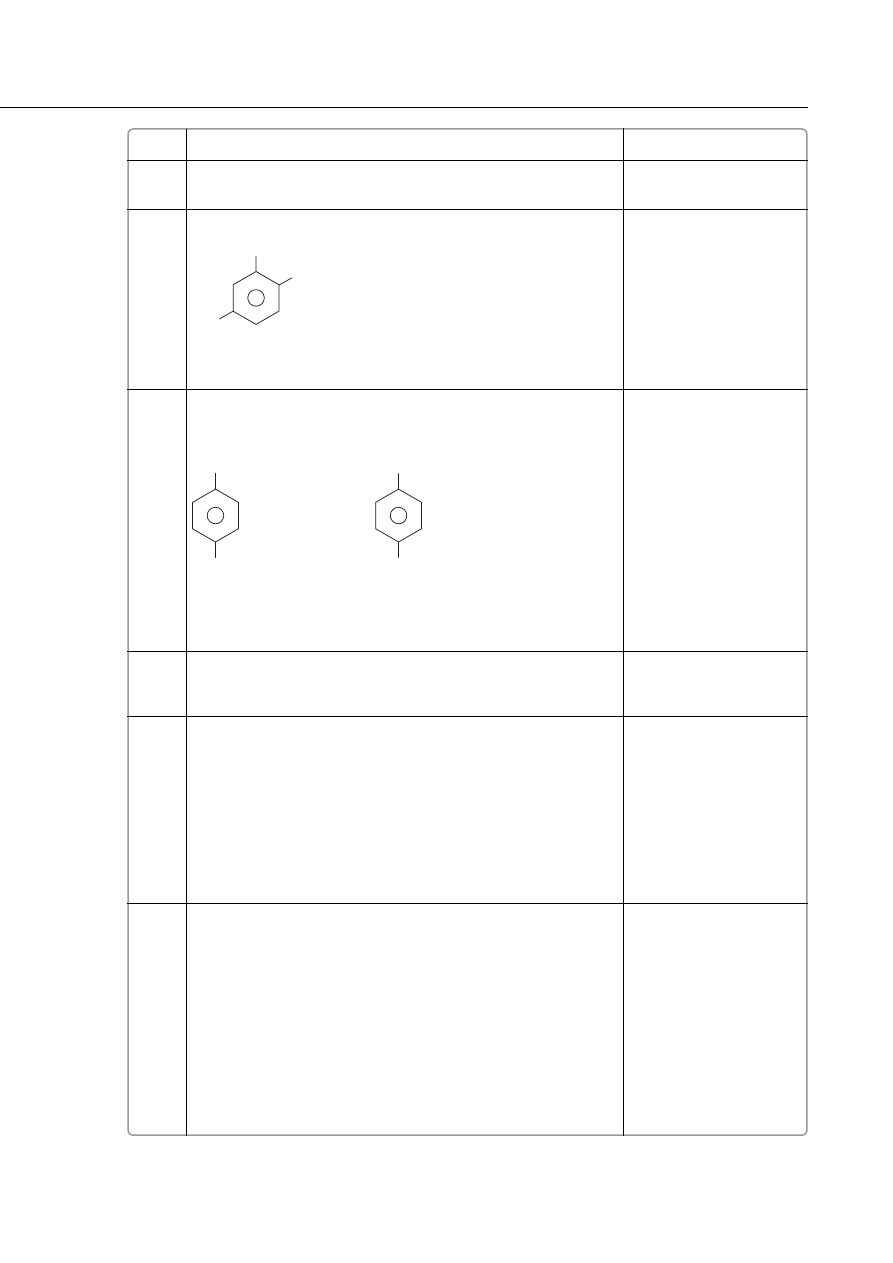
34.
a) podanie wzoru laktonu – 1 pkt
2
lakton
b) podanie wzoru hydroksykwasu – 1 pkt
hydroksykwas
5
A R K U S Z I I – M O D E L E O D P O W I E D Z I I S C H E M A T P U N K T O W A N I A
■
w w w. o p e r o n . p l
+ HNO
3
$ + H
2
O
H
2
SO
4
NO
2
+ HNO
3
$ + H
2
O
H
2
SO
4
OH
NO
2
OH
H
2
C
O
CH
2
CH
2
CH
3
—CH
CH==O
CH
3
––CH––CH
2
––CH––CH
2
––COOH
––
––
OH
CH
3
6
■
C H E M I A – Z A K R E S R O Z S Z E R Z O N Y
w w w. o p e r o n . p l
1
2
3
35.
za podanie symbolu, wartoÊci
Z i A – po 1 pkt
3
P,
A = 30, Z = 15
36.
podanie wzoru pó∏strukturalnego – 1 pkt
2
podanie wzoru sumarycznego – 1 pkt
C
10
H
14
O
37.
napisanie wzorów produktów – 1 pkt
3
napisanie wspó∏czynników stechiometrycznych – 1 pkt
sporzàdzenie bilansu elektronowego – 1 pkt
–III III
C
$
C + 6
VI III
2 Cr + 6 e
–
$
2 Cr
38.
podanie nazw 3 pierwiastków – 1 pkt
2
podanie nazw 4 pierwiastków – 2 pkt
nazwy pierwiastków: hel, fluor, fosfor, chlor
39.
obliczenie sta∏ej dysocjacji – 1 pkt
3
K =
=
= 1,6 · 10
–3
wskazanie kwasu – 1 pkt
kwas chlorooctowy
obliczenie stopnia dysocjacji – 1 pkt
α = =
0,17
α = 17%
40.
a) podanie nazw 2 pierwiastków – 1 pkt
5
lit i fluor
konfiguracje elektronowe – 2 x 1 pkt
Li: 1
s
2
2
s
1
lub
K
2
L
1
F: 1
s
2
2
s
2
2
p
5
lub
K
2
L
7
podanie nazwy wiàzania – 1 pkt
wiàzanie jonowe
b) podanie nazw 2 pierwiastków beryl i fluor – 1 pkt
0,008
–––––––––––––
0,008 + 0,04
(0,008)
2
––––––––
0,04
[H
+
][
A
–
]
––––––––
[H
A]
OH
CH––CH
3
—
H
3
C
CH
3
CH
3
NO
2
COOH
NO
2
+ Cr
2
O
7
2–
+ 8 H
+
$ + 2 Cr
3+
+ 5 H
2
O
1
2
3
41.
wskazanie równania kinetycznego: II – 1 pkt
3
odczytanie
k – 1 pkt
obliczenie
V – 1 pkt
V = k[A][B]
2
V = 0,1
· 2
3
= 0,8
42.
napisanie wzoru – 1 pkt
2
podanie nazwy – 1 pkt
D(–)fruktoza
43.
za napisanie 2 wzorów estrów – po 1 pkt
4
napisanie równaƒ reakcji – 2 x 1 pkt
44.
napisanie równania reakcji – 1 pkt
3
BaO + H
2
O
$
Ba(OH)
2
obliczenie masy Ba(OH)
2
– 1 pkt
m
Ba(OH)
2
= 11,4 g
obliczenie masy roztworu – 1 pkt
m
roztworu
= 103,8 g
45.
obliczenie entalpii reakcji – 2 pkt
2
∆H = 461,8 kJ
Maksymalna liczba punktów – 70.
mol
––––––––
dm
3
· s
dm
3
––––––––
mol
2
· s
7
A R K U S Z I I – M O D E L E O D P O W I E D Z I I S C H E M A T P U N K T O W A N I A
■
w w w. o p e r o n . p l
CH
2
OH
CH
2
OH
C==O
HO––C––H
H––C––OH
H––C––OH
HCOOC
2
H
5
CH
3
—COOCH
3
HCOOC
2
H
5
+ NH
3
$ HC + C
2
H
5
OH
NH
2
O
CH
3
COOCH
3
+ NH
3
$ CH
3
—C + CH
3
OH
NH
2
O
Wyszukiwarka
Podobne podstrony:
0000 01 02 odp
01 02 tytulowa
ei 2005 01 02 s078
LKM cw 01 02
01 02 2013
2007 05 02 odp
01 02 (3)
01 02 Projektstruktur Step7 Funktionen S7
2010 01 02, str 106 110
O Czym Lekarze Ci Nie Powiedzą 01 02 2014
312[01] 02 112
312[01] 02 062 CZERWIEC 2006
ekonomia W 01 02, ekonomia wyklady
01.02.04, Specyfikacje Techniczne
01 02 Taikyoku Sono Ichi, Ni
więcej podobnych podstron