2011-03-17
1
BIAŁKA – STRUKTURA, FUNKCJE,
METABOLIZM
BIAŁKA
BIAŁKA
BIAŁKA
H
3
N
H
N
N
H
H
N
N
H
H
N
N
H
H
N
N
H
H
N
N
H
H
N
O
O
O
O
O
R
1
R
2
R
3
R
4
R
5
O
R
6
R
7
O
R
8
O
R
9
O
R
10
O
R
11
O
R
12
O
+
Struktura pierwszorzędowa polipeptydu zdeterminowana jest
genetycznie. Sekwencja polipeptydu zawiera informację o strukturze
przestrzennej polipeptydu, tj. o konformacji.
Struktura pierwszorzędowa to liniowa sekwencja kolejnych
aminokwasów połączonych wiązaniami peptydowymi.
+
C
O
-
N
H
C
O
N
H
C
N
H
C
'
C
O
w wiązaniu peptydowym połączenie między atomem węgla i azotu
ma charakter częściowo (w ~40%) wiązania podwójnego. Wiązanie
peptydowe jest sztywne, wszystkie jego cztery atomy znajdują się
w jednej płaszczyźnie.
BIAŁKA – STRUKTURA I RZĘDOWA
BIAŁKA – STRUKTURA II RZĘDOWA

2011-03-17
2
BIAŁKA – STRUKTURA II RZĘDOWA
BIAŁKA – STRUKTURA II RZĘDOWA
BIAŁKA – STRUKTURA II RZĘDOWA
BIAŁKA – STRUKTURA III RZĘDOWA
BIAŁKA – STRUKTURA III RZĘDOWA
Specyficzne
wiązanie się białek z innymi cząsteczkami stanowi
istotę ich funkcjonowania.
BIAŁKA – STRUKTURA A FUNKCJA
Rozmaitość łańcuchów bocznych znajdujących się na powierzchniach
cząsteczek białek umożliwia im tworzenie wiązań wodorowych,
elektrostatycznych i van der Waalsa z innymi cząsteczkami a to
decyduje o pełnieniu określonych funkcji.
Oddziaływania pomiędzy
aktyną a miozyną
umożliwiają skurcz
mięśni
Możliwość wiązania przez
mioglobinę grupy hemowej
decyduje o jej zdolności do
magazynowania tlenu w
mięśniach
Wiązanie obcych cząsteczek
do przeciwciał pozwala na
reakcję immunologiczną
Specyficzne wiązanie
enzymu z substratem jest
podstawą reakcji
katalitycznej
(tu lipooksygenaza)
2011-03-17
3
BIAŁKA – STRUKTURA A FUNKCJA
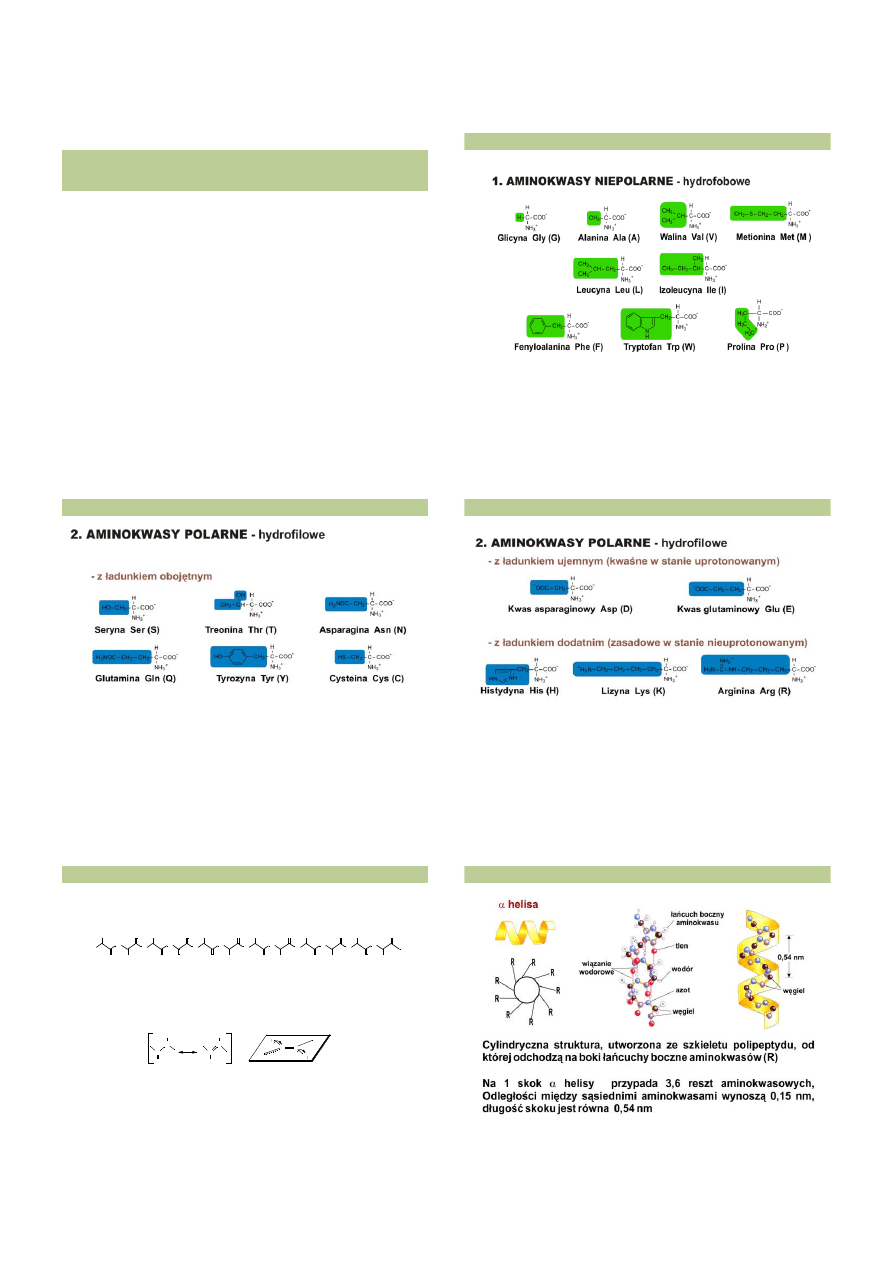
http://adultstemcellawareness.files.wordpress.com/2007/10/sickle-cell.jpg
PUNKT IZOELEKTRYCZNY BIAŁKA
Wzajemne ułożenie względem siebie kilku polipeptydowych
podjednostek białka (dotyczy tylko białek wielopodjednostkowych)
Przykładem jest hemoglobina
– białko allosteryczne.
Wiązanie tlenu z hemoglobiną
jest kooperatywne tzn.
związanie tlenu z jednym
hemem ułatwia wiązanie tlenu
z hemem kolejnej podjednostki
Wynika to z faktu, że
utlenowanie prowadzi do
znacznych zmian w
czwartorzędowej strukturze
hemoglobiny
BIAŁKA – STRUKTURA IV RZĘDOWA
BIAŁKA SUROWICY
FRAKCJE BIAŁEK
SUROWICY
60%
4%
9%
10%
17%
Albuminy
α1-globuliny
α2-globuliny
β-globuliny
γ-globuliny
BIAŁKA SUROWICY
ALBUMINY
– dobrze rozpuszczają się
w wodzie i wykazują do niej wysokie
powinowactwo
• Dzięki temu utrzymują prawidłowe
ciśnienie onkotyczne krwi.
• Wpływają w ten sposób na rozmieszczenie
płynów między przestrzenią pozakomórkową
a łożyskiem naczyniowym
• Są wytwarzane w wątrobie i mają zdolność
wiązania i transportu m.in. bilirubiny, miedzi, wapnia, niektórych
hormonów i leków
• Spadek stężenia albuminy (hipoalbuminemia) wywołany
zmniejszoną syntezą w przypadku uszkodzenia hepatocytów lub
ucieczką albumin do moczu np. w nerczycy, prowadzi do
powstawania obrzęków
FRAKCJE BIAŁEK SUROWICY
2011-03-17
4
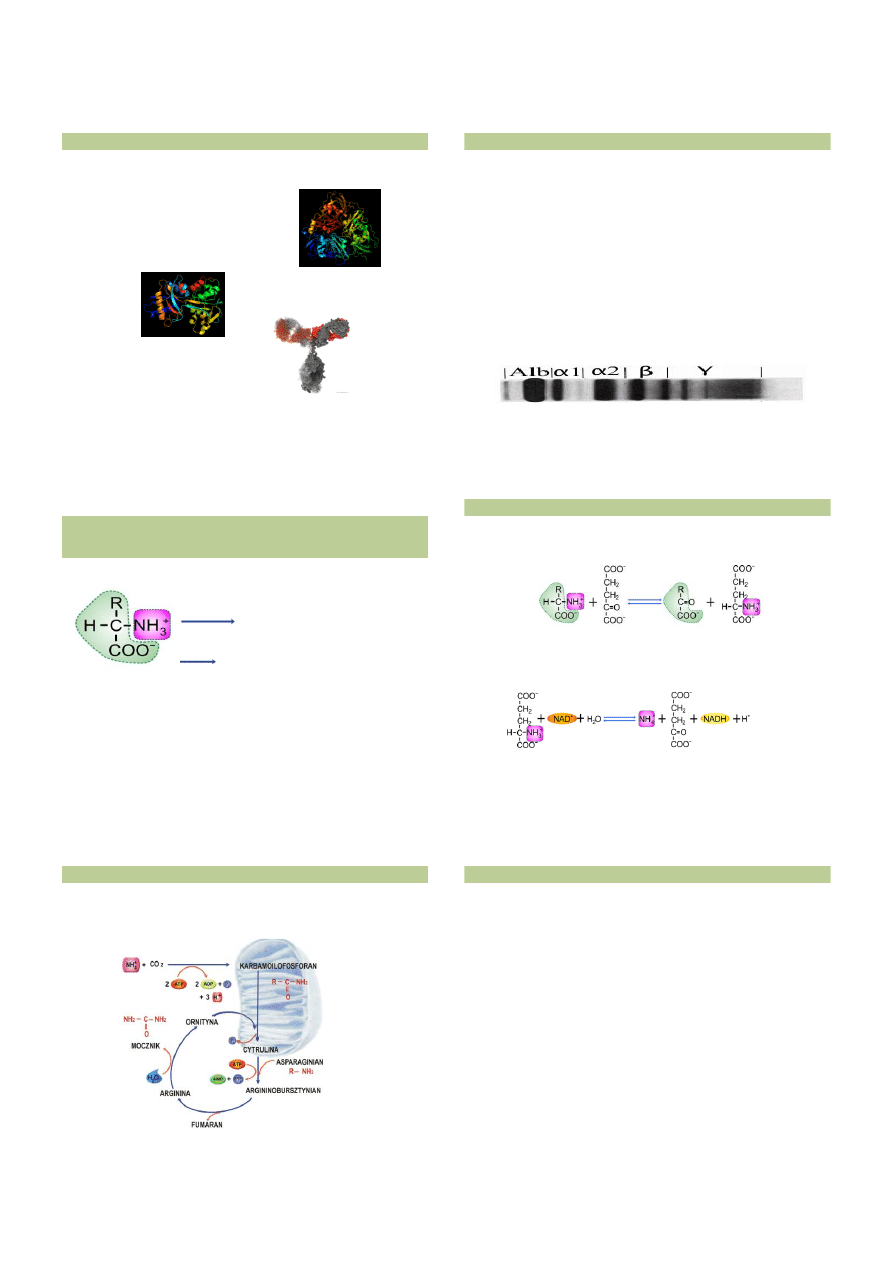
α1 GLOBULINY –
należy tu m.in.
α1 antytrypsyna -
białko ostrej fazy
α2 GLOBULINY – należą tu m.in.
ceruloplazmina
transportująca miedź
transkortyna
wiążąca hormony steroidowe
(glikokortykoidy) we krwi, które w tej postaci
nie wykazują aktywności biologicznej
β GLOBULINY – m.in.
transferyna -
transportująca żelazo
γ GLOBULINY –
należą tu
przeciwciała
Wzrost stężenia tej frakcji świadczy o toczącym
się w organizmie procesie zapalnym
FRAKCJE BIAŁEK SUROWICY
http://en.wikipedia.org
Określa się wykonując tzw. proteinogram czyli rozdział
elektroforetyczny białek
Wzrost ilości białka całkowitego - bardzo rzadko, np. w szpiczaku
(pojawia się białko patologiczne)
• Obniżenie stężenia białka całkowitego występuje przy dużej jego
utracie z ustroju, np. w nerczycy
• Częste są przesunięcia w obrębie frakcji białkowych, np.
• Obniżenie zawartości albumin –
może świadczyć o nadmiernej
ich utracie z ustroju (białkomocz, krwotoki, ciecze wysiękowe) lub
z zahamowaniem syntezy (choroby wątroby)
• Podwyższenie zawartości frakcji globulinowych
spotyka się
najczęściej w stanach zapalnych (α-globuliny), w przewlekłych
chorobach zakaźnych lub schorzeniach wątroby (β- i γ-globuliny)
ZABURZENIA ILOŚCI BIAŁEK SUROWICY
2
) Szkielety węglowe
zostają przekształcone
w jeden lub więcej
metabolitów pośrednich
1
) Grupa α-aminowa
zostaje odłączona
w procesie
transaminacji
KATABOLIZM AMINOKWASÓW
Grupa α-aminowa
w reakcji TRANSAMINACJI, katalizowanej przez
aminotransferazy
zostaje przeniesiona najczęściej na
α-ketoglutaran.
Koenzymem w tej reakcji jest
fosforan pirydoksalu
(pochodna wit.
B6
)
Następnie
glutaminian
ulega OKSYDACYJNEJ DEAMINACJI,
katalizowanej przez
dehydrogenazę glutaminianową
i powstaje
amoniak
. Koenzymem w tej reakcji jest
NAD+
aminokwas α-ketoglutaran
α-ketokwas
glutaminian
glutaminian
amoniak
α-ketoglutaran
KATABOLIZM AMINOKWASÓW
Toksyczny
amoniak
po przekształceniu w
karbamoilofosforan
wchodzi do CYKLU MOCZNIKOWEGO,
w którym zostaje
przekształcony w
mocznik
- w tej postaci wydalany jest nadmiar
azotu z organizmu
KATABOLIZM AMINOKWASÓW
Szkielety węglowe aminokwasów
(
α-ketokwasy)
zostają
przekształcone w odpowiednie metabolity, w zależności od rodzaju
aminokwasu:
- aminokwasy glukogenne
–
po przekształceniu w pirogronian, α-
ketoglutaran, bursztynylo-CoA, fumaran lub szczawiooctan
mogą być dalej utleniane w cyklu Krebsa i dostarczać energii lub
mogą brać udział w syntezie
glukozy
- aminokwasy ketogenne -
po przekształceniu w acetylo-CoA lub
acetoacetylo-CoA
mogą być dalej utleniane w cyklu Krebsa
dostarczając energię (acetylo-CoA) lub mogą brać udział w syntezie
ciał ketonowych
KATABOLIZM AMINOKWASÓW
Wyszukiwarka
Podobne podstrony:
Prezentacja rozszerzona
informatyka sekrety skutecznych prezentacji multimedialnych wydanie ii rozszerzone pawel lenar ebook
Prezentacja 3 Charakterystyka egzaminu na poziomie rozszerzonym
prezentacja finanse ludnosci
prezentacja mikro Kubska 2
Religia Mezopotamii prezentacja
Prezentacja konsument ostateczna
Strategie marketingowe prezentacje wykład
motumbo www prezentacje org
lab5 prezentacja
Prezentacja 18
Materialy pomocnicze prezentacja maturalna
Prezentacja na seminarium
Lato prezentacja 3
Prezentacja1
Wyklad 3 rozszerzony
więcej podobnych podstron