
LIPIDY. BUDOWA I METABOLIZM
Lipidy są heterogenną grupą nierozpuszczalnych w wodzie (hydrofobowych) związków organicznych, które
mogą być ekstrahowane z tkanek przy użyciu rozpuszczalników niepolarnych.
Z powodu ich nierozpuszczalności w środowisku wodnym rozmieszczenie lipidów w organizmie jest bardzo
nierównomierne.
Większość z nich jest skupiona w cytoplazmie komórek tłuszczowych, w błonach biologicznych i w komplek-
sach z białkami osoczowymi.
Lipidy są głównym źródłem energii dla organizmu ludzkiego.
Ponadto stwarzają hydrofobowe struktury błonowe, odgraniczające komórkę od macierzy pozakomórkowej i
dzielące wnętrze komórki na wiele przedziałów.
Niektóre z lipidów są witaminami lub koenzymami.
Lipidowy charakter wykazują także substancje regulujące homeostazę ustrojową, wśród nich hormony
steroidowe i prostaglandyny.
Nieprawidłowości w metabolizmie lipidów to źródło poważnych procesów patologicznych, przede wszystkim
miażdżycy i otyłości.
W organizmie ludzkim najobficiej występującymi lipidami są kwasy tłuszczowe, acyloglicerole, fosfolipidy,
sfingolipidy oraz cholesterol i jego liczne pochodne.
Kwasy tłuszczowe
Kwasy tłuszczowe składają się z łańcucha węglowodorowego zakończonego grupą karboksylową.
W fizjologicznym pH grupa ta występuje w postaci zjonizowanej (-COO-), kwas tłuszczowy, którego grupa -
COOH została pozbawiona fragmentu -OH nosi nazwę reszty acylowej lub grupy acylowej.
Wspomniane formy kwasu tłuszczowego, na przykładzie kwasu palmitynowego, przedstawia
ryc. 7. 1.
Rys. 7.1. Kwas palmitynowy .
A – postać niezdysocjonowana
B- anionowa postać tego kwasu
C- reszta (grupa) palmitoilowa
Zdecydowana większość kwasów tłuszczowych cechuje się
parzystą liczbę atomów węgla.
Najczęściej występujące zawierają 16 lub 18 atomów węgla.
Dzielą się one na nasycone (tabela 7.1) i nienasycone (tabela
7.2).
Te ostatnie zawierają od 1 do 6 wiązań podwójnych, najczę-
ściej o konfiguracji cis.
Konfiguracja trans występuje rzadko.
Obecność podwójnego wiązania typu cis sprawia, iż w miejscu tym następuje zagięcie długiej osi kwasu
tłuszczowego.
Jeżeli kwas tłuszczowy zawiera dwa lub więcej podwójnych wiązań, nigdy nie występują one w bezpośrednim
sąsiedztwie.
Atomy węgla uczestniczące w tworzeniu takich wiązań są rozdzielone przez grupę
[-CH2-].
W miarę wzrostu liczby atomów węgla w cząsteczce kwasu tłuszczowego rośnie jego temperatura topnienia,
natomiast obecność i wzrost liczby podwójnych wiązań powoduje obniżenie tej temperatury.
Cząsteczka kwasu tłuszczowego ma charakter amfipatyczny.
Oznacza to, iż posiada ona fragment hydrofobowy (łańcuch węglowodorowy) i fragment hydrofilny (grupa
karboksylowa-zdolna do dysocjacji).
Jednakże, szczególnie w kwasach tłuszczowych o długim łańcuchu węglowodorowym, zdecydowanie dominu-
ją właściwości hydrofobowe.
Kwasy takie, mimo obecności fragmentu hydrofilnego, są nierozpuszczalne w środowisku wodnym.
Poszczególnym atomom węgla, wchodzącym w skład cząsteczki kwasu tłuszczowego, przypisano kolejne
numery; poczynając od węgla grupy karboksylowej, oznaczanego numerem 1 (C1).
Równolegle funkcjonuje inny system oznaczania atomów węgla.
Atom C2, z którym wiąże się grupa karboksylowa, nazywany jest węglem α, atom C3 jest węglem β, atom C4
węglem γ etc.
Ostatni z atomów węgla, tworzący koniec metylowy nosi nazwę węgla ω niezależnie od długości łańcucha.
W niektórych przypadkach, szczególnie w odniesieniu do kwasów nienasyconych, stosuje się numerację
atomów węgla, poczynając od węgla ω i nadając mu numer ω1.
Na przykład, kwas linolenowy jest kwasem ω-3, ponieważ wiązanie podwójne najbliższe węglowi ω znajduje
się przy węglu 3, natomiast kwas linolowy jest zaliczany do kwasów ω-6, ponieważ najbliższe węglowi ω
wiązanie podwójne, znajduje się przy węglu
C6.
Rys. 7.2. Sposób numeracji atomów węgla
w kwasach tłuszczowych i oznaczania ich
literami greckimi:
A – w kwasach nasyconych – poczynając od
grupy karboksylowej, B – w kwasach
nienasyconych – poczynając od końca
metylowego (od węgla ω)
Niemal wszystkie kwasy tłuszczowe mają łańcuchy proste.
Kwasy rozgałęzione występują bardzo rzadko.
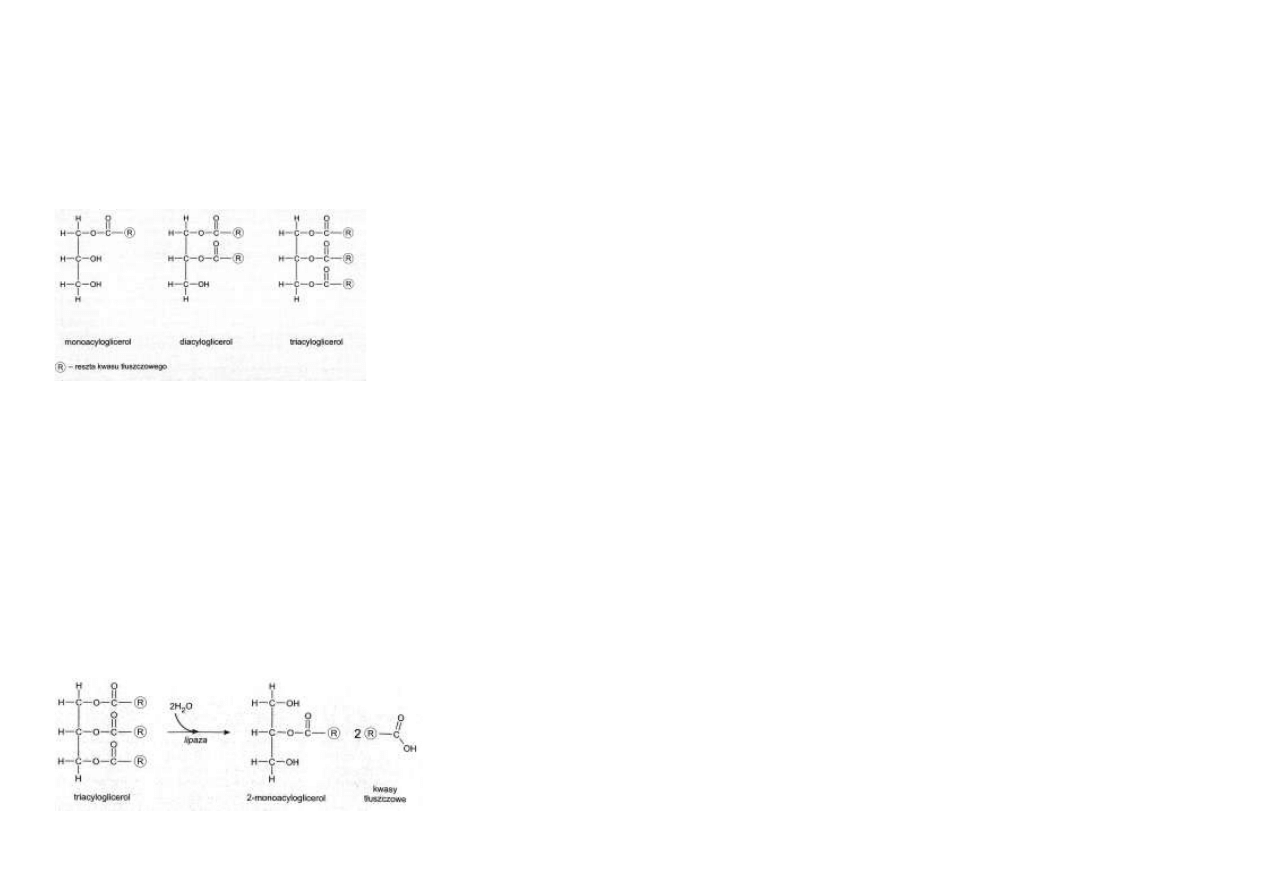
Acyloglicerole
Acyloglicerole są estrami glicerolu i kwasów tłuszczowych.
W zależności od liczby reszt kwasów tłuszczowych wchodzących w skład cząsteczki, wyróżnia się monoacylo-
glicerole, diacyloglicerole i triacyloglicerole (ryc. 7.3).
Rys. 7.3. Acyloglicerole o różnej liczbie reszt
kwasów tłuszczowych.
W skład jednej cząsteczki triacyloglicerolu
mogą wchodzić reszty jednakowych (rzadko)
bądź różnych (często) kwasów tłuszczowych.
W pozycji C1 glicerolu zwykle kwas nasyco-
ny, przy węglu C2 kwas nienasycony, a przy
C3 równie często każdy z nich.
Obecność nienasyconych kwasów tłuszczo-
wych obniża temperaturę topnienia acylogli-
ceroli.
Triacyloglicerole są głównym rezerwuarem energii dla organizmu ludzkiego.
Są one bowiem (w przeciwieństwie do cukrów) w wysokim stopniu zredukowane.
Stosunek wodoru do tlenu w triacyloglicerolach jest wielokrotnie wyższy niż w cukrach.
Są one magazynowane w organizmie w bezwodnej formie.
Stanowią około 60-90% masy tkanki tłuszczowej.
W małej objętości tkanki może być zdeponowana duża ilość substratu energetycznego.
Utlenienie 1 g tłuszczu do CO2 i H2O dostarcza ponad dwukrotnie więcej (około 37 kJ/g) energii niż utlenia-
nie cukrów czy białek (około I 7 kJ/g).
Trawienie acylogliceroli pokarmowych
Dorosły człowiek pobiera w ciągu doby około 60 - 150 g lipidów.
Ponad 90% z nich to triacyloglicerole.
Wśród pozostałych występują cholesterol i jego estry, fosfolipidy i wolne kwasy tłuszczowe.
Rozkład acylogliceroli i innych estrów kwasów tłuszczowych nosi nazwę lipolizy.
Enzymy katalizujące proces lipolizy nazywają się lipazami.
Triacyloglicerole są trawione przez
lipazę trzustkową, która odłącza
kwasy tłuszczowe przy skrajnych
atomach węgla: C1 i C3 glicerolu.
Produktami tej reakcji jest mie-
szanina 2-monoacyloglicerolu i
wolnych kwasów tłuszczowych
(ryc. 7.4).
Rys. 7.4. Hydrolityczny rozpad
triacylogliceroli pod działaniem
lipazy trzustkowej.
Na powierzchni komórek śródbłonka naczyń włosowatych, głównie mięśni szkieletowych, tkanki tłuszczowej,
mięśnia sercowego, płuc, nerki i wątroby, występuje lipaza lipoproteinowa.
Enzym ten rozkłada triacyloglicerole, zawarte w krążących chylomikronach, do glicerolu i wolnych kwasów
tłuszczowych.
Od łacińskiej nazwy limfy (chyle) wywodzi się nazwa tych kompleksów: chylomikrony.
Wędrują one jako składnik limfy poprzez przewód piersiowy do lewej żyły podobojczykowej, gdzie miesza ją
się z krwią.
Glicerol uwalniany z triacylogliceroli jest zużywany niemal wyłącznie przez wątrobę do produkcji glicerolo-3-
fosforanu, który jest utleniany do fosfodihydroksyacetonu.
Ten ostatni może być przekształcany w jednym spośród trzech możliwych głównych kierunków.
Włącza się do glikolizy - przetwarzając się w pirogronian, lub do glukoneogenezy - przetwarzając się w gluko-
zę, bądź redukuje się do glicerolo-3-fosforanu - służąc jako substrat do ponownej syntezy triacylogliceroli.
Kwasy tłuszczowe uwolnione z triacylogliceroli wnikają do wnętrza przylegających komórek lub wiążą się z
albuminą osoczową i krążą we krwi do czasu ich wychwycenia przez komórki.
Większość komórek utlenia kwasy tłuszczowe w celu produkcji energii.
Inaczej zachowują się komórki tkanki tłuszczowej, zwane lipocytami lub adipocytami.
Zużywają one wolne kwasy tłuszczowe do resyntezy triacylogliceroli, które są przechowywane we wnętrzu
tych komórek jako zapasowy materiał energetyczny.
Rozkład triacylogliceroli w komórkach
Mechanizm rozkładu triacylogliceroli w komórkach, a przede wszystkim w tkance tłuszczowej, jest zasadni-
czo podobny do rozpadu triacylogliceroli w przewodzie pokarmowym.
Proces ten jest jednak regulowany przez układ hormonalny.
Mobilizacja kwasów tłuszczowych, zmagazynowanych w postaci triacylogliceroli w komórkach tłuszczowych,
następuje na drodze hydrolizy katalizowanej przez lipazę hormonowrażliwą, która odłącza kwasy tłuszczowe
w pozycji C1 lub C3 triacyloglicerolu.
Inne lipazy, specyficzne wobec monoacylogliceroli lub diacylogliceroli, odłączają pozostałe kwasy tłuszczowe.
Lipaza hormonowrażliwa - jak wskazuje jej nazwa - pozostaje pod regulacyjną kontrolą hormonów, głównie
adrenaliny.
Hormon ten pobudza proces lipolizy w tkankach.
Lipaza hormonowrażliwa jest aktywowana poprzez fosforylację białka enzymatycznego - pobudzaną przez
adrenalinę, a unieczynnianą na drodze defosforylacji tego enzymu, pobudzanej przez insulinę.
Wolne kwasy tłuszczowe przenikają przez błonę komórkową adipocytów, dostają się do krwi, gdzie wiążą się z
albuminą osoczową.
W kompleksie z albuminą są transportowane do tkanek obwodowych, gdzie ponownie wnikają do komórek i
są utleniane w celu uzyskania energii.
Niektóre komórki - a zwłaszcza erytrocyty i komórki nerwowe - nie mogą zużywać kwasów tłuszczowych do
celów energetycznych.
Utlenienie kwasów tłuszczowych
Głównym źródłem kwasów tłuszczowych w komórce jest lipoliza acylogliceroli i estrów cholesterolu oraz
biosynteza tych kwasów w komórce.
Obydwa te procesy zachodzą w cytosolu, natomiast utlenienie kwasów tłuszczowych zachodzi w macierzy
mitochondrialnej.
Oznacza to, iż kwasy tłuszczowe przeznaczone do utlenienia muszą być przetransportowane do wnętrza
mitochondrium.
W procesie utleniania kwasów tłuszczowych współdziałają: cytosol i mitochondria, a w utlenianiu kwasów o
bardzo długim łańcuchu węglowym (ponad 20 C) dodatkowo uczestniczą peroksysomy.
Kwasy tłuszczowe o krótkim łańcuchu, zawierającym do 10 atomów węgla, przenikają bezpośrednio do
wnętrza mitochondrium.
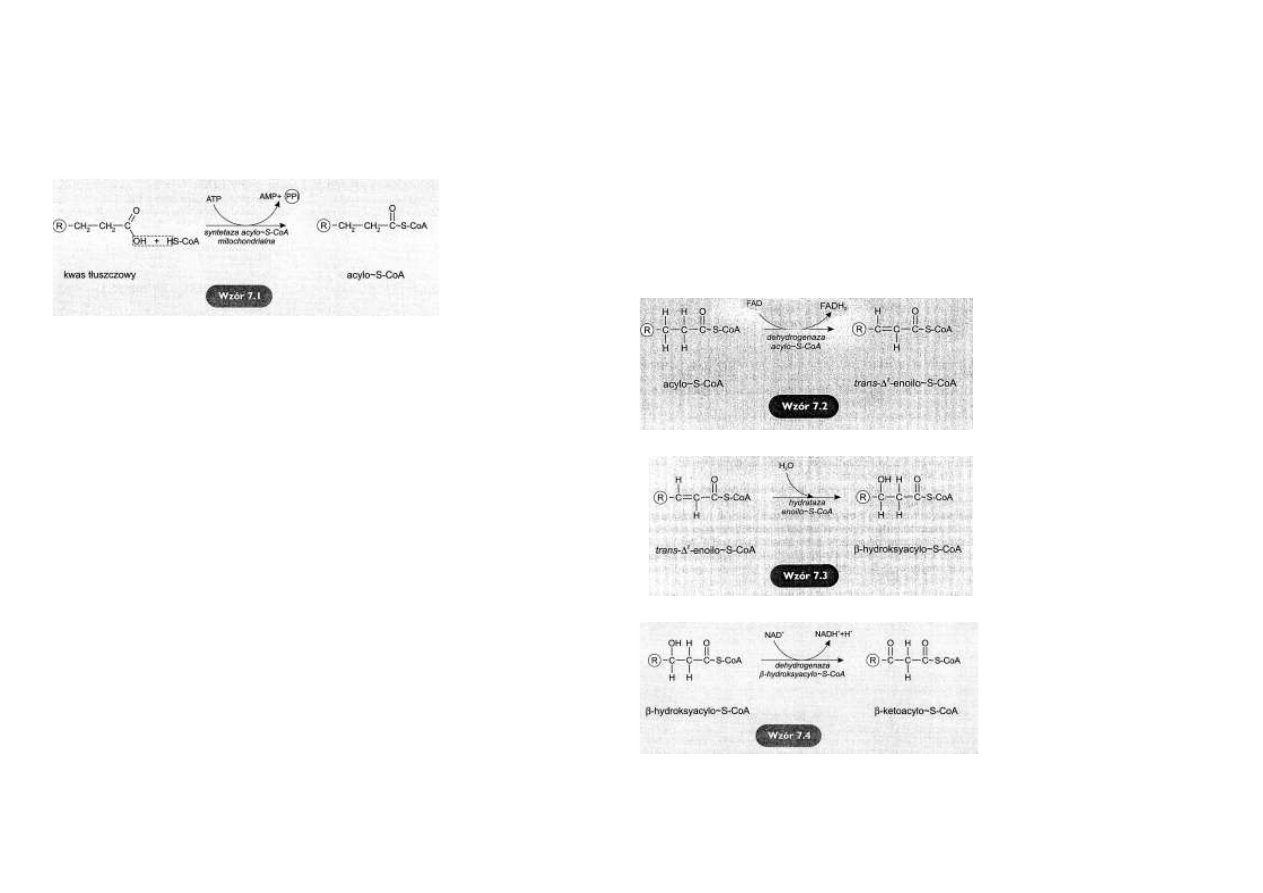
Tam są aktywowane poprzez przyłączenie CoA-SH, kosztem energii powstałej z rozpadu jednej cząsteczki ATP
do AMP i pirofosforanu.
Powstaje odpowiedni acylo~S-CoA
(wzór 7.1).
Reakcja
jest
katalizowana
przez mitochondrialną synte-
tazę acylo~S-CoA (tiokinazę).
Koszt energetyczny tego proce-
su jest równoważny utracie
dwóch cząsteczek ATP przy
jego przemianie do ADP.
Powstały pirofosforan rozpada
się natychmiast pod działa-
niem pirofosfatazy do dwóch
cząsteczek fosforanu nieorganicznego, dlatego reakcja aktywacji kwasu tłuszczowego jest nieodwracalna.
Kwasy tłuszczowe o długich łańcuchach (12 i więcej atomów C w cząsteczce) nie mogą bezpośrednio wnikać
do mitochondrium.
Przeszkodę stanowi wewnętrzna błona mitochondrialna.
Ich aktywacja zachodzi w cytosolu poprzez przyłączenie CoA-SH, kosztem energii powstałej z rozpadu jednej
cząsteczki ATP do AMP i pirofosforanu.
Reakcja jest katalizowana przez cytosolową syntetazę acylo~S-CoA (tiokinazę).
Powstaje odpowiedni acylo~S-CoA (wzór 7.1), a pirofosforan rozpada się natychmiast pod działaniem pirofos-
fatazy do dwóch cząsteczek fosforanu, podobnie jak w wyżej przedstawionej reakcji aktywacji kwasów tłusz-
czowych w mitochondrium.
Także i w tym przypadku koszt energetyczny tego procesu jest równoważny utracie 2 cząsteczek ATP przy
jego przemianie do ADP.
Wewnętrzna błona mitochondrialna jest nieprzepuszczalna dla (cytosolowego) acylo~S-CoA.
Dlatego w komórce funkcjonuje specjalistyczny system transportu reszt acylowych, z cytosolu do macierzy
mitochondrialnej.
Przenośnikiem jest karnityna.
Proces ten polega na przenoszeniu reszt acylowych z cytosolowego acylo~S-CoA na karnitynę z wytworzeniem
acylokarnityny.
Ta przenika do macierzy mitochondrialnej, gdzie grupa acylowa zostaje przeniesiona na mitochondrialny
CoA-SH z ponownym wytworzeniem (mitochondrialnego) acylo~S-CoA.
Wspomniany system transportu nosi nazwę czółenka karnitynowego lub mostka karnitynowego .
Utlenianie kwasów tłuszczowych w mitochondriach jest procesem dwuetapowym.
Każdy z etapów składa się z wielu reakcji pośrednich.
Pierwszy etap tego procesu nosi nazwę β-oksydacji.
Polega on na:
- wielokrotnie powtarzanych reakcjach utleniania łańcucha węglowodorowego kwasu tłuszczowego przy
węglu β,
- na rozpadzie utlenianego substratu na fragmenty dwuwęglowe.
Każdy cykl β-oksydacji powoduje skrócenie łańcucha kwasu tłuszczowego o kolejny fragment dwuwęglowy,
co skutkuje pojawianiem się coraz to nowych węgli β.
Produktem β-oksydacji jest wiele cząsteczek acetylo~S-CoA.
Drugi etap polega na utlenianiu reszt acetylowych (octanowych) w cyklu kwasów trikarboksylowych do CO2 i
H2O.
Obydwa procesy są bardzo wydajne pod względem energetycznym.
Dostarczają ATP.
Przebieg procesu β-oksydacji wszystkich kwasów tłuszczowych przebiega podobnie.
Jednak pomiędzy utlenianiem kwasów o parzystej i nieparzystej liczbie atomów węgla,
-kwasów nasyconych i nienasyconych,
-kwasów o łańcuchu prostym i rozgałęzionym zachodzą pewne różnice, które wymagają odrębnego omówie-
nia.
β-oksydacja nasyconych kwasów tłuszczowych o parzystej liczbie atomów węgla
Większość kwasów tłuszczowych nasyconych, występujących w organizmie człowieka, zawiera parzystą
liczbę atomów węgla.
Dlatego podczas β-oksydacji rozpada się na odpowiednią liczbę cząsteczek acetylo~S-CoA.
Utlenianie acylo~S-CoA
Pierwszym etapem β-oksydacji jest odłą-
czenie pary atomów wodoru od węgli α i β.
Reakcję katalizuje dehydrogenaza acylo~S-
CoA.
Akceptorem wodorów jest FAD.
Powstaje trans Δ2enoilo~S-CoA i cząstecz-
ka FADH2
(wzór 7.2).
Hydratacja trans-Δ2enoilo~S-CoA
Produkt poprzedniej reakcji przyłącza H2O
w miejscu podwójnego wiązania.
Reakcję katalizuje hydrataza enoilo~S-CoA.
Wodór wiąże się z węglem α a grupa -OH z
węglem β.
Powstaje β-hydroksyacylo~S-CoA
(wzór
7.3).
Utlenianie β-hydroksyacylo~S-CoA
Kolejna reakcja polega na utlenianiu
produktu poprzedniej reakcji przy udziale
dehydrogenazy β-hydroksyacy1o~S-CoA,
współdziałającej z NAD+.
Enzym odłącza parę atomów wodoru
(2H++2e-) od β-hydroksyacylo~S-CoA.
Powstaje β-ketoacylo~S-CoA i cząsteczka
NADH +H
+ (wzór 7.4).
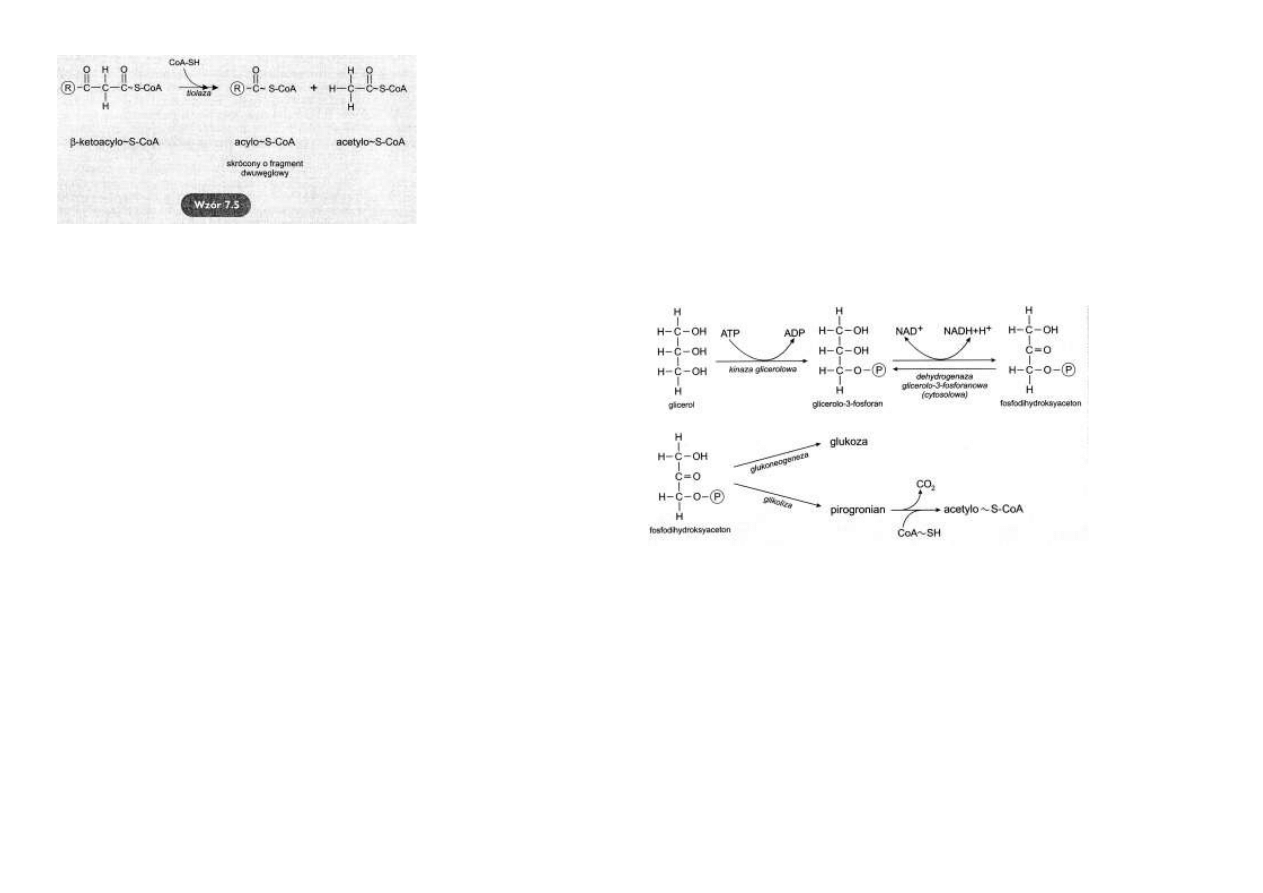
Odłączenie acetylo~S-CoA
Kolejna reakcja prowadzi do skró-
cenia łańcucha kwasu tłuszczowe-
go o fragment dwuwęglowy.
Pod działaniem tiolazy i CoA-SH
następuje odłączenie acetylo~S-
CoA i powstanie nowego acylo~S-
CoA, krótszego od poprzedniego o
dwa atomy węgla
(wzór 7.5).
Cztery powyższe reakcje powtarzają
się wielokrotnie, aż do całkowitego
rozpadu kwasu tłuszczowego na n cząsteczek acetylo~S-CoA.
Wartość n równa się liczbie par atomów węgla występujących w utlenianym kwasie tłuszczowym.
Liczba zachodzących β-oksydacji równa się: n-1, gdyż produktem ostatniej z nich są dwie cząsteczki acety-
lo~S-CoA.
Rola peroksysomów
Peroksysomy uczestniczą w β-oksydacji kwasów tłuszczowych o bardzo długim łańcuchu (ponad 22 C).
Proces ten prowadzi do skrócenia wspomnianych łańcuchów, a to ułatwia ich dalszą β-oksydację w mito-
chondriach.
Metaboliczne losy acetylo~S-CoA
Większość acetylo~S-CoA - włącza się do cyklu kwasów trikarboksylowych, gdzie reszty acetylowe utleniają
się do CO2 i H2O.
Ponadto metabolit ten może być substratem w biosyntezie cholesterolu, estrów acetylowych, ciał ketono-
wych, nowych kwasów tłuszczowych lub acetylowych pochodnych aminoheksoz.
Bilans energetyczny β-oksydacji i utleniania jej produktów
Ilość energii uwolnionej w wyniku całkowitego utlenienia kwasu tłuszczowego zależy przede wszystkim od
długości łańcucha węglowego.
Przykładem może być niżej przedstawiony bilans utleniania kwasu palmitynowego, zawierającego 16 atomów
węgla.
Aktywacja palmitynianu, zachodząca w cytosolu, pociąga za sobą wydatek energii równoważny utracie 2
cząsteczek ATP.
W każdej β-oksydacji zachodzą dwie reakcje utleniania, pierwsza z udziałem FAD, której towarzyszy powsta-
nie 2 cząsteczek ATP, i druga z odziałem NAD+, której towarzyszy powstanie 3 cząsteczek ATP.
Każda β-oksydacja dostarcza więc 5 cząsteczek ATP.
Utlenienie każdej reszty acetylowej w cyklu Krebsa dostarcza 12 cząsteczek ATP.
Proces β-oksydacji zachodzi 7-krotne, w jego wyniku powstaje 8 cząsteczek acetylo~S-CoA.
Z powyższych rozważań wynika, niżej przedstawiony bilans energetyczny utleniania palmitynianu.
Aktywacja palmitynianu do palmitoilo~S-CoA -2 ATP
β-oksydacja palmitoilo~S-CoA (7 x 5 ATP) +35 ATP
Spalanie reszt acetylowych w cyklu Krebsa (8 x 12 ATP) +96 ATP
Łącznie: utlenienie 1 cząsteczki palmitynianu do CO2 i H2O dostarcza 129 cząsteczek ATP.
Utlenianie kwasów tłuszczowych o niższej lub wyższej liczbie atomów węgla w cząsteczce, dostarcza odpo-
wiednio mniej lub więcej ATP.
Utleniane glicerolu
Glicerol, pochodzący z rozpadu acylogliceroli, jest fosforylowany w cytosolu przez kinazę glicerolową zużywa-
jącą cząsteczkę ATP.
Powstaje glicerolo-3-fosforan.
W kolejnym etapie glicerolo-3-fosforan jest utleniany przez dehydrogenazę glicerolo-3-fosforanową kosztem
redukcji NAD+ do NADH+H+.
Powstaje fosfodihydroksyaceton, który jest metabolitem pośrednim, zarówno w glukoneogenezie, jak i w
glikolizie.
Może przekształcać się w glukozę (jest to dominujący kierunek przemiany glicerolu) lub utleniać się do piro-
gronianu.
Ten ostatni drogą oksydacyjnej dekarboksylacji przekształca się w acetylo~S-CoA, a reszta acetylowa - po-
przez cykl kwasów
trikarboksylowych -
utlenia się do CO2 i
H2O
dostarczając
ATP (ryc. 7.7).
Rys. 7.7. Metabolizm
glicerolu.
Glicerol, jako pro-
dukt lipolizy po-
wstaje głównie w
adipocytach, ale nie
może być w nich
metabolizowany,
ponieważ komórki te
nie posiadają kinazy
glicerolowej.
Glicerol jest związ-
kiem dobrze roz-
puszczalnym
w
wodzie.
Przenika do krwi i jest transportowany do wątroby.
Tam jest fosforylowany przez wątrobową kinazę glicerolową i przetwarzany w sposób wyżej omówiony.
Bilans energetyczny utleniania glicerolu wynika:
- z wcześniejszych rozważań nad efektem energetycznym glikolizy,
- oksydacyjnej dekarboksylacji pirogronianu i utleniania reszt acetylowych w cyklu Krebsa.
Uwzględnia następujące etapy jego przemiany:
Fosforylacja glicerolu (zużywająca ATP) -1 ATP
Utlenienie glicerolo-3-fosforanu do fosfodihydroksyacetonu +3 ATP
Przemiana fosfodihydroksyacetonu w pirogronian drogą glikolizy +5 ATP
Oksydacyjna dekarboksylacja pirogronianu +3 ATP
Utlenianie reszty acetylowej w cyklu Krebsa + 12 ATP
Łącznie: utlenienie 1 cząsteczki glicerolu do CO2 i H2O po uwzględnieniu „straty” 1 cząsteczki ATP
zużytej na fosforylację glicerolu, dostarcza 22 cząsteczek ATP.
Wyszukiwarka
Podobne podstrony:
LIPIDY budowa i metabolizm
lipidy - podział i metabolizm, Technologia żywności i żywienia człowieka, Biochemia
BCH Integracja i regulacja metabolizmu
lipidy - podział i metabolizm, Technologia żywności i żywienia człowieka, Biochemia
BCh Budowa zwiazkow id 81937 Nieznany (2)
BCh Budowa związków
wd 4 glukoza, lipidy metabolizm, regulatory ekspresji genów
Lipidy metabolizm, Kosmetologia, Notatki i wyłady, Biochemia
Fizjologia, budowa i regulacja metabolizmu tkanki kostnej
Budowa chemiczna i metabolizm TSH
10 budowa i rozwój OUN
Budowa Układu Okresowego Pierwiastków
więcej podobnych podstron