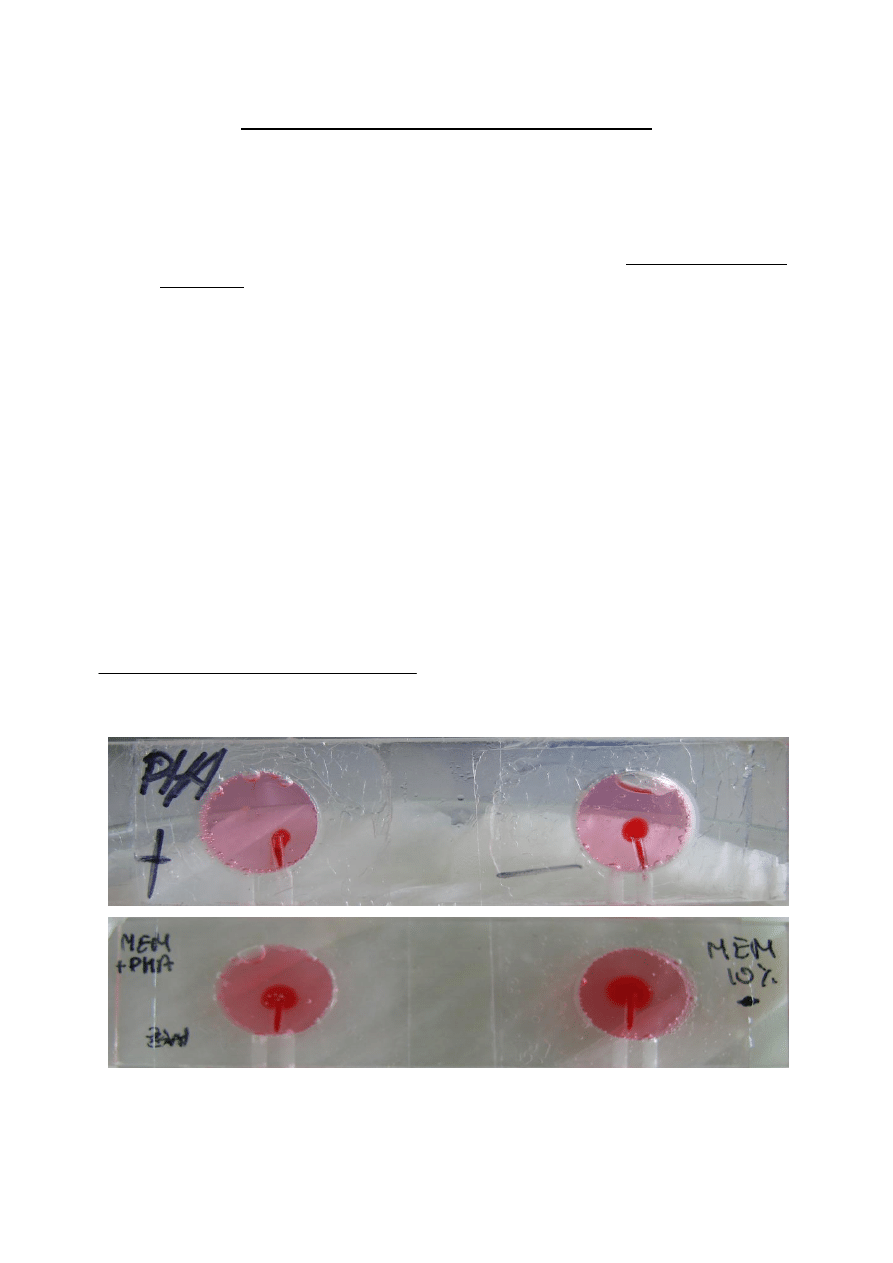
Ćw. 7 Test zahamowania migracji makrofagów.
•
Cel:
wykrycie jednej z cytokin, zwanej czynnikiem hamującym migrację (MIF – Migration
Inhibitory Factor)
• Pobudzone antygenem (np. endotoksyną – LPS) monocyty i makrofagi wytwarzają cytokinę
MIF zatrzymującą te komórki w miejscu infekcji. Cytokina ta jest miernikiem odpowiedzi
komórkowej na dany antygen.
• Badanie wykonuje się w rurkach kapilarnych, w których obecne są leukocyty izolowane z krwi
lub wysięku otrzewnowego.
•
Jeśli brak jest antygenu
, to komórki ruchliwe (makrofagi i monocyty) wędrują z kapilary do
otaczającego środowiska.
•
Dodanie do płynu hodowlanego swoistego antygenu
skutkuje wydzielaniem przez uczulone
limfocyty T cytokiny MIF, a co za tym idzie zahamowanie migracji makrofagów.
Mierząc strefy zajęte przez wędrujące komórki w próbie badanej i kontrolnej, można określid stopieo
zahamowania ich migracji (MII – Migration Inhibitory Index) korzystając ze wzoru:
% zahamowania migracji makrofagów:
średni obszar migracji w obecności antygenu
średni obszar migracji bez antygenu

Wykonanie:
1. Komory do testu przemyd alkoholem i wytrzed jałową gazą.
2. Z jednej strony nakleid (smar silikonowy) szkiełko nakrywkowe.
3. Nakłud palec jałową igłą.
4. Wprowadzid krew do dwóch kapilar na wysokośd około 1cm.
5. Pusty koniec kapilary zatopid w płomieniu palnika i odwirowad przez 7 min przy 500xg w
wirówce hematokrytowej.
6. Po odwirowaniu uciąd kapilarę na granicy płynu i osadu komórek.
7. Odcięte kapilary przykleid częścią zatopioną do dna komory smarem silikonowym.
8. Jedno oczko komory wypełnid płynem Eagle‘a bez antygenu (
kontrola
), drugie - płynem
Eagle‘a z dodatkiem antygenu (
próba badana
).
9. Oczka komory zakleid szkiełkami nakrywkowymi, a otwory boczne zakleid parafiną.
10. Płytki umieścid w wilgotnej komorze i inkubowad przez 24h w 37
o
C.
Wyszukiwarka
Podobne podstrony:
cw 07a
Cw estymacja TEST
cw 07a
Test-XX, studia, Logistyka Politechnika Świętokrzyska, Semestr 2, Makroekonomia, ćw, zestawy
jak zahamować agresję, APS, psychologia spoleczna ćw
Test wzorcowy, ćw
Test wzorcowy, ćw 2
Test-XXX, studia, Logistyka Politechnika Świętokrzyska, Semestr 2, Makroekonomia, ćw, zestawy
Test-X 1, studia, Logistyka Politechnika Świętokrzyska, Semestr 2, Makroekonomia, ćw, zestawy
MiUT test ćw 5 Bembenek, WIMiR AGH, Semestr VI, Maszyny i Urządzenia Technologiczne (MiUT), Kolokwia
Test ZSIK 10 (cw)
Zarządzanie projektami - A. Zaleśna - ćw - test odp 05.06.2011r, wsfizZarządzanie projektami
więcej podobnych podstron