
Rok Akademicki
2013/2014
Laboratorium Chemii Fizycznej
Ćwiczenie nr
2
Temat ćwiczenia:
Ogniwa chemiczne.
Wydział Inżynierii Materiałowej i
Ceramiki
Tomasz Bugaj
Beata Duda
Martyna Pokwiczał
Marta Tempka
Kierunek:
Inżynieria Materiałowa
Rok studiów
II rok
Grupa I
Zespół 1
Data zajęć:
05.04.2014
Data oddania sprawozdania:
Oceny
(pkt):
Prowadzący ćwiczenie
TOMASZ BRYLEWSKI
Dzień zajęć
Sobota
Kolokwium
Podpis prowadzącego:
Godzina zajęć 9:00-12:45
Sprawozdanie
1. Cel ćwiczenia:
Celem ćwiczenia przeprowadzonego na zajęciach laboratoryjnych, było zmierzenie siły
elektromotorycznej ogniw Daniella o różnych stężeniach roztworów oraz wyznaczenie iloczynu
rozpuszczalności trudno rozpuszczalnej soli srebra na podstawie pomiarów SEM ogniwa
miedziowo-srebrowego podczas miareczkowania roztworu AgNO
3
roztworem soli KCl.
2. Opracowanie wyników:
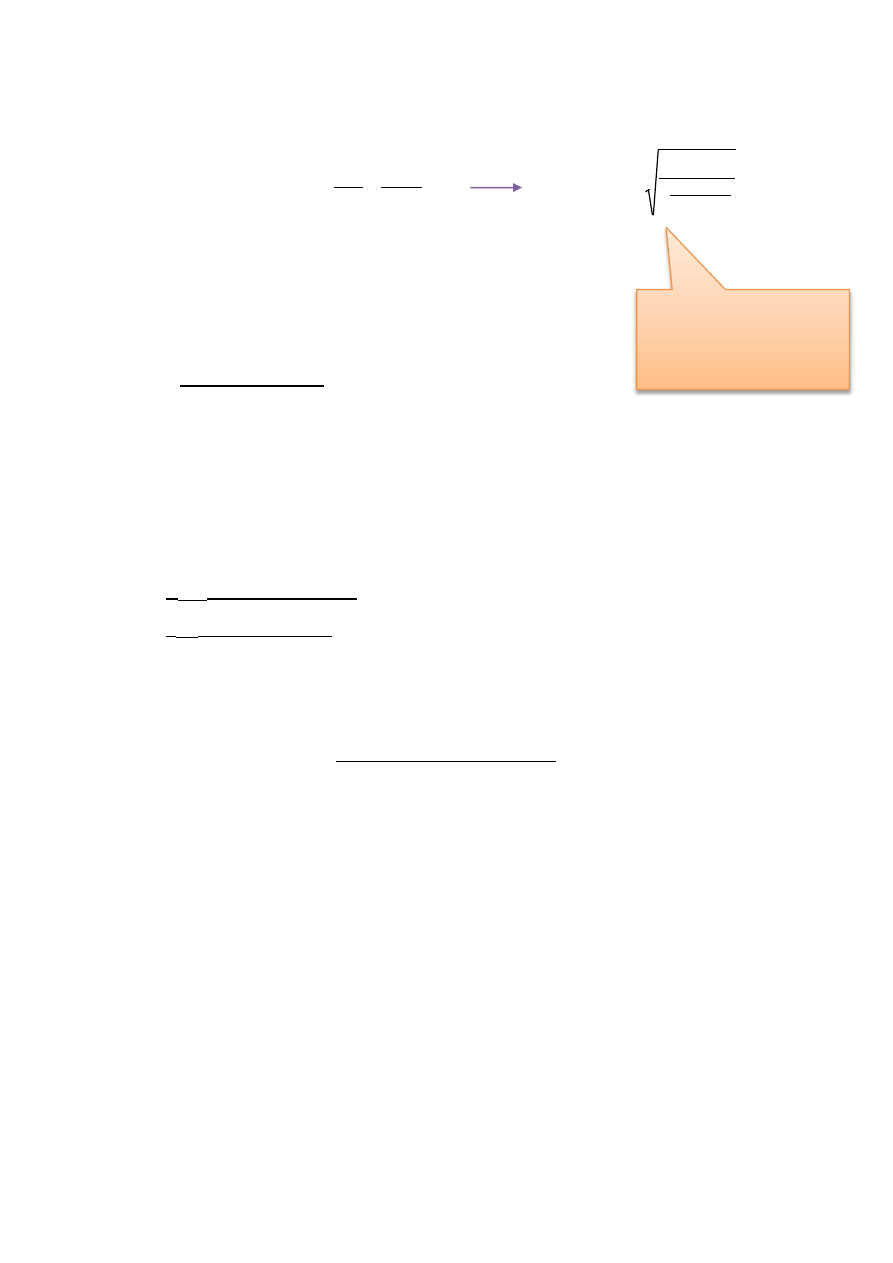
1) Obliczanie wartości teoretycznej SEM ogniwa Daniella:
gdzie:
R - uniwersalna stała gazowa = 8,314[J/mol*K]
T-temperatura =298[K]
F-stała Faradaya =96500 [C]
E
0
– standardowa SEM ogniwa
Stężenie
roztworu [M]
Rodzaj
ogniwa
E
teor
[V]
E
dośw
[V]
Potencjał
dyfuzyjny
E
d
Błąd
względny
[%]
0,1
ZnSO
4
/ KCl /
CuSO
4
1,100348
1,101899
0,001555
0,14
0,5
ZnSO
4
/ KCl /
CuSO
4
1,1003504
1,103494
0,0031436
0,29
1,0
ZnSO
4
/ KCl /
CuSO
4
1,100306
1,100308
0,000002
0,000182
2
2
2
2
ln
2
ln
2
Cu
Zn
o
Zn
Cu
Cu
Zn
o
a
a
F
RT
E
a
a
a
a
F
RT
E
E
Wartości SEM teoretycznej są nieznacznie różne od wartości zmierzonych doświadczalnie.
Prawdopodobnie różnice te są spowodowane potencjałem dyfuzyjnym.
2) Obliczanie wartości teoretycznej SEM ogniwa miedziowo-srebrowego
gdzie:
R - uniwersalna stała gazowa = 8,314[J/mol*K]
T-temperatura =298[K]
F-stała Faradaya =96500 [C]
E
0
– standardowa SEM ogniwa
Przyczyny tych rozbieżności są takie same jak w przypadku ogniw Daniella.
3) Obliczanie aktywności jonów Ag
+
przy której SEM badanego ogniwa
przyjmuje wartość zero.
KCl [ml]
SEM [V]
∆ SEM/∆ KCl
∆ KCl
∆SEM
0,7
0,368
0,0168
0,3
0,00504
1
0,36296
0,00724
0,5
0,00362
1,5
0,35934
0,01462
0,5
0,00731
2
0,35203
0,00936
0,5
0,00468
2,5
0,34735
0,00536
0,5
0,00268
3
0,34467
0,01628
0,5
0,00814
3,5
0,33653
0,0296
0,1
0,00296
3,6
0,33357
0,0072
0,1
0,00072
3,7
0,33285
0,0109
0,1
0,00109
3,8
0,33176
0,0312
0,1
0,00312
3,9
0,32864
0,0116
0,1
0,00116
4
0,32748
0,0697
0,1
0,00697
4,1
0,32051
0,0382
0,1
0,00382
4,2
0,31669
0,0345
0,1
0,00345
4,3
0,31324
0,0395
0,1
0,00395
4,4
0,30929
0,0372
0,1
0,00372
4,5
0,30557
0,0732
0,1
0,00732
4,6
0,29825
0,0915
0,1
0,00915
4,7
0,2891
0,0718
0,1
0,00718
4,8
0,28192
0,2814
0,1
0,02814
4,9
0,25378
1,205
0,1
0,1205
5
0,13328
0,1858
0,1
0,01858
5,1
0,1147
0,0695
0,1
0,00695
2
0
2
ln
2
Ag
Cu
a
a
F
RT
E
E
Rodzaj ogniwa
E
teor
[V]
E
dośw
[V]
Potencjał
dyfuzyjny E
d
Błąd
względny [%]
1M CuSO
4
/ 0,01M
AgNO
3(50ml)
0,4349
0,3731
-0
,
061777
14,2
5,2
0,10775
0,0665
0,1
0,00665
5,3
0,1011
0,0611
0,1
0,00611
5,4
0,09499
0,0553
0,1
0,00553
5,5
0,08946
0,03202
0,5
0,01601
6
0,07345
0,01698
0,5
0,00849
6,5
0,06496
0,01238
0,5
0,00619
7
0,05877
0,00998
0,5
0,00499
7,5
0,05378
0,00718
0,5
0,00359
8
0,05019
0,00558
0,5
0,00279
8,5
0,0474
0,00628
0,5
0,00314
9
0,04426
0,00562
0,5
0,00281
9,5
0,04145
0,00452
0,5
0,00226
10
0,03919
0,0038
1
0,0038
11
0,03539
0,00262
1
0,00262
12
0,03277
0,00269
1
0,00269
13
0,03008
0,00267
1
0,00267
14
0,02741
0,00228
1
0,00228
15
0,02513
0,00153
1
0,00153
16
0,0236
0,00184
1
0,00184
17
0,02176
0,0014
1
0,0014
18
0,02036
0,00141
1
0,00141
19
0,01895
0,00106
1
0,00106
20
0,01789
0,0009
1
0,0009
21
0,01699
0,00117
1
0,00117
22
0,01582
0,0005
1
0,0005
23
0,01532
0,0001
1
0,0001
24
0,01422
0,00068
1
0,00068
25
0,01354
0,00078
1
0,00078
26
0,01276
0,0007
1
0,0007
27
0,01206
0,00045
1
0,00045
28
0,01161
0,00085
1
0,00085
29
0,01076
0,00061
1
0,00061
30
0,01015
0,00027
1
0,00027
31
0,00988
0,0006
1
0,0006
32
0,00928
0,00052
1
0,00052
33
0,00876
0,00048
1
0,00048
34
0,00828
0,00061
1
0,00061
35
0,00767
0,00058
1
0,00058
36
0,00709
0,00031
1
0,00031
37
0,00678
0,0004
1
0,0004
38
0,00638
0,00039
1
0,00039
39
0,00599
0,00029
1
0,00029
40
0,0057
0,00027
1
0,00027
41
0,00543
0,00038
1
0,00038
42
0,00505
0,00052
1
0,00052
43
0,00453
0,0003
1
0,0003
44
0,00423
0,00003
1
0,00003
45
0,0042
0,00021
1
0,00021
46
0,00399
0,00115
1
0,00115
47
0,00284
0,00016
1
0,00016
48
0,00268
0,00029
1
0,00029
49
0,00239
0,00019
1
0,00019
50
0,0022
0
0,05
0,1
0,15
0,2
0,25
0,3
0,35
0,4
w
ar
to
ść
S
EM
[V
]
KCl [ml]
E=f(V)
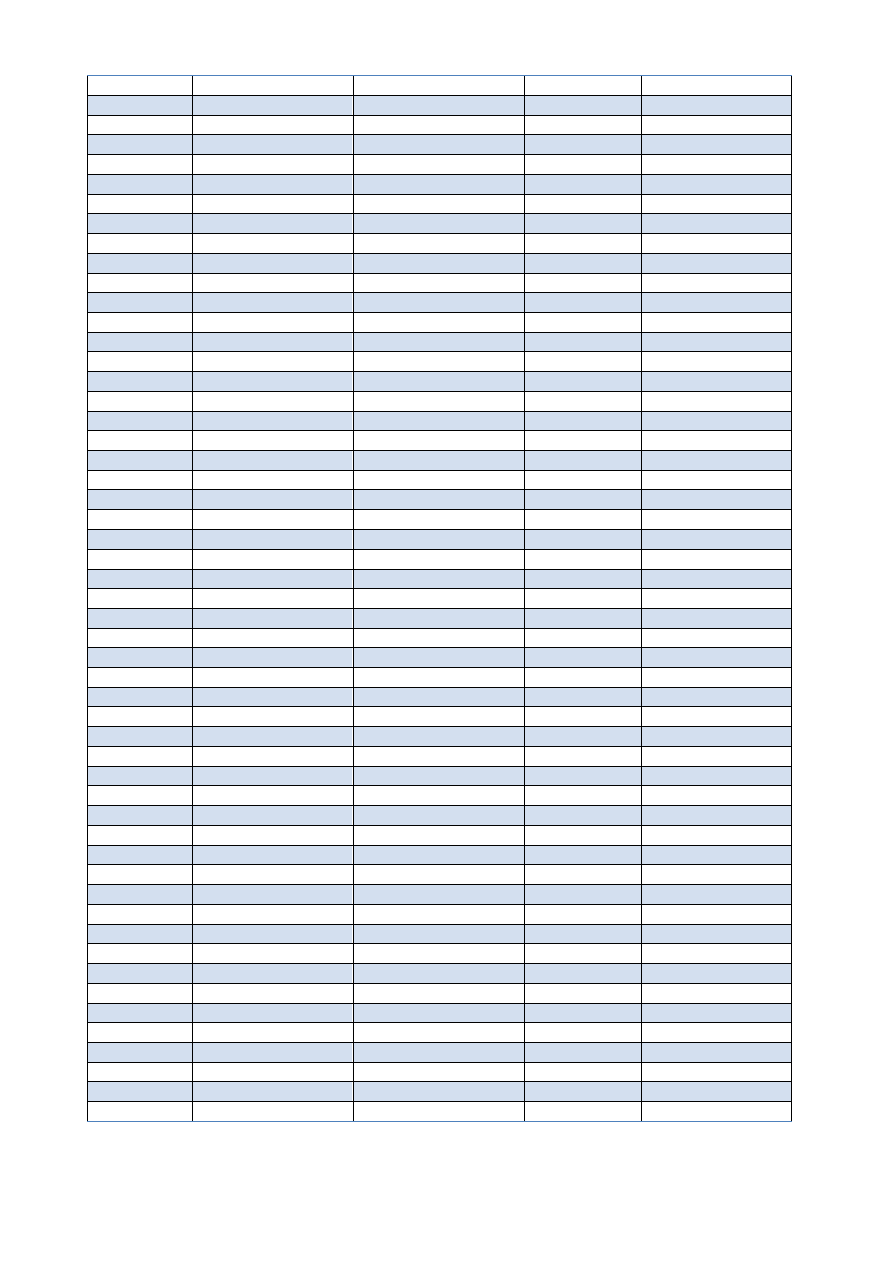
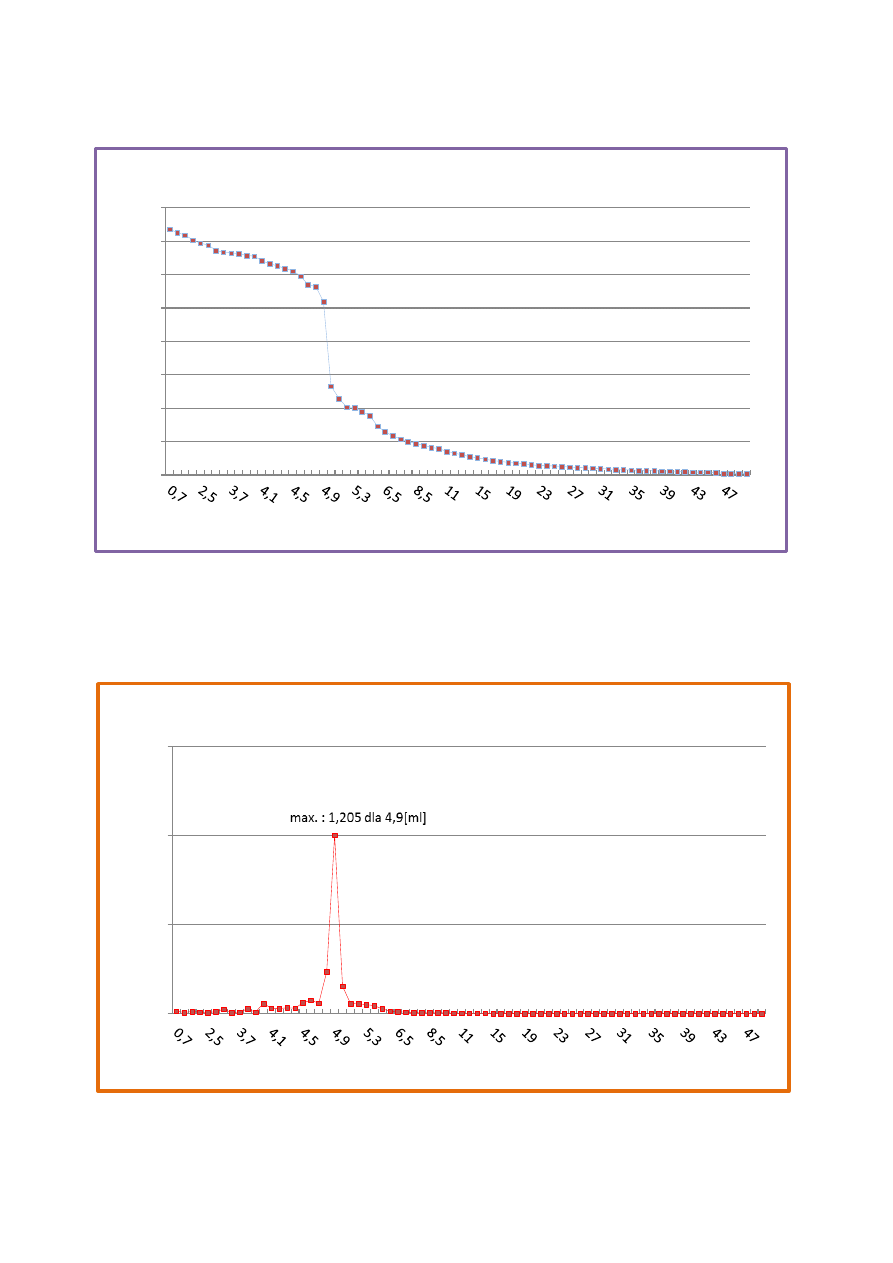
SEM: 0,25378 dla 4,9[ml]
0
0,6
1,2
1,8
∆
S
EM
/
∆
KC
l
[
V
/m
l]
KCl [ml]
∆ E (SEM) /∆ V (KCl) = f(V KCl)
a) Wyznaczanie aktywność jonów Ag+ gdzie E=0
V KCl w punkcie równoważnikowym PR = 4,9
a Ag
+
=0,0000819
b) Wyznaczanie iloczynu rozpuszczalności AgCl
L
AgCl
= a
Ag
+
∙ a
Cl
-
L
AgCl
= (a
Ag
+
)
2
L
AgCl
(dośw.) =6,71∙10^-9
L
AgCl
(teor.) = 9,3∙10^-10
Błąd względny:
|(
) (
)
|
3. Wnioski:
Wartości doświadczalne siły elektromotorycznej (SEM) ogniw użytych w doświadczeniu różnią się
nieznacznie od wartości teoretycznych. Spowodowane jest to potencjałem dyfuzyjnym.
Wartość iloczynu rozpuszczalności AgCl doświadczalna wynosi L
AgCl
= 6,71 ∙ 10^-9 i różni się od
wartości tablicowej (L
AgCl
= 9,3 ∙ 10^-10 ) o 6,21%. Jest to spowodowane prawdopodobnie
wystąpieniem błędów podczas wykonywania ćwiczenia.
2
0
2
ln
2
Ag
Cu
r
a
a
F
RT
E
E
RT
F
E
E
Cu
Ag
r
e
a
a
2
)
(
0
2
Er=0,253780
E0=0,460 [V]
R = 8,314 [J mol-1 K-1]
T = 295 [K]
F = 96500 [C]
Wyszukiwarka
Podobne podstrony:
LABCHFIZ I 1BugajTomaszDudaBeataPokwiczałMartynaTempkaMarta1 (1)
LABCHFIZ.I.1BugajTomaszDudaBeataPokwiczałMartynaTempkaMarta4, IV semestr, semestr IV, Chemia fizyczn
LABCHFIZ I 1BugajTomaszDudaBeat Nieznany (2)
LABCHFIZ I 1BugajTomaszDudaBeat Nieznany
LABCHFIZ I 1BugajTomaszDudaBeataPokwiczałMartynaTempkaMarta2
LABCHFIZ I 1BugajTomaszDudaBeataPokwiczałMartynaTempkaMarta1 (1)
Zagadnienia do opracowania do wybranych aewiczen LABCHFIZ 2010
LABCHFIZ 6E SzaniawskaA SzczygiełP ŚwierczekA 8
LABCHFIZ 6E SzaniawskaA Szczygi Nieznany
więcej podobnych podstron