2013/2014
LABORATORIUM Z CHEMII FIZYCZNEJ
Ćwiczenie nr 12
Konduktometria – przewodnictwo elektrolitów mocnych i słabych.
WIMiC
Technologia Chemiczna
II rok
6/E
SZANIAWSKA Anna
SZCZYGIEŁ Przemysław
ŚWIERCZEK Aleksandra
Data zajęć
Data oddania
sprawozdania
Oceny (pkt)
dr inż. Anna RAKOWSKA
Poniedziałek 2 VI 2014
12:30 – 17:00
9.05.2014
Kolokwium
Praktyka
Sprawozdanie
Cel ćwiczenia:
Celem ćwiczenia jest wyznaczenie granicznego przewodnictwa molowego elektrolitów
mocnych (np. HCl, CH3COONa) i słabych (CH3COOH) oraz wyznaczenie stałej dysocjacji
kwasu octowego na podstawie pomiarów przewodnictwa roztworów tych elektrolitów.
Wykonanie ćwiczenia:
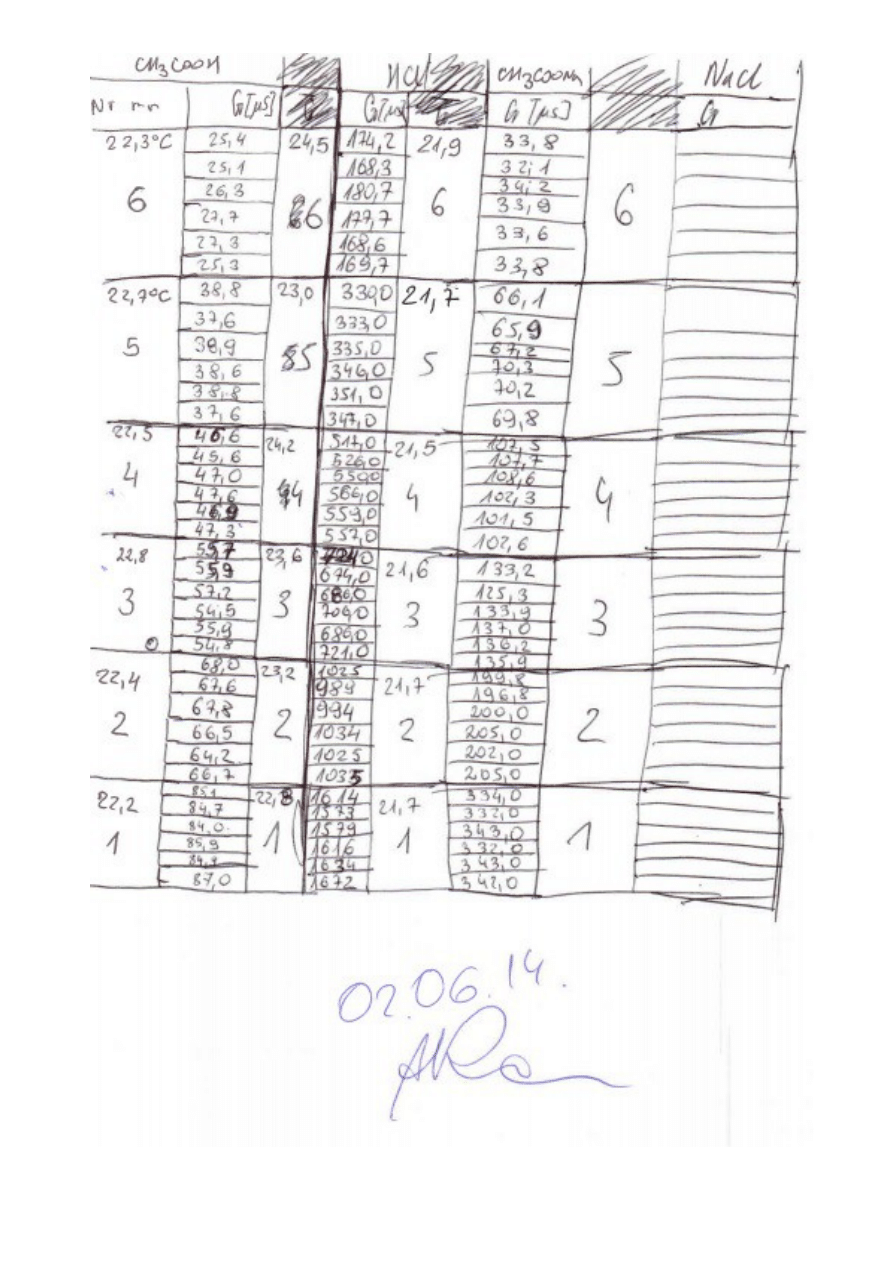
1. Przygotowanie roztworów CH
3
COOH według poniższej tabelki.
2. Pomiar przewodnictwa każdego z roztworów.
3. Przygotowanie roztworów HCl według poniższej tabelki.
4. Pomiar przewodnictwa każdego z roztworów.
5. Przygotowanie roztworów CH
3
COONa według poniższej tabelki.
6. Pomiar przewodnictwa każdego z roztworów.
Nr roztworu
V
odcz
[cm
3
]
1
25
2
15
3
10
4
7,5
5
5
6
2,5
Roztwory o objętości 50 cm
3
– dopełnione wodą destylowaną.
KWAS OCTOWY
c=
V
odcz
V
p
⋅
c
odcz
V
p
=
50 cm
3
c
odcz
=
0,01
mol
dm
3
κ=
G
k
Λ
m
=
1000⋅κ
c
k =1 cm
−
1
Nr r-ru
c
[mol·dm
-3
]
G
[Ω
-1
·]
G
śr
[Ω
-1
·]
κ
[Ω
-1
·cm
-1
]
Λ
m
[Ω
-1
·cm
2
·mol
-1
]
1/Λ
m
c·Λ
m
1
0,0050
87,00 · 10
-6
85,52 · 10
-6
85,52 · 10
-6
17,10
0,0585
0,0855
84,90 · 10
-6
85,90 · 10
-6
84,70 · 10
-6
85,10 · 10
-6
2
0,0030
68,00 · 10
-6
66,60 · 10
-6
66,60 · 10
-6
22,20
0,0450
0,0666
67,60 · 10
-6
66,50 · 10
-6
64,20 · 10
-6
66,70 · 10
-6
3
0,0020
55,70 · 10
-6
55,36 · 10
-6
55,36 · 10
-6
27,68
0,0361
0,0554
55,90 · 10
-6
54,80 · 10
-6
54,50 · 10
-6
55,90 · 10
-6
4
0,0015
46,60 · 10
-6
46,68 · 10
-6
46,68 · 10
-6
31,12
0,0321
0,0467
45,60 · 10
-6
47,00 · 10
-6
46,90 · 10
-6
47,30 · 10
-6
5
0,0010
38,80 · 10
-6
38,34 · 10
-6
38,34 · 10
-6
38,34
0,0261
0,0383
37,60 · 10
-6
38,90 · 10
-6
38,80 · 10
-6
37,60 · 10
-6
6
0,0005
25,40 · 10
-6
25,88· 10
-6
25,88· 10
-6
51,76
0,0193
0,0259
25,10 · 10
-6
26,30 · 10
-6
27,30 · 10
-6
25,30 · 10
-6
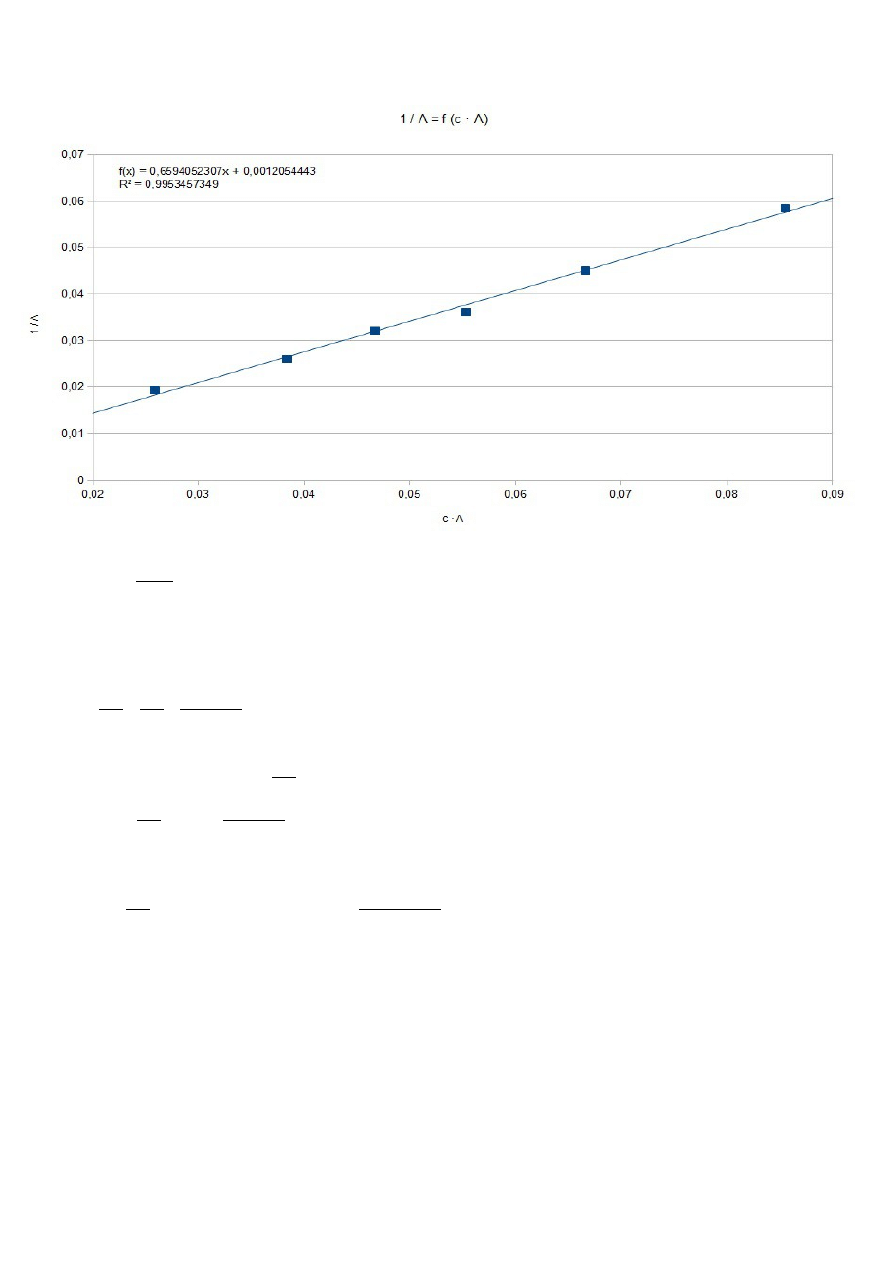
Λ
m
=α ⋅Λ
m
0
K =
c⋅α
2
1−α
Na podstawie prawa Kohlaruscha dla słabych elektrolitów oraz prawa rozcieńczeń Ostwalda
możemy wyprowadzić zależność:
1
Λ
m
=
1
Λ
m
0
+
Λ
m
⋅
c
K⋅(Λ
m
0
)
2
f (Λ
m
⋅
c)=Λ
m
⋅
c⋅A+B=
1
Λ
m
B=
1
Λ
m
0
A=
1
K⋅(Λ
m
0
)
2
Na podstawie regresji liniowej
B=
1
Λ
m
0
=
0,001205⇒ Λ
m
0
=
829,5696
1
Ω⋅
cm
2
⋅
mol

α=
Λ
m
0
Λ
m
K =
c⋅α
2
1−α
Nr r-ru
c
[mol·dm
-3
]
α
K
1
0,0050
0,0206
2,17 · 10
-6
2
0,0030
0,0268
2,20 · 10
-6
3
0,0020
0,0333
2,30 · 10
-6
4
0,0015
0,0375
2,19 · 10
-6
5
0,0010
0,0462
2,24 · 10
-6
6
0,0005
0,0624
2,08 · 10
-6
K
śr
=
0,22⋅10
−
5
K
tabl
=
1,75⋅10
−
5
Błąd względny wynosi 0,8743 . Wartości się różnią o jeden rząd wielkości, co może być
spowodowane błędami przyrządzania roztworów, błędem odczytu z konduktometru oraz różnicą
temperatur gdyż pomiary były przeprowadzane w temp. 295 K.
KWAS SOLNY
c=
V
odcz
V
p
⋅
c
odcz
V
p
=
50 cm
3
c
odcz
=
0,01
mol
dm
3
κ=
G
k
Λ
m
=
1000⋅κ
c
k =1 cm
−
1
Nr r-ru
c
[mol·dm
-3
]
G
[Ω
-1
·]
G
śr
[Ω
-1
·]
κ
[Ω
-1
·cm
-1
]
Λ
m
[Ω
-1
·cm
2
·mol
-1
]
c
1/2
1
0,0050
1614 · 10
-6
1614,67 · 10
-6
85,52 · 10
-6
322,93
0,0707
1573 · 10
-6
1616 · 10
-6
1672 · 10
-6
1634 · 10
-6
1579 · 10
-6
2
0,0030
1035 · 10
-6
1017,00 · 10
-6
66,60 · 10
-6
339,00
0,0548
1025 · 10
-6
1034 · 10
-6
994 · 10
-6
989 · 10
-6
1025 · 10
-6
3
0,0020
721 · 10
-6
699,50 · 10
-6
55,36 · 10
-6
349,75
0,0447
686 · 10
-6
706 · 10
-6
686 · 10
-6
674 · 10
-6
724 · 10
-6
4
0,0015
557 · 10
-6
545,83 · 10
-6
46,68 · 10
-6
363,89
0,0387
559 · 10
-6
566 · 10
-6
550 · 10
-6
526 · 10
-6
517 · 10
-6
5
0,0010
347 · 10
-6
340,33 · 10
-6
38,34 · 10
-6
340,33
0,0316
351 · 10
-6
346 · 10
-6
335 · 10
-6
333 · 10
-6
330 · 10
-6
6
0,0005
174,2 · 10
-6
173,20· 10
-6
25,88· 10
-6
346,40
0,0224
168,3 · 10
-6
187,7 · 10
-6
177,7 · 10
-6
168,6 · 10
-6
169,7 · 10
-6
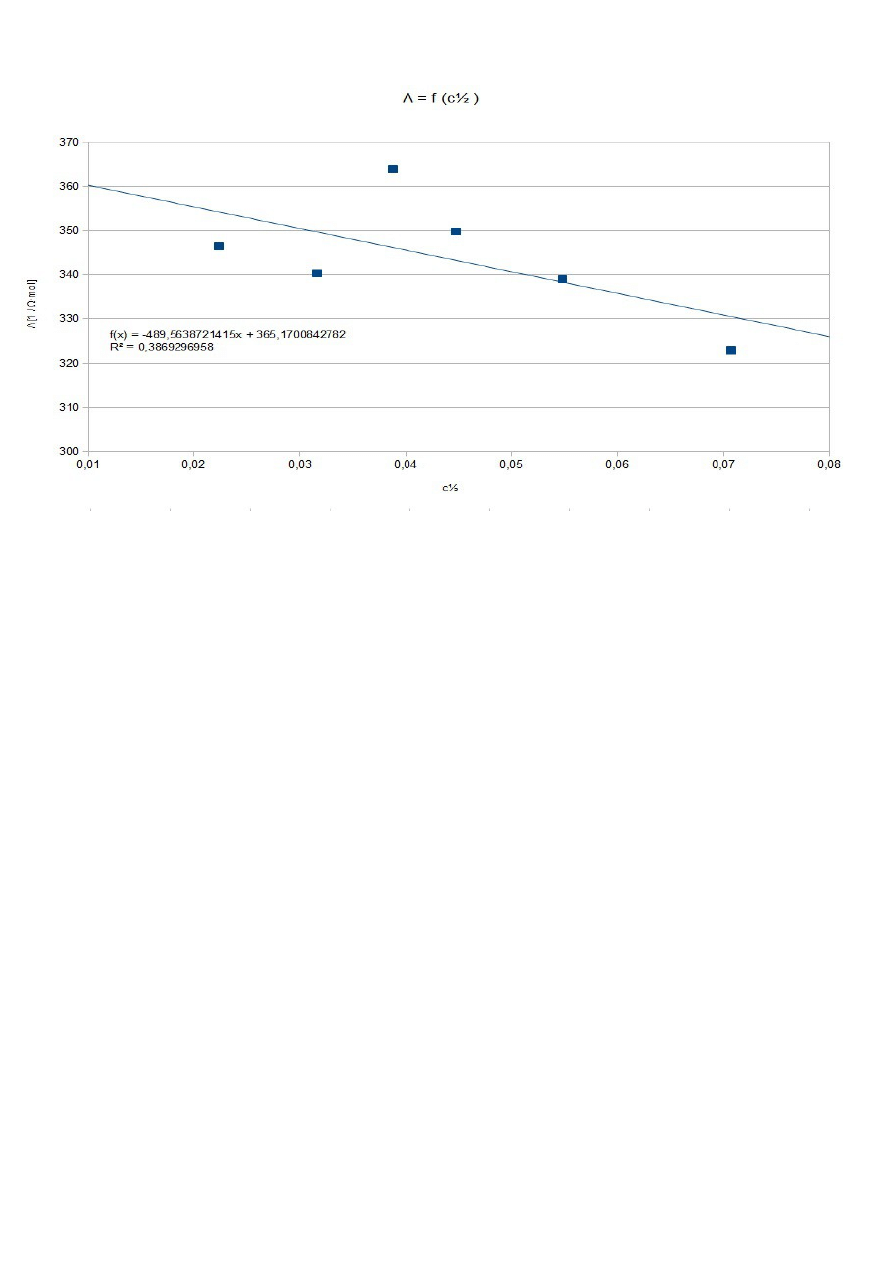
Λ
m
=Λ
m
0
−
K⋅c
1 /2
Na podstawie prawa Kohlaruscha dla mocnych elektrolitów.
Λ
m
=
f (c
1/ 2
)=
B−A⋅c
1/ 2
B=Λ
m
0
A=(−K )
Na podstawie regresji liniowej:
B=Λ
m
0
=
365,17 Ω
−
1
⋅
cm
−
1
Λ
m (dośw.)
0
=
365,17±14,34 Ω
−
1
⋅
cm
−
1
Λ
m (tabl.)
0
=
426,16 Ω
−
1
⋅
cm
−
1
Błąd względny wynosi 0,1095 . Wartości się różnią o 11% co może być spowodowane błędami
przyrządzania roztworów, błędem odczytu z konduktometru oraz różnicą temperatur gdyż pomiary
były przeprowadzane w temp. 295 K.
OCTAN SODU
c=
V
odcz
V
p
⋅
c
odcz
V
p
=
50 cm
3
c
odcz
=
0,01
mol
dm
3
κ=
G
k
Λ
m
=
1000⋅κ
c
k =1 cm
−
1
Nr r-ru
c
[mol·dm
-3
]
G
[Ω
-1
·]
G
śr
[Ω
-1
·]
κ
[Ω
-1
·cm
-1
]
Λ
m
[Ω
-1
·cm
2
·mol
-1
]
c
1/2
1
0,0050
342 · 10
-6
337,67 · 10
-6
85,52 · 10
-6
67,53
0,0707
343 · 10
-6
332 · 10
-6
343 · 10
-6
332 · 10
-6
334 · 10
-6
2
0,0030
205 · 10
-6
201,43 · 10
-6
66,60 · 10
-6
67,14
0,0548
202 · 10
-6
205 · 10
-6
200 · 10
-6
196,8 · 10
-6
199,8 · 10
-6
3
0,0020
135,9 · 10
-6
133,58 · 10
-6
55,36 · 10
-6
66,79
0,0447
136,2 · 10
-6
137,0 · 10
-6
133,9 · 10
-6
125,3 · 10
-6
133,2 · 10
-6
4
0,0015
102,6 · 10
-6
105,03 · 10
-6
46,68 · 10
-6
70,02
0,0387
101,5 · 10
-6
102,3 · 10
-6
108,6 · 10
-6
107,7 · 10
-6
107,5 · 10
-6
5
0,0010
69,8 · 10
-6
68,25 · 10
-6
38,34 · 10
-6
68,25
0,0316
70,2 · 10
-6
70,3 · 10
-6
67,2 · 10
-6
65,9 · 10
-6
66,1 · 10
-6
6
0,0005
33,8 · 10
-6
33,57 · 10
-6
25,88· 10
-6
67,13
0,0224
32,1 · 10
-6
34,2 · 10
-6
33,9 · 10
-6
33,6 · 10
-6
33,8 · 10
-6
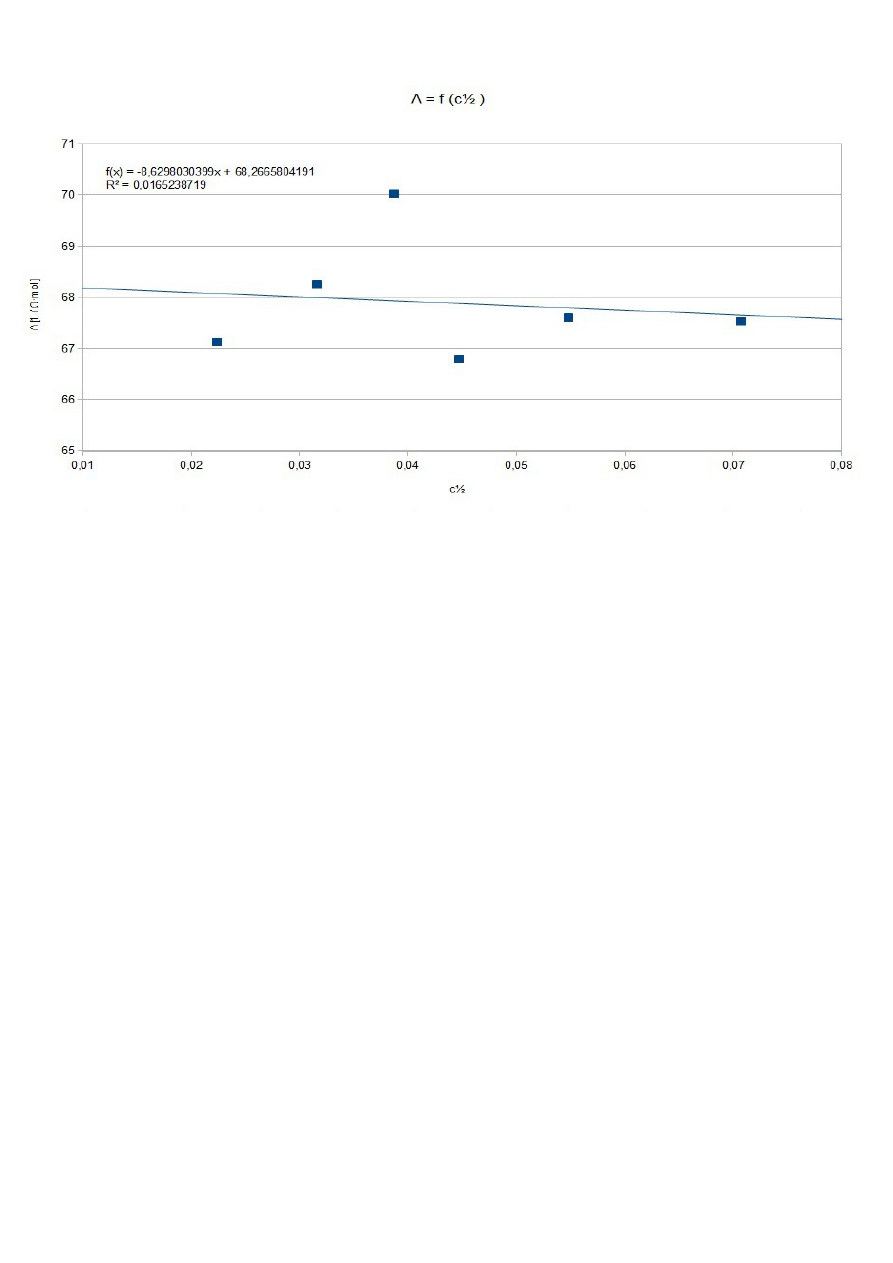
Λ
m
=Λ
m
0
−
K⋅c
1 /2
Na podstawie prawa Kohlaruscha dla mocnych elektrolitów.
Λ
m
=
f (c
1/ 2
)=
B−A⋅c
1/ 2
B=Λ
m
0
A=(−K )
Na podstawie regresji liniowej:
B=Λ
m
0
=
68,27 Ω
−
1
⋅
cm
−
1
Λ
m (dośw.)
0
=
68,27±1,55Ω
−
1
⋅
cm
−
1
Λ
m (tabl.)
0
=
91,00Ω
−
1
⋅
cm
−
1
Błąd względny wynosi 0,2327 . Wartości się różnią o 23%, co może być spowodowane błędami
przyrządzania roztworów, błędem odczytu z konduktometru oraz różnicą temperatur gdyż pomiary
były przeprowadzane w temp. 295 K.

Wnioski:
Przeprowadzone doświadczenie pokazało różnicę w przewodności słabych i mocnych elektrolitów.
Wyniki odbiegały od wartości tablicowych co mogło być spowodowane błędami ludzkimi oraz
warunkami przeprowadzenia pomiarów przewodnictwa.
Wyszukiwarka
Podobne podstrony:
LABCHFIZ 6E SzaniawskaA SzczygiełP ŚwierczekA 8
LABCHFIZ I 1BugajTomaszDudaBeat Nieznany (2)
LABCHFIZ I 1BugajTomaszDudaBeat Nieznany
Gor±czka o nieznanej etiologii
02 VIC 10 Days Cumulative A D O Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
45 sekundowa prezentacja w 4 ro Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
Mechanika Plynow Lab, Sitka Pro Nieznany
katechezy MB id 233498 Nieznany
2012 styczen OPEXid 27724 Nieznany
metro sciaga id 296943 Nieznany
Mazowieckie Studia Humanistyczn Nieznany (11)
cw 16 odpowiedzi do pytan id 1 Nieznany
perf id 354744 Nieznany
DO TEL! 5= Genetyka nadci nieni Nieznany
więcej podobnych podstron