2013/2014
LABORATORIUM Z CHEMII FIZYCZNEJ
Ćwiczenie nr 8
Katalityczny rozkład wody utlenionej
WIMiC
Technologia Chemiczna
II rok
6/E
SZANIAWSKA Anna
SZCZYGIEŁ Przemysław
ŚWIERCZEK Aleksandra
Data zajęć
Data oddania
sprawozdania
Oceny (pkt)
dr inż. Jarosław DĄBEK
Wtorek 14 IV 2014
12:30 – 17:00
5.05.2014
Kolokwium
Praktyka
Sprawozdanie
Cel ćwiczenia:
Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji rozkładu wody H
2
O
2
w obecności
różnych ilości katalizatora (MnO
2
) oraz w roztworze bez katalizatora.
Wykonanie ćwiczenia:
a) Przygotowanie roztworu boranowego (180 cm
3
H
3
BO
3
+ 20 cm
3
Na
2
B
4
O
7
)
b) Przygotowanie roztworu H
2
O
2
(rozcieńczenie 5 krotnie perhydrolu)
c) Przygotowanie badanych roztworów
d) Badanie szybkości rozpadu wody utlenionej poprzez miareczkowanie jej 0,02M KMnO
4
5 H
2
O
2
+
2 KMnO
4
+
3 H
2
SO4 → MnSO
4
+
K
2
SO
4
+
H
2
O+5 O
2
c
w.utlenionej
=
n
w.utlenionej
V
p
n
w.utlenionej
=
2,5⋅c
m
⋅
V
V
p
=
0,01 dm
3
c
m
=
0,02
mol
dm
3
V
p
– objętość próbki [dm3] ; c
m
– stężenie titrantu [mol/dm
3
] ; V – objętość titrantu [dm
3
]
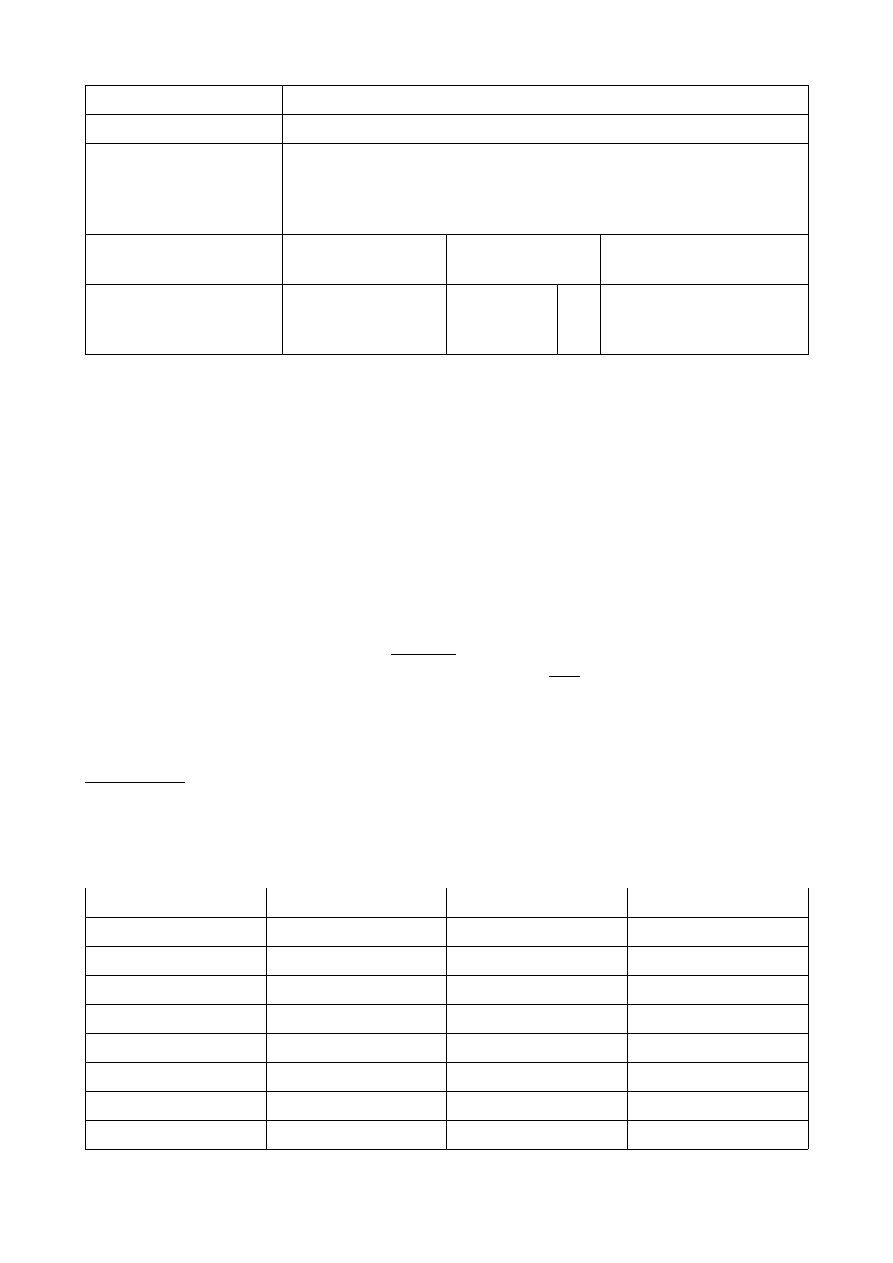
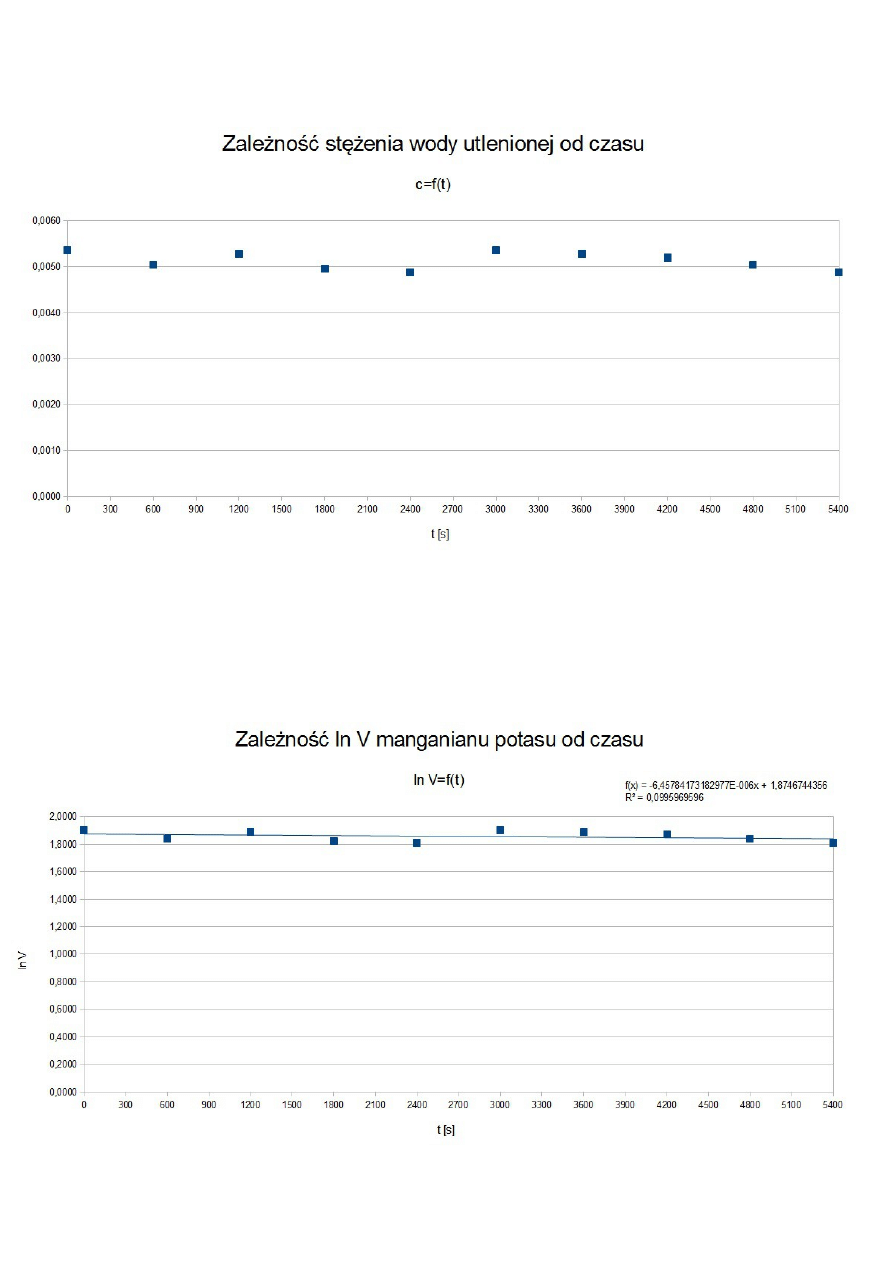
ROZTWÓR I
150 cm
3
wody destylowanej
50 cm
3
buforu boranowego
5 cm
3
wody utlenionej
10 cm
3
katalizatora
t [s]
V KMnO
4
[cm
3
]
c H
2
O
2
[mol/dm
3
]
ln V KMnO
4
0
6,9
0,0055
1,9315
300
6,9
0,0055
1,9315
600
6,0
0,0048
1,7918
900
5,5
0,0044
1,7047
1200
4,8
0,0038
1,5686
1500
4,0
0,0032
1,3863
1800
3,5
0,0028
1,2528
3000
1,4
0,0011
0,3365
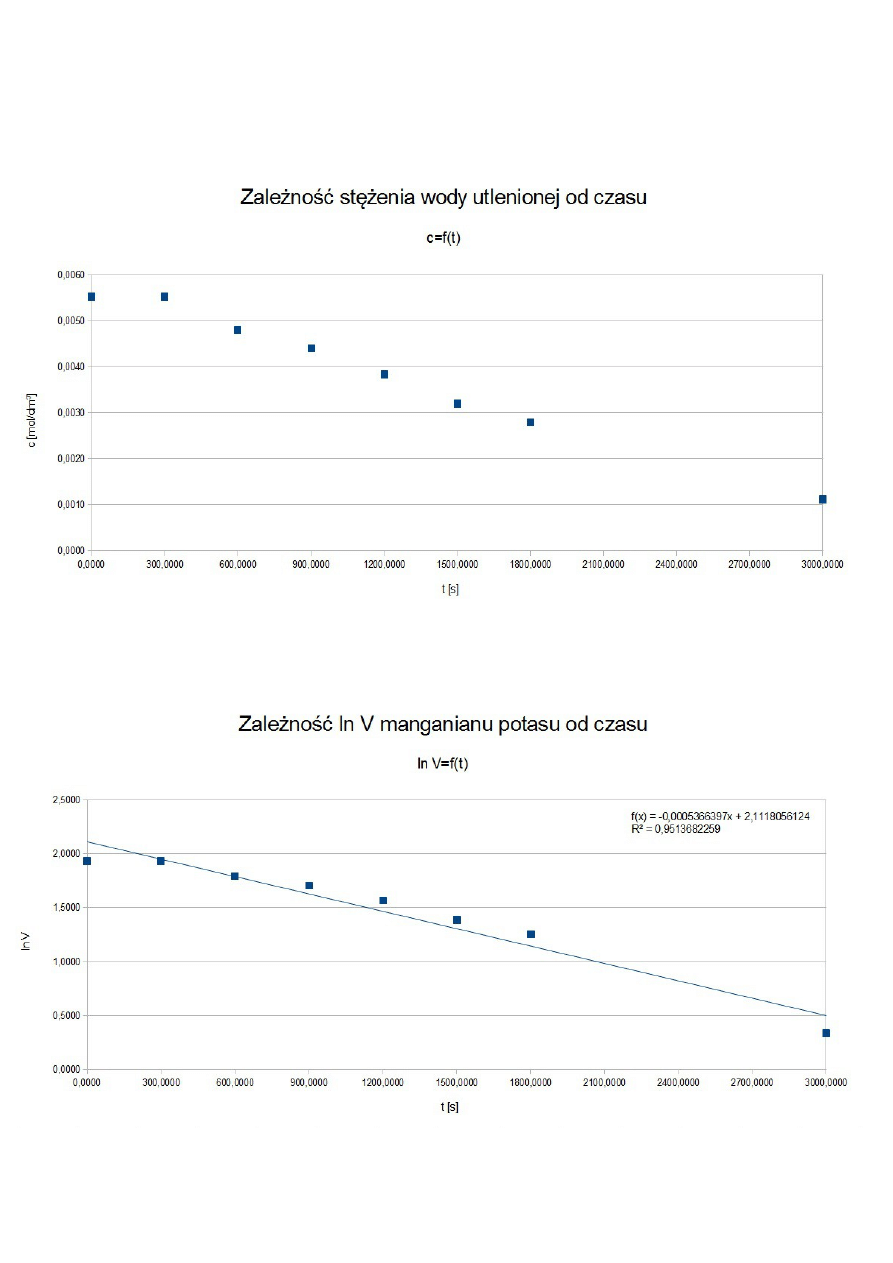
ROZTWÓR II
150 cm
3
wody destylowanej
50 cm
3
buforu boranowego
5 cm
3
wody utlenionej
8 cm
3
katalizatora
t [s]
V KMnO
4
[cm
3
]
c H
2
O
2
[mol/dm
3
]
ln V KMnO
4
0
7,8
0,0062
2,0541
300
7,4
0,0059
2,0015
600
7,1
0,0057
1,9601
900
6,6
0,0053
1,8871
1200
6,4
0,0051
1,8563
1500
6,0
0,0048
1,7918
1800
6,0
0,0048
1,7918
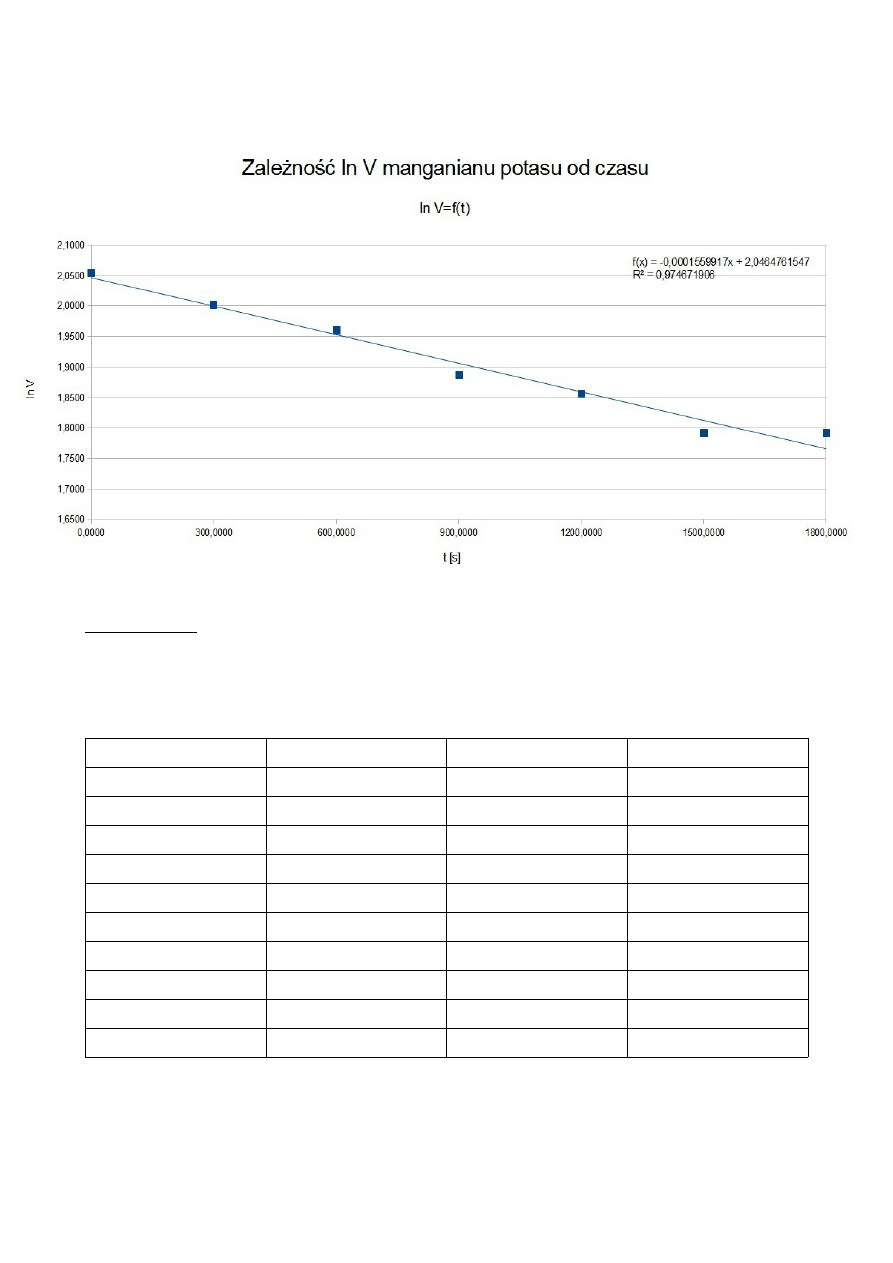
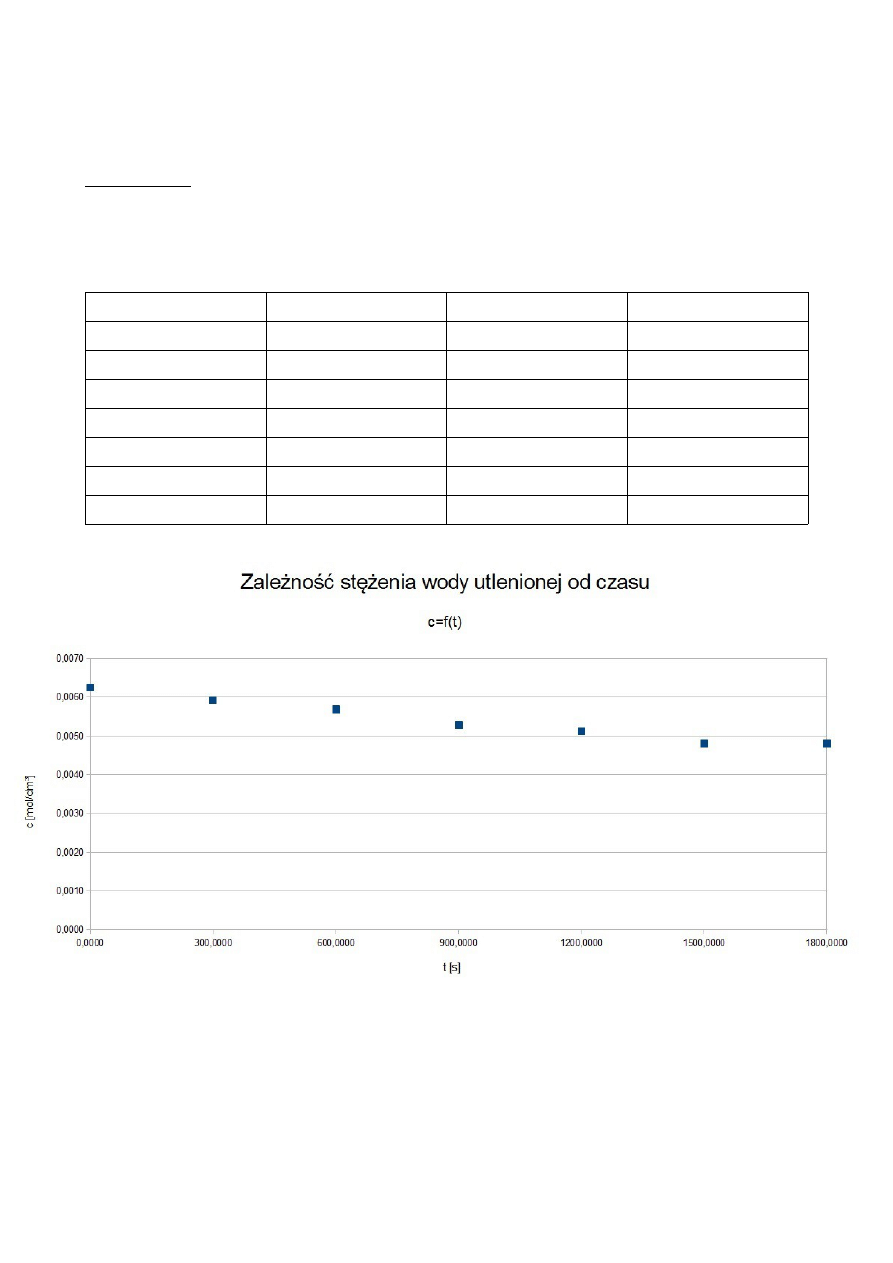
ROZTWÓR III
150 cm
3
wody destylowanej
50 cm
3
buforu boranowego
5 cm
3
wody utlenionej
5 cm
3
katalizatora
t [s]
V KMnO
4
[cm
3
]
c H
2
O
2
[mol/dm
3
]
ln V KMnO
4
0
6,7
0,0054
1,9021
600
6,3
0,0050
1,8405
1200
6,6
0,0053
1,8871
1800
6,2
0,0050
1,8245
2400
6,1
0,0049
1,8083
3000
6,7
0,0054
1,9021
3600
6,6
0,0053
1,8871
4200
6,5
0,0052
1,8718
4800
6,3
0,0050
1,8405
5400
6,1
0,0049
1,8083
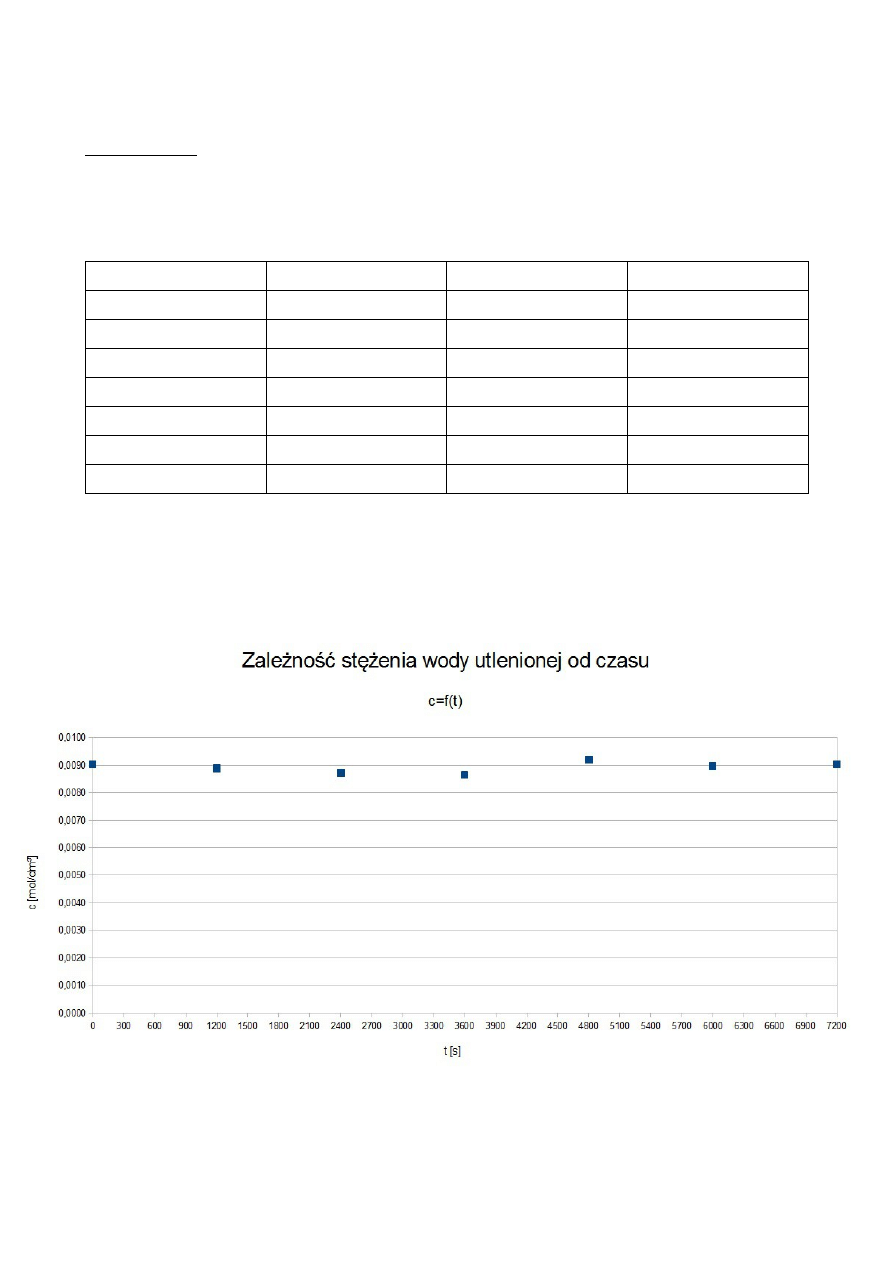
ROZTWÓR IV
150+5 cm
3
wody destylowanej
50 cm
3
buforu boranowego
5 cm
3
wody utlenionej
0 cm
3
katalizatora
t [s]
V KMnO
4
[cm
3
]
c H
2
O
2
[mol/dm
3
]
ln V KMnO
4
0
11,3
0,0090
2,4248
1200
11,1
0,0089
2,4069
2400
10,9
0,0087
2,3888
3600
10,8
0,0086
2,3795
4800
11,5
0,0092
2,4423
6000
11,2
0,0090
2,4159
7200
11,3
0,0090
2,4248
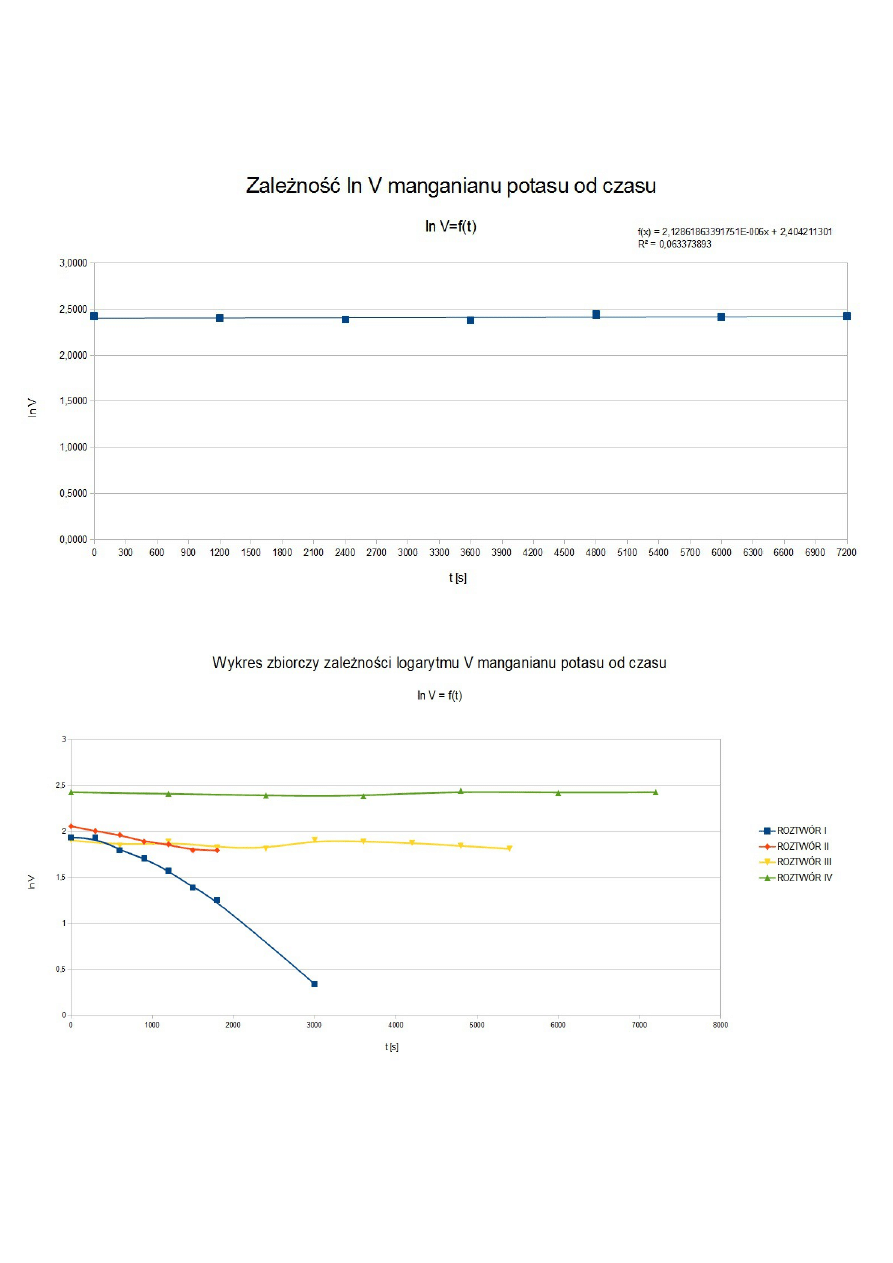
ln
V
t
V
0
=
k⋅t
ln V
t
=
ln V
0
−
k⋅t
Równanie doprowadzamy do postaci równania liniowego gdzie a = -k. Do obliczeń korzystamy
z funkcji wbudowanej w OpenOffice.org – regresja liniowa (REGLINP).
Nr roztworu
V
kat
. [cm
3
]
a
u(a)
k [1/s]
u(k)
I
10
-5,37 · 10
-4
4,95 · 10
-5
5,37 · 10
-4
4,95 · 10
-5
II
8
-1,56 · 10
-4
1,12 · 10
-5
1,56 · 10
-4
1,12 · 10
-5
III
5
-6,46 · 10
-6
6,86 · 10
-6
6,46 · 10
-6
6,86 · 10
-6
IV
0
2,67 · 10
-6
3,70 · 10
-6
-2,67 · 10
-6
3,70 · 10
-6
Dla roztworu IV reakcja biegnie tak wolno, że wg naszego doświadczenia stała szybkości ma wartość
ujemną. Do dalszych obliczeń brany pod uwagę będzie moduł z tej wartości.
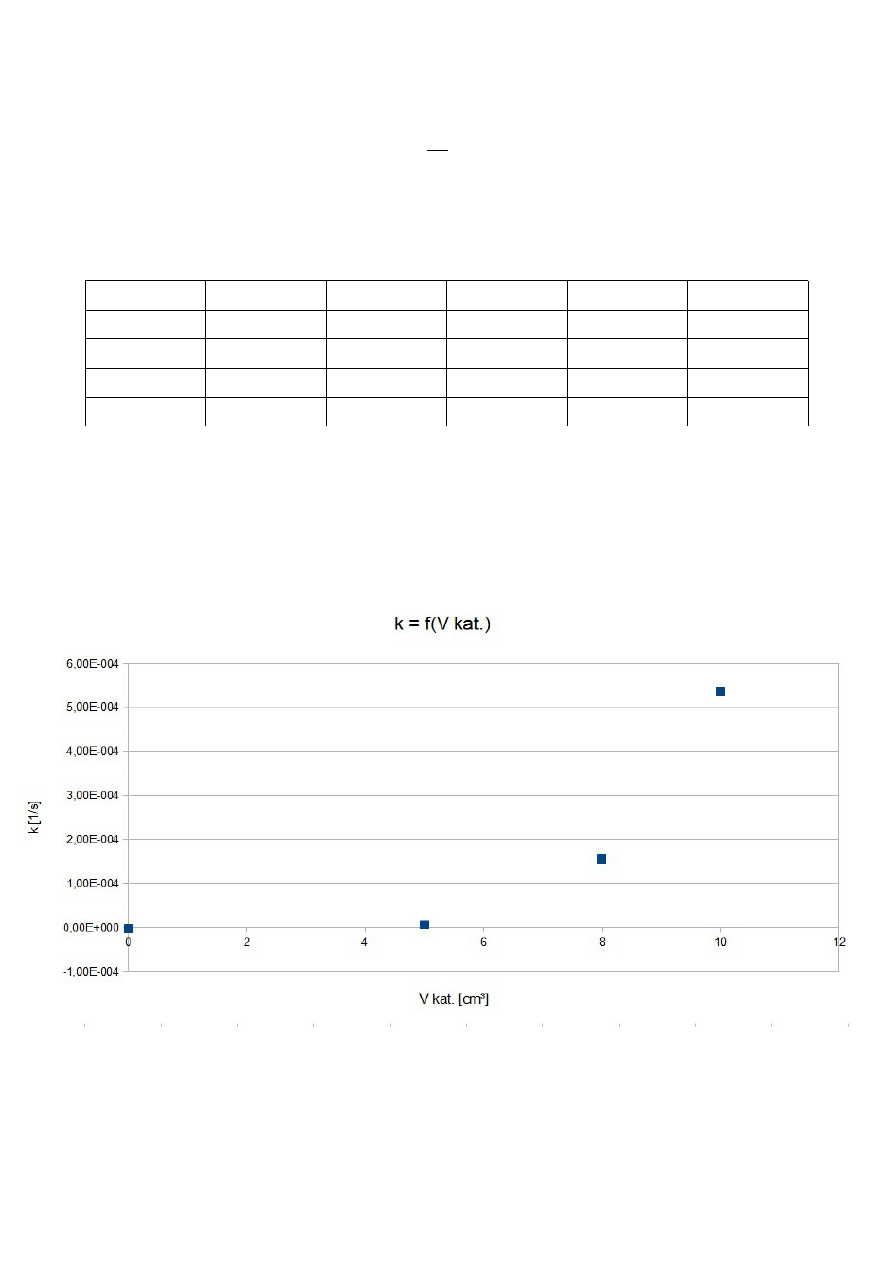
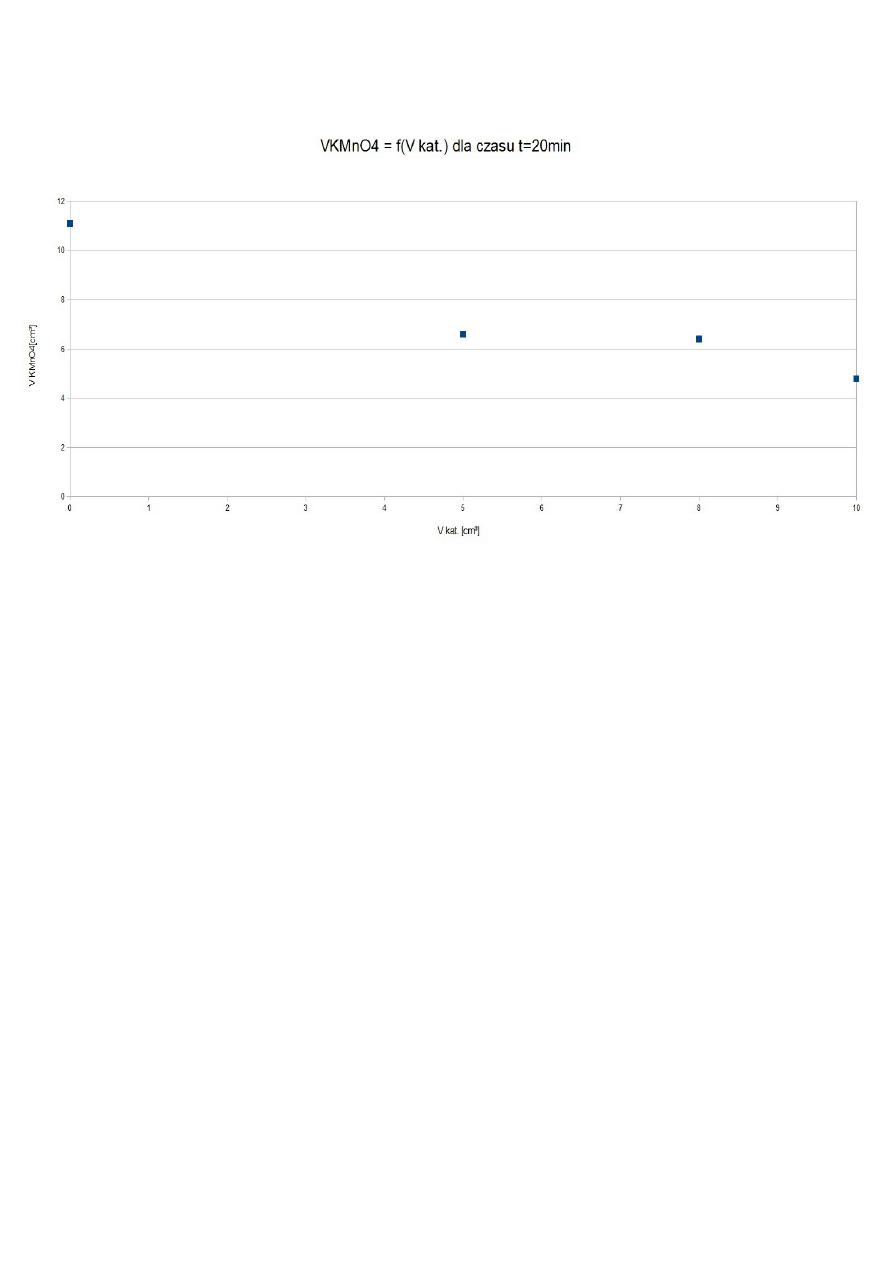
Wg Ostwalda zależność stałej szybkości od objętości katalizatora jest funkcją liniową, w celu
sprawdzenie tego stwierdzenia wykonano wykres k = f(V
kat.
).
Na podstawie przeprowadzonego doświadczenia nie można stwierdzić słuszności równania Ostwalda,
gdyż poszczególne punkty nie tworzą krzywej prostoliniowej.
Czas połowicznej przemiany :
τ=
ln2
k
Nr roztworu
V
kat
. [cm
3
]
k [1/s]
τ [s]
I
10
5,37 · 10
-4
1291
II
8
1,56 · 10
-4
4443
III
5
6,46 · 10
-6
107298
IV
0
2,67 · 10
-6
259606
Na podstawie powyższego wykresu można stwierdzić istnienie proporcjonalności pomiędzy stężeniem
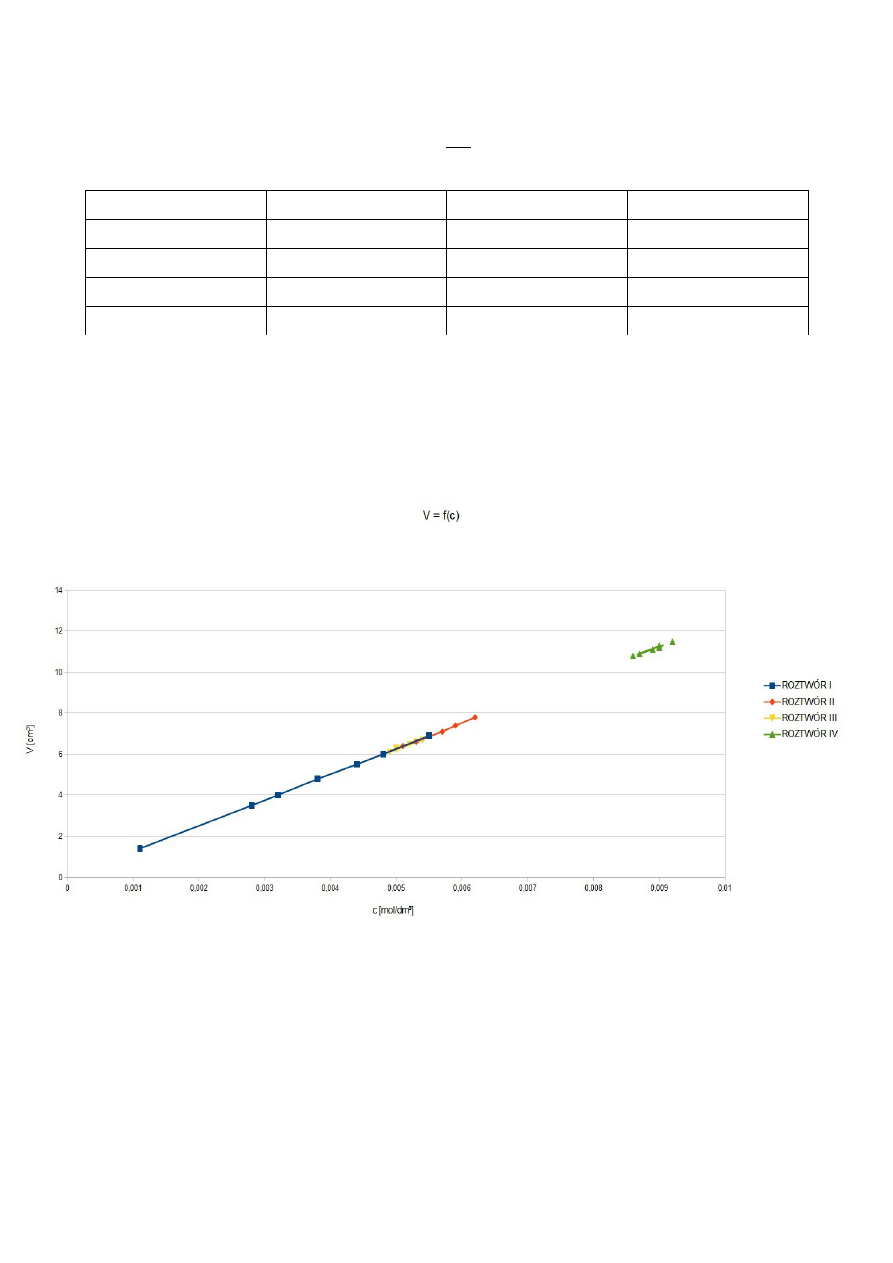
wody utlenionej a zużytą objętością titrantu przy miareczkowaniu.
Wnioski:
Doświadczenia wykazało wpływ katalizatora na szybkość reakcji rozpadu wody utlenionej.
Przeprowadzone próby nie wskazały słuszności równania Ostwalda, gdyż zależność stałych szybkości
otrzymanych doświadczalnie nie zależą liniowo od ilości dodanego katalizatora. Odstępstwo to może
wynikać z małej ilości przeprowadzonych prób oraz z powodu błędów, które mogły przytrafić się w
trakcie wykonywania prób i pomiarów – niepowtarzalne miareczkowania, błędy ludzkie oraz błędy
przy określaniu czasu.
Naszym zdaniem istotny wpływ miało użycie trzeciej biurety, która nie jest zainstalowana na stałe w
laboratorium. Pomiary wykonane przy jej pomocy szybko ciemniały.
Wyszukiwarka
Podobne podstrony:
LABCHFIZ 6E SzaniawskaA Szczygi Nieznany
„ŻEGLARZ” JERZEGO SZANIAWSKIEGO, dwudziestolecie
EEkonspekt z Szaniawskiego, PBS
LABCHFIZ I 1BugajTomaszDudaBeataPokwiczałMartynaTempkaMarta1 (1)
Szczygieł, inżynieria materialów i nauka o materiałach, zagadnienia dla części metale
Pigłowski & Szczygieł, Materiałoznastwo, polimery
J Szaniawski Profesor Tutka
LABCHFIZ I 1BugajTomaszDudaBeataPokwiczałMartynaTempkaMarta2
6E
Szaniawski Żeglarz opracowanie
Szaniawski J., FILOLOGIA POLSKA UWM, Dwudziestolecie
rezonans, ŚWIERCZYŃSKI POLITECHNIKA ŚWIĘTOKRZYSKA
lekturki, 13 szaniawski, 13 - Szaniawski
Zagadnienia do opracowania do wybranych aewiczen LABCHFIZ 2010
Pigłowski & Szczygieł, Materiałoznawstwo, Pytania egzaminacyjne
więcej podobnych podstron