
Wydział Chemii, Zakład Dydaktyki Chemii
ul. Ingardena 3, 30-060 Kraków
tel./fax: 12 663 22 58
www.zmnch.pl
Temat lekcji : Czy kwasy mogą reagowad z alkoholami?
Program nauczania: A. Kandia, Z. Kluz, K. Łopata,
E. Odrowąż, M.Poźniczek, Chemia w gimnazjum, WSiP, 2009
(lekcja nr 8, dział 9)
Gimnazjum
Lekcja bieżąca - 45 minut
Uwaga: Komentarz zapisany kursywą (kolorem niebieskim) nie
musi znajdowad się w standardowym konspekcie studenckim
Cele dydaktyczno-wychowawcze:
zapoznanie uczniów z nową grupą związków chemicznych
– estrami, dwiczenie umiejętności przeprowadzania obserwacji i wyciągania wniosków,
ukazanie praktycznego zastosowania związków chemicznych
Cele operacyjne:
uczeo potrafi podad definicję estrów, na podstawie wzoru podad nazwę
estru i odwrotnie, zapisad równanie reakcji estryfikacji, ze zwróceniem uwagi na rolę H
2
SO
4
,
omówid właściwości fizyczne i zastosowanie estrów, zaprojektowad doświadczenie
pozwalające otrzymad dany ester
Metody nauczania:
słowna: pogadanka, rozwiązywanie zadań
oglądowa: pokaz doświadczeń chemicznych
praktyczna: budowa modeli związków chemicznych
Środki dydaktyczne:
roztwory: kwasu octowego i alkoholu etylowego, st. H
2
SO
4
, uniwersalne papierki
wskaźnikowe, min. 3 probówki, łapa do probówek, palnik, wkraplacz, modele kulkowe, karty
pracy nr 1 (dla każdej grupy) i nr 2 (dla każdego ucznia) oraz kserokopie notatki dla każdego
ucznia, układ okresowy pierwiastków.
Uwaga kolorem zielonym wyodrębniono notatkę do zeszytu ucznia.
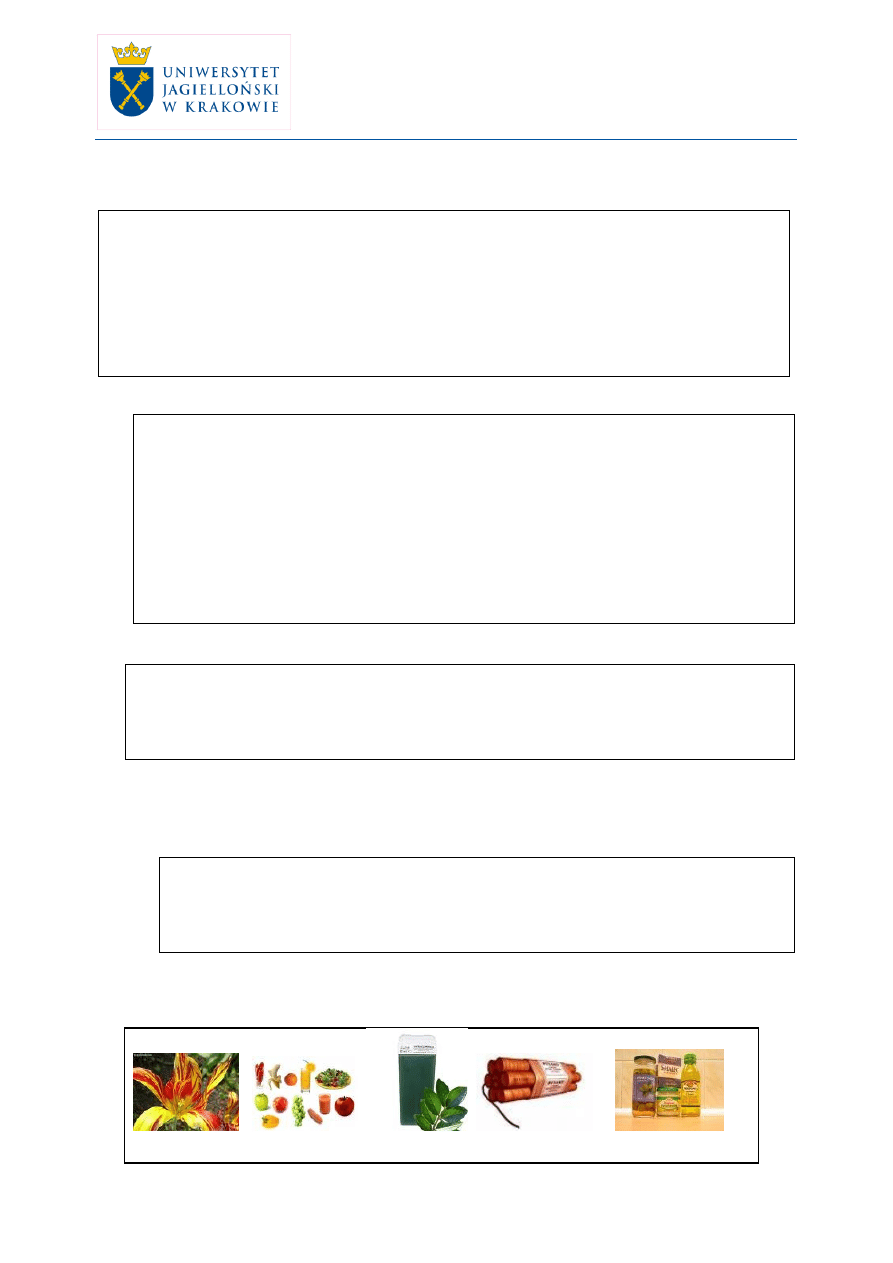
Wydział Chemii, Zakład Dydaktyki Chemii
ul. Ingardena 3, 30-060 Kraków
tel./fax: 12 663 22 58
www.zmnch.pl
Częśd nawiązująca:
W części nawiązującej zostaną powtórzone najważniejsze informacje o kwasach
karboksylowych i alkoholach.
Nauczyciel ma przygotowane dwie ponumerowane probówki, jedną z kwasem
octowym, a drugą z alkoholem etylowym. Uczniowie nie znają zawartości probówek.
Ich zadaniem jest identyfikacja tych substancji oraz zbudowanie modeli
zidentyfikowanych związków. W tym celu pracując w grupach cztero osobowych,
najpierw rozwiązują następujące zadanie:
Poprawne rozwiązanie: CZY TO JEST POTRZEBNE
Kwas karboksylowy o masie 60 u to kwas octowy CH
3
COOH
Identyfikowany alkohol to etanol
Po rozwiązaniu zadania jedna osoba, badając odczyn roztworów identyfikuje roztwory
w probówkach. Uczeń z innego zespołu prezentuje zbudowane modele związków.
Uczniowie z grupy która pierwsza dobrze rozwiązała zadania otrzymują plusy lub
oceny.
Częśd postępująca:
Przed przystąpieniem do realizacji tematu, w celu zaciekawienia uczniów,
nauczyciel prezentuje foliogram 1, na którym znajdują się zdjęcia różnych
kwiatów, owoców, tłuszczu, itp. i informuje uczniów, że na dzisiejszej lekcji
poznamy związki, które łączą te wszystkie produkty.
FOLIOGRAM 1
kwiaty warzywa i owoce woski roślinne dynamit tłuszcze
Karta pracy nr 1
1. Wiedząc, że probówki zawierają kwas karboksylowy i alkohol, zaproponuj sposób
ich identyfikacji, mając do dyspozycji uniwersalny papierek wskaźnikowy oraz
następujące dane:
a. masa cząsteczkowa kwasu wynosi 60 u
b. reakcję całkowitego spalania identyfikowanego alkoholu można zapisać
równaniem:
C
x
H
y
OH + 3 O
2
= 2 CO
2
+ 3 H
2
O
2. Zbuduj modele zidentyfikowanych związków
3.
Wydział Chemii, Zakład Dydaktyki Chemii
ul. Ingardena 3, 30-060 Kraków
tel./fax: 12 663 22 58
www.zmnch.pl
Dalszym wprowadzeniem do tematu lekcji jest skierowanie do uczniów następujących
pytań:
A. Czy kwas octowy i alkohol etylowy można odróżnid wykorzystując ich właściwości
fizyczne? Jaka właściwośd fizyczna pozwala odróżnid te substancje?
B. Jak myślicie, czy związki te mogą reagowad ze sobą? Jak to ewentualnie można
sprawdzid?
C. Jakie efekty mogą świadczyd o zachodzeniu reakcji (np. zmiana barwy, wytrącenie
osadu, wydzielenie się gazu, zmiana odczynu, zmiana zapachu – obydwie substancje
mają charakterystyczny zapach)?
Kolejne pytania w trakcie pogadanki będą zależały od odpowiedzi uczniów. Celem jej
jest uzmysłowienie uczniom, że alkohol etylowy i kwas octowy mają charakterystyczne
zapachy, i że zmiana zapachu substancji może być objawem zachodzenia reakcji. Po
przypomnieniu nauczyciel przystępuje do wykonania doświadczenia.
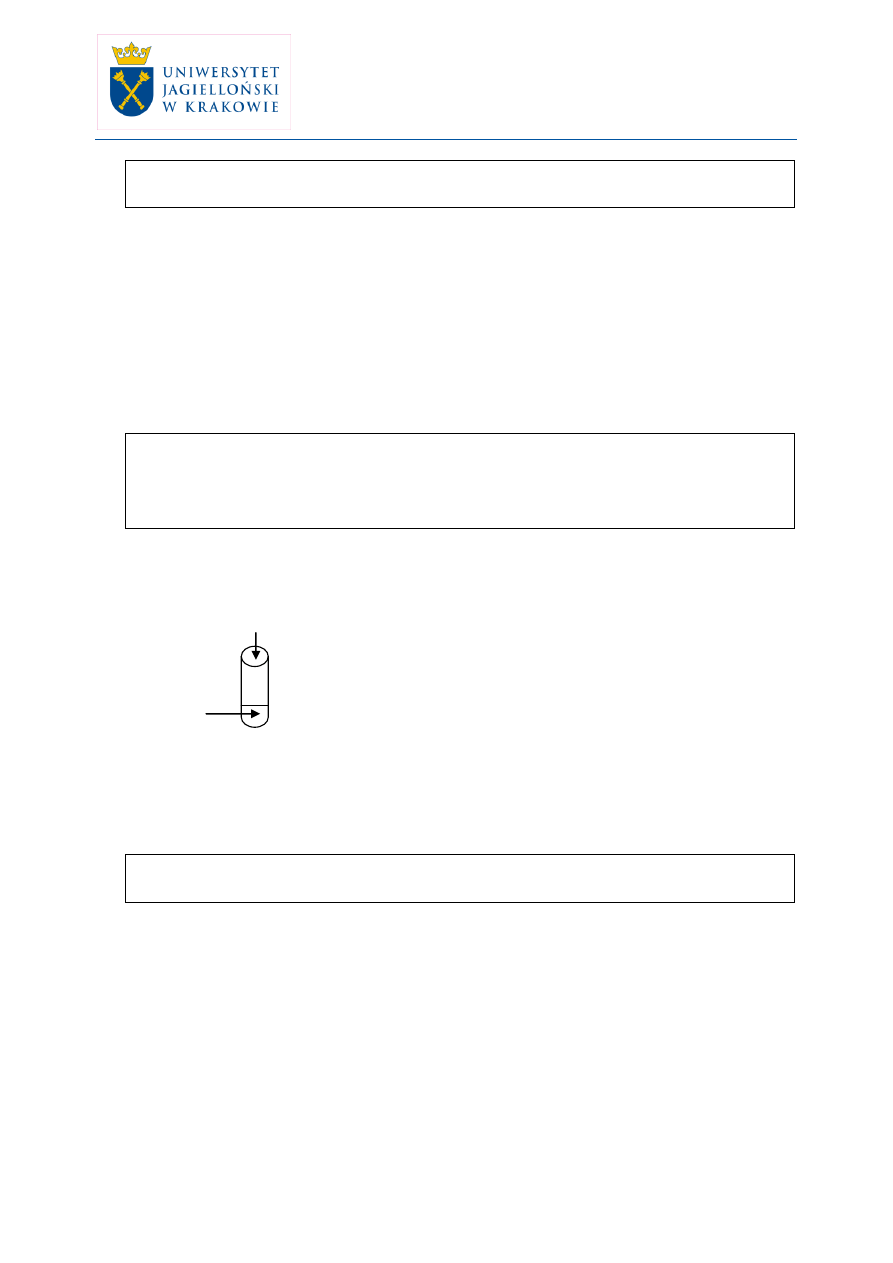
Doświadczenie: Reakcja kwasu octowego z alkoholem etylowym (pokaz).
(1) kwas octowy
(2) st. H
2
SO
4
etanol
X
Obserwacje: substancja w probówce ma zapach zmywacza do paznokci.
Wniosek: zachodzi reakcja chemiczna, powstaje związek o innym zapachu niż
substancje wyjściowe.
Po wykonaniu doświadczenia nauczyciel wyjaśnia przebieg procesu i formułuje notatkę
do zeszytu:
W reakcji kwasu z alkoholem powstaje ester, drugim produktem reakcji jest woda
powstająca przez połączenie atomu wodoru pochodzącego z grupy hydroksylowej
alkoholu i grupy –OH pochodzącej z grupy karboksylowej.

Wydział Chemii, Zakład Dydaktyki Chemii
ul. Ingardena 3, 30-060 Kraków
tel./fax: 12 663 22 58
www.zmnch.pl
Na podstawie tej informacji uczniowie, pracując w grupach 4-osobowych, modelują
przebieg reakcji, wykorzystując modele związków zbudowane wcześniej - w ten sposób
uczniowie równocześnie przypominają sobie nazwy grup funkcyjnych, ponieważ
nauczyciel wyjaśniając przebieg reakcji, podaje tylko ich nazwy.
Uczniowie zapisują równanie reakcji wzorami półstrukturalnymi, w których
zaznaczono wiązania w grupach funkcyjnych, oraz wpisują nazwy związków – nazwa
estru zostanie wpisana po wyjaśnieniu zasad nomenklatury tych związków.
O
O
CH
3
– C + C
2
H
5
– O
– H
= CH
3
– C
+ H
2
O
O – H
O – C
2
H
5
kwas etanowy alkohol etylowy etanian etylu
(octowy) (octan etylu)
Po zapisaniu równania reakcji nauczyciel wyjaśnia zasady nomenklatury estrów.
Nazwy estrów tworzy się podobnie jak nazwy soli, tzn. po nazwie reszty kwasowej
dodaje się nazwę podstawionej grupy węglowodorowej, np.
HCOOCH
3
– metanian metylu, lub mrówczan metylu
C
2
H
5
COOC
2
H
5
– propanian etylu.
Po wyjaśnieniu zasad nomenklatury estrów nauczyciel podaje nazwę reakcji
(estryfikacja), i zapisuje na tablicy schemat tej reakcji.
H
2
SO
4
alkohol + kwas karboksylowy ester + woda
estryfikacja
Analizując powyższy schemat uczniowie, z pomocą nauczyciela próbują wyjaśnić rolę
stężonego kwasu siarkowego(VI) w reakcji estryfikacji. Powinny się tutaj znaleźć
stwierdzenia: kwas siarkowy(VI) jest katalizatorem tej reakcji, a także jako substancja
silnie higroskopijna, wiąże wydzielającą się wodę, uniemożliwiając tym samym reakcję
rozpadu estru, która zachodzi właśnie w obecności wody. Podsumowaniem tego etapu
jest kolejna notatka do zeszytu ucznia.

Wydział Chemii, Zakład Dydaktyki Chemii
ul. Ingardena 3, 30-060 Kraków
tel./fax: 12 663 22 58
www.zmnch.pl
Rola kwasu siarkowego(VI) w reakcji estryfikacji:
Katalizuje przebieg reakcji
Wiąże wodę uniemożliwiając przebieg reakcji odwrotnej.
Na zakończenie części postępującej nauczyciel rozdaje uczniom notatkę dotyczącą
właściwości, występowania i znaczenia estrów. Rozdanie notatki w formie odbitek
kserograficznych, oszczędza czas na jej dyktowanie, a jednocześnie uczniowie uczą się
czytać tekst ze zrozumieniem.
Rekapitulacja:
W ramach rekapitulacji uczniowie uzupełniają kartę pracy, dwicząc zapis równao reakcji
estryfikacji oraz nazwy związków organicznych. Zapisując równania tłumaczą
„mechanizm” reakcji.
Estry to związki organiczne, które powstają w reakcji kwasów z alkoholami.
Występują one w organizmach roślinnych (szczególnie w owocach i korzeniach) i
zwierzęcych. Są one również otrzymywane w laboratoriach na drodze estryfikacji.
Estry niższych kwasów karboksylowych są bezbarwnymi, lotnymi cieczami, słabo
rozpuszczalnymi w wodzie, o przyjemnym, często owocowym zapachu. Naturalny
zapach owoców spowodowany jest obecnością mieszanin różnych estrów i innych
substancji lotnych.
Karta pracy nr 2.
1. Stosując wzory półstrukturalne, uzupełnij równania reakcji i podaj nazwy związków
organicznych, biorących udział w tych reakcjach:
a. HCOOH + CH
3
OH = …………… + ……………..
………… ………… …………....
………… …………. ……………
b. …………. + ………….. = ………………. + ……………….
(wzorami podstrukturalnymi)
…………… …………. octan metylu
…………... ………….
2. Prawda czy fałsz?
Określ, które zdanie jest prawdziwe a które fałszywe
a. Mrówczan etylu jest białym ciałem stałym …….
b. Katalizatorem w reakcji estryfikacji jest kwas siarkowy(VI) …….
c. Estry nie występują w przyrodzie………

Wydział Chemii, Zakład Dydaktyki Chemii
ul. Ingardena 3, 30-060 Kraków
tel./fax: 12 663 22 58
www.zmnch.pl
Zadanie domowe:
W wyniku reakcji alkoholu o masie cząsteczkowej 46 u z kwasem karboksylowym
powstał ester o masie cząsteczkowej 74 u. Na podstawie tych danych zidentyfikuj
alkohol i kwas, a następnie napisz równanie zachodzącej reakcji i podaj nazwę estru.
Przykładowe rozwiązanie
Identyfikacja alkoholu:
Wzór ogólny alkoholu: C
n
H
2n+1
OH
46 u – 17u = 29 u - masa reszty węglowodorowej
12n + 1 (2n + 1) = 29 u
n = 2
C
2
H
5
OH to etanol
Identyfikacja kwasu:
alkohol + kwas = ester + woda
masa cząsteczkowa kwasu = masa cząsteczkowa estru + masa cząsteczkowa wody – masa
cząsteczkowa alkoholu (wykorzystane prawo zachowania masy)
masa cząsteczkowa kwasu = 74 u + 18 u – 46 u = 46 u
masa C
n
H
2n+1+COOH
= 46 u
masa reszty węglowodorowej = 46u – 45 u = 1u
HCOOH to kwas metanowy (mrówkowy)
Wzór estru: HCOOC
2
H
5
mrówczan (metanian) etylu
Równanie reakcji:
HCOOH + C
2
H
5
OH = HCOOC
2
H
5
+ H
2
O
Wyszukiwarka
Podobne podstrony:
MNS jesteśmy fajne
estry mrówczan butylu
Chemia 2 ściąga (klasówka aldehydy alkohole estry kw karb ?nole)
Jak zrobić na klawiaturze taki znak jak serce lub inne fajne rzeczy Zapytaj onet
sex test, Dokumenty-Fajne i Ważne
PC ogolna bardzo fajne polecam
estry, prace do szkoły (wypracowania) itp
Opis przebiegu ćwiczenia estry
fajne opisy na gg
TESTY I FAJNE INNE GLUPOTY XD, podryw
zabawy integracyjne, ściaga maturalna , fajne cytaty , kawaly itp. - duzo fajnych rzeczy
plakaty puszki aluminiowe fajne
2 12 Estry i Tuszcze
Estry i tłuszcze, ESTRY KWASÓW KARBOKSYLOWYCH
więcej podobnych podstron