Z. Kąkol-Notatki do Wykładu z Fizyki
36-1
Wykład
36
36.
Atomy wieloelektronowe, układ okresowy pierwiastków.
Fizycy badający strukturę atomów wieloelektronowych starali się odpowiedzieć na
fundamentalne pytanie, dlaczego wszystkie elektrony w atomie znajdującym się w sta-
nie podstawowym nie są związane na najbardziej wewnętrznej powłoce (orbicie).
Fizyka klasyczna nie wyjaśnia tego problemu; dopiero mechanika kwantowa przyniosła
podstawy teoretyczne, na gruncie których można przewidzieć własności pierwiastków.
36.1
Liczby kwantowe
Na poprzednich wykładach przedstawione zostało wprowadzenie do świata fizyki
kwantowej. Poznaliśmy między innymi jak ograniczenie ruchu cząstki do obszaru za-
wartego pomiędzy sztywnymi ściankami wpływa na prawdopodobieństwo jej znalezie-
nia oraz jak wpływa na skwantowanie wartości energii
......
,
2
,
1
,
8
2
2
2
=
=
n
ml
h
n
E
Podobnie wartości energii elektronu w atomie wodoru zależą tylko od liczby kwanto-
wej n.
Inaczej jednak jest w przypadku odpowiedniej fali (stojącej) materii. Funkcja falowa
zależy od
trzech liczb kwantowych
co wynika z faktu, że ruch w przestrzeni jest opisany
przez trzy niezależne zmienne; na każdą współrzędną przestrzenną przypada jedna licz-
ba.
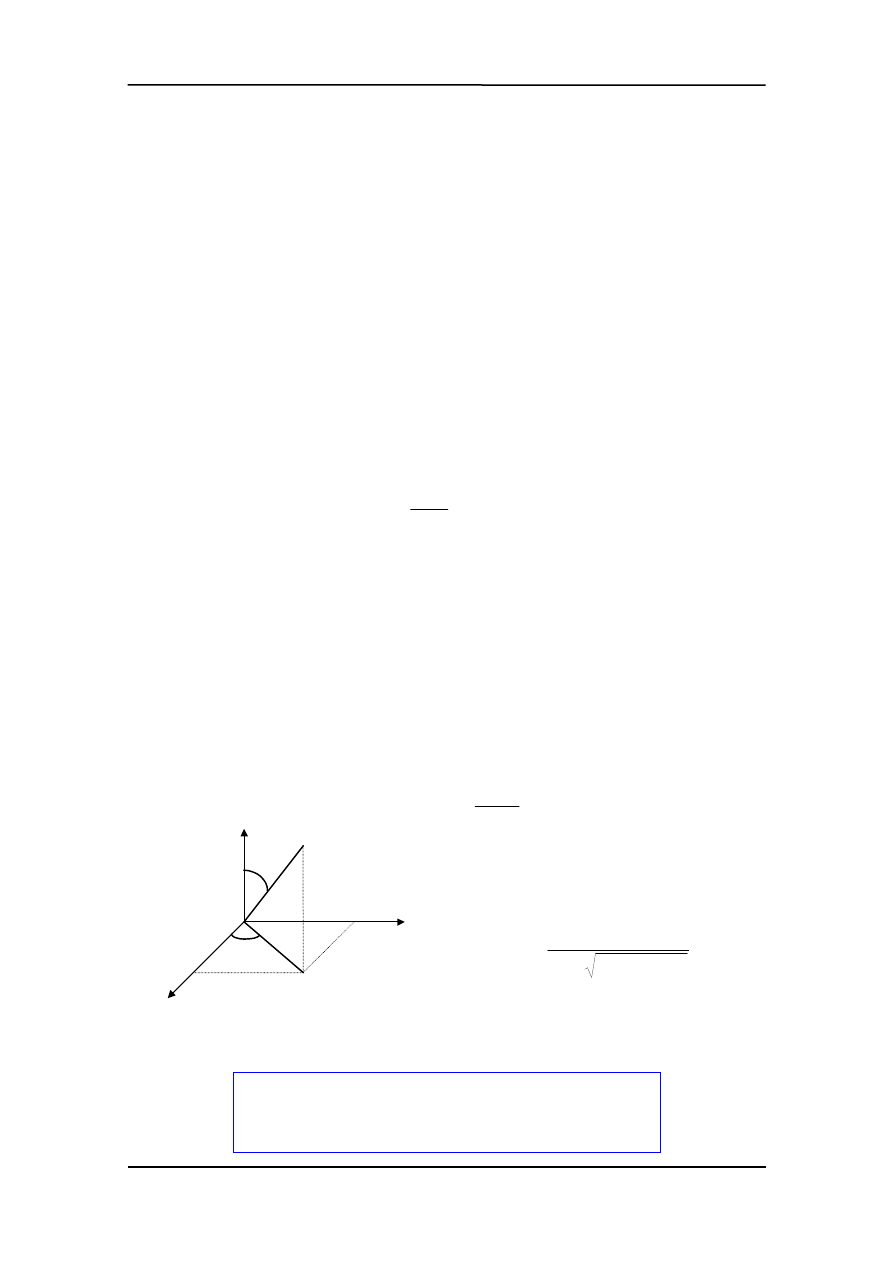
Na rysunku obok pokazane są współrzędne prostokątne (x, y, z) i współrzędne sferyczne
(r,
θ
,
ϕ
) punktu P.
Stosowanie współrzędnych sferycznych w zdecydowany sposób ułatwia obliczenia.
Wynika to z faktu, że energia potencjalna oddziaływania elektronu z jądrem
r
e
U
0
2
4
πε
−
=
jest funkcją tylko jednej zmien-
nej we współrzędnych sferycznych podczas
gdy we współrzędnych prostokątnych funkcją
wszystkich trzech współrzędnych
2
2
2
0
2
4
z
y
x
e
U
+
+
−
=
πε
Trzy liczby kwantowe n, l, m
l
spełniają nastę-
pujące warunki
l
m
l
l
l
l
l
l
l
m
n
l
n
l
n
l
l
≤
≤
−
−
−
+
−
+
−
−
=
−
≤
≤
−
=
=
lub
,
1
,
2
,
.....
,
2
,
1
,
1
0
lub
1
,
......
,
2
,
1
,
0
.....
,
3
,
2
,
1
(36.1)
x
y
z
x
y
z
P
r
θ
ϕ

Z. Kąkol-Notatki do Wykładu z Fizyki
36-2
Ze względu na rolę jaką odgrywa liczba
n
w określeniu energii całkowitej atomu, jest
nazywana
główną liczbą kwantową
. Liczba
l
nosi nazwę
azymutalnej liczby kwantowej
,
a liczba
m
l
nazywana jest
magnetyczną liczbą kwantową
. Z warunków (36.1)
widać, że
dla danej wartości n
(danej energii)
istnieje na ogół kilka różnych możliwych wartości l,
m
l
.
36.2
Zasada Pauliego
W 1869 r. Mendelejew jako pierwszy zauważył, że większość własności pierwiast-
ków chemicznych jest okresową funkcją liczby atomowej Z określającej liczbę elektro-
nów w atomie co najlepiej uwidacznia się w odpowiednio skonstruowanym układzie
okresowym pierwiastków. Właściwości chemiczne i fizyczne pierwiastków powtarzają
się jeżeli zebrać je w grupy zawierające 2, 8, 8, 18, 18, 32 elementów.
W 1925 r. Wolfgang Pauli podał prostą zasadę, dzięki której automatycznie są genero-
wane grupy o liczebności 2, 8,18,32. Pauli
zapostulował, że na jednej orbicie mogą
znajdować się nie więcej niż dwa elektrony, czyli tylko dwa elektrony mogą być opisane
tą samą falą stojącą materii
.
Zatem na orbicie n = 1 będą dwa elektrony bo mamy tylko jedną falę stojącą, czyli jeden
orbital
(n, l, m
l
) = (1,0,0)
Dla n = 2 są cztery orbitale
(n, l, m
l
) = (2,0,0);
(2,1,1), (2,1,0), (2,1,–1)
Stąd wynika, że w stanie n = 2 może być 8 elektronów (dwa na orbital).
Podobnie dla n = 3 mamy 9 orbitali czyli 18 elektronów
(n, l, m
l
) = (3,0,0);
(3,1,1), (3,1,0), (3,1,–1);
(3,2,2), (3,2,1), (3,2,0), (3,2,–1), (3,2,–2)
Widać, że okresy 2, 8, 18 są konsekwencja zasady Pauliego i teorii kwantowej, z której
wynikają warunki (36.1).
W czasie gdy Pauli podał swoją zasadę była ona zasadą ad hoc, nie można było jej wy-
prowadzić w ramach istniejącej teorii. Pozostawało więc pytanie: dlaczego akurat dwa
elektrony (a nie inna liczba) mogą być opisane tą samą falą stojącą?
36.2.1
Spin elektronu
W roku 1926 odkryto, że wszystkie elektrony mają wewnętrzny moment pędu
L
wew
= (1/2)(h/2
π
), który został nazwany
spinowym momentem pędu
.
Elektron zachowuje się tak, jakby był kulką wirującą wokół pewnej osi obrotu (analo-
gicznie jak Ziemia obiegająca Słońce i obracająca się wokół swej osi).
Wewnętrzny moment pędu elektronu nigdy nie zwiększa się ani też nie maleje.
Okazało się ponadto, że dla danego stanu orbitalnego są możliwe
dwa kierunki spinu
.
Mamy więc inny sposób wyrażenia zasady Pauliego. Oznacza to, że zasada Pauliego nie
była postulatem wprowadzona ad hoc.

Z. Kąkol-Notatki do Wykładu z Fizyki
36-3
Znajomość spinu jest niezbędna do opisu stanu elektronu. Kiedy te stany są określone to
zasada Pauliego, która w pierwotnym brzmieniu stwierdzała, że w danym stanie orbital-
nym nie może być więcej elektronów niż dwa, oznacza teraz, że
w danym stanie
(z uwzględnieniem spinu) może znajdować się tylko jeden elektron
.
36.3
Atomy wieloelektronowe, układ okresowy pierwiastków
Posługując się zasadą Pauliego można określić jakie stany w atomie będą obsadzane.
Rozpatrzmy np. jądro neonu Z = 10. Jeżeli w pobliżu jądra umieścimy jeden elektron to
zajmie on orbital n = 1. Tak samo będzie z drugim elektronem (inny kierunek spinu). Te
dwa elektrony zapełnią orbitę n = 1. Pozostałe 8 elektronów zapełni orbitę o n = 2, czyli
cztery orbitale (l, m
l
) = (0,0), (1,1), (1,0), (1,–1). W ten sposób rozpatrzymy przewidy-
waną przez teorię kwantową strukturę niektórych pierwiastków.
Z = 1, Wodór
Jedyny elektron znajduje się w stanie n = 1, o energii E = – 13.6 eV. Tak więc
energia
wiązania
czyli
energia jonizacji
atomu wodoru wynosi 13.6 eV. Oznacza to, że mini-
malne napięcie potrzebne do zjonizowania atomu wodoru wynosi 13.6 V. To minimalne
napięcie nazywamy potencjałem jonizacyjnym.
Z = 2, Hel
Zacznijmy od jonu helu, He
+
, który składa się z jądra oraz jednego elektronu.
Mamy układ podobny do wodoru tylko inna jest siła elektrostatyczna działająca na elek-
tron (większa o czynnik Z). Energia jest dana wzorem analogicznym jak w modelu
Bohra
eV
6
.
13
8
2
2
2
2
1
2
2
2
0
4
2
n
Z
n
Z
E
n
h
me
Z
E
−
=
=
−
=
ε
(36.2)
Ze względu na czynnik Z
2
energia jonizacji He
+
wynosi 4·13.6 eV = 54.4 eV.
Wartość ta zgadza się ze zmierzonym potencjałem jonizacji.
Jeżeli teraz dodamy drugi elektron na powłokę n = 1 to przez połowę czasu będzie on
bliżej jądra niż pierwszy i będzie „czuł” ładunek jądra Z, a przez połowę czasu będzie
dalej więc będzie „widział” jądro o ładunku Z i 1 elektron czyli „obiekt” o ładunku
(Z – 1). Prosta średnia arytmetyczna tych dwóch wartości daje
efektywny ładunek
Z
ef
= 1.5e jaki „czują” elektrony w atomie helu. Możemy teraz uogólnić wzór (36.2) do
postaci
eV
6
.
13
2
2
n
Z
E
ef
−
=
(36.3)
Na podstawie tak oszacowanego ładunku efektywnego otrzymujemy potencjał jonizacji
równy około (1.5)
2
·13.6 V = 30 V.
W rzeczywistości elektrony nie tylko ekranują ładunek jądra ale też odpychają się na-
wzajem (dodatnia energia potencjalna), więc energia wiązania powinna być mniejsza.
Wyznaczony doświadczalnie potencjał jonizacyjny helu wynosi 24.6 V i jest największy
dla wszystkich pierwiastków. śadna siła chemiczna nie może dostarczyć takiej energii,
która jest potrzebna do utworzenia He
+
.

Z. Kąkol-Notatki do Wykładu z Fizyki
36-4
Gdybyśmy spróbowali utworzyć ujemny jon He
-
to dodatkowy elektron obsadzi powło-
kę n = 2 o dużo większym promieniu niż n = 1, na której są już dwa elektrony. Ładunek
efektywny widziany przez ten elektron będzie więc równy zeru, nie działa żadna siła
mogąca przytrzymać ten elektron. W rezultacie hel nie tworzy cząsteczek z żadnym
pierwiastkiem. Hel i inne atomy o całkowicie wypełnionych powłokach są nazywane ga-
zami szlachetnymi.
Z = 3, Lit
Dwukrotnie zjonizowany atom litu jest atomem wodoropodobnym przy czym energie
trzeba pomnożyć przez czynnik Z
2
= 9.
Jednokrotnie zjonizowany atom litu ma energie podobne do atomu helu ale
Z
ef
≈
(3 – 1/2) zamiast (2 – 1/2), jak dla helu.
Trzeci elektron znajduje się na powłoce n = 2. Dla niego ładunek efektywny musi być
w pobliżu (trochę większy) jedności. Zatem należy oczekiwać, że potencjał jonizacji litu
będzie nieco większy niż 13.6/n
2
= 13.6/2
2
= 3.4 V. Wartość zmierzona wynosi 5.4 V co
odpowiada Z
ef
= 1.25e.
Oderwanie drugiego elektronu wymaga potencjału aż 75.6 V. Zatem w związkach che-
micznych lit powinien zawsze wykazywać wartościowość +1.
Z = 4, Beryl
Zgodnie z zasadą Pauliego w stanie n = 2, l = 0 jest miejsce dla dwóch elektronów. Dla
berylu drugi potencjał jonizacyjny nie jest więc dużo większy od pierwszego i beryl w
związkach chemicznych ma wartościowość +2.
Wprowadźmy teraz do opisu konfiguracji następującą konwencję: numer powłoki (n)
piszemy cyfrą, natomiast podpowłoki: l = 0, 1, 2, 3 4 oznaczmy literami s, p, d, f.
Wskaźnik górny przy symbolu podpowłoki określa liczbę znajdujących się w niej elek-
tronów a wskaźnik dolny przy symbolu chemicznym pierwiastka określa wartość Z.
Tak więc konfiguracje dotychczas omawianych pierwiastków zapiszemy w postaci
1
H :
1s
1
2
He : 1s
2
3
Li :
1s
2
2s
1
4
Be : 1s
2
2s
2
Od Z = 5 (Boru) do Z = 10 (neonu)
W tych sześciu pierwiastkach elektrony zapełniają podpowłokę 2p (n = 2, l = 1)
5
B :
1s
2
2s
2
2p
1
10
Ne : 1s
2
2s
2
2p
6
Wśród tych pierwiastków znajdują się fluor i tlen, którym do zapełnienia orbity p braku-
je odpowiednio 1 i 2 elektrony. Pierwiastki te wykazują silną tendencję do przyłączenia
dodatkowych elektronów tworząc trwałe jony Fl
–
i O
– –
. To zjawisko jest zwane
powi-
nowactwem elektronowym
.
Kontynuując powyższy schemat można napisać konfigurację elektronową dowolnego
atomu. Okazuje się jednak, że w niektórych przypadkach obserwowane konfiguracje nie
pokrywają się z obserwowanymi. Wnioskujemy, że różnice energii pomiędzy niektóry-
mi podpowłokami muszą być tak małe, że w pewnych wypadkach może zostać odwró-
Z. Kąkol-Notatki do Wykładu z Fizyki
36-5
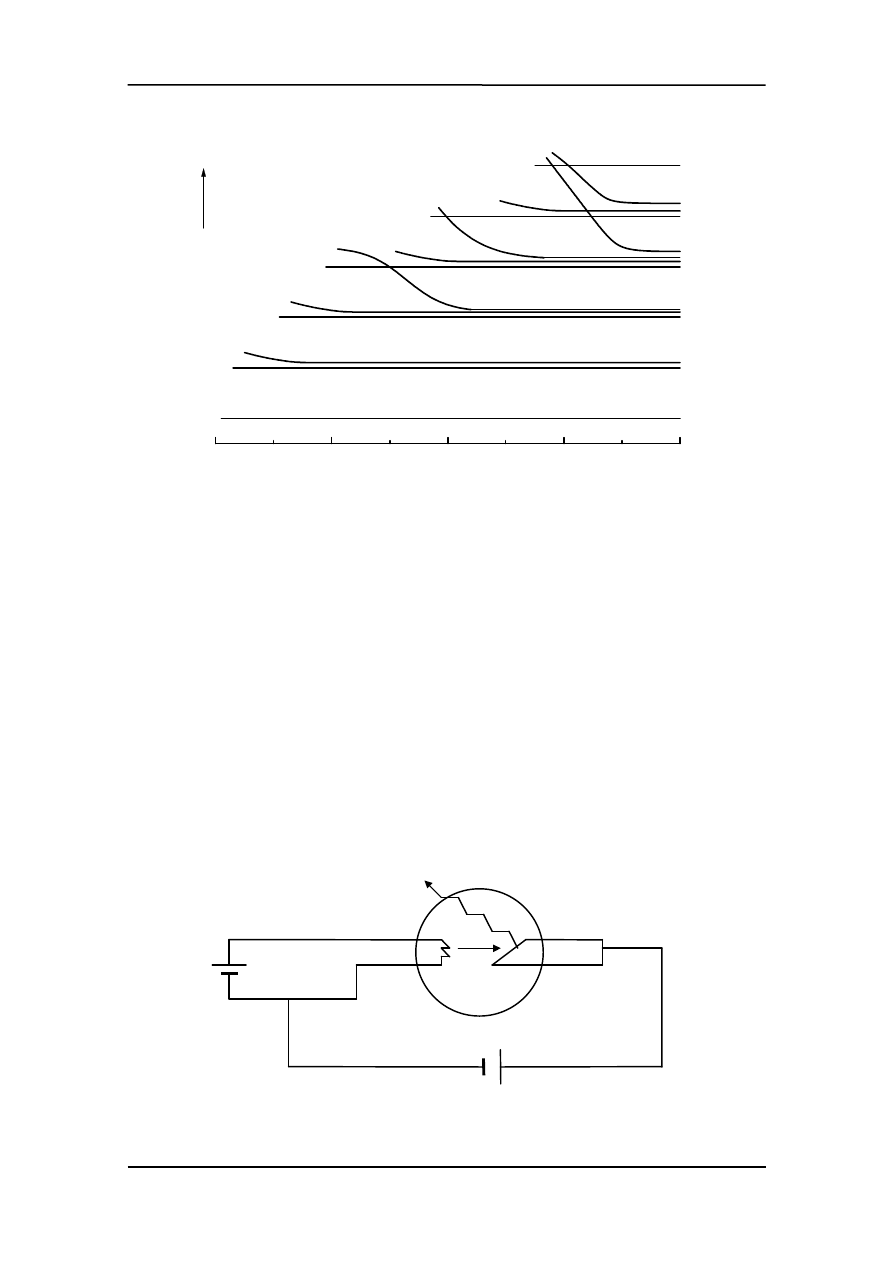
cona kolejność ich zapełniania. Można to zobaczyć na rysunku poniżej (na następnej
stronie). Krzywe kończą się na Z = 80 (rtęć). Uwaga: skala energii nie jest liniowa.
Zwróćmy też uwagę, że każda podpowłoka p ma wyższą energię od poprzedzającej ją
powłoki s. Natomiast różnice energii pomiędzy każdą podpowłoką s i poprzedzającą ją
powłoką p są szczególnie duże. W konsekwencji wzbudzenie elektronu w atomach
pierwiastków, w których zakończyło się właśnie zapełnianie powłoki p jest bardzo trud-
ne (gazy szlachetne).
W ten sposób na gruncie mechaniki kwantowej (z uwzględnieniem spinu elektronu)
można przeanalizować własności wszystkich pierwiastków.
36.4
Promienie X
Wielokrotnie mówiliśmy o zastosowaniu promieniowania rentgenowskiego. Teraz
poznamy więcej szczegółów dotyczących widma tego promieniowania.
0
20
40
60
80
e
n
e
rg
ia
5d
4f
6s
5p
4d
5s
4p
3d
4s
3p
3s
2p
2s
1s
Z
K
A
U
promieniowanie X

Z. Kąkol-Notatki do Wykładu z Fizyki
36-6
Na rysunku poniżej pokazana jest lampa rentgenowska.
Elektrony emitowane z katody K są przyspieszane przez napięcie U rzędu 10
4
V (przy-
łożone pomiędzy katodą i anodą) i wreszcie uderzają w anodę (tarczę). Elektrony są
hamowane w anodzie, aż do ich całkowitego zatrzymania.
Zgodnie z fizyką klasyczną w wyniku tego hamowania (ładunek doznający przyspiesze-
nia) powinna nastąpić emisja promieniowania elektromagnetycznego o widmie ciągłym
.
Przykładowy rozkład widmowy rentgenowski otrzymany dla wolframu jest pokazany na
wykresie poniżej.
Najbardziej charakterystycznymi cechami obserwowanych rozkładów widmowych pro-
mieniowania X są:
•
charakterystyczne linie widmowe tj. maksima natężenia promieniowania występują-
ce dla ściśle określonych długości fal. Zaobserwowano, że
widmo liniowe
zależy od
materiału (pierwiastka) anody.
•
istnienie dobrze określonej minimalnej długości fali
λ
min
widma ciągłego
. Stwier-
dzono, że wartość
λ
min
zależy jedynie od napięcia U i jest taka sama dla wszystkich
materiałów, z jakich wykonana jest anoda.
Istnienie krótkofalowej granicy widma ciągłego promieniowania X nie może być wyja-
ś
nione przez klasyczną teorię elektromagnetyzmu. W świetle tej teorii nie istnieją żadne
powody, aby z anody nie mogły być wysłane fale o długości mniejszej od jakiejś warto-
ś
ci granicznej.
Jeżeli jednak potraktujemy promieniowanie rentgenowskie jako strumień fotonów to
wyjaśnienie obserwowanego zjawiska jest proste.
Elektron o początkowej energii kinetycznej E
k
(uzy-
skanej dzięki napięciu U) w wyniku oddziaływania
z ciężkim jądrem atomu tarczy jest hamowany
i energia jaką traci pojawia się w formie kwantów
(rysunek obok). Energia powstającego fotonu jest da-
na wzorem:
hv = E
k
- E
k
'
0.00
0.05
0.10
0.15
N
a
t
ę
ż
e
n
ie
λ
(nm)
E
k
E
k
'
j
ą
dro
foton
elektron

Z. Kąkol-Notatki do Wykładu z Fizyki
36-7
gdzie E
k
' jest energią elektronu po zderzeniu. Elektron w trakcie zderzenia przekazuje
jądru pewną energię jednak ze względu na to, że jądra tarczy są bardzo ciężkie (w po-
równaniu do elektronu) możemy ją zaniedbać.
Długość fali fotonu można obliczyć z relacji
'
k
k
E
E
c
h
−
=
λ
W wyniku zderzeń elektrony tracą różne ilości energii typowo elektron zostaje zatrzy-
many w wyniku wielu zderzeń z jądrami tarczy - otrzymujemy szereg fotonów o róż-
nych energiach (różnych
λ
). Wobec tego promieniowanie rentgenowskie wytwarzane
przez wiele elektronów będzie miało
widmo ciągłe
.
Powstaje wiele fotonów o długościach od
λ
min
do
λ
→
∞
, co odpowiada różnym ener-
giom traconym w zderzeniach.
Foton o najmniejszej długości fali
λ
min
(maksymalnej energii) będzie emitowany wtedy
gdy elektron straci całą energię w jednym procesie zderzenia. Oznacza to, że po tym
zderzeniu E
k
' = 0 więc
k
E
c
h
=
min
λ
(36.4)
Ponieważ energia kinetyczna jest równa eU (elektron przyspieszony napięciem U) więc
zachodzi relacja
eU
c
h
=
min
λ
czyli
eU
hc
=
min
λ
(36.5)
Tak więc minimalna długość fali odpowiadająca całkowitej zamianie energii kinetycz-
nej elektronów na promieniowanie zależy jedynie od U, a nie zależy np. od materiału z
jakiego zrobiono tarczę (anodę).
Podobnie na gruncie fizyki kwantowej można wyjaśnić powstawanie
widma liniowego
(charakterystycznego)
.
Elektron z wiązki padającej przelatując przez atom anody, niekiedy przechodzi w pobli-
ż
u elektronu podpowłoki wewnętrznej. W wyniku oddziaływania kulombowskiego
między tymi elektronami może dojść do wybicia elektronu z podpowłoki poza atom.
Pozostawia to atom w stanie wysoko wzbudzonym ponieważ ubył elektron o dużej
energii wiązania. Atom ostatecznie powróci do stanu podstawowego, emitując serię fo-
tonów wysokoenergetycznych.
Aby to szczegółowo prześledzić rozpatrzmy atom anody, z którego podpowłoki 1s zo-
stał usunięty elektron. W pierwszym kroku powrotu atomu do stanu podstawowego
elektron z jednej z podpowłok o mniej ujemnej (wyższej) energii np. elektron 2p, prze-
chodzi na wolne miejsce w podpowłoce 1s. Pozostawia to dziurę w podpowłoce 2p.
Towarzyszy temu emisja fotonu o energii równej spadkowi energii wzbudzenia tj. róż-

Z. Kąkol-Notatki do Wykładu z Fizyki
36-8
nicy energii atomu z brakującym elektronem 1s i atomu z brakującym elektronem 2p.
Oczywiście dziura w podpowłoce 2p może być zapełniona przez elektron 3d, a powstała
dziura w podpowłoce 3d przez elektron 4p itd.
Zazwyczaj proces powrotu atomu do stanu podstawowego składa się z kilku kroków.
W każdym kroku dziura przeskakuje do podpowłoki o mniej ujemnej energii, aż przej-
dzie do najbardziej zewnętrznej podpowłoki gdzie zostanie zajęta przez jakiś elektron
będący w pobliżu. Atom jest znowu w stanie podstawowym i jest obojętny elektrycznie.
Każdemu przejściu dziury do stanu o mniej ujemnej energii towarzyszy emisja fotonu o
energii równej spadkowi energii wzbudzenia. W ten sposób powstaje
widmo liniowe
.
Ponieważ przejścia odbywają się pomiędzy podpowłokami atomu anody więc wysyłane
promieniowanie X jest charakterystyczne dla atomów konkretnego pierwiastka anody.
Liniowe widma rentgenowskie są interesujące praktyczni ze względu na wiele użytecz-
nych zastosowań w nauce i technice.
Wyszukiwarka
Podobne podstrony:
36 Atomy wieloelektronowe, uklad okresowy pierwiastkow (10)
36 atomy wieloelekronowe, układ okresowy pierwiastków
Atomy wieloelektronowe, układ okresowy pierwiastków
UKŁAD OKRESOWY PIERWIASTKÓW
7 układ okresowy pierwiastków, wiązania chemiczne
Walkowiak, Chemia ogólna, Układ okresowy pierwiastków
Wyklad 6. Uklad okresowy pierwiastkow, pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Powt. Dz. II, Powtórzenie wiadomości z działu II: Układ okresowy pierwiastków
UKŁAD OKRESOWY PIERWIASTKÓW (WERSJA SKRÓCONA) kolor, Dokumenty - chemia
Układ okresowy pierwiastków2, Chemia
Współczesny Układ Okresowy Pierwiastków, Chemia
uklad-okresowy-pierwiastkow
88 Uklad okresowy pierwiastkow 2
więcej podobnych podstron