
Konkursy w województwie podkarpackim w roku szkolnym 2006/2007
Strona 1 z 11
....................................
kod pracy ucznia
.............................................
piecz tka nagłówkowa szkoły
PRZEDMIOTOWY KONKURS CHEMICZNY
DLA UCZNIÓW GIMNAZJUM
ETAP SZKOLNY
Drogi Uczniu,
witaj na I etapie konkursu chemicznego. Przeczytaj uwa nie instrukcj i postaraj si
prawidłowo odpowiedzie na wszystkie pytania.
•
Arkusz liczy 11 stron i zawiera 20 zada .
•
Przed rozpocz ciem pracy sprawd , czy Twój test jest
kompletny. Je eli zauwa ysz usterki, zgło je Komisji
konkursowej.
•
Zadania czytaj uwa nie i ze zrozumieniem.
•
Pisz tylko czarnym lub niebieskim długopisem lub piórem.
•
W przypadku testu wyboru podane s cztery odpowiedzi:
A, B, C, D. Tylko jedna jest poprawna. Wybierz j i wpisz
znak X zaznaczaj c odpowiedni liter w te cie.
•
Staraj si nie popełni bł dów przy zaznaczaniu odpowiedzi,
ale je eli si pomylisz, otocz bł dn odpowied kółkiem
i zaznacz inn .
•
W zadaniach otwartych przedstaw tok rozumowania
prowadz cy do wyniku.
•
Oceniane b d tylko odpowiedzi, które zostały umieszczone
w miejscu do tego przeznaczonym.
•
Nie u ywaj korektora i kalkulatora.
•
Mo esz korzysta z tablic doł czonych do zestawu zada .
•
Brudnopis nie podlega ocenie.
Pracuj samodzielnie
.
Powodzenia!
Czas pracy:
60 minut
Liczba punktów
mo liwych
do uzyskania:
55

Konkursy w województwie podkarpackim w roku szkolnym 2006/2007
Strona 2 z 11
Zadanie 1. (0-1 pkt.)
Liczba atomowa jodu Z = 53 a masowa A = 127. Liczba protonów w atomie jodu
wynosi:
A. 127
C. 74
B. 53
D. 180
Zadanie 2. (0-2 pkt.)
Który pierwiastek spełnia równocze nie warunki: 1) atom ma 3 powłoki
elektronowe, 2) tworzy tlenek typu E
2
O
A. wodór
C. sód
B. lit
D. potas
Zadanie 3. (0-1 pkt.)
Rozmieszczenie elektronów na powłokach pierwiastka jest nast puj ce:
K
2
L
8
M
2
.
Liczba atomowa tego pierwiastka wynosi:
A. 2
C. 10
B. 8
D. 12
Zadanie 4. (0-2 pkt.)
Której z cz steczek:
A) O
2
B) H
2
C) Cl
2
D) N
2
przyporz dkowujesz wzór elektronowy?
__
__
E
E

Konkursy w województwie podkarpackim w roku szkolnym 2006/2007
Strona 3 z 11
Zadanie 5. (0-1 pkt.)
W jonie Na
+
znajduje si :
A) 11 protonów i 11 elektronów
B) 11 protonów i 10 elektronów
C) 10 protonów i 11 elektronów
D) 10 protonów i 10 elektronów
Zadanie 6. (0-1 pkt.)
W roztworze pewnej substancji fenoloftaleina nie przyj ła malinowej barwy.
Wybierz zdanie prawdziwe:
A) pH roztworu mo e by wi ksze od 7
B) mo e to by wodny roztwór tlenku niemetalu
C) mo e to by wodny roztwór tlenku metalu
D) mo e to by roztwór wodorotlenku
Zadanie 7. (0-2 pkt.)
Ile siarczku elaza (II) powstanie w reakcji elaza z 8g siarki:
A. 14g
C. 88g
B. 22g
D. 44g
Zadanie 8. (0-2 pkt.)
Podane wzory s ogólnymi wzorami elektrolitów:
M (OH)
n
H
n
R M
n
R
m
Aby otrzyma roztwór zawieraj cy dwa razy wi cej kationów ni anionów,
nale y rozpu ci w wodzie:
A) wodorotlenek, w którym n=2
B) kwas, w którym n=1
C) sól, w którym n=1 i m=2
D) sól, w której n=2 i m=1

Konkursy w województwie podkarpackim w roku szkolnym 2006/2007
Strona 4 z 11
Zadanie 9. (0-2 pkt.)
Zmieszano próbki roztworów. W którym przypadku powstanie osad:
A. Ba
2+
i Cl
−
C. Pb
2+
i SO
4
2-
B. Fe
3+
i OH
−
D. Odpowiedzi B i C s prawidłowe
Zadanie 10. (0-2 pkt.)
Ile cz steczek Ca(OH)
2
zoboj tni całkowicie 30 cz steczek H
3
PO
4
A. 45
C. 90
B. 60
D. 30
Zadanie 11. (0-1 pkt.)
Wybieraj c odpowiednie zako czenie zdania, wska twierdzenie fałszywe.
Podczas przebiegu reakcji chemicznej:
A. zastaje zachowana ł czna masa substancji
B. zostaj zachowane cz steczki reaguj cych substancji
C. zostaj zachowane atomy reaguj cych substancji
D. ł czna liczba atomów przed reakcj jest równa ł cznej liczbie atomów po
reakcji
Zadanie 12. (0-2 pkt.)
Suma współczynników produktów reakcji Al. + H
2
SO
4
→
→
→
→
(po uzupełnieniu)
wyniesie:
A. 8
C. 5
B. 9
D. 4

Konkursy w województwie podkarpackim w roku szkolnym 2006/2007
Strona 5 z 11
Zadanie 13. (0-2 pkt.)
W czasie chlorowania wody wodoci gowej powstaje tlen atomowy, który ma
wła ciwo ci bakteriobójcze:
H
2
O + Cl
2
→
→
→
→
HCl + O
Suma współczynników równania reakcji (po uzgodnieniu) wynosi:
A. 5
C. 2
B. 4
D. 6
Zadanie 14. (0-3 pkt.)
Z rur wydechowych samochodów wydostaj si do atmosfery szkodliwe dla
rodowiska gazy m.in. tlenek w gla (II) i tlenek azotu (II). Przepuszczone przez
katalizator reaguj ze sob tworz c dwa składniki powietrza.
Ułó i zbilansuj równanie tej reakcji, wska reduktor
równanie ........................................................................................................................
reduktor ........................................................................................................................
Zadanie 15. (0-2 pkt.)
W 2 molach cz steczek wody znajduje si :
A. 4 mole atomów wodoru
B. 24,08
⋅
10
23
atomów wodoru
C. 4 atomy wodoru
D. Odpowiedzi A i B s prawidłowe

Konkursy w województwie podkarpackim w roku szkolnym 2006/2007
Strona 6 z 11
Zadanie 16. (0-5 pkt.)
Masa 1 mola siarczku pewnego trójatomowego pierwiastka jest 1,3 razy
wi ksza od masy 1 mola tlenku tego pierwiastka. Jaki to pierwiastek? Podaj
wzór tlenku i siarczku tego pierwiastka.
Wykonaj obliczenia
........................................................................................................................................
........................................................................................................................................
........................................................................................................................................
........................................................................................................................................
........................................................................................................................................
.......................................................................................................................................
Tym pierwiastkiem
jest.................................................................................................................................
Wzór tlenku tego
pierwiastka.....................................................................................................................
Wzór siarczku tego
pierwiastka.....................................................................................................................
Zadanie 17. (0-2 pkt.)
Rozpuszczalno KCl w temperaturze 40
o
C wynosi 40g / 100g H
2
O. Podaj
stosunek masowy KCl : H
2
O w nasyconym roztworze w tej temperaturze
........................................................................................................................................
........................................................................................................................................
........................................................................................................................................
........................................................................................................................................
........................................................................................................................................
.......................................................................................................................................

Konkursy w województwie podkarpackim w roku szkolnym 2006/2007
Strona 7 z 11
Zadanie 18. (0-2 pkt.)
W ilu gramach 20% roztworu NaOH znajduje si 10g substancji rozpuszczonej?
........................................................................................................................................
........................................................................................................................................
........................................................................................................................................
........................................................................................................................................
........................................................................................................................................
.......................................................................................................................................
Zadanie 19. (0-3 pkt.)
Podaj wzory substancji, które po wprowadzeniu do wody tworz :
wod utlenion .............................................................................................................
wod sodow ................................................................................................................
wod wapienn ..............................................................................................................
Zadanie 20. (0-17 pkt.)
Uzupełnij luki:
Jest pierwiastkiem o najwi kszym rozpowszechnieniu na Ziemi (ok. 49% masowych).
Nazw zaproponował Jan Oczapowski w 1853 roku. Jest obecny w powietrzu (ok.
20,98% obj.). Wyst puje w dwóch odmianach (zjawisko alotropii). Jedna z odmian
o masie cz steczkowej 32u przedstawiona jest wzorem ............................................
Druga odmiana powstaje z pierwszej pod wpływem wyładowa atmosferycznych, jest
nietrwała i łatwo przechodzi w pierwsz .
Napisz odpowiednie równanie ......................................................................................
Podaj nazw drugiej odmiany .......................................................................................
W przemy le pierwiastek ten otrzymuje si z powietrza lub wody. Ze skroplonego
powietrza otrzymuje si go w procesie .........................................................................
wg. równania .................................................................................................................
Z wody otrzymuje si go w procesie .............................................................................
wg. równania .................................................................................................................

Konkursy w województwie podkarpackim w roku szkolnym 2006/2007
Strona 8 z 11
Skroplenia tego gazu po raz pierwszy dokonali w 1883 roku polscy uczeni
..................................................................................... i ...............................................
.......................................................................................................................................
Z wodorem dany pierwiastek tworzy dwa zwi zki, w których stosunki masowe tego
pierwiastka do wodoru wynosz odpowiednio 8:1 i 6:1
Podaj wzory strukturalne i sumaryczne tych zwi zków.
....................................................................
.............................................................
....................................................................
.............................................................
Mo na kupi w aptece roztwór b d cy mieszanin obu tych zwi zków o nazwie
........................................................................, stosowany do dezynfekcji przy
skaleczeniach. Pierwiastek ten mo e by odbierany z jego zwi zków np. przez
w giel, wodór, metale a proces ten nosi nazw ...........................................................
Działa niszcz co na niektóre metale wyrz dzaj c olbrzymie straty w gospodarce.
Ten niszcz cy proces nazywamy ..................................................................................

Konkursy w województwie podkarpackim w roku szkolnym 2006/2007
Strona 9 z 11
BRUDNOPIS
(nie podlega ocenie)
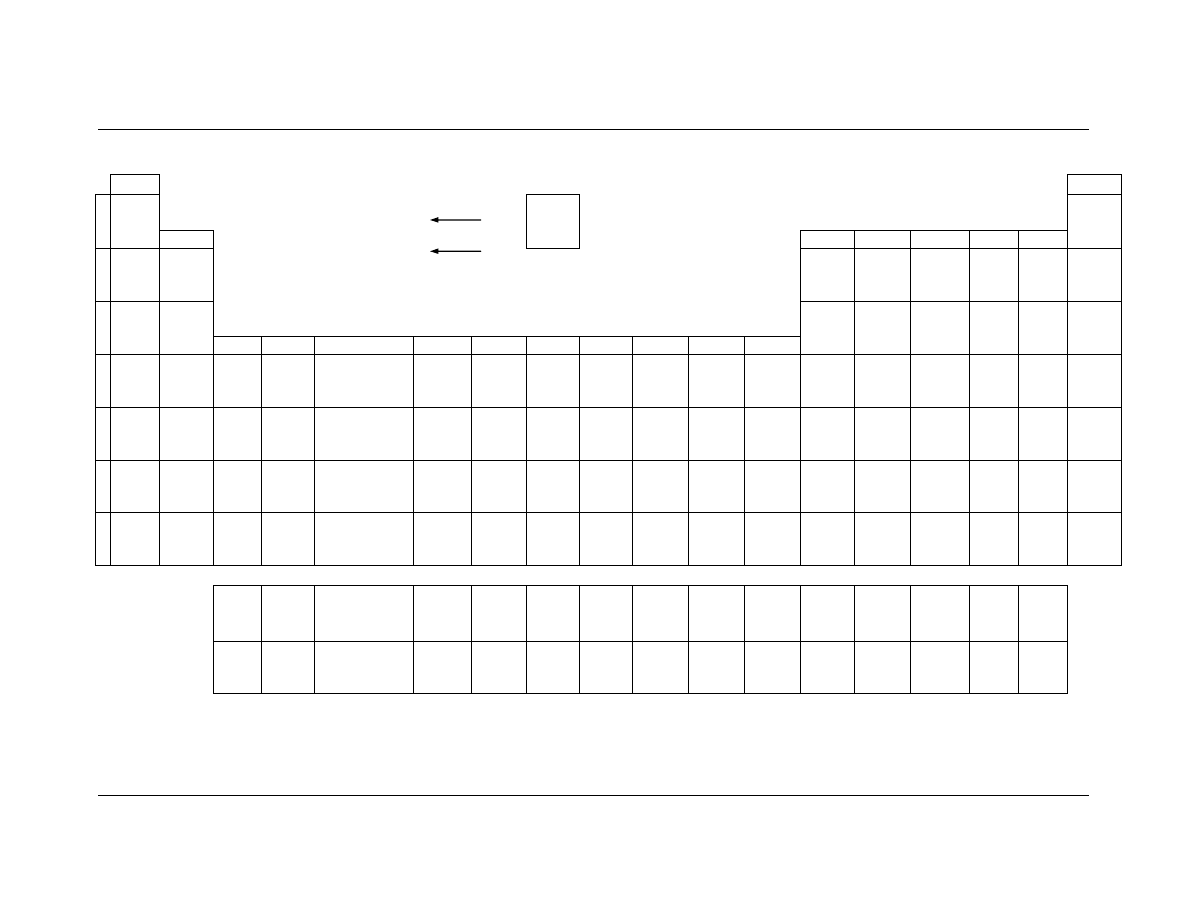
Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
U
K Ł A D O K R E S O W Y P I E R W I A S T K Ó W C H E M I C Z N Y C H
1
18
1
1
H
wodór
1,01
2
12
Mg
magnez
24,31
13
14
15
16
17
2
He
hel
4,0
2
3
Li
lit
6,94
4
Be
beryl
9,01
5
B
bor
10,81
6
C
w giel
12,01
7
N
azot
14,01
8
O
tlen
16,0
9
F
fluor
19,0
10
Ne
neon
20,18
3
11
Na
sód
22,99
12
Mg
magnez
24,31
3
4
5
6
7
8
9
10
11
12
13
Al
glin
26,98
14
Si
krzem
28,09
15
P
fosfor
30,97
16
S
siarka
32,06
17
Cl
chlor
35,45
18
Ar
argon
39,95
4
19
K
potas
39,10
20
Ca
wap
40,08
21
Sc
skand
44,96
22
Ti
tytan
47,88
23
V
wanad
50,94
24
Cr
chrom
51,99
25
Mn
mangan
54,94
26
Fe
elazo
55,85
27
Co
kobalt
58,93
28
Ni
nikiel
58,69
29
Cu
mied
63,55
30
Zn
cynk
65,38
31
Ga
gal
69,72
32
Ge
german
72,59
33
As
arsen
74,92
34
Se
selen
78,96
35
Br
brom
79,9
36
Kr
krypton
83,8
5
37
Rb
rubid
85,47
38
Sr
stront
87,62
39
Y
itr
88,91
40
Zr
cyrkon
91,22
41
Nb
niob
92,91
42
Mo
molibden
95,94
43
Tc
technet
96,90
44
Ru
ruten
101,07
45
Rh
rod
102,91
46
Pd
pallad
106,42
47
Ag
srebro
107,87
48
Cd
kadm
112,41
49
In
ind
114,82
50
Sn
cyna
118,69
51
Sb
antymon
121,75
52
Te
tellur
127,60
53
I
jod
126,91
54
Xe
ksenon
131,29
6
55
Cs
cez
132,91
56
Ba
bar
137,33
La-Lu
57-71
72
Hf
hafn
178,49
73
Ta
tantal
180,95
74
W
wolfram
183,85
75
Re
ren
186,21
76
Os
osm
190,2
77
Ir
iryd
192,2
78
Pt
platyna
195,08
79
Au
złoto
196,97
80
Hg
rt
200,59
81
Tl
tal
204,38
82
Pb
ołów
207,2
83
Bi
bizmut
208,98
84
Po
polon
208,98
85
At
astat
209,99
86
Rn
radon
222,02
7
87
Fr
frans
223,02
88
Ra
rad
226,03
Ac-Lr
89-103
104
Rf
rutherford
261,1
105
Db
dubn
262,11
106
Sg
seaborg
263,12
107
Bh
bohr
262,12
108
Hs
has
265,1
109
Mt
meitner
266,1
110
Uun
111
Uuu
112
Uub
114
Uuq
57
La
lantan
138,91
58
Ce
cer
140,12
59
Pr
prazeodym
140,91
60
Nd
neodym
144,24
61
Pm
promet
144,91
62
Sm
samar
150,36
63
Eu
europ
151,96
64
Gd
gadolin
157,25
65
Tb
terb
158,93
66
Dy
dysproz
162,5
67
Ho
holm
164,93
68
Er
erb
167,26
69
Tm
tul
168,93
70
Yb
iterb
173,04
71
Lu
lutet
174,97
89
Ac
aktyn
227,03
90
Th
tor
232,04
91
Pa
protaktyn
231,04
92
U
uran
238,03
93
Np
neptun
237,05
94
Pu
pluton
244,06
95
Am
ameryk
243,06
96
Cm
kiur
247,07
97
Bk
berkel
247,07
98
Cf
kaliforn
251,08
99
Es
einstein
252,08
100
Fm
ferm
257,09
101
Md
mendelew
258,1
102
No
nobel
259,1
103
Lr
lorens
260,1
liczba atomowa
masa atomowa [u]
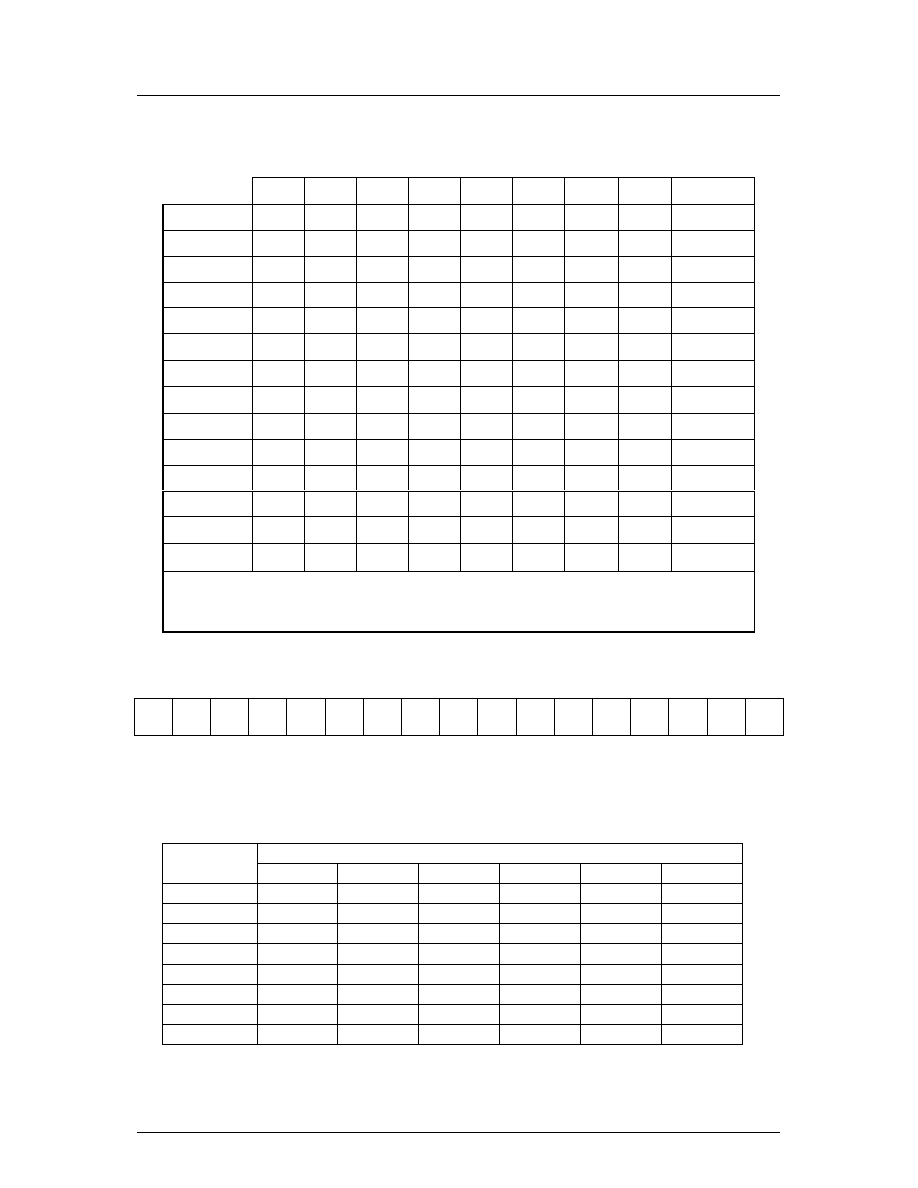
Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
T
A B E L A R O Z P U S Z C Z A L N O C I N I E K T Ó R Y C H S O L I
I W O D O R O T L E N K Ó W W W O D Z I E
I.
Szereg aktywno ci metali
K Na Li Ca Mg Al Mn Zn Fe Sn Pb
H
2
Cu Hg Ag Au Pt
R
O Z P U S Z C Z A L N O
N I E K T Ó R Y C H S U B S T A N C J I
W Z A L E N O C I O D T E M P E R A T U R Y
Rozpuszczalno [ g / 100 g H
2
O ]
Substancja
0
o
C
20
o
C
40
o
C
60
o
C
80
o
C
100
o
C
KNO
3
13,6
31,9
62,9
109,0
170,9
242,4
K
2
CO
3
158,5
167,3
181,4
202,7
230,9
268,6
K
2
SO
4
8,53
11,0
14,8
18,4
21,5
24,0
CuSO
4
24,0
35,5
53,2
81,8
131,2
139,5
NaCl
35,6
35,9
36,4
37,1
38,0
39,0
NH
4
Cl
29,4
37,1
45,8
55,3
65,7
77,0
CH
3
COONa
79
111
192
139
153
170
C
12
H
22
O
11
179
204
238
288
363
488
OH
-
Cl
-
NO
3
-
S
2-
SO
3
2-
SO
4
2-
CO
3
2-
PO
4
3-
CH
3
COO
-
Li
+
R
R
R
R
R
R
R
N
R
Na
+
R
R
R
R
R
R
R
R
R
K
+
R
R
R
R
R
R
R
R
R
NH
4
+
R
R
R
R
R
R
R
R
R
Ag
+
N
N
R
N
N
T
N
N
R
Mg
2+
N
R
R
−
N
R
N
N
R
Ca
2+
T
R
R
R
N
T
N
N
R
Cu
2+
N
R
R
N
−
R
N
N
R
Ba
2+
R
R
R
R
N
N
N
N
R
Zn
2+
N
R
R
N
N
R
N
N
R
Pb
2+
N
T
R
N
N
N
N
N
R
Fe
2+
N
R
R
N
N
R
N
N
R
Fe
3+
N
R
R
N
−
R
−
N
−
Al
3+
N
R
R
−
−
R
−
N
R
R – substancja rozpuszczalna; T – substancja trudno rozpuszczalna; N – substancja
praktycznie nierozpuszczalna;
− oznacza, e substancja nie została otrzymana lub
rozkłada si w wodzie
Wyszukiwarka
Podobne podstrony:
chemia test 2004
diagnostyka test 2006
test 2006 podstawy, Biologia - testy liceum
chemia listopad 2006
chemia klucz 2006
''Natura i zastosowanie związków ciekłokrystalicznych'' (''Chemia w szkole'' 5 2006 r )
Chemia dr inz. Krystyna Kelar [ polimery itp] [ test], chemiaTest, TEST 1
pediatria test 2006, a)
Diagna test 2006, diagnostyka
''Kawa czy herbata'' (''Chemia w Szkole'' 4 2006 r )
Biochemia, test 2006, termin I B
Makroekonomia+test+A+2006
Prawo pracy test 2006, Różne Dokumenty, MARKETING EKONOMIA ZARZĄDZANIE
test 2006 lekarski, Mikrobiologia, Mikrobiologia, Rozpiska, Nowy folder (3), zrobione testy
chemia test bialy sciaga, energetyka, 1 rok
geografia test 2006
więcej podobnych podstron