
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
i NAUKI
Małgorzata Jagodzińska
Badanie wody 311[24].Z1.02
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2005

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Małgorzata Łukaszewska
mgr inż. Marzena Baranowska
Opracowanie redakcyjne:
mgr inż. Katarzyna Maćkowska
Konsultacja:
dr hab. Barbara Baraniak
Korekta:
mgr inż. Teresa Sagan
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311[24].Z1.02
Badanie wody zawartego w programie nauczania dla zawodu technik ochrony środowiska.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2005

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
4
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Materiał nauczania
7
4.1. Klasyfikacja wód naturalnych
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające 9
4.1.3. Ćwiczenia 9
4.1.4. Sprawdzian postępów 9
4.2. Podstawowe pojęcia geologiczne, hydrogeologiczne i hydrologiczne
10
4.2.1. Materiał nauczania
10
4.2.2. Pytania sprawdzające 11
4.2.3. Ćwiczenia 11
4.2.4. Sprawdzian postępów 12
4.3. Charakterystyka wód powierzchniowych i podziemnych
13
4.3.1. Materiał nauczania
13
4.3.2. Pytania sprawdzające 15
4.3.3. Ćwiczenia 15
4.3.4. Sprawdzian postępów 16
4.4. Ruch wody powierzchniowej i podziemnej
17
4.4.1. Materiał nauczania
17
4.4.2. Pytania sprawdzające 17
4.4.3. Ćwiczenia 17
4.4.4. Sprawdzian postępów 18
4.5. Metody pomiarów hydrometrycznych wody
19
4.5.1. Materiał nauczania
19
4.5.2. Pytania sprawdzające 23
4.5.3. Ćwiczenia 23
4.5.4. Sprawdzian postępów 25
4.6. Stany i przepływy wody
26
4.6.1. Materiał nauczania
26
4.6.2. Pytania sprawdzające 28
4.6.3. Ćwiczenia 28
4.6.4. Sprawdzian postępów 29
4.7. Cel i zakres badania wód
30
4.7.1. Materiał nauczania
30
4.7.2. Pytania sprawdzające 31
4.7.3. Ćwiczenia 31
4.7.4. Sprawdzian postępów 32
4.8. Metody pobierania próbek wody do badania
33
4.8.1. Materiał nauczania
33
4.8.2. Pytania sprawdzające 41
4.8.3. Ćwiczenia 41
4.8.4. Sprawdzian postępów 42

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
4.9. Analizy fizykochemiczne wody powierzchniowej i podziemnej
43
4.9.1. Materiał nauczania
43
4.9.2. Pytania sprawdzające 45
4.9.3. Ćwiczenia 45
4.9.4. Sprawdzian postępów 47
4.10. Wskaźniki biologiczne i mikrobiologiczne wody
48
4.10.1. Materiał nauczania
48
4.10.2. Pytania sprawdzające 51
4.10.3. Ćwiczenia 51
4.10.4. Sprawdzian postępów 52
4.11. Źródła i rodzaje zanieczyszczeń wody
53
4.11.1. Materiał nauczania
53
4.11.2. Pytania sprawdzające 55
4.11.3. Ćwiczenia 55
4.11.4. Sprawdzian postępów 56
4.12. Ścieki – ich rodzaje i skład
57
4.12.1. Materiał nauczania
57
4.12.2. Pytania sprawdzające 59
4.12.3. Ćwiczenia 59
4.12.4. Sprawdzian postępów 60
4.13. Badanie ścieków
61
4.13.1. Materiał nauczania
64
4.13.2. Pytania sprawdzające 64
4.13.3. Ćwiczenia 65
4.13.4. Sprawdzian postępów 66
4.14. Metody opracowywania wyników badań
66
4.14.1. Materiał nauczania
66
4.14.2. Pytania sprawdzające 66
4.14.3. Ćwiczenia 67
4.14.4. Sprawdzian postępów 67
4.15. Przepisy bezpieczeństwa i higieny pracy obowiązujące w laboratorium
i w terenie podczas prowadzenia pomiarów i badania wody
68
4.15.1. Materiał nauczania
68
4.15.2. Pytania sprawdzające 69
4.15.3. Ćwiczenia 70
4.15.4. Sprawdzian postępów 70
5. Sprawdzian osiągnięć
71
6. Literatura
74

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
1. WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu wiedzy o badaniu wody: procedurach,
sposobach pobierania próbek i interpretowaniu wyników.
Poradnik ten zawiera:
1. Wymagania wstępne, czyli wykaz niezbędnych umiejętności i wiedzy, które powinieneś
mieć opanowane, aby przystąpić do realizacji tej jednostki modułowej.
2. Cele kształcenia tej jednostki modułowej.
3. Materiał nauczania umożliwiający samodzielne przygotowanie się do wykonania ćwiczeń
i zaliczenia sprawdzianów. Wykorzystaj wskazaną literaturę oraz inne źródła informacji
do poszerzenia wiedzy. Każdy rozdział obejmuje również ćwiczenia, które zawierają:
− wykaz materiałów, narzędzi i sprzętu potrzebnych do realizacji ćwiczenia,
− pytania sprawdzające wiedzę potrzebną do wykonania ćwiczenia,
− sprawdzian teoretyczny,
− sprawdzian umiejętności praktycznych.
Zakres treści kształcenia przedstawiony w materiale nauczania jest bardzo szeroki
i obejmuje:
klasyfikację wód naturalnych; podstawowe pojęcia geologiczne, hydrogeologiczne
i hydrologiczne; charakterystykę wód powierzchniowych i podziemnych; ruch wody; metody
pomiarów hydrometrycznych; stany i przepływy wody; cel i zakres badania wód; metody
pobierania próbek do badań; analizy fizyczne i chemiczne wody; biowskaźniki, źródła
i rodzaje zanieczyszczeń; ścieki i ich rodzaje; badanie ścieków; metody opracowywania
wyników; przepisy bezpieczeństwa i higieny pracy.
Przy wyborze odpowiednich treści niewątpliwie pomocny będzie nauczyciel, który wskaże
Ci metody uczenia się, ułatwi zrozumienie instrukcji wykonywanych ćwiczeń oraz sprawdzi
poprawność ich wykonania. Część odczynników ze względu na złożoność ich produkcji
przygotuje nauczyciel, a część pod jego kontrolą i opieką przygotujesz samodzielnie.
Wykonując ćwiczenia przedstawione w poradniku lub zaproponowane przez nauczyciela,
będziesz poznawał cele, zakres i metody badania wód oraz zmiany zachodzące w środowisku
wodnym.
Po wykonaniu zaplanowanych ćwiczeń, sprawdź poziom swoich postępów wykonując test
Sprawdzian postępów, zamieszczony zawsze po podrozdziale „ćwiczenia”. W tym celu:
– przeczytaj pytania i odpowiedz na nie,
− wpisz TAK jeśli Twoja odpowiedź na pytanie jest prawidłowa,
− wpisz NIE jeśli Twoja odpowiedź na pytanie jest niepoprawna.
Odpowiedzi NIE wskazują luki w Twojej wiedzy, informują Cię również jakich
elementów badania wody jeszcze dobrze nie poznałeś. Oznacza to także konieczność powrotu
do treści, które nie są dostatecznie opanowane.
Po zapoznaniu się z jednostką modułową Badanie wody, nauczyciel przeprowadzi test, by
sprawdzić stan Twojej wiedzy, która będzie Ci potrzebna do wykonywania ćwiczeń i nauki
następnych jednostkach modułowych.
Bezpieczeństwo i higiena pracy
W czasie pobytu w pracowni musisz przestrzegać regulaminów, przepisów
bezpieczeństwa i higieny pracy oraz instrukcji przeciwpożarowych, wynikających z rodzaju
wykonywanych prac. Przepisy te poznasz podczas trwania nauki.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
− poszukiwać informacji w różnych źródłach,
− selekcjonować, porządkować i przechowywać informacje,
− dokumentować, notować i selekcjonować informacje,
− przeprowadzać nieskomplikowane rozumowania matematyczne i fizyczne,
− przeliczać jednostki matematyczne i fizyczne,
− interpretować wykresy,
− posługiwać się rocznikiem statystycznym, komputerem podczas wyszukiwania danych
i przeprowadzania ćwiczeń,
− interpretować związki wyrażone za pomocą wzorów, wykresów, schematów, diagramów,
tabel,
− dostrzegać i opisywać związki między naturalnymi składnikami środowiska, człowiekiem
i jego działalnością,
− oceniać własne możliwości sprostania wymaganiom stanowiska pracy i wybranego
zawodu,
− posługiwać się podstawowymi pojęciami z zakresu ochrony środowiska, a także
bezpieczeństwa i higieny pracy,
− oceniać zagrożenia wody.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
− sklasyfikować rodzaje wód naturalnych,
− posłużyć się pojęciami z zakresu geologii, hydrogeologii, hydrologii,
− zastosować podstawowe prawa mechaniki płynów,
− określić źródła zanieczyszczeń wody,
− dobrać metody badania wody,
− określić zakres i częstotliwość pomiarów,
− zorganizować stanowisko pracy zgodnie z wymaganiami ergonomii, zasadami bhp,
ochrony przeciwpożarowej, ochrony środowiska,
− oznaczyć parametry hydrometryczne cieku wodnego,
− dobrać techniki i metody pobierania prób wody,
− pobrać i przygotować próbki wody do badania,
− obsłużyć aparaturę pomiarową do badania wody,
− wykonać analizy fizykochemiczne wody,
− określić biologiczne wskaźniki jakości wody,
− oznaczyć parametry określające stopień zanieczyszczenia wody,
− ocenić skład wód naturalnych w odniesieniu do obowiązujących wymagań,
− określić skutki zanieczyszczenia wód powierzchniowych i podziemnych,
− sklasyfikować ścieki,
− zbadać ścieki pod względem ilościowym i jakościowym,
− zastosować techniki komputerowe do opracowywania wyników badań,
− zastosować przepisy bezpieczeństwa i higieny pracy oraz ochrony przeciwpożarowej
podczas wykorzystania badań laboratoryjnych i terenowych.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1. Klasyfikacja wód naturalnych
4.1.1. Materiał nauczania
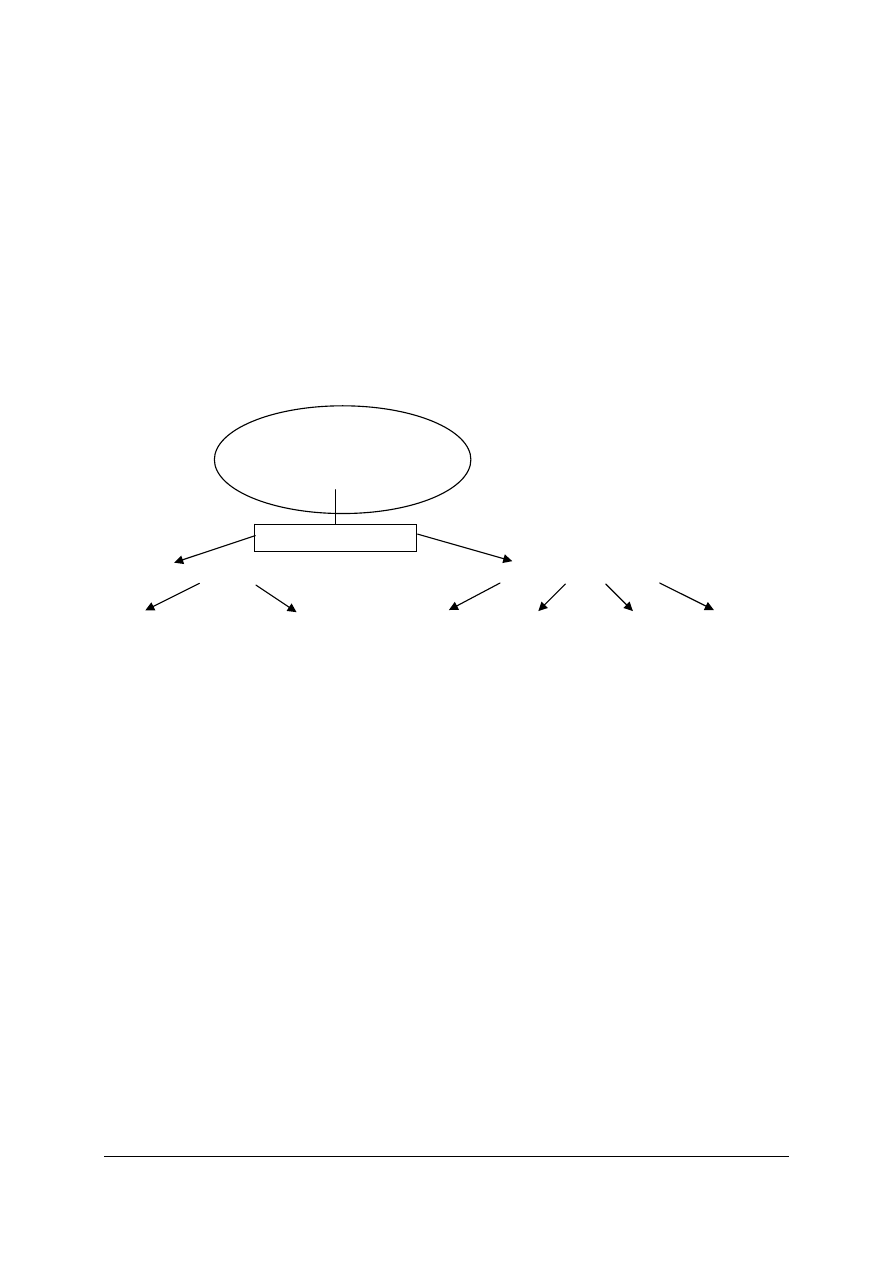
Opad atmosferyczny, odpływ, parowanie i retencja to podstawowe procesy
hydrologiczne.
Opad atmosferyczny występuje zarówno w postaci ciekłej jak i stałej.
Odpływ wody kształtuje się zarówno na powierzchni ziemi jak i w środowisku
podziemnym.
⇒ ŚNIEG
⇒ DESZCZ
⇒ ROSA
⇒ SZADŹ
⇒ SZRON
⇒ GRAD
WODY POWIERZCHNIOWE
WODY PODZIEMNE
stojące
płynące zaskórne gruntowe wgłębne głębinowe
- jeziora
- rzeki
- stawy
- potoki
- rowy
Rys. 1. Klasyfikacja wód
Źródło: opracowano na podstawie: Chełmicki W.: Woda. Zasoby, degradacja, ochrona. Wydawnictwo Naukowe
PWN, Warszawa 2002.
Opad – to depozycja wody atmosferycznej na powierzchni terenu w formie stałej lub ciekłej.
Jest to proces dynamiczny, odznacza się zmiennością czasową i przestrzennym
zróżnicowaniem.
Opady atmosferyczne są kształtowane przez następujące czynniki (Chełmicki, 2002):
a) naturalne
− stałe (położenie geograficzne, wzniesienie nad poziomem morza, odległość od mórz
i oceanów, warunki orograficzne).
− zmienne (sytuacja baryczna, przebieg frontów atmosferycznych)
b) antropogeniczne (np. zmiany użytkowania terenu).
Woda opadowa po osiągnięciu powierzchni terenu gromadzi się na niej, spływa i wsiąka.
Rozdział wody opadowej na powierzchni terenu ma zasadnicze znaczenie dla kształtowania
się zasobów wodnych obszaru. Od tego jaka część wody spłynie a jaka wsiąknie w grunt
(infiltruje) zależy zasobność obszaru w wodę.
Zgodnie z Rozporządzeniem Ministra Środowiska z dnia 11 lutego 2004 r. w sprawie
klasyfikacji dla prezentowania stanu wód powierzchniowych i podziemnych, sposobu
prowadzenia monitoringu oraz sposobu interpretacji wyników i prezentacji stanu tych wód
(Dz. U. Nr 32, poz. 284, wprowadzono klasyfikację obejmującą pięć klas jakości tych wód,
OPADY
ATMOSFERYCZNE
ODPŁYW

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
z uwzględnieniem kategorii jakości wody A1, A2 i A3, określonych w przepisach w sprawie
wymagań, jakim powinny odpowiadać wody powierzchniowe wykorzystywane do
zaopatrzenia ludności w wodę przeznaczoną do spożycia:
1) klasa I – wody o bardzo dobrej jakości:
a) spełniają wymagania określone dla wód powierzchniowych wykorzystywanych do
zaopatrzenia ludności w wodę przeznaczoną do spożycia, w przypadku ich uzdatniania
sposobem właściwym dla kategorii A1,
b) wartości wskaźników jakości wody nie wskazują na żadne oddziaływania
antropogeniczne;
2) klasa II – wody dobrej jakości:
a) spełniają w odniesieniu do większości wskaźników jakości wody wymagania określone
dla wód powierzchniowych wykorzystywanych do zaopatrzenia ludności w wodę
przeznaczoną do spożycia, w przypadku ich uzdatniania sposobem właściwym dla
kategorii A2,
b) wartości biologicznych wskaźników jakości wody wykazują niewielki wpływ
oddziaływań antropogenicznych;
3) klasa III – wody zadowalającej jakości:
a) spełniają wymagania określone dla wód powierzchniowych wykorzystywanych do
zaopatrzenia ludności w wodę przeznaczoną do spożycia, w przypadku ich uzdatniania
sposobem właściwym dla kategorii A2,
b) wartości biologicznych wskaźników jakości wody wykazują umiarkowany wpływ
oddziaływań antropogenicznych;
4) klasa IV – wody niezadowalającej jakości:
a) spełniają wymagania określone dla wód powierzchniowych wykorzystywanych do
zaopatrzenia ludności w wodę przeznaczoną do spożycia, w przypadku ich uzdatniania
sposobem właściwym dla kategorii A3,
b) wartości biologicznych wskaźników jakości wody wykazują, na skutek oddziaływań
antropogenicznych, zmiany ilościowe i jakościowe w populacjach biologicznych;
5) klasa V – wody złej jakości:
a) nie spełniają wymagań dla wód powierzchniowych wykorzystywanych do zaopatrzenia
ludności w wodę przeznaczoną do spożycia,
b) wartości biologicznych wskaźników jakości wody wykazują, na skutek oddziaływań
antropogenicznych, zmiany polegające na zaniku występowania znacznej części
populacji biologicznych.
W przypadku wód podziemnych wprowadzono klasyfikację jakości wód nieco różniącą
się od klasyfikacji jakości wód powierzchniowych. Główna różnica polega na podziale klasy
pierwszej wód na dwie podklasy: wody najwyższej jakości i wody wysokiej jakości.
Pozostałe dwie klasy wód odpowiadają pod względem wskaźników wodom średniej i niskiej
jakości.
Przy klasyfikowaniu tych wód dopuszcza się przekroczenie wartości granicznych trzech
wskaźników (na podanych 59), nie dyskwalifikujące badanej wody do niższej klasy.
Niedopuszczalne jest przekroczenie wartości granicznych o charakterze toksycznym:
antymonu, arsenu, azotanów, azotynów, cyjanków, fluoru, fenoli, chromu, glinu, kadmu,
miedzi, niklu, ołowiu, pestycydów, rtęci, selenu, siarkowodoru i srebra.
Stan czystości zwykłych wód podziemnych na terenie kraju jest rozpoznawany od 1992 r,
ze względu na dopiero zorganizowany monitoring. Z danych dotyczących 1996 r, wynika, że
ok. 56% tych wód można zaliczyć do najwyższej i wysokiej jakości. Do tej klasy zalicza się
wody spełniające wymagania dla wody do picia pod względem chemicznym i fizycznym.
Istnieje jednak duże zagrożenie zanieczyszczeniem zwykłych wód podziemnych.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczenia.
1) Co to jest opad?
2) Jakie są jego rodzaje?
3) Co to jest odpływ?
4) Jak można sklasyfikować wody?
5) Jakie są klasy czystości wód?
6) Czym się różni klasyfikacja wód powierzchniowych od klasyfikacji wód podziemnych?
4.1.3. Ćwiczenia
Ćwiczenie 1
Dokonaj oceny klas czystości wód na podstawie materiałów źródłowych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wskazać na podstawie danych z rocznika statystycznego „Ochrona środowiska” rzeki
Polski o najwyższej i najniższej klasie czystości,
2) przeanalizować dane dotyczące charakteru środowiska w danych odcinkach oznaczonych
rzek,
3) wskazać przyczyny danego stanu.
Wyposażenie stanowiska pracy
− rocznik statystyczny „Ochrona środowiska”,
− komputer z dostępem do Internetu,
− notes,
− ołówek.
4.1.4. Sprawdzian postępów
Czy potrafisz:
TAK NIE
1) zdefiniować pojęcie
opad?
2) scharakteryzować wody powierzchniowe?
3) scharakteryzować wody podziemne?
4) wymienić klasy czystości wód podziemnych?
5) wymienić klasy czystości wód powierzchniowych?
6) wymienić rodzaje opadów atmosferycznych?
7) scharakteryzować klasy czystości wód powierzchniowych?
8) określić źródło pochodzenia wody, którą spożywa?
9) ocenić organoleptycznie spożywaną wodę?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
4.2. Podstawowe pojęcia geologiczne, hydrogeologiczne
i hydrologiczne
4.2.1. Materiał nauczania
Hydrogeologia wchodzi w zakres nauk geologicznych (z gr. hydor – woda, ge – Ziemia,
logos – nauka).
Podobnie jak inne nauki geologiczne, obejmuje wiele zagadnień teoretycznych (genezę
czyli pochodzenie wód podziemnych, rozprzestrzenienie i warunki występowania wód
podziemnych, właściwości fizyczne i chemiczne oraz zmiany, jakie w nich zachodzą), jak
i ściśle związanych z gospodarką.
Ważnym zadaniem hydrogeologii jest ustalenie zasobów wodnych występujących na
określonych obszarach.
Wody podziemne występują zawsze w określonych utworach skalnych. Między tymi
utworami a wodą w nich zawartą istnieje ścisła wzajemna zależność.
Wody podziemne oddziałują na skały: mają zdolność rozpuszczania niektórych
minerałów, powodują różne procesy chemiczne, wpływają na właściwości fizyczne skał,
wywierają ciśnienie dynamiczne oraz wpływają na inne zjawiska. Dlatego też badania wód
podziemnych muszą być oparte na dobrej znajomości budowy geologicznej danego regionu.
Człowiek żyje na pograniczu trzech sfer:
− atmosfery (z gr. atmos – para, sphaira – kula) – powłoka gazowa Ziemi złożona
z mieszaniny gazów (powietrza)
− litosfery (z gr. lithos – kamień, skała) – stała, skalna powłoka zwana także skorupą
ziemską
− hydrosfery – powłoka wodna Ziemi zajmująca przeważającą powierzchnię globu
ziemskiego.
Hydrogeologowie zajmują się głównie litosferą, gdyż to właśnie w obrębie niej zachodzą
zjawiska będące przedmiotem ich pracy.
Litosfera (skorupa ziemska) jest też z tego powodu przedmiotem badań nauk
geologicznych.
Skład chemiczny skorupy ziemskiej określony do głębokości 16 km wykazuje, że tlen
stanowi 47-50% jej masy, krzem 26-29,5%, glin 7,5% - 8%, żelazo 4,2-5%. Udział innych
znaczących pierwiastków jest nieznaczny. Wodór, tytan, węgiel, chlor, fosfor, mangan,
siarka, bar, fluor stront stanowią łącznie tylko 1,5% litosfery, a pierwiastki promieniotwórcze
należą do śladowych.
Bardzo niewiele pierwiastków występuje samodzielnie (bez udziału związków
chemicznych w skład których mogłyby wchodzić).
Z uwagi na fakt, ze tlen stanowi najwyższy procent wśród pierwiastków budujących
litosferę, w jej budowie można wyróżnić liczne połączenia tlenowe: SiO
2
(60% składu
zewnętrznej strefy Ziemi), Al
2
O
3
– ok. 15%, FeO+Fe
2
O
3
– ok. 7%, CaO – ok. 5% i dalsze
Na
2
O, H
2
O, TiO
2
.
W
gorących wodach znajdujących się w głębi skorupy ziemskiej są rozpuszczone,
nieraz w znacznej ilości, składniki mineralne, które krystalizują w spękaniach i próżniach
skalnych. W ten sposób powstają niekiedy złoża surowców mineralnych, np. niektóre rudy.
Minerały mogą się także tworzyć z roztworów ziemnych, np. sól ze strącenia z wód
morskich i jeziornych lub kalcyt, który krystalizuje w postaci nacieków, stalaktytów
i stalagmitów w grotach i jaskiniach.
Minerały, gdy tylko zmieniają się warunki fizyczno-chemiczne, ulegają przemianom.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Niektóre z nich występują zawsze w określonym zespole. Zespołami naturalnymi są
przede wszystkim skały. Ze względu na genezę i skład dzielimy je na trzy typy: magmowe,
osadowe, przeobrażone.
Skały magmowe: powstają z zakrzepnięcia pierwotnej magmy podczas tworzenia się
skorupy ziemskiej. Mogą być wylewne (bazalt) lub głębinowe (granit).
Skały osadowe: powstały w wyniku nagromadzenia materiału pochodzącego
z rozkruszania skał poprzednio istniejących (piaski, piaskowce, żwiry i zlepieńce) lub
częściowo z rozpuszczenia ich składników i ponownego wytrącania (sól, gips), a także ze
szczątków organizmów zwierzęcych i roślinnych (wapień, węgiel).
Skały przeobrażone: utwory pochodzenia magmowego lub osadowego, które pod
wpływem temperatury, wysokiego ciśnienia oraz procesów chemicznych uległy przemianom.
(gnejsy, łupki mikowe, marmury).
Hydrologia – nauka zajmująca się krążeniem wody w przyrodzie. Przedmiotem badań są
wody powierzchniowe płynące (rzeki, strumyki, potoki) i stojące (oceany, morza, jeziora),
wody podziemne (gruntowe) oraz zjawiska zachodzące w wodzie częściowo zatrzymanej
czasowo w postaci stałej (śniegu lub lodu), w pokrywie śnieżnej, lodowcach lub w pokrywie
wód powierzchniowych. W hydrologii wyróżnia się następujące działy:
• potamologia – hydrologia powierzchniowych wód płynących
• oceanologia – hydrologia oceanów i mórz
• limnologia –
hydrologia
jezior
środowisko
• glacjologia – hydrologia lodowców
• hydrogeologia – hydrologia wód podziemnych
• hydrometria – dział zajmujący się techniką i metodami
pomiarowymi
• hydrografia – dział obejmujący opis i obserwację zjawisk
oraz zestawienie obserwacji hydrologicznych
• hydronomia – dział zajmujący się wyciąganiem wniosków
czynności
z przeprowadzonych obserwacji oraz ustalaniem zależności
między poszczególnymi zjawiskami.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczenia.
1) Jakie są podstawowe działy hydrologii?
2) Z jakich pierwiastków zbudowana jest litosfera?
3) Czym zajmuje się hydrometria?
4) Jakie możesz wymienić jej przykłady?
5) Jaka jest definicja poszczególnych działów hydrologii?
4.2.3. Ćwiczenia
Ćwiczenie1
Skonstruuj schemat budowy wnętrza Ziemi.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wyszukać informacje zawarte w podręczniku oraz w innych dostępnych źródłach,
2) zaproponować schemat budowy wnętrza Ziemi na podstawie zebranych materiałów,
3) uwzględnić wszystkie sfery.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Wyposażenie stanowiska pracy:
− podręcznik,
− komputer z dostępem do Internetu,
− notatki
− notes, ołówek.
4.2.4. Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) zdefiniować pojęcia: hydrologia, skały magmowe,
osadowe i przeobrażone?
2) rozróżnić pojęcia hydrometria, hydronomia, hydrografia?
3) wymienić przykłady skał magmowych?
4) wymienić przykłady skał
osadowych?
5) wymienić przykłady skał przeobrażonych?
6) wymienić składniki geologicznej budowy Ziemi?
7) scharakteryzować atmosferę?
8) scharakteryzować litosferę?
9) scharakteryzować hydrosferę?
10) omówić zadania hydrologii?
11) omówić zadania hydrometrii?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
4.3. Charakterystyka wód powierzchniowych i podziemnych
4.3.1. Materiał nauczania
Wody powierzchniowe zawierają zarówno rozpuszczone związki mineralne jak i związki
organiczne pochodzenia naturalnego i sztucznego, a także produkty biologicznego ich
rozkładu. Odrębną grupę zanieczyszczeń stanowią zanieczyszczenia pochodzenia
przemysłowego trudno rozkładalne na drodze biochemicznej.
W okresach wysokich stanów wód powierzchniowych można zaobserwować liczne
zawiesiny, a w czasie stanów niskich duże ilości substancji koloidalnej (głównie związki
humusowe).
Wody powierzchniowe charakteryzują się dość wysokimi wartościami poszczególnych
wskaźników zanieczyszczeń, a mianowicie: sucha pozostałość może wynosić od
kilkudziesięciu do ponad tysiąca mg/dm
3
, zawartość zawiesin – od kilkunastu do kilkuset
i więcej mg/dm
3
, barwa – od kilkunastu do ponad stu mg Pt/dm
3
, twardość – rzędu kilku
mval/dm
3
, zawartość soli (głównie siarczanów i chlorków) – od kilkudziesięciu do kilkuset
mg/dm
3
.
Temperatura wód powierzchniowych zmienia się w ciągu roku od blisko zera do
kilkunastu
0
C w rzekach górskich i dwudziestu kilku
0
C w rzekach nizinnych.
Temperatura w niskich partiach jezior jest ustabilizowana na poziomie ok. 4
0
C.
Zawartość bakterii przy hodowli ich na agarze lub żelatynie może dochodzić do dziesiątek
tysięcy w 1 cm
3
wody. Wyjątkowo niskie są zazwyczaj wartości miana coli, a mianowicie od
tysięcznych części cm
3
do kilku cm
3
(pod tym względem znacznie korzystniejsze są wody
rzek górskich i czystych jezior).
Czynniki kształtujące skład wód powierzchniowych
− budowa geologiczna zlewni i wielkość kompleksu sorpcyjnego gleb,
− topografia zlewni,
− procesy wietrzenia i rozpuszczania materiałów budujących zlewnię,
− procesy fizyczne (sedymentacja, sorpcja) i chemiczne (hydroliza, reakcje redox,
strącania) zachodzące w środowisku wodnym,
− prędkość i natężenie przepływu wody,
− stopień mieszania się wód o różnym składzie,
− rodzaj organizmów wodnych i aktywność przemian biologicznych,
− warunki atmosferyczne (temperatura, wysokość opadów),
− sposób użytkowania wód,
− głębokość zbiorników wód i ich lokalizacja w stosunku do źródeł emisji zanieczyszczeń,
− sposób i stopień zagospodarowania zlewni.
Skład chemiczny wód powierzchniowych
Stężenie substancji rozpuszczonych w wodzie, zw. ogólną mineralizacją, wyraża się
najczęściej w jednostkach masy substancji na jednostkę objętości roztworu (np. mg/dm
3
).
Mineralizacja wody jest ważnym wskaźnikiem jej pochodzenia, warunkuje występowanie
w wodzie określonych organizmów, ma wpływ na rozpuszczalność tlenu, dzięki czemu może
asymilować zanieczyszczenia.
zasolenie – stężenie wyrażone w jednostkach masy substancji na jednostkę objętości roztworu
wody ultrasłodkie – o mineralizacji mniejszej niż 0,1g/dm
3
,
wody słodkie – od 0,1 – 0,5 g/dm
3
,
wody o podwyższonej mineralizacji (akratopegi) 0,5 – 1,0 g/dm
3
,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
wody mineralne – powyżej 1g/dm
3
,
solanki - wody silnie mineralizowane – powyżej 35 g/dm
3
,
Podstawowe składniki wód powierzchniowych to kationy: Ca
2+
, Na
+
, Mg
2+
i aniony: HCO
3
-
,
SO
4
2-
, Cl
-
oraz krzemionka.
Odczyn wód powierzchniowych od 6,5 – 8.5 pH.
Przewodność elektrolityczna – jest miarą zawartości jonów w wodzie, a jej pomiar może
służyć do przybliżonego określenia siły jonowej zasolenia, suchej pozostałości i zawartości
substancji rozpuszczonych.
Twardość wody – jest miarą zawartości jonów wapnia i magnezu (kationów podstawowych).
Poza wymienionymi powodują ją również jony żelaza, glinu, manganu i kationy metali
ciężkich.
Twardość ogólną można wyliczyć według wzoru:
X =
V
a
1000
01
,
0
⋅
⋅
,
gdzie a – objętość wersenianu zużyta do miareczkowania
0,01 – liczba milimoli wapnia odpowiadająca 1 cm
3
wersenianu
V – objętość próbki (50 cm
3
) w cm
3
Wody podziemne
charakteryzują się zazwyczaj ustabilizowanym składem chemicznym
i w miarę stałą temperaturą. Skład tych wód zależy od rodzaju skał, z którymi się kontaktują,
stopnia ich zwietrzenia, uziarnienia, prędkości ruchu wody podziemnej oraz stopnia kontaktu
z wodami powierzchniowymi i opadowymi. Wody podziemne są pozbawione zawiesin, mają
małą mętność i dużą przeźroczystość a barwa ich może być bardzo słaba lub silna.
Zanieczyszczenia wód podziemnych stanowią:
− związki żelaza,
− związki manganu,
− niekiedy znaczne ilości rozpuszczonego CO2 przekraczając twardością dopuszczalne
normy.
Wody podziemne posiadają małą zawartość bakterii (od kilku do kilkudziesięciu kolonii na
agarze i na żelatynie w 1 cm
3
) i wysokim mianem coli (od kilkudziesięciu do ponad 100 cm
3
).
Czynniki kształtujące skład wód podziemnych można podzielić na:
hydrogeochemiczne,
fizyczne i biologiczne. Najważniejsze to:
− utlenianie i redukcja,
− rozpuszczanie (ługowanie) i strącanie,
− hydratacja i hydroliza,
− wietrzenie,
− sorpcja, desorpcja, wymiana jonowa i procesy membranowe,
− migracja (dyspersja),
− procesy biochemiczne.
Rodzaje wód podziemnych:
Wody przypowierzchniowe – hipodermiczne
Występują na małych głębokościach a ich zwierciadło jest tuż pod powierzchnią terenu
(ok. kilkudziesięciu cm) i praktycznie pozbawione strefy aeracji. Są silnie zanieczyszczone,
reagują na zmiany pogodowe, tworzą lokalnie zanieczyszczenia. Nie nadają się do spożycia
i potrzeb komunalnych.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
Wody wgłębne
Występują w warstwach wodonośnych pokrytych skalami trudno przepuszczalnymi. Są
zasilane:
− drogą infiltracji wód opadowych (opadów atmosferycznych) w wychodniach warstw
wodonośnych bądź bezpośrednio przez szczeliny uskokowe lub tzw. okna
hydrogeologiczne (przerwy w utworach nieprzepuszczalnych)
− lub wodami z innych poziomów wodonośnych przesączającymi się przez utwory o niskiej
przepuszczalności.
Zwierciadło tych wód jest napięte – tzw. wody naporowe pod ciśnieniem. Jeżeli wznios
zwierciadła sięga powierzchni terenu – są to wody artezyjskie, jeżeli jej nie osiąga – są to
wody subartezyjskie. Wody pod ciśnieniem biorą udział w krążeniu wód oraz stanowią
właściwe źródło wody zaopatrującej mieszkańców danego terenu.
Wody gruntowe – freatyczne
Są bezpośrednio zasilane przez wody opadowe i powierzchniowe, oddzielone od
powierzchni terenu miąższową strefą aeracji. Głębokość ich występowania jest różna.
W obniżeniach terenu występują zazwyczaj płytko, miejscami mogą wypływać na
powierzchnię w postaci źródeł i wycieków tworząc obszary zabagnione; na obszarach
położonych wyżej ich zwierciadło występuje na znacznych głębokościach (ok. 6-10m). Skład
tych wód wskutek dokonujących się procesów samooczyszczania pozwala na spełnienie
wymagań sanitarnych stawianych wodzie pitnej.
Wody głębinowe
Występują głęboko pod powierzchnią Ziemi i są odizolowane od niej kompleksem
utworów nieprzepuszczalnych. Nie biorą udziału w krążeniu wód, są nieodnawialne, znajdują
się w bezruchu, często są to tzw. cieplice.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczenia.
1) Jakie można rozróżnić rodzaje wód podziemnych?
2) Od czego zależy skład wód podziemnych?
3) Jakie są czynniki kształtujące skład wód powierzchniowych?
4) Na czym polega przewodność elektrolityczna?
5) Co to jest twardość wody?
6) Które z wód naturalnych mają z reguły wysokie wskaźniki zanieczyszczeń?
7) Jakie czynniki mają zasadniczy wpływ na skład wód podziemnych?
4.3.3
.
Ćwiczenia
Ćwiczenie 1
Określ cechy fizyczne próbki wody z rzeki, jeziora i studni.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) nalać do dwóch przeźroczystych naczyń lub kolb stożkowych próbki wody z rzeki lub
jeziora (I), ze studni kopanej (II),
2) przyjrzeć się im uważnie,
3) zaobserwować różnice.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Wyposażenie stanowiska pracy:
− 2 przeźroczyste naczynia lub kolby stożkowe,
− próbki wody z jeziora, rzeki, studni,
− lupa,
− notes i ołówek.
Ćwiczenie 2
Oznacz twardość wody w próbce z rzeki lub jeziora.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) odmierzyć 50 cm
3
badanej klarownej wody i nalać do kolby stożkowej o pojemności
300cm
3
,
2) dodać 1 cm
3
roztworu buforowego (1) i około 0,1 g czerni eriochromowej (3),
3) natychmiast miareczkować roztworem wersenianu dwusodowego (2) do zmiany barwy
roztworu z czerwonego na niebieskoszafirowe.
4) dodawać wersenian kroplami w momencie pojawienia się zabarwienia fioletowego,
energicznie mieszając zawartość kolby. Próbka po upływie 2-3 minut nie powinna
zmienić zabarwienia. W przeciwnym razie oznaczenie należy powtórzyć,
5) wykonać obliczenia twardości ogólnej.
Wyposażenie stanowiska pracy:
− roztwór buforowy (pH = 9)
− wersenian dwusodowy cz.d.a., roztwór 0,01 mol/dm
3
(przygotowuje nauczyciel)
− czerń eriochromowa T – wskaźnik. (1 część czerni eriochromowej na 50 części NaCl).
4.3.4. Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) zdefiniować twardość
wody?
2) zdefiniować przewodność elektrolityczną?
3) wskazać czynniki kształtujące skład wód powierzchniowych?
4) wymienić czynniki kształtujące skład wód podziemnych?
5) wymienić rodzaje wód podziemnych?
6) scharakteryzować wody wgłębne i głębinowe?
7) określić, które z wód naturalnych mają z reguły
wysokie wskaźniki zanieczyszczeń?
8) obliczyć twardość wody?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
4.4. Ruch wody powierzchniowej i podziemnej
4.4.1. Materiał nauczania
Wody podziemne
znajdujące się w powierzchniowej warstwie litosfery przeważnie są
w ruchu. Przepływ może być różny: od powolnego i nieznacznego, aż do osiągającego
znaczne prędkości w szczelinach i kawernach. Bardzo często obserwuje się przemieszczenia
wód na odległość nieraz nawet do kilkuset kilometrów.
Dynamika wód podziemnych
– całokształt ruchu wód podziemnych pod wpływem
czynników naturalnych i sztucznych.
Badanie dynamiki wód podziemnych pozwala na obliczanie ilości i prędkości wód w różnych
warunkach geologicznych. Tego typu wyliczenia są bardzo ważne gdyż pozwalają na
projektowanie różnych inwestycji hydrotechnicznych (dla górnictwa, przemysłu, rolnictwa
i zaopatrywania ludności w wodę).
Wody bardzo głębokie
, nie zasilane z powierzchni Ziemi znajdują się najczęściej
w bezruchu
.
Ruch warstwowy
– laminarny (z łac. lamina – warstewka, blaszka).W ruchu laminarnym
tory cząstek mało różnią się od siebie. Pozostające w ruchu medium można traktować jako
zbiór oddzielnych warstw, poruszających się względem siebie z różną prędkością i nie
mieszających się ze sobą. Ruch taki występuje w mediach o dużej lepkości (µ), np. lawa
wulkaniczna.
Filtracja
– (z łac. filtrum – wojłok) to powolny laminarny przepływ wody, np. warstewki
i strużki spływającej wody, które się nie mieszają i nie krzyżują. Prędkość przepływu wody
tym ruchem nie przekracza 1mm/s.
Ruch burzliwy – turbulentny
(z łac. turbulentia – niepokój). W ruchu turbulentnym
ruch cząstek płynu powoduje mieszanie się ze sobą rożnych warstw. Ruch ten występuje
w mediach o względnie małej lepkości (µ), np. woda, powietrze.
Flaucja
– (z łac. fluere – lać się, płynąć) to szybki ruch wody, np. w porach,
w szczelinach i kawernach. Tu drogi spływu schodzą się i krzyżują, miejscami nawet
przerywają.
Ruch laminarno-turbulentny
– to ruch mieszany.
Ruch wód powierzchniowych różni się znacznie od ruchu wód podziemnych. Prędkości
wody w ciekach wahają się w granicach od kilkunastu centymetrów do kilku metrów na
sekundę, podczas gdy naturalne prędkości wód podziemnych wynoszą kilka metrów na dobę.
Ponadto prędkość przepływu wody w cieku nie jest równa w całym jego przekroju: przy
brzegach prędkości wody są mniejsze niż na środku, a największe prędkości powstają
w najgłębszych częściach przekroju poprzecznego. Łącząc ze sobą punkty, w których
w kolejnych przekrojach poprzecznych panują największe prędkości otrzymuje się linię
nurtu
.
Długość cieku
mierzona jest wzdłuż linii nurtu, odpowiadającej stanowi wody przyjętemu
jako średni dla danego odcinka cieku.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczenia.
1) Co to jest flaucja?
2) Jak zdefiniujesz ruch warstwowy – laminarny?
3) Jaka jest definicja ruchu burzliwego?
4) Jakie są różnice między ruchem wód powierzchniowych a ruchem wód podziemnych?
5) W jaki sposób oblicza się długość cieku?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
4.4.3. Ćwiczenia
Ćwiczenie 1
Oblicz długości cieku.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przeczytać polecenie: długość cieku została oznaczona w terenie stałymi znakami. Jednak
z biegiem czasu koryto zmieniło trochę swój bieg między zaznaczonymi w sposób trwały
kilometrami,
2) zastanowić się,
3) wyznaczyć jego długość.
Wyposażenie stanowiska pracy:
− materiały źródłowe,
− notes, ołówek.
4.4.4.
Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) zdefiniować pojęcie: flaucja?
2) zdefiniować pojęcie: filtracja?
3) zdefiniować pojęcia: wylewy, wycieki, wysięki?
4) wymienić rodzaje ruchu wód?
5) określić na czym polega ruch warstwowy – laminarny?
6) scharakteryzować ruch burzliwy?
7) wskazać różnice między ruchem wód powierzchniowych
a ruchem wód podziemnych?
8) wyjaśnić zasadę obliczania długości cieku?
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
4.5. Metody pomiarów hydrometrycznych wody
4.5.1. Materiał nauczania
Hydrometria
(gr) to dział hydrologii, zajmujący się obserwacją zmian poziomu wód
powierzchniowych i podziemnych oraz form ich zlodzenia, także pomiarami głębokości,
prędkości i natężenia przepływu wody, temperatury i składu chemicznego wód i opadów
atmosferycznych oraz parowania z powierzchni wody i gruntu.
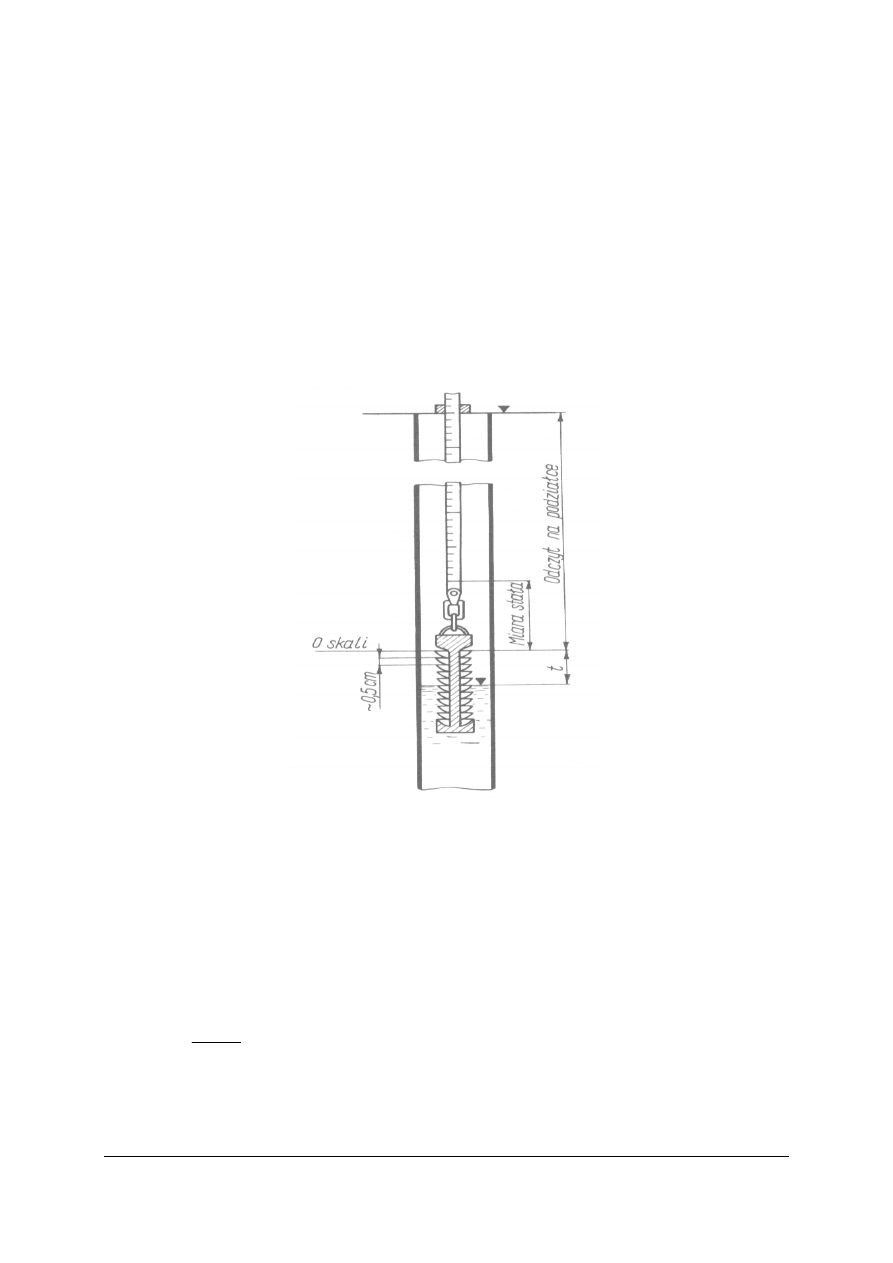
Do pomiaru stanów wód służą wodowskazy:
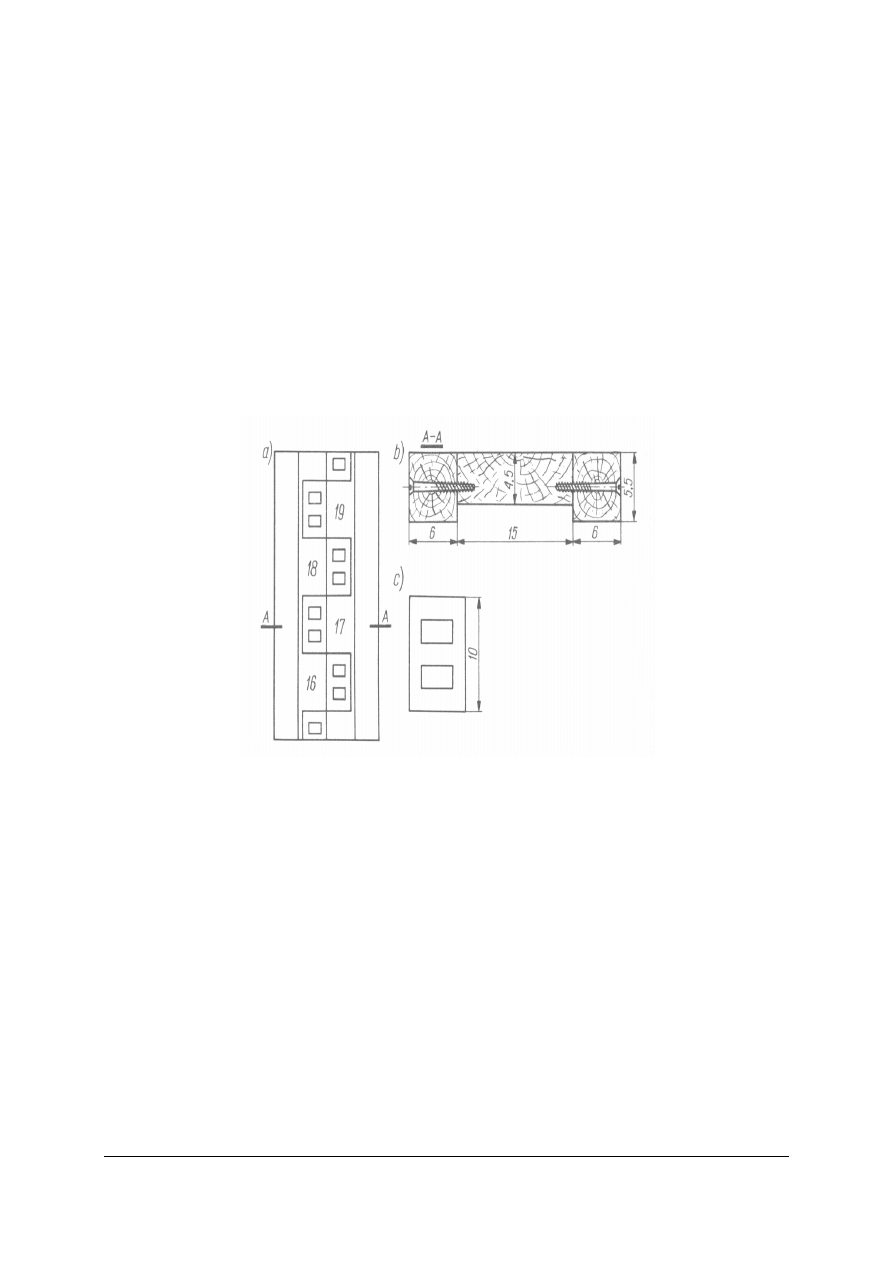
łaty wodowskazowe –
pionowe, drewniane listwy podobne do łat niwelacyjnych. Pozwalają
na odczytywanie stanów wody istniejących w chwili pomiaru, a przebieg wahań stanów
można przeanalizować z zestawień poszczególnych pomiarów dokonywanych w określonych
odstępach czasu.
Rys. 2. Łata wodowskazowa: a) widok łaty z przodu, b) przekrój poprzeczny łaty,
c) dziesięciocentymetrowa tabliczka metalowa podziałki łaty
Źródło: Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika z elementami hydrogeologii. WSiP, Warszawa 1997
Dokładny przebieg zmian (wahań) stanów w czasie można uzyskać przy zastosowaniu
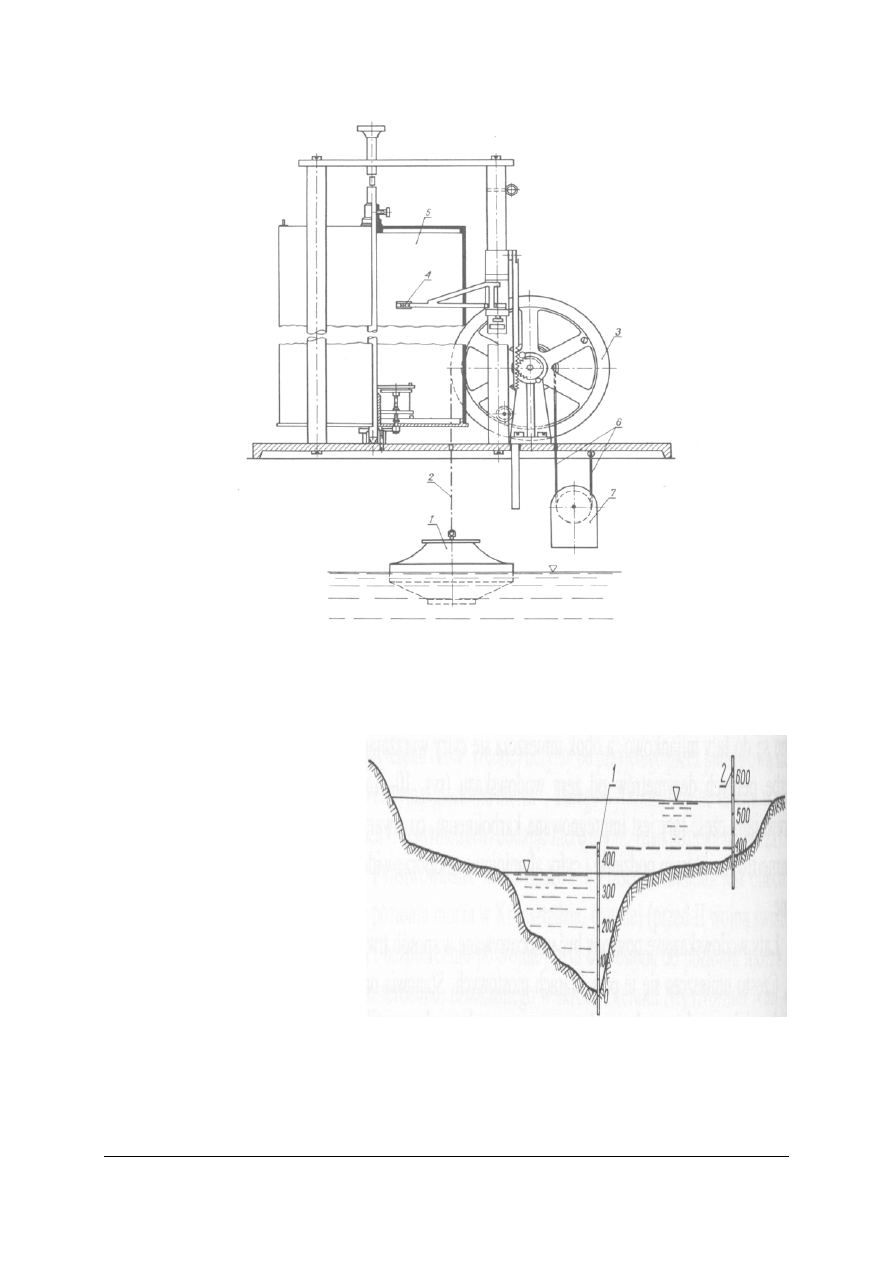
wodowskazów samopiszących – limnigrafów.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Rys. 3. Wodowskaz samopiszący (limnigraf) z walcem pionowym
Źródło: Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika z elementami hydrogeologii. WSiP, Warszawa
1997
wodowskazy sprzężone –
przy
płaskich brzegach i dużych
wahaniach zwierciadła wody
umieszcza się dwie łaty: jedna
w korycie stale wypełnionym
wodą, drugą na obszarze
zalewowym. Podziałki obu
łat powinny być tak
umieszczone, aby odczyty na
nich były równoznaczne, aby
odpowiadające sobie liczby skali
były na tym samym poziomie.
Rys. 4. Wodowskaz łatowy sprzężony
Źródło: Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika
z elementami hydrogeologii. WSiP, Warszawa 1997
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
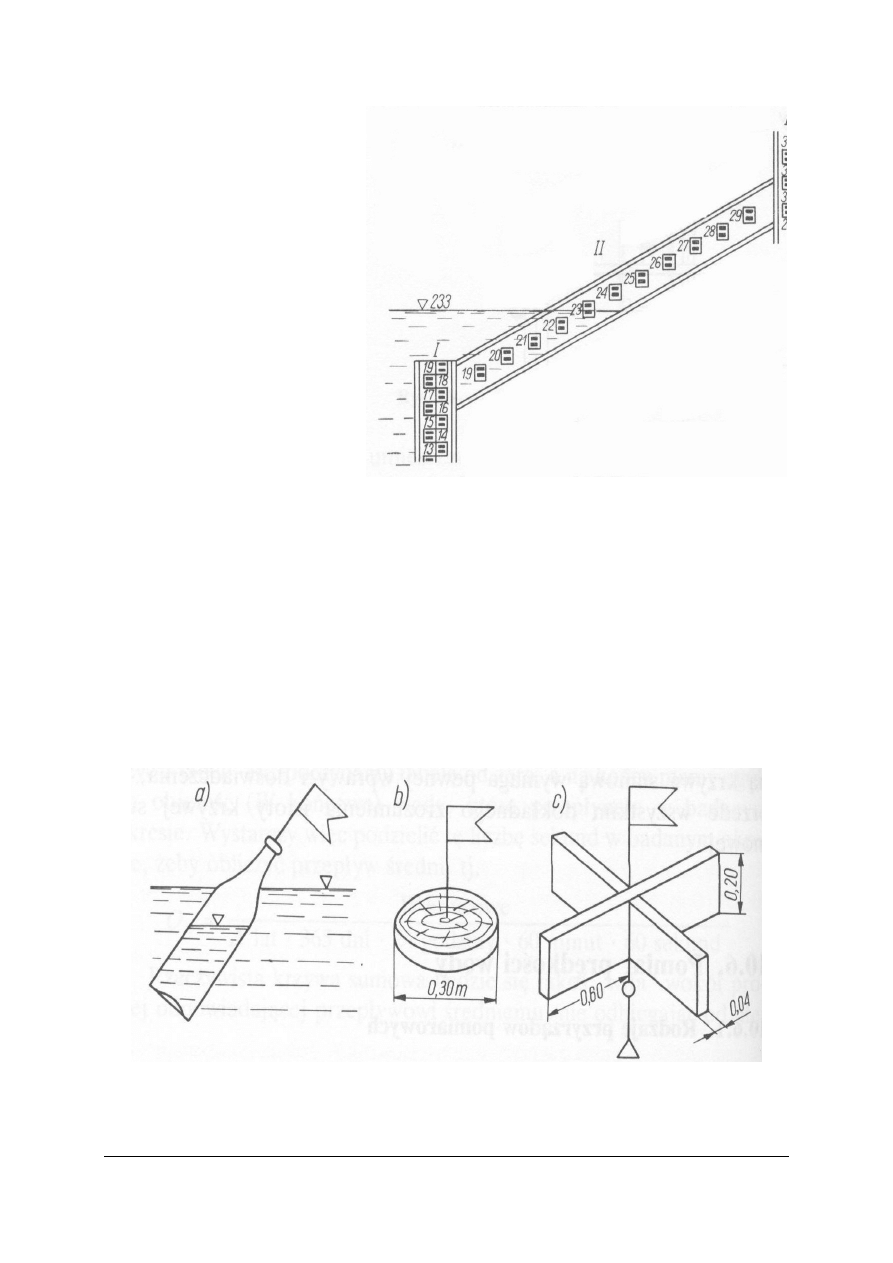
Czasem podziałki wodowskazowe
umieszczone są na pochyłych
skarpach. Wówczas wymiary
podziałek wodowskazu
usytuowanego na skarpie są tak
dobrane, aby odczyty na nich
odpowiadały centymetrowym
(dwucentymetrowym)
wzniesieniom zwierciadła wody
w pionie.
Rys. 5. Wodowskaz złożony umieszczony na skarpie
Źródło: Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika
z elementami hydrogeologii. WSiP, Warszawa 1997
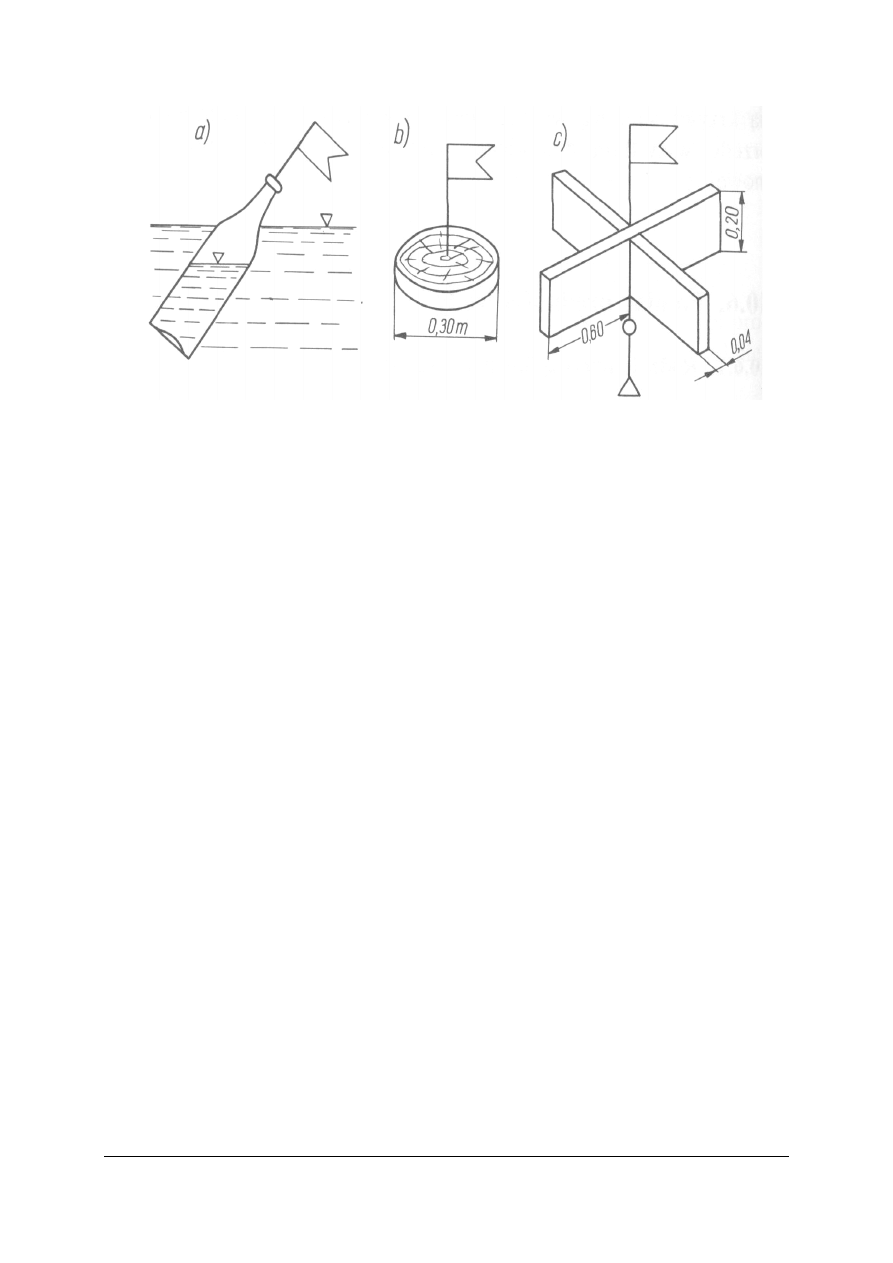
Do pomiaru prędkości wody służą:
− pływaki (przyrządy płynące wraz z wodą z tą samą prędkością). Czas, z jakim pływak
pokona odcinek o odpowiedniej długości = prędkości wody
− młynki hydrometryczne (pomiar prędkości obrotów skrzydełek młynka poruszanych
przez płynącą wodę),
− dynamometry (mierzą bezpośrednio nacisk prądu wody na przyrząd lub odpowiednią
jego część składową),
− batymetry (przyrządy służące do pobierania próbek wody. Tylko niektóre mogą służyć
do określania prędkości).
Rys. 6.
Pływaki:
a) butelka częściowo wypełniona wodą, b) krążek drewniany, c) krzyżak drewniany.
Źródło: Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika z elementami hydrogeologii. WSiP, Warszawa
1997
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Pomiar objętości przepływu
Pomiary objętości przepływu w małych ciekach można także dokonać metodami
polegającymi na pomiarze rozcieńczenia roztworów o znanym stężeniu (metoda chemiczna,
kolorymetryczna, izotopowa).
Pomiaru poziomu wody gruntowej
można dokonać za pomocą:
− pionowej rurki wpuszczonej w grunt. Po wyjęciu rurki (pręta) obserwujemy, do którego
miejsca został on zwilżony (dla ułatwienia koniec pręta można powlec kredą),
− przyrządu talerzykowego składającego się z szeregu talerzyków, których krawędzie
odległe są od siebie o 0,5 cm i zawieszonego na taśmie z podziałką. Pomiaru dokonujemy
opuszczając taśmę do rury aż do częściowego zanurzenia przyrządu w wodę. Część
talerzyków zaczerpnie wodę. Po wyjęciu widać w ilu talerzykach znajduje się woda, co
określa zanurzenie przyrządu a tym samym daje możność odczytania położenia poziomu
wody.
Rys. 7. Przyrząd talerzykowy do pomiaru zwierciadła wody gruntowej
Źródło: Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika z elementami hydrogeologii. WSiP, Warszawa
1997
Uwaga!
Przy pomiarach na większych głębokościach na końcu przyrządu umieszcza się
gwizdek, który sygnalizuje dojście do poziomu wody.
Najdokładniej można uchwycić poziom wody gruntowej posługując się przyrządami
przekazującymi sygnał elektryczny z chwilą zetknięcia się ze zwierciadłem wody.
Pomiar natężenia przepływu –
można go dokonać za pomocą obliczenia stężenia soli
dodanej do wody, według wzoru:
Q = q
0
1
1
k
k
k
k
−
−
Q – natężenie przepływu wody w cieku w m
3
/s
q – natężenie przepływu doprowadzonego roztworu w m
3
/s
k – stężenie roztworu soli w doprowadzanym roztworze w kg/m
3

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
k
1
– stężenie roztworu soli w wodzie cieku po wymieszaniu z doprowadzonym
roztworem w kg/m
3
k
0
– stężenie roztworu soli w cieku naturalnym w kg/m
3
wartość q = µ
.
A
h
g
⋅
2
m
3
/s
µ –
współczynnik wydatku (wartość odczytuje się z tabeli „wartość wydatku µ dla
otworów okrągłych o średnicy d lub dla otworów kwadratowych o boku a”
A –
przekrój wylotu kranu przy zbiorniku [m
2
],
g –
przyspieszenie ziemskie [m/s
2
],
h –
stała aparatu do wprowadzania roztworu [m].
Jeżeli zawartość soli w naturalnym cieku k
0
jest nieznaczna, można ją pominąć i wzór ma
uproszczoną postać
Q = q
1
1
k
k
k
−
4.5.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1) Co to jest hydrometria?
2) Do czego służą wodowskazy?
3) Jakie znasz rodzaje wodowskazów?
4) Na czym polega pomiar objętości przepływu?
5) Za pomocą czego dokonuje się pomiaru poziomu wody gruntowej?
6) Za pomocą czego dokonuje się pomiaru prędkości wody?
4.5.3. Ćwiczenia
Ćwiczenie 1
Oblicz prędkość powierzchniową w nurcie rzeki.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przygotować trzy rodzaje pływaka tak jak pokazano na rysunku 8,
2) obrać możliwie prosty odcinek rzeki i w odległości 20–40 m od siebie zaznaczyć dwa
przekroje poprzeczne – każdy za pomocą dwóch tyczek ustawionych na obu brzegach,
3) ustawić obserwatora przy każdym wyznaczonym przekroju tak, aby kierując swój wzrok
wzdłuż kierunku wyznaczonego przez tyczki mógł zaobserwować chwilę, kiedy pływak
przepływa przez wyznaczony przekrój,
4) zmierzyć za pomocą stopera czas przepływu pływaka. (W chwili przejścia przez pierwszy
przekrój obserwator stający przy nim powinien naciskać stoper. Obserwator stający przy
drugim przekroju obserwuje, kiedy pływak przepływa przez drugi przekrój i daje znak,
np. przez machnięcie ręką – wtedy pierwszy obserwator zatrzymuje stoper),
5) obliczyć prędkość przepływu pływaka między wyznaczonymi za pomocą tyczek
przekrojami.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Rys. 8.
Pływaki: butelka częściowo wypełniona wodą, b) krążek drewniany, c) krzyżak drewniany
Źródło: Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika z elementami hydrogeologii. WSiP, Warszawa
1997
Wyposażenie stanowiska pracy:
− pływaki: butelka częściowo wypełniona wodą, krążek drewniany lub krzyżak drewniany.
− stoper.
Ćwiczenie 2
Zmierz objętość przepływu za pomocą roztworu soli NaCl.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wprowadzić do cieku (rzeki) strumieniem o małym natężeniu przepływu q roztwór soli
o znanym stężeniu k,
2) pobrać próbkę,
3) określić stężenie soli w mieszaninie wprowadzonego roztworu z wodą cieku k
1
,
4) określić stężenie soli w naturalnej wodzie cieku k
0
, gdyż naturalny
ciek
może zawierać
pewną ilość soli,
5) obliczyć natężenie przepływu.
Wyposażenie stanowiska pracy:
− roztwór soli NaCl,
− naczynie do pobrania próbki,
−
kalkulator.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
4.5.4. Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) zdefiniować pojęcie hydrometria ?
2) omówić zastosowanie dynamometrów?
3) wymienić rodzaje wodowskazów?
4) wymienić przyrządy do pomiaru poziomu
wody gruntowej?
5) dokonać pomiaru prędkości wody?
6) określić, do czego służą wodowskazy?
7) wyjaśnić, na czym polega pomiar
objętości przepływu?
8) opisać poszczególne wodowskazy?
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.6. Stany i przepływy wody
4.6.1. Materiał nauczania
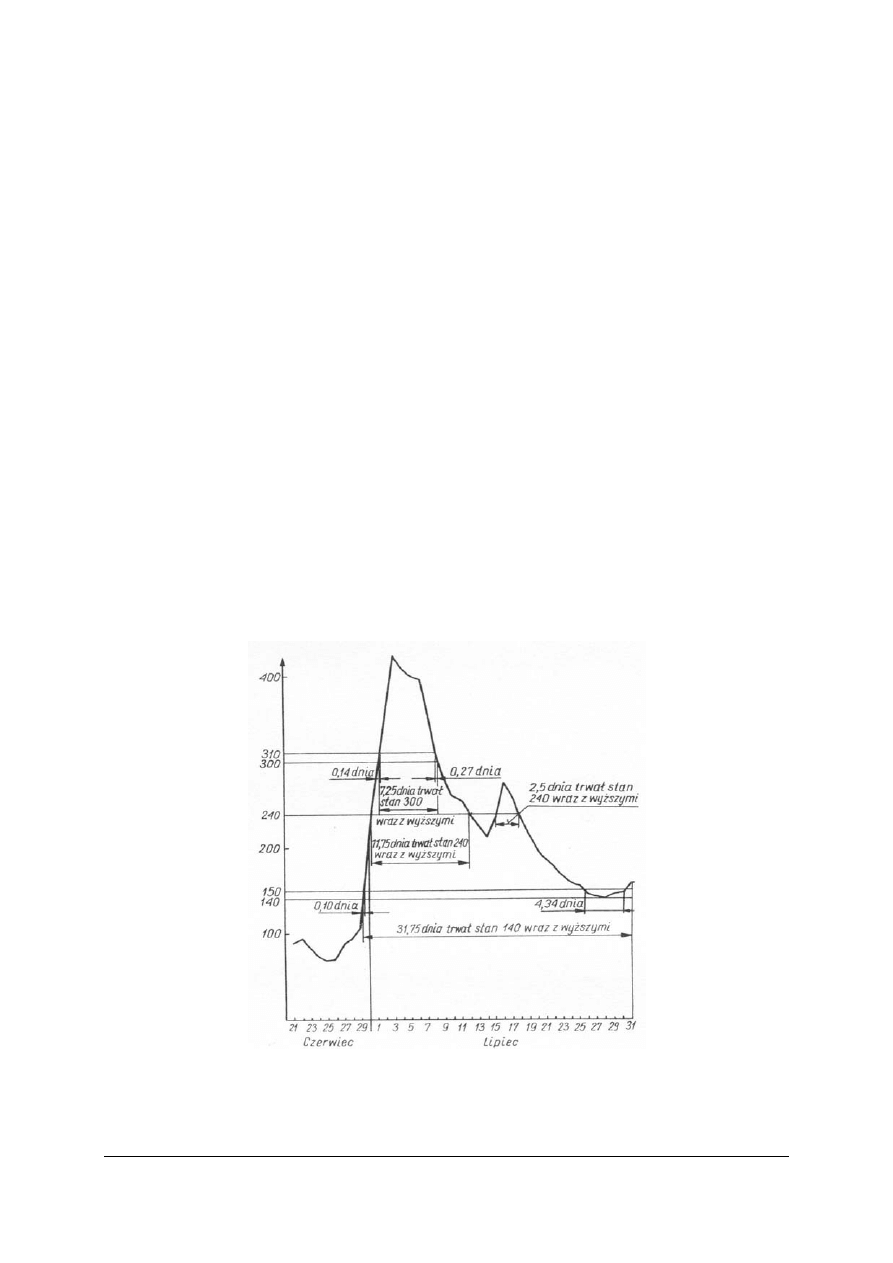
Stan wody w cieku lub zbiorniku wodnym to poziom wzniesienia zwierciadła wody
w miejscu pomiaru ponad umowny poziom porównawczy, zwany zerem wodowskazu.
Bardzo ważne jest to, aby nie mylić terminu stan wody z terminem poziom wody.
Poziom terenu liczony jest od przyjętego przez państwową sieć niwelacyjną „poziomu
morza”, dlatego wyrażamy rzędne terenu w metrach i centymetrach dodając literę n.p.m. (nad
poziomem morza).
Natomiast państwowa sieć wodowskazów w Polsce odniesiona jest obecnie do poziomu
morza w Kronsztadzie. Wzniesienie zwierciadła wody liczone jest od ustalonego „zera”
wodowskazu i nazywane jest stanem wody.
Zera wodowskazów ustalane są zawsze poniżej najniższego stanu wody. Chodzi o to, aby
nie było ujemnych odczytów, oraz aby zero było na tyle wysoko, żeby odczyty
w centymetrach wyrażane były co najwyżej liczbami trzycyfrowymi.
Wykres stanów wody – krzywa wodowskazowa
– przejrzysty obraz przebiegu zmian
stanów wody na wodowskazie.
Wykres stanów wody powstaje na podstawie danych uzyskanych z pomiarów (odczytów,
notowań) stanów wody każdego dnia na wodowskazach.
Na osi odciętych zaznaczany jest czas (kolejno dzień za dniem) a na osi rzędnych stany
w centymetrach – powstają punkty odwzorowujące notowane stany. Łącząc kolejno
otrzymane punkty, otrzymujemy wykres stanów wody.
Rys. 9. Fragment wykresu stanów wody
Źródło: Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika z elementami hydrogeologii. WSiP, Warszawa
1997
[cm]

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Zanotowanie wysokości wody jest czynnością łatwą i szybką, dlatego też obserwacje
stanów można prowadzić systematycznie (codziennie albo kilka razy na dobę), a nawet przy
stosowaniu limnigrafów uzyskiwać obserwacje ciągłe.
Jakie przesłanki przemawiają za obserwowaniem stanów wody?
− Przepływy dają podstawę do określenia ilości wody, którą możemy pobierać z cieku na
potrzeby gospodarcze.
− Znajomość wykresu stanów wody pozwala na określenie możliwości uzyskania energii
wodnej, do określenia pojemności zbiorników retencyjnych.
Pomiary przepływu natomiast są bardziej pracochłonne, potrzebny jest profesjonalny
sprzęt. Dlatego też takie pomiary są prowadzone sporadycznie.
Przepływ zwany natężeniem przepływu (
Q) to objętość wody przepływająca przez
określony przekrój poprzeczny cieku.
Krzywa konsumpcyjna
– (krzywa przepływu) wyprowadzona jest na podstawie
wyników obserwacji stanów. Jeżeli przepływ wody w rzece odbywa się w warunkach
ustalonych, w tym samym korycie, w takich samych warunkach zewnętrznych, to każdemu
przepływowi odpowiada określone napełnienie koryta, tzn. określony stan wody (mniejsze
przepływy – niższe stany wody, wyższe przepływy – wyższe stany wody).
Na osi rzędnych odkładany jest stan wody a na osi odciętych pomiar przepływu.
Mając do dyspozycji wyniki wielu pomiarów dokonywanych przy różnych stanach
otrzymuje się szereg punktów pozwalających na wykreślenie krzywej konsumpcyjnej, z której
można odczytać dla każdego stanu odpowiadający mu przepływ.
Zależność między przepływami i stanami ujmowana w postaci dwóch równań:
Q = a + bH + cH
2
lub
Q = α (H + β)
n
a, b, c, α, β, n określane są na podstawie punktów uzyskanych z pomiaru.
Q = przepływ wody, zwany natężeniem przepływu [m
3
/s],
H – stany wody (cm)
Stany charakterystyczne
– stany na wodowskazie szczególnie interesujące, przydatne
do różnych celów technicznych i gospodarczych. Np. stany umożliwiające przepływ barki
w ciągu 210 dni w roku albo stany, przy których woda występuje z koryta rzeki i rozpoczyna
się zalew terenów przybrzeżnych.
Stany charakterystyczne określane są dla poszczególnych okresów: rocznych, półrocznych,
miesięcznych, wieloleci, okresu letniego, okresu żeglugi.
Tabela 1. Oznaczenia głównych stanów i przepływów charakterystycznych
Oznaczenia
Określenie wielkości
charakterystycznych
stanów przepływów
Najwyższa wartość obserwowana
WWW
WW Q
Najwyższa wartość w roku
WW
W Q
Średnia wartość z najwyższych stanów
w okresie
SWW SW
Q
Średnia wartość w okresie
SSW
SS Q
Średnia wartość w roku
SW
S Q
Średnia wartość z najniższych stanów
w okresie
SNW SN
Q
Najniższa wartość w roku
NW
N Q
Najniższa wartość obserwowana
NNW
NN Q
Źródło: Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika z elementami hydrologii. WSiP , Warszawa 1997.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
Najwyższa lub najniższa wartość obserwowana (WWW lub NNW) albo najwyższa
wielka woda lub najniższa niska woda są to: najwyższy i najniższy stan jaki dotychczas
zaobserwowano na danym wodowskazie w ciągu prowadzenia na nim obserwacji. Wartości te
mogą ulegać zmianom, gdy zdarzy się stan wyższy lub niższy od zaobserwowanego
dotychczas. Nazywamy je także absolutnym maksimum albo absolutnym minimum.
Średnia wartość stanu
– średnia arytmetyczna stanów codziennych albo wyliczona na
podstawie zmierzonego pola ograniczonego krzywą wodowskazową lub krzywą sum czasów
trwania stanów i podzielenie go przez liczbę dni.
Stan ostrzegawczy i stan alarmowy
–są to stany wyznaczane dla każdego posterunku
wodowskazowego w związku z ochroną przeciwpowodziową. Przekroczenie stanu
alarmowego daje podstawę do ogłoszenia alarmu przeciwpowodziowego.
Stan wody brzegowej
– stan powyżej którego woda występuje z brzegów koryta
i zaczyna się wylew.
Stan wody żeglownej
– ustalany przez żeglugę, określony przez ładowność barek, przy
której mogą one kursować na danym odcinku rzeki.
4.6.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1) Co oznacza pojęcie stan alarmowy?
2) Co to jest krzywa konsumpcyjna?
3) Co to jest krzywa wodowskazowa?
4) Co nazywamy zerem wodowskazu?
4.6.3. Ćwiczenia
Ćwiczenie 1
Sporządź wykresy stanu wody na podstawie danych z tabeli
Data 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Stan
wody
205 205 200 245 240 230 225 220 210 200 200 195 210 215 210 205
[cm]
Data 17 18 19 20 21 22 23 24 25 26 27 28 29 30
Stan
wody
195 190 185 180 180 180 185 185 210 230 225 225 220 220
[cm]
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) odczytać stany wody na rzece,
2) sporządzić wykres,
3) zaznaczyć WWW (najwyższa wartość obserwowana), NNW (najniższa wartość
obserwowana),
4) obliczyć SSW (średnia wartość w okresie).

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Wyposażenie stanowiska pracy:
− odczyty stanów wody,
− notes, ołówek.
4.6.4.
Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) zdefiniować pojęcie krzywa konsumpcyjna?
2) zdefiniować pojęcie krzywa wodowskazowa?
3) wymienić rodzaje stanów wody?
4) wyjaśnić, co
nazywamy zerem wodowskazu?
5) wyjaśnić różnice między stanem ostrzegawczym
a stanem alarmowym?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
4.7. Cel i zakres badania wód
4.7.1. Materiał nauczania
Głównym celem badań jakości wód powierzchniowych i podziemnych jest określenie ich
składu fizykochemicznego oraz stanu sanitarnego, najczęściej pod katem przydatności do
ewentualnego wykorzystania gospodarczego po to, aby określić przydatność do picia, potrzeb
gospodarczych i przemysłowych.
Woda przeznaczona do picia i potrzeb gospodarczych powinna:
− odpowiadać wymaganiom sanitarno-epidemiologicznym,
− być klarowna, bezbarwna,
− bezwonna,
− nie zawierać składników lub domieszek szkodliwych dla zdrowia i ujemnie
wpływających na jej walory smakowe,
− nie zawierać bakterii chorobotwórczych, pasożytów zwierzęcych oraz ich jaj.
Woda przemysłowa Stawiane
są jej różne wymagania w zależności od jej wykorzystania
Woda stosowana do
celów energetycznych
Przeznaczona do zasilania kotłów parowych. Woda kotłowa
powinna być:
− klarowna,
− bez zawiesin,
− nie powinna zawierać substancji pieniących się,
− nie powinna zawierać substancji tworzących kamień kotłowy,
− nie powinna zawierać gazów.
Gromadzenie się kamienia na ściankach kotła zmniejsza ich
przewodnictwo cieplne, zwiększa zużycie paliwa i może
doprowadzić do zniszczenia kotła. Rozpuszczone gazy, szczególnie
tlen i dwutlenek węgla powodują korozję kotła.
Woda technologiczna
Używana bezpośrednio w procesach technologicznych musi
odpowiadać określonym normom branżowym. Na przykład
przemysł farmaceutyczny czy odczynników chemicznych wymaga
stosowania wody destylowanej lub oczyszczonej (zdemineralizowanej)
za pomocą jonitów. W przemyśle spożywczym woda powinna
odpowiadać takim samym wymaganiom jak woda do picia. Żelaza
i manganu nie powinny zawierać wody stosowane w przemyśle
garbarskim i papierniczym. Przemysł ceramiczny wymaga
stosowania wody miękkiej, a cukrownie nie powinny używać wody
zawierającej NaCl (utrudnia krystalizację) i jonów SO
4
2-
(razem
z cukrem strącają się w postaci gipsu).
Woda chłodnicza Używana w urządzeniach chłodniczych, nie powinna zawierać
substancji osadzających się na powierzchniach urządzeń
chłodniczych i powodujących korozję. Substancje osadzające się na
powierzchni chłodnic obniżają zdolność do wymiany ciepła. Do
nich należą związki chemiczne powodujące twardość wody oraz
tłuszcze i smary.
Zanieczyszczenia występujące w wodach można podzielić na:
− makroskopowe – dające się oddzielić mechanicznie za pomocą sit, odstojników, filtrów,
− koloidalne – oleje, smary,
− cząsteczkowe – rozpuszczone w wodzie sole i gazy.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
W zależności od przeznaczenia wody ustala się zakres jej badań. Może on być: pełny,
rozszerzony, skrócony.
Badania skrócone
– dla rutynowej kontroli jakości wody do picia i potrzeb gospodarstwa
domowego ze źródeł stale zaopatrujących mieszkańców. Obejmują tylko niektóre oznaczenia:
temperatura, mętność, barwa, zapach, odczyn, twardość ogólna i niewęglanowa, zasadowość,
żelazo ogólne, mangan, chlorki, amoniak, azotany (V), azotany (III), utlenialność.
Badania rozszerzone
– prowadzone w celu stwierdzenia przydatności wody do potrzeb
gospodarczych czy przemysłowych oraz uzyskania orientacyjnej charakterystyki nowych
źródeł wody. Obejmują one badania sanitarne te same co przy metodzie skróconej oraz
dodatkowo sucha pozostałość i siarczany (VI).
Badania pełne
– mają na celu określenie charakterystyki fizycznej i chemicznej nie
zbadanych dokładnie nowych źródeł wody i ustalenie ich przydatności do określonych celów.
Badania te obejmują badanie rozszerzone oraz: fluor, siarkowodór, wolny i agresywny
dwutlenek węgla, sód, potas, cynk, miedź, glin, arsen, selen, chrom, kadm, ołów, cyjanki,
fosforany, rozpuszczony tlen, chemiczne zapotrzebowanie na tlen (ChZT), biologiczne
zapotrzebowanie na tlen (BZT), azot albuminowy, substancje powierzchniowo-czynne,
substancje z wyciągu chloroformowego, fenol, wielopierścieniowe węglowodory
aromatyczne, poziom radioaktywności.
Badania specjalne
(niekiedy) dotyczą określenia składników uzdatnianych dla
konkretnego użytkownika.
4.7.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1) Jaki jest cel badania jakości wód?
2) Jakie wymienisz rodzaje badań jakości wód?
3) Jak scharakteryzujesz każdy z nich?
4) Jaki jest ogólny podział zanieczyszczeń?
5) Jakie badania należy przeprowadzić, aby zbadać przydatność wody do picia?
4.7.3. Ćwiczenia
Ćwiczenie 1
Określ jakie badania wody należy przeprowadzić, aby określić jej przydatność do różnych
celów:
− Zaopatrzenia ludności - grupa I
− przemysłu papierniczego - grupa II
− przemysłu spożywczego - grupa III
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) skorzystać z dostępnych źródeł informacji,
2) wyszukać informacje dotyczące zakresu badań wody w celu określenia jej przydatności
do różnych celów,
3) zaprezentować wypracowany materiał na forum klasy w dowolnej formie.
Wyposażenie stanowiska pracy:
− podręcznik.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
4.7.4.
Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) scharakteryzować skrócone badania wody?
2) scharakteryzować pełne
badania
wody?
3) wymienić rodzaje badań jakości
wód?
4) omówić wymagania stawiane wodzie do picia?
5) omówić wymagania stawiane wodzie technologicznej?
6) omówić podstawowe rodzaje badań wody?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
4.8. Metody pobierania próbek wody do badania
4.8.1. Materiał nauczania
Aby rzetelnie móc zanalizować wyniki przeprowadzonych badań niezbędne jest
przygotowanie w
odpowiedni sposób odczynników chemicznych, prawidłowy sposób
pobierania próbek wody do analizy, ich utrwalanie i przechowywanie.
Próbka pierwotna
– określona objętość wody pobierana jednorazowo w punkcie
pobierania próbek. Reprezentuje ona skład i właściwości wody w danym miejscu i czasie.
Jeżeli wiadomo (z wcześniejszych badań), że skład wody w dalszej odległości nie zmienia się,
to próbka pierwotna będzie reprezentatywna w określonej przestrzeni. Gdy wiadomo, że skład
wody nie zmienia się również w dłuższym czasie, to będzie ona reprezentatywna także
w określonym czasie.
Próbka złożona
– zaliczyć tu można próbki ogólne średnie, ogólne okresowe,
proporcjonalne, proporcjonalne ogólne, proporcjonalne okresowe. Należy je pobierać, gdy
skład wody jest zmienny w danej przestrzeni oraz w czasie.
Próbka ogólna średnia
– otrzymywana jest ze zmieszania próbek pierwotnych
o jednakowej objętości, pobieranych w tym samym czasie z różnych punktów, w tym samym
miejscu lub z kilku miejsc pobierania próbek.
W przypadku pobierania próbek z zaworów, kurków, wylotów, rur, punkt pobierania
próbek pokrywa się z miejscem pobierania próbek.
Próbka ogólna okresowa
– otrzymywana jest ze zmieszania próbek pierwotnych lub
ogólnych o danej objętości, pobranych w określonych odstępach czasu, np. co 2 godziny.
Próbka taka jest reprezentatywna dla określonego przedziału czasu.
Próbka proporcjonalna
– otrzymywana jest w wyniku pobrania odpowiedniej objętości,
proporcjonalnej do wielkości przepływu wody, ścieków w danej chwili w określonym
punkcie. Próbka jest charakterystyczna w określonym momencie czasu.
Próbka proporcjonalna ogólna
– otrzymywana jest ze zmieszania próbek
proporcjonalnych pobieranych w określonych odstępach czasu. Próbka jest reprezentatywna
dla danego przepływu wody, ścieków, osadów ściekowych.
Próbka proporcjonalna ogólna okresowa
– otrzymywana jest ze zmieszania próbek
proporcjonalnych, pobieranych w określonych odstępach czasu. Próbka jest reprezentatywna
dla danego przepływu i dla określonego przedziału czasu.
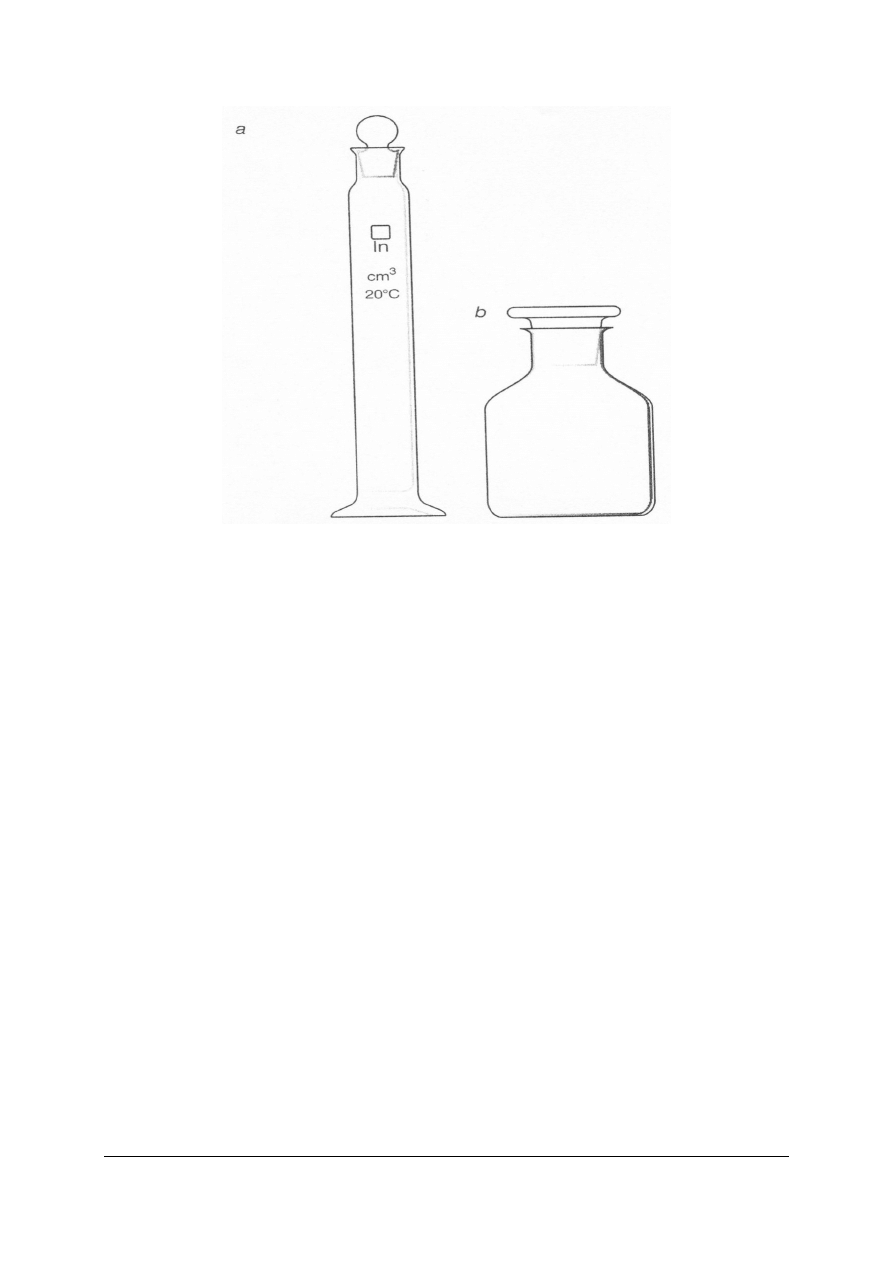
Naczynia i przyrządy do pobierania i przechowywania próbek:
− butelki szklane z doszlifowanymi korkami szklanymi lub dopasowanymi korkami
z tworzywa sztucznego,
− butelki szklane z doszlifowanymi ukośnie ściętymi korkami szklanymi,
− słoiki szklane z doszlifowanymi korkami szklanymi lub dopasowanymi korkami
z tworzywa sztucznego,
− butelki lub inne naczynia z tworzyw sztucznych ze szczelnymi zamknięciami,
− cylindry miarowe szklane z tworzyw sztucznych.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
Rys. 10. Naczynia do pobierania i przechowywania próbek wody i ścieków
Źródło: Lipkowska-Grabowska K., Faron-Lewandowska E.: Pracownia chemiczna. Analiza wody i ścieków.
WSiP, Warszawa 1998
− naczynia mocowane w uchwytach metalowych o zróżnicowanej konstrukcji,
przeznaczone do bezpośredniego pobierania próbek wody i ścieków na głębokości do 1,5
m,
− czerpaki o pojemności 1 – 5 dm3. Próbka pobierana jest do naczynia w kształcie
prostopadłościanu, walca lub ściętego stożka, wykonanego z materiału nie korodującego
lub z tworzywa sztucznego. Naczynie to zamocowywane jest na żerdzi lub linie, która
umożliwia pobieranie próbki z wymaganej głębokości.
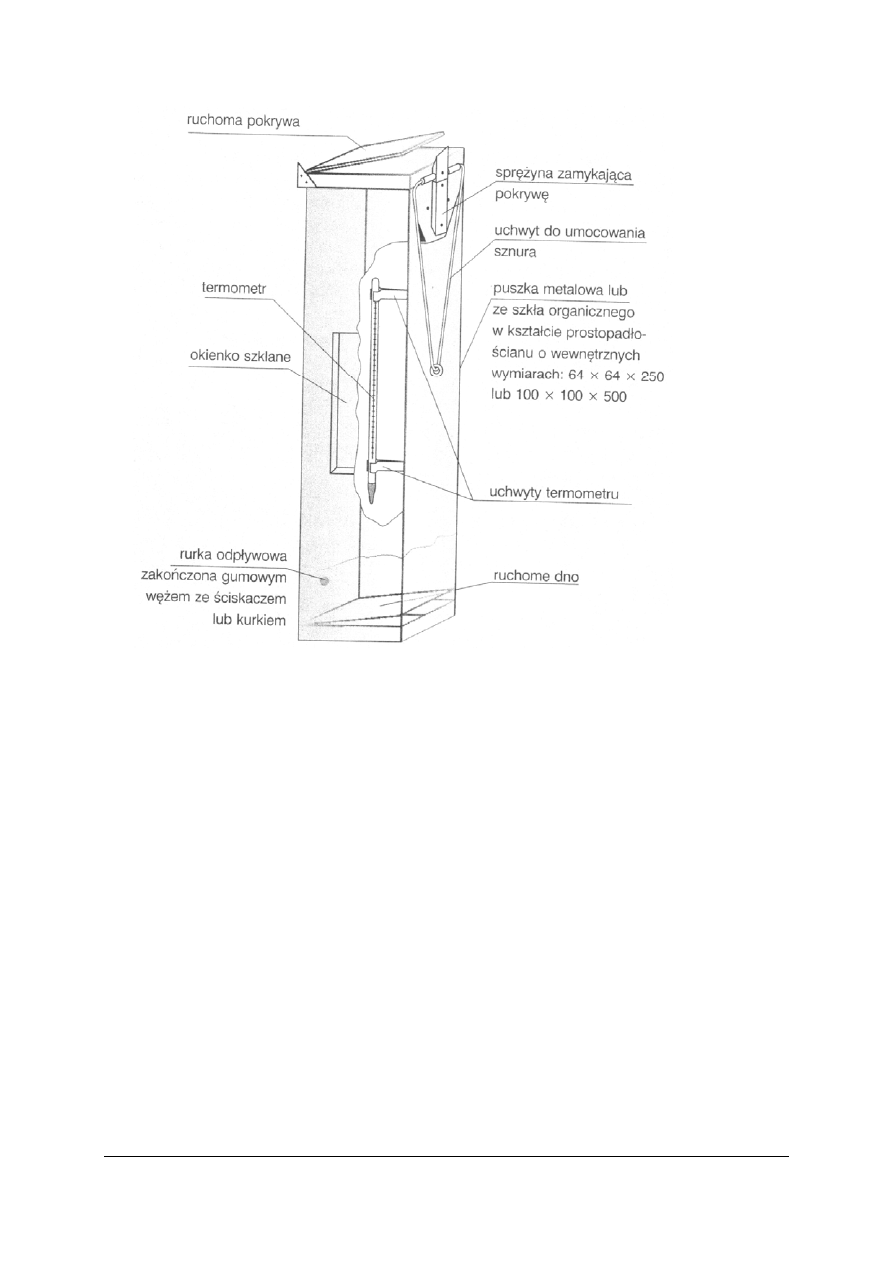
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Rys. 11. Czerpacz Patalasa
Źródło: Lipkowska-Grabowska K., Faron-Lewandowska E.: Pracownia chemiczna. Analiza wody i ścieków.
WSiP, Warszawa 1998
Czerpacz Patalasa umożliwia pobieranie próbek z dowolnej głębokości przy
jednoczesnym pomiarze temperatury wody lub ścieków. Pobrana próbka może być też
wykorzystana do oznaczania gazów rozpuszczonych w wodzie. Czerpacz opuszcza się
powoli, szarpnięcie linki powoduje uwolnienie pokrywy, która się zamyka pod wpływem
zwiększonego parcia na nią wody. Pobrane próbki należy natychmiast przelać do naczyń
dostosowanych do przechowywania próbek.
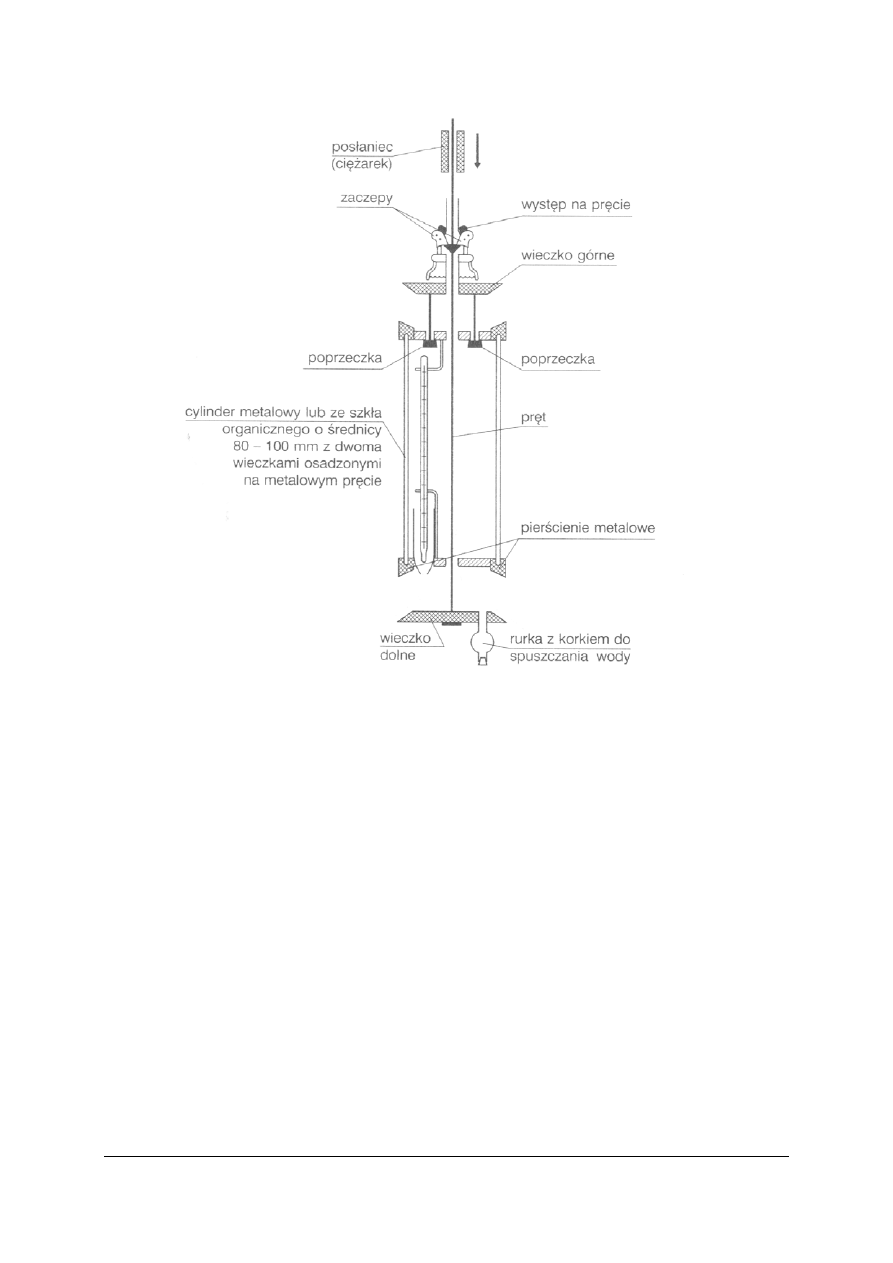
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
Rys. 12. Czerpacz Ruttnera
Źródło: Lipkowska-Grabowska K., Faron-Lewandowska E.: Pracownia chemiczna. Analiza wody i ścieków.
WSiP, Warszawa 1998
Czerpacz Ruttnera otwarty, wprowadza się na wybraną głębokość, po czym opuszcza
ciężarek wzdłuż linki. Ciężarek powoduje uwolnienie zaczepów z występu pręta. Uwolnione
w ten sposób wieczko, pod wpływem własnego ciężaru opada na krawędź pierścienia cylindra
i zamyka wieczko górne.
Pobrana próbka może być przeznaczona do oznaczania gazów w wodzie.
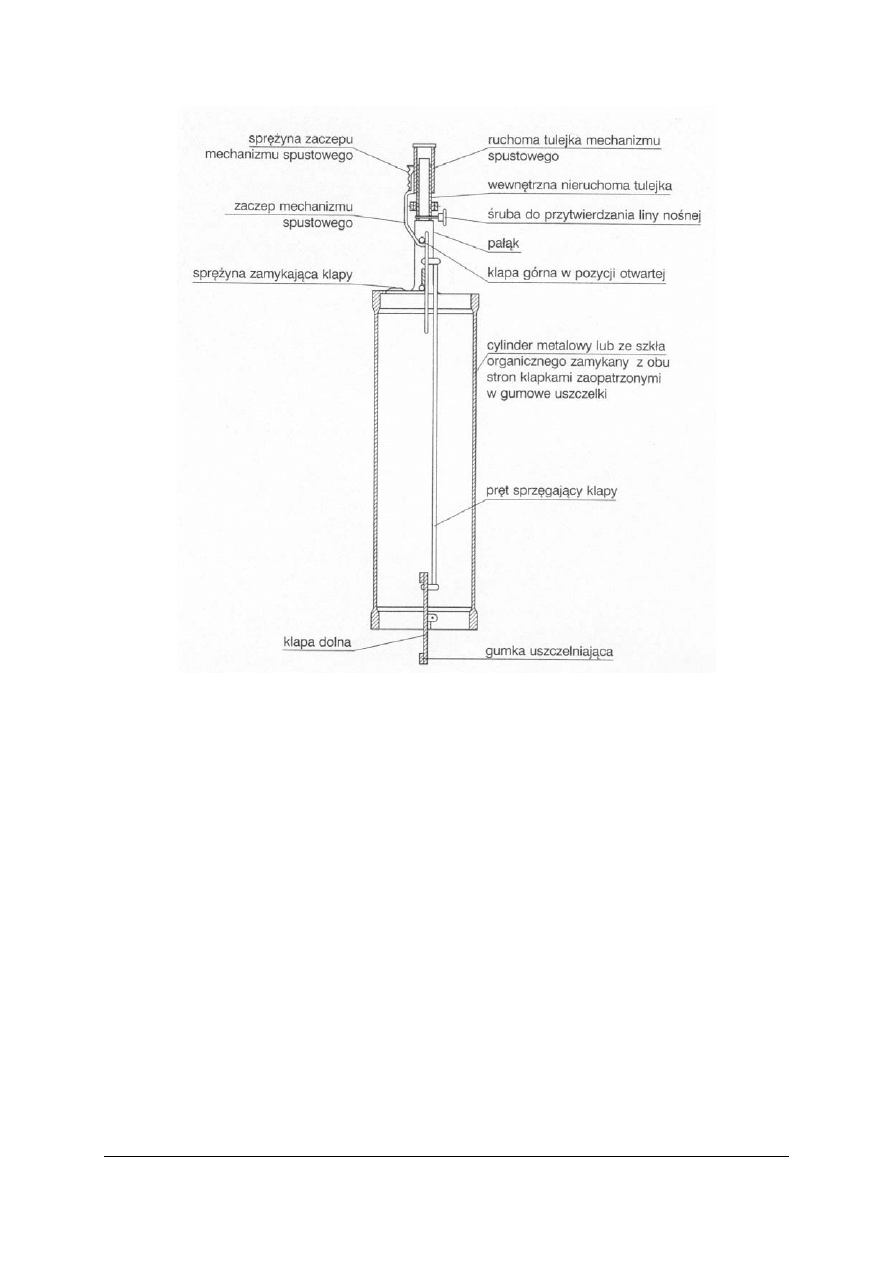
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
Rys. 13. Czerpacz Bernatowicza
Źródło: Lipkowska-Grabowska K., Faron-Lewandowska E.: Pracownia chemiczna. Analiza wody i ścieków.
WSiP, Warszawa 1998
Po zanurzeniu czerpacza Bernatowicza na żądaną głębokość, za pomocą mechanizmu
sprężynowego zamykany jest cylinder.
Czerpacz jest używany do pobierania wody i ścieków z dowolnej głębokości.
− urządzenia automatyczne – przy ich stosowaniu należy postępować zawsze zgodnie
z instrukcją.
Utrwalanie i przechowywanie próbek
jest bardzo ważne z racji tego, że nie zawsze
pobrana próbka jest natychmiast analizowana. Należy ją zabezpieczyć wówczas na czas
transportu, aby pobrana próbka nie zmieniła swojego składu chemicznego.
Przyczyny zmiany składu próbek:
− utlenianie niektórych związków chemicznych tlenem rozpuszczonym lub tlenem
zawartym w powietrzu atmosferycznym.
− dwutlenek węgla znajdujący się w powietrzu, absorbując się w próbce może wpływać na
zmianę pH, przewodnictwa, zawartości wytrącanych węglanów, mogą też wytrącić się
niektóre związki, np. węglan wapnia, wodorotlenki metali, fosforan (V)magnezu.
− adsorpcja metali i niektórych związków organicznych w postaci koloidalnej na
cząsteczkach zawiesiny i ściankach naczynia.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
− występujące w pobranej próbce organizmy podczas swoich procesów życiowych
pobierają wybrane substancje jako pożywienie, wydzielając przy tym produkty przemiany
materii.
− Zmiany w składzie próbki zależą od jej:
− składu chemicznego,
− składu biologicznego,
− temperatury,
− działania światła,
− rodzaju materiału, z którego wykonane jest naczynie,
− czasu, który musi upłynąć do wykonania badań.
− Aby ograniczyć zmiany składu pobieranych do badania próbek należy:
− naczynia napełniać do pełna (ogranicza to wstrząsanie próbki podczas transportu),
− podczas pobierania próbek do oznaczania zawartości tlenu rozpuszczonego składników
lotnych należy pamiętać o tym, aby pod korkiem nie pozostawały pęcherzyki powietrza,
− gdy próbka jest przeznaczona do oznaczeń substancji w niej rozpuszczonych należy
bezpośrednio po pobraniu ją przesączyć przez uprzednio przemyty i odpowiednio dobrany
sączek bibułowy.
− podczas transportu wskazane jest aby próbki były schłodzone do temperatury 2-50C i nie
były wystawione na działanie światła,
− stosuje się również zamrażanie próbek, które wydłuża czas przechowywania. Do tego
celu używa się naczyń polietylenowych.
− można zapobiegać zmianom jakości próbek utrwalając je za pomocą niewielkiej ilości
odczynników chemicznych. Odczynniki należy wprowadzić bezpośrednio do naczynia
przed pobraniem próbki lub do pobranej próbki bezpośrednio po jej pobraniu.
Postępowanie zgodnie z zasadami pobierania, utrwalania i przechowywania próbek wody
i ścieków daje możliwość uniknięcia błędów wpływających na zmianę składu próbek, co
z kolei umożliwia uzyskanie poprawnych wyników oznaczeń wybranych wskaźników.
Tabela 3. Sposoby utrwalania próbek wody i ścieków, miejsce analizy, dopuszczalny czas przechowywania próbki
Oznaczany
parametr
Rodzaj naczynia
do
przechowywania
próbki
Sposób
utrwalania próbki
Miejsce
wykonania
analizy
Dopuszczalny
czas
przechowywania
próbki
Azot amonowy,
azot
organiczny,
azot ogólny
Kjeldahla,
azot
albuminowy
szklane lub
polietylenowe
- dodanie 2 cm
3
chloroformu do
1 dm
3
próbki (dla próbek
przechowywanych w szklanych
naczyniach)
- zakwaszenie do pH < 2
kwasem azotowym (VI)
- schłodzenie do temp. 2-5
o
C
laboratorium 48
h
48 h
6 h
Azot
azotanowy (V)
szklane lub
polietylenowe
- dodanie 2 cm
3
chloroformu do
1 dm
3
(dla próbek
przechowywanych w szklanych
naczyniach)
- schłodzenie do temp. 2-5
o
C
laboratorium 48
h
24 h
Azot
azotanowy (III)
(azotynowy)
szklane lub
polietylenowe
- dodanie 2 cm
3
chloroformu do
1 dm
3
próbki (dla próbek
przechowywanych w szklanych
naczyniach)
- schłodzenie do temp. 2-5
o
C
laboratorium 48h
4h
Barwa
szklane lub
W miejscu
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
Oznaczany
parametr
Rodzaj naczynia
do
przechowywania
próbki
Sposób
utrwalania próbki
Miejsce
wykonania
analizy
Dopuszczalny
czas
przechowywania
próbki
polietylenowe
-schłodzenie do temp. 2-5
o
C
pobrania próbki,
laboratorium
24 h
BZT
szklane -schłodzenie do temp. 2-5
o
C
przechowywanie w ciemności
laboratorium 24
h
ChZT
szklane
-zakwaszenie do pH < 2
-schłodzenie do temp. 2-5
o
C
laboratorium 24h
Chlor pozostały szklane _
w
miejscu
pobrania próbki
_
Chlorki
szklane lub
polietylenowe
schłodzenie do temp. 2-5
o
C laboratorium
96
h
Chrom (VI),
Chrom (III)
(zawartość
chromu (III)
oblicza się z
różnicy stężeń
Cr
og.
i Cr (VI))
szklane lub
polietylenowe
- dodanie 5 cm
3
roztworu
buforowego według PN-87/C-
04570/09 i jeżeli pH różni się od
7,5-8, dodanie potrzebnej ilości
kwasu fosforowego (V) lub
wodorotlenku sodu,
schłodzenie do temp. 2-5
o
C
laboratorium 2
h
Dwutlenek
węgla
szklane lub
polietylenowe
- schłodzenie do temp. 2-5
o
C w
miejscu
pobrania próbki,
laboratorium
4 h
Fosforany,
ortofosforany
i polifosforany
rozpuszczone
szklane lub
polietylenowe
- sączenie w miejscu pobrania
próbki
- sączenie w miejscu pobrania
próbki i dodanie 2 cm
3
chloroformu do 1 dm
3
przesączu;
schłodzenie do 2-5
o
C
laboratorium 4
h
48 h
Fosforany
ogólne
szklane lub
polietylenowe
- zakwaszenie do pH < 2
kwasem siarkowym(VI)
- schłodzenie do temp. 2-5
o
C
w miejscu
pobrania próbki,
laboratorium
4 h
48 h
Kwasowość
(analizy
powinny być
wykonywane
w miejscu
pobrania)
szklane lub
polietylenowe
- schłodzenie do temp. 2-5
o
C laboratorium
4
h
Krzemionka
zdysocjowana
i ogólna
polietylenowe -
schłodzenie do temp. 2-5
o
C laboratorium
24
h
Magnez
szklane lub
polietylenowe
- zakwaszenie do pH < 2
laboratorium 4
h
48 h
Mangan
rozpuszczony
szklane lub
polietylenowe
- sączenie w miejscu pobrania
próbki, zakwaszenie przesączu
do pH < 2,
- schłodzenie do temp. 2-5
o
C
laboratorium 48
h
Mangan ogólny szklane lub
polietylenowe
- zakwaszenie do pH < 2,
schłodzenie do temp. 2-5
o
C
laboratorium 48
h
Mętność
(analizy
powinny być
wykonane
w miejscu
pobrania próbki)
szklane _
laboratorium
4
h
Ołów
rozpuszczony
szklane lub
polietylenowe
- sączenie w miejscu pobrania
próbki, zakwaszenie przesączu
do pH < 2 kwasem siarkowym
laboratorium 48
h
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
Oznaczany
parametr
Rodzaj naczynia
do
przechowywania
próbki
Sposób
utrwalania próbki
Miejsce
wykonania
analizy
Dopuszczalny
czas
przechowywania
próbki
(VI)
Ołów ogólny
szklane lub
polietylenowe
- zakwaszenie do pH < 2
kwasem siarkowym (VI)
laboratorium 48
h
pH
szklane lub
polietylenowe
- schłodzenie do temp. 2-5
o
C w
miejscu
pobrania próbki
4 h
Potas
szklane
- zakwaszenie do pH < 2,
schłodzenie do temp 2-5
o
C
laboratorium 48
h
Przezroczystość szklane lub
polietylenowe
_ laboratorium
24
h
Siarczany (VI) szklane lub
polietylenowe
- dodanie do 2-3 cm
3
formaldehydu do 1 dm
3
próbki
laboratorium 48
h
Siarczany (IV) szklane lub
polietylenowe
- korekcja do ph > 11
laboratorium
24 h
Tlen
rozpuszczony
szklane -
związanie tlenu w miejscu
pobrania próbki – opis
w metodzie oznaczania,
przechowywanie w ciemności
laboratorium 4
doby
Twardość
szklane lub
polietylenowe
- zakwaszenie do
pH < 2, schłodzenie do temp.
2-5
o
C; nie stosować kwasu
siarkowego (VI)
laboratorium 4
h
48 h
Wapń
szklane lub
polietylenowe
- zakwaszenie do pH < 2,
schłodzenie do tepm. 2-5
o
C;
nie stosować kwasu siarkowego
(VI)
laboratorium 48
h
Zapach, smak
i posmak
szklane -
schłodzenie do temp. 2-5
o
C laboratorium
12
h
Zasadowość
(analizy
powinny być
wykonane
w miejscu
pobrania próbki)
szklane lub
polietylenowe
- schłodzenie do temp. 2-5
o
C
4
h
Zawiesiny
szklane lub
polietylenowe
- dodanie 2 cm
3
chloroformu do
1 dm
3
próbki, schłodzenie do
temp. 2-5
o
C
laboratorium 24
h
Żelazo
rozpuszczone
szklane lub
polietylenowe
- sączenie w miejscu pobrania
próbki, zakwaszenie do pH < 2
laboratorium 48
h
Żelazo ogólne
szklane lub
polietylenowe
- zakwaszenie do pH < 2
laboratorium
48 h
Źródło: Lipkowska-Grabowska K., Faron-Lewandowska E.: Pracownia chemiczna. Analiza wody i ścieków.
WSiP, Warszawa 1988).
Uwaga!
Podczas pobierania próbek wody należy pamiętać o tym, że:
1. Skóra może znaleźć się w bezpośrednim kontakcie z wodą, powinna być ochraniana.
Trzeba koniecznie włożyć gumowe rękawiczki i kalosze. Użycie wysięgnika zmniejszy
kontakt z rzeką czy innym ciekiem wodnym.
2. Przy badaniu wód w pobliżu oczyszczalni ścieków, zwłaszcza przy silnych wiatrach
wiejących od strony oczyszczalni, powinno się używać masek ochraniających przed
drobnymi kroplami cieczy rozproszonymi w powietrzu, które mogą dostać się do płuc.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
3. Należy skontaktować się z najbliższą Terenową Stacją Sanitarno- Epidemiologiczną:
Działem Higieny Komunalnej w celu otrzymania informacji o specyficznych
zagrożeniach występujących w lokalnych rzekach. Pewne odcinki rzeki lub przyległe do
niej tereny mogą zawierać niebezpieczne, toksyczne zanieczyszczenia. W razie
wątpliwości skonsultować się z lokalnymi władzami ochrony środowiska.
4. Należy unikać pobierania próbek z ruchliwych mostów, albo robić to wyłącznie pod
nadzorem, z zachowaniem szczególnej ostrożności. Unikać miejsc o stromych schodach.
4.8.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1) Jakie są rodzaje próbek złożonych?
2) W jaki sposób otrzymywana jest próbka ogólna średnia?
3) Jaka próbka jest reprezentatywna dla określonego przedziału czasu?
4) W jakim celu pobiera się próbki proporcjonalne ogólne okresowe?
5) Kiedy próbki wody pobiera się do naczyń szklanych, a kiedy do wykonanych z tworzyw
sztucznych?
6) W jakich miejscach należy pobrać próbki wody powierzchniowej, aby były one
reprezentatywne?
7) Z jakich miejsc pobiera się próbki wody podziemnej?
8) Jakie znasz przyczyny zmiany składu próbki podczas kilku pierwszych godzin od
pobrania?
4.8.3. Ćwiczenia
Ćwiczenie 1
Zaplanuj pobór próbki wody.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) określić całą procedurę, od chwili wyboru rodzaju próbki, pobrania, transportu aż do
momentu oznaczenia,
2) scharakteryzować każdy etap.
Wyposażenie stanowiska pracy
− teksty źródłowe,
− podręcznik ucznia,
− komputer z dostępem do Internetu.
Ćwiczenie 2
Ustal sposób zabezpieczenia próbki wody pobranej z jeziora, w celu stwierdzenia
przydatności wody do kąpieli.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wyszukać w różnych dostępnych materiałach źródłowych informacje dotyczące zakresu
badań próbki wody z jeziora,
2) pomyśleć, jakim zmianom może ulec próbka wody podczas transportu do laboratorium,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
3) ustalić sposób zabezpieczenia próbki,
4) zdecydować, czy próbkę należy utrwalić chemicznie czy może zamrozić.
Wyposażenie stanowiska pracy
− poradnik dla ucznia,
− komputer z dostępem do Internetu.
4.8.4. Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) zdefiniować pojęcie próbka złożona?
2) zdefiniować pojęcie próbka ogólna średnia?
3) zdefiniować pojęcie próbka proporcjonalna?
4) wymienić
rodzaje
próbek?
5) scharakteryzować naczynia i przyrządy do pobierania próbek?
6) wymienić odczynniki chemiczne niezbędne
do utrwalania próbek?
7) określić cel zabezpieczania próbek wody?
8) określić miejsca lokalizacji punktów poboru próbek wody?
9) oznaczyć odpowiednio pobraną próbkę?
10) opisać sposób pobierania próbek z wody
powierzchniowej płynącej i stojącej?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
4.9. Analizy fizykochemiczne wody powierzchniowej i podziemnej
4.9.1. Materiał nauczania
Zakres analizy fizykochemicznej wody zależy od celu, jaki poprzez badanie wody
zamierzamy zrealizować. Inny będzie w przypadku badania wód powierzchniowych pod
kątem ich gospodarczego wykorzystania, inny gdy zadaniem będzie kontrola prawidłowości
przebiegu procesu uzdatniania wody.
W przypadku badań fizykochemicznych wód podziemnych analizy można podzielić na
trzy grupy:
− hydrogeochemiczne (pełne, ogólne i wskaźnikowe – wykonuje się je w celu np. ustalenia
genezy wód, określeniem związków między chemizmem wód a budową geologiczną)
− techniczne (wykonywane wówczas, gdy celem jest określenie zasobów i jakości wód pod
kątem ich gospodarczego wykorzystania, np. komunalnego, przemysłowego),
− balneologiczne (wykonywane przy badaniu wód mineralnych i ich eksploatacji dla celów
leczniczych).
Do fizycznych wskaźników jakości wody należą:
− zapach,
− barwa,
− mętność, przeźroczystość,
− temperatura,
− przewodność właściwa.
Chemiczne wskaźniki jakości wody to utlenialność, zawartość gazów rozpuszczonych ,
kwasowość, zasadowość, pH, zawartość różnych anionów, kationów metali w szczególności
wapnia i magnezu, które powodują twardość wody oraz żelaza i manganu występujących
często w nadmiernych ilościach w wodach podziemnych.
Przewodność właściwa
roztworów wodnych zależy od rodzaju rozpuszczonych
substancji, ich stężenia i temperatury.
Przewodność właściwa wód naturalnych świadczy o zanieczyszczeniu ich związkami
mineralnymi. Przewodność wody wynikająca z obecności zanieczyszczeń organicznych jest
zwykle niewielka.
Pomiar przewodności właściwej wody może być wykorzystany przy określeniu
przybliżonej wartości suchej pozostałości dla wód nieznacznie zanieczyszczonych. W tym
celu należy wynik pomiaru przewodności właściwej wody pomnożyć przez współczynnik
uprzednio wyznaczony doświadczalnie, którego wartości wahają się w granicach 0,55 – 0,9.
Pomiar przewodności właściwej może również służyć do określenia przybliżonej sumy
kationów i anionów w wodzie badanej. Przewodność właściwą wyrażoną w µ
.
S
.
cm
-1
należy
pomnożyć przez 0,01. Wynik otrzymujemy w mval/dm
3
.
Przewodność wody X oblicza się według wzoru:
X = k
.
z
.
f [µ
.
S
.
cm
-1
] , gdzie;
k – stała konduktometryczna naczynka
z – zmierzona przewodność próbki [µ
.
S
.
cm
-1
]
f – współczynnik temperaturowy
Jeśli aparat jest wyskalowany w jednostkach oporności to wówczas przewodność oblicza
się według wzoru:

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
X =
R
k
f [µ
.
S
.
cm
-1
], gdzie;
k - stała konduktometryczna naczynka
R – zmierzona oporność próbki [µ Ω
.
cm
-1
]
f – współczynnik temperaturowy
Wyznaczenie stałej konduktometrycznej k można dokonać przez pomiar przewodności
wzorcowego roztworu KCl, a następnie wyliczyć z następującej zależności:
k =
2
1
z
z
, gdzie;
z
1
– teoretyczna przewodność wzorcowego roztworu KCl µ
.
S
.
cm
-1
z
2
- zmierzona przewodność wzorcowego roztworu KCl µ
.
S
.
cm
-1
Jeśli aparat pomiarowy wyskalowany jest w jednostkach oporności, stałą
konduktometryczną k oblicza się ze wzoru:
k = R
1
R
2
, gdzie:
R
1
– teoretyczna oporność wzorcowego roztworu KCl [µ Ω
.
cm
-1
]
R
2
– zmierzona oporność wzorcowego roztworu [µ Ω
.
cm
-1
]
Kwasowość wód naturalnych i ścieków
oznacza ich zdolność do zobojętniania
dodawanych do nich silnych zasad lub węglanów potasowców i wapniowców.
Kwasowość nadają wodzie obecne w niej słabo zjonizowane kwasy mineralne (np. węglowy),
organiczne (taninowy, huminowy, bulwowy), a także produkty hydrolizy niektórych soli
mocnych kwasów i słabych zasad (np. Al
2
(SO
4
)
3
, Fe
2
(SO
4
)
3
.
W zakresie odczynu od 4,5 do 8,3 pH w wodach mogą współistnieć kwasowość
i zasadowość. Stan taki wynika z faktu jednoczesnej obecności w wodzie jonów HCO
3
-
i wolnego dwutlenku węgla. Rozróżnia się pojęcia: kwasowość ogólna i kwasowość
mineralna
.
Kwasowość ogólną (Kw
og
)
nadają obecne w wodzie lub w ściekach słabe i mocne kwasy
mineralne, kwasy organiczne, produkty hydrolizy soli mocnych kwasów i słabych zasad.
Kwasowość mineralna (Kw
m
)
pochodzi wyłącznie od mocnych kwasów mineralnych,
obecnych w zanieczyszczonych wodach.
Woda do picia nie może wskazywać kwasowości mineralnej (niskie pH) oraz kwasowości
wywołanej produktami hydrolizy soli.
Kwasowość ogólną wody, ścieków oblicza się w mmol/dm
3
według wzoru:
Kw
og
=
V
V
p
⋅
50
Kwasowość mineralną wody, ścieków oblicza się w mmol/dm
3
według wzoru:
Kw
m
=
V
V
m
⋅
50
V
p
– ilość roztworu 0,05-molowego NaOH zużyta do miareczkowania badanej próbki wody
wobec fenoloftaleiny (cm
3
)

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
V
m
– ilość roztworu 0,05-molowego NaOH zużyta do miareczkowania badanej próbki wody
wobec metyloranzu (cm
3
)
V – objętość próbki wody użyta do oznaczania (cm
3
).
Zasadowość wód naturalnych
określa ich zdolność do zobojętniania kwasów do
określonej wartości pH. Zdolność tę nadają wodom naturalnym obecne w nich
wodorowęglany i węglany – głównie metali alkalicznych (wapnia i magnezu), a w przypadku
wód o pH powyżej 8,3 także wodorotlenki.
W wodach zanieczyszczonych ściekami przemysłowymi (pH powyżej 9,0) mogą
występować także mocne zasady, ulegające dysocjacji z wytworzeniem jonów OH
-
.
W zależności od zakresu wartości pH wody lub ścieków, rozróżnia się zasadowość
wobec fenoloftaleiny
(Z
f
) i zasadowość ogólną (Z
m
)
Zasadowość Z
m
Zasadowość Z
f
pH 4,6 8,3
Zasadowość ogólna określa sumę wszystkich związków chemicznych zawartych
w wodzie, które reagują zasadowo wobec oranżu metylowego do wartości pH = 4,5.
Zasadowość ogólną wody oblicza się w mmol/dm
3
według wzoru:
Z
m
=
V
a
1000
1
,
0
⋅
Zasadowość wody wobec fenoloftaleiny obliczyć w mmol/dm
3
według wzoru
Z
f
=
V
b 1000
1
,
0
⋅
a – ilość 0,1 molowego roztworu kwasu solnego zużyta do miareczkowania próbki badanej
wody wobec metyloranżu (cm
3
)
b – ilość 0,1 molowego roztworu kwasu solnego zużyta do zmiareczkowania próbki
badanej wody wobec fenoloftaleiny (cm
3
)
0,1 – współczynnik stężenia 1 cm
3
0,1 molowego roztworu kwasu odpowiada 0,1 mmola
zasadowości
V – objętość próbki wody lub ścieków użytej do oznaczania (cm
3
).
4.9.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczenia.
1) Jaki jest zakres analizy fizycznej wody podziemnej?
2) Jaki jest zakres analizy fizycznej wody powierzchniowej?
3) Jakie są fizyczne wskaźniki badania wód.
4) Co to jest przewodność właściwa?
5) Jak można zbadać kwasowość wód?
6) Jak można zbadać zasadowość wód?
4.9.3. Ćwiczenia
Ćwiczenie 1
Oznacz przewodność właściwą.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) uruchomić aparat zgodnie z fabryczną instrukcją obsługi,
2) przemyć naczynko konduktometryczne kilkoma porcjami badanej próbki,
3) napełnić naczynko próbką bez pozostawiania pęcherzyków powietrza na powierzchni
elektrod i zmierzyć przewodność zgodnie z instrukcją producenta aparatu,
4) równolegle wykonać pomiar temperatury badanej próbki,
5) obliczyć przewodność właściwą.
Wyposażenie stanowiska pracy
− konduktometr
− naczynko konduktometryczne lub czujnik zanurzeniowy z elektrodami.
Ćwiczenie 2
Oznacz kwasowość ogólną i mineralną metodą miareczkową wobec wskaźników.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) odmierzyć 100 cm
3
badanej wody do butelki o pojemności ok. 250 cm
3
z doszlifowanym
korkiem,
2) dodać 10 kropli roztworu fenoloftaleiny i kilka kropli roztworu soli Seignetta,
3) wymieszać łagodnie próbkę i niezwłocznie miareczkować roztworem wodorotlenku
sodowego do momentu uzyskania lekko różowego zabarwienia, utrzymującego się co
najmniej przez 3 minuty (wskazane jest mieszanie miareczkowanej próbki w butelce
zamkniętej doszlifowanym korkiem, po dodaniu każdej porcji wodorotlenku sodowego,
zużytego przy pierwszym miareczkowaniu, a potem domiareczkować próbkę do momentu
uzyskania zabarwienia jak podano wyżej).
4) obliczyć kwasowość ogólną na podstawie objętości roztworu wodorotlenku sodowego
zużytej do miareczkowania badanej próbki,
5) odmierzyć 100 cm
3
badanej wody (ścieków) do kolby stożkowej o pojemności ok. 300
cm
3
,
6) dodać 3 krople roztworu metyloranżu i miareczkować próbkę roztworem wodorotlenku
sodowego do uzyskania zmiany zabarwienia badanego roztworu z czerwonego na
żółtopomarańczowe,
7) obliczyć kwasowość mineralną na podstawie objętości roztworu wodorotlenku sodowego
zużytego do miareczkowania badanej próbki.
Wyposażenie stanowiska pracy
− wodorotlenek sodowy cz.d.a., roztwór 0,05–molowy wolny od węglanów
− winian sodowo-potasowy (sól Seignetta) cz.d.a., roztwór 33% (KOOC)
.
(CHOH)
2
.
(NaOOC), zobojętniony roztworem wodorotlenku sodowego
− fenoloftaleina – wskaźnik, roztwór alkoholowy 1%, zobojętniony roztworem
wodorotlenku sodowego
− oranż metylowy – wskaźnik, roztwór wodny 0,1%.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
47
Ćwiczenie 3
Oznacz zasadowość metodą miareczkowania wobec wskaźników.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) odmierzyć pipetą 100 cm
3
dobrze wymieszanej, klarownej badanej wody (lub klarownych
bezbarwnych ścieków) do kolby stożkowej o pojemności 250 cm
3
,
2) dodać 2 krople oranżu metylowego i miareczkować roztworem kwasu solnego do
momentu uzyskania zmiany zabarwienia badanej próbki z żółtego na żółtoróżowe,
3) obliczyć zasadowość ogólną na podstawie objętości roztworu kwasu solnego użytego do
miareczkowania badanej próbki,
4) odmierzyć pipetą 100 cm
3
klarownej badanej wody (lub klarownych bezbarwnych
ścieków) do kolby stożkowej, jak wyżej,
5) dodać cztery krople fenoloftaleiny i miareczkować roztworem kwasu solnego do
momentu odbarwienia się roztworu,
6) obliczyć zasadowość wobec fenoloftaleiny na podstawie objętości kwasu solnego
zużytego do miareczkowania badanej próbki.
Wyposażenie stanowiska pracy
− kwas solny cz.d.a., roztwór 0,1 mol/dm
3
− fenoloftaleina – wskaźnik, roztwór alkoholowy 1%, zobojętniony roztworem
wodorotlenku sodowego
− oranż metylowy – wskaźnik, roztwór wodny 0,1%.
4.9.4. Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) zdefiniować przewodność właściwą?
2) wymienić fizyczne wskaźniki badania wód?
3) scharakteryzować zakres analizy fizycznej
wody podziemnej?
4) omówić zakres analizy fizycznej wody
powierzchniowej?
5) wyjaśnić jak można zbadać kwasowość wód?
6) wyjaśnić jak można zbadać zasadowość wód?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
48
4.10. Wskaźniki biologiczne i mikrobiologiczne wody
4.10.1. Materiał nauczania
Biologiczna ocena jakości wód opiera się na założeniu, że istnieją ścisłe powiązania
między organizmami żywymi, a ich środowiskiem życia.
Praktyczną metodą opisowo-analityczną jest system saprobów, który polega na spisie
organizmów wskaźnikowych (biowskaźników) i określenia na tej podstawie czystości wód.
Dobrymi wskaźnikami biologicznymi są glony i denna makrofauna bezkręgowców.
Glony – Algae
Analizy ilościowej i jakościowej glonów dokonuje się na podstawie obserwacji
przeprowadzanych za pomocą mikroskopu. Posługując się listą organizmów wskaźnikowych
można określić sferę zanieczyszczenia zbiornika wodnego.
Strefa:
− polisaprobowa
– wybitnie zanieczyszczone – p
− alfamezosaprobowa – silnie zanieczyszczone – a
− betamezosaprobowa
– słabo zanieczyszczone – b
− oligosaprobowa
– czyste
– o
Rys. 14. Wskaźnikowe organizmy zanieczyszczenia wód: glony wód czystych
Źródło: Podręcznik do wykonywania badań jakości wód. Narodowa Fundacja Ochrony Środowiska, Warszawa
1992
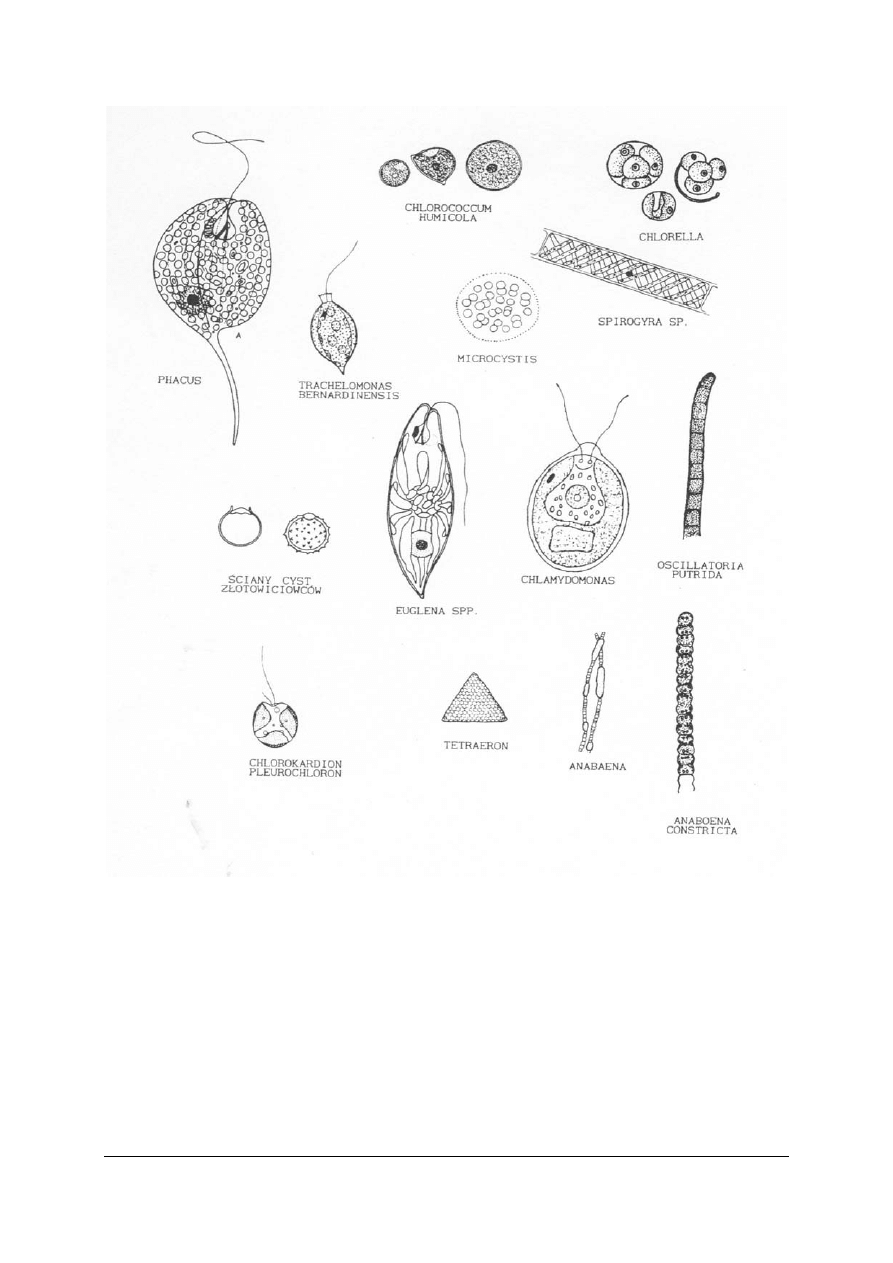
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
49
Rys. 15. Wskaźnikowe organizmy zanieczyszczenia wód: glony wód zanieczyszczonych.
Źródło: Podręcznik do wykonywania badań jakości wód. Narodowa Fundacja Ochrony Środowiska,
Warszawa 1992
Wskaźnikami czystości wód są również bezkręgowce bentosowe, których obserwacja
wzdłuż biegu rzeki umożliwia ocenę zmian naturalnych i tych, które wynikają
z przemieszczania się organizmów wodnych.
Na podstawie odporności bezkręgowców na zanieczyszczenia można ustalić tzw.
współczynnik odporności
. Organizmy są pobierane i identyfikowane przez porównanie
z rysunkiem 14 i przy użyciu klucza. Każda z trzech grup ma przyporządkowaną pewną
wartość współczynnika (najwyższa grupa najmniej odporna).
Stan jakości wody
oblicza się mnożąc liczbę gatunków organizmów w każdej grupie
przez wartość współczynnika i dodając do siebie trzy liczby wynikowe.
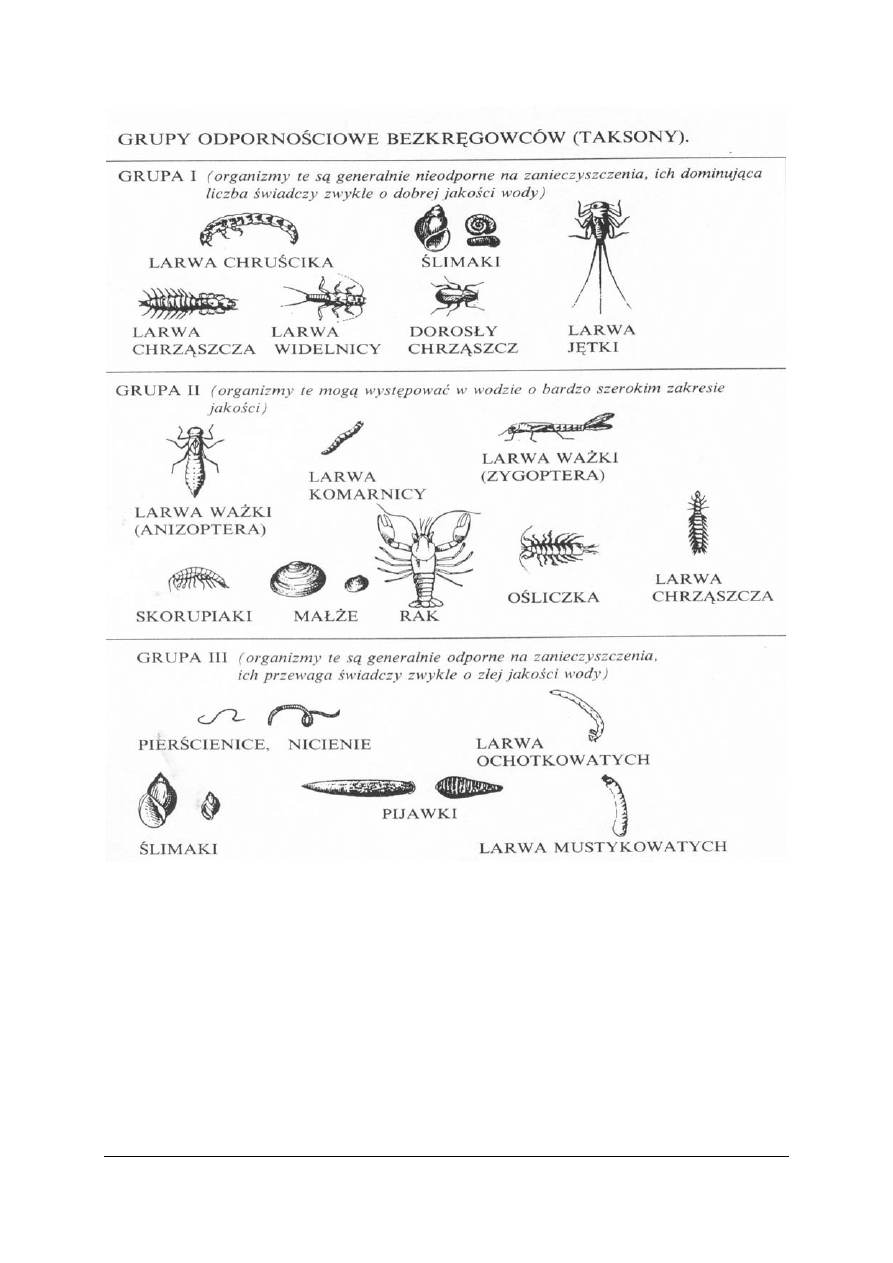
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
50
Rys. 16. Tabela grup odpornościowych
Źródło: Podręcznik do wykonywania badań jakości wód. Narodowa Fundacja Ochrony Środowiska,
Warszawa 1992

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
51
Tabela 4. Karta oceny makroorganizmów
Przybliżona liczba
(kod literowy)
A = 1 do 10
B = 10 do 49
C = 50 do 99
D = 100 i więcej
Grupa I TAXA
Larwy chruścika
Larwa muchówki
Larwy jętki
Larwy widelnicy
Larwy chrząszcza
Grupa II TAXA
Larwy ważki Zygoptera
Larwy ważki Anizoptera
Larwy komarnicy
Rak
Grupa III TAXA
Larwa meszki (mustykowatych)
Pierścienice, nicienie
Larwy ochotkowatych
Pijawki
Ślimaki
Liczba TAXA x wartość
współczynnika -3.
Liczba TAXA x wartość
współczynnika -2.
Liczba TAXA x wartość
współczynnika -1.
Łączna wartość współczynnika
Znakomita > 22
Względna 11 - 16
Dobra 17 – 22
Zła < 11
Źródło: Podręcznik do wykonywania badań jakości wód. Narodowa Fundacja Ochrony Środowiska,
Warszawa 1992
4.10. 2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1) Co to są biowskaźniki?
2) Co to jest współczynnik odporności?
3) Jak można ocenić stan czystości wody na podstawie współczynnika odporności?
4) Co zaliczysz do bezkręgowców bentosowych?
5) Jakie grupy glonów należą do biowskaźników?
6) Dlaczego glony są wskaźnikami czystości wód?
4.10.3. Ćwiczenia
Ćwiczenie 1
Oblicz współczynnik odporności.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wyliczyć współczynnik odporności na podstawie zapisu „W badanej próbce wody
zidentyfikowano: chruściki, widelnice, jętki, ważki, raki, mięczaki, mustykowate,
ochotkowate”,
2) ustalić stan jakości wody na podstawie tabeli klasyfikacji grup odpornościowych oraz
karty oceny mikroorganizmów.
Wyposażenie stanowiska pracy
− karta oceny mikroorganizmów
− tabela grup odpornościowych
− notes, ołówek

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
52
Ćwiczenie 2
Oceń stan czystości wód na podstawie współczynnika odporności.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wybrać obszar badań na powierzchni 1x1m,
2) zastosować niewód do pobrania próbki,
3) pobrać po trzy próbki w każdym miejscu dla uzyskania reprezentatywnej liczby
organizmów,
4) umieścić próbki w naczyniach zawierających 70% roztwór alkoholu i zachować do
późniejszego oznaczenia,
5) zapisać obecność każdego oznaczonego gatunku organizmu oraz sklasyfikować go
według grupy odporności na zanieczyszczenia (rys.15),
6) obliczyć współczynnik odporności.
Wyposażenie pracy
− karta oceny mikroorganizmów,
− tabela grup odpornościowych,
− notes, ołówek,
− 70% roztwór alkoholu.
4.10.4. Sprawdzian postępów
Czy potrafisz?
TAK
NIE
1) zdefiniować biowskaźniki?
2) zdefiniować współczynnik odporności?
3) wymienić bezkręgowce bentosowe?
4) wymienić grupy glonów biowskaźników?
5) pobrać próbkę z organizmami wskaźnikowymi?
6) obliczyć współczynnik odporności?
7) ocenić stan czystości wody na podstawie
współczynnika odporności?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
53
4.11. Źródła i rodzaje zanieczyszczeń wody
4.11.1. Materiał nauczania
Źródła zanieczyszczenia wody lub inaczej „ogniska zanieczyszczenia” można podzielić
na: obszarowe, punktowe i liniowe. Termin „ognisko zanieczyszczenia” jest bardziej
odpowiedni dla obiektów skoncentrowanych, o silnym oddziaływaniu na środowisko, jak
składowiska odpadów, zbiorniki paliw, podczas gdy określenie „źródło zanieczyszczenia" ma
wydźwięk bardziej uniwersalny i odnosić się może do obiektów o różnym charakterze.
Źródła obszarowe
Dostarczają zanieczyszczeń na dużym obszarze. Przykładem obszarowych źródeł
zanieczyszczenia są tereny intensywnego rolnictwa, które są dostawcą do rzek
spłukiwanych nawozów i środków ochrony roślin, wysypiska i składowiska odpadów
oraz obszary zurbanizowane i kwaśne deszcze.
Źródła punktowe
Dostawa zanieczyszczeń do środowiska dokonuje się w jednym miejscu (punkcie).
Przykładem są zrzuty ścieków oraz wycieki z różnego rodzaju zbiorników i
przewodów.
Źródła liniowe
Zanieczyszczają środowisko wzdłuż pewnej linii. Przykładem mogą być drogi, z
których następuje spływ zanieczyszczeń związanych z transportem (kolej oraz
kanały).
Klasyfikacja zanieczyszczeń
Klasyfikację zanieczyszczeń w wodach można przeprowadzić z różnych punktów
widzenia.
Ze względu na sposób usuwania zanieczyszczeń można je podzielić na trzy grupy:
− zanieczyszczenia zawieszone i pływające usuwane w procesach fizycznych
sedymentacji lub filtracji,
− zanieczyszczenia koloidalne o wielkości cząstek poniżej 100 µm usuwane w
specjalnych procesach, np. ultrafiltracji, koagulacji,
− zanieczyszczenia rozpuszczone, występujące w formie roztworu wodnego, możliwe do
usunięcia metodami fizykochemicznymi lub chemicznymi.
Również na trzy grupy można podzielić zanieczyszczenia z punktu widzenia ich wpływu
na zdrowie:
− związki trujące i szkodliwe dla zdrowia,
− związki nieszkodliwe dla zdrowia, które w zależności od stężenia mogą jednocześnie
wskazywać na zanieczyszczenie wody,
− związki pożądane dla zdrowia.
Stosowany jest także podział według kryterium określającego pochodzenie
zanieczyszczeń:
− zanieczyszczenie biologiczne i bakteriologiczne,
− zanieczyszczenie fizyczne,
− zanieczyszczenie chemiczne,
− zanieczyszczenie izotopami pierwiastków promieniotwórczych.
Zanieczyszczenia bakteriologiczne i biologiczne
wód zawsze występują w wodach
powierzchniowych. Większość bakterii występujących w wodach jest nieszkodliwa dla
człowieka. Obok nich występują jednak bakterie chorobotwórcze. Bakterie tego typu żyją w
wodzie przeważnie przez kilka dni, ale niektóre z nich w sprzyjających warunkach dożywają
nawet do kilku miesięcy. Używanie zakażonej wody grozi epidemią takich chorób przewodu
pokarmowego, jak: dur brzuszny, czerwonka, cholera itp.
Dlatego ważną oceną, jakiej poddawana jest woda do celów pitnych, gospodarczych czy
kąpieliskowych jest ocena sanitarna.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
54
Dokonując oceny sanitarnej określa się tzw. miano coli, czyli najmniejszą ilość wody
wyrażoną w cm
3
, w której stwierdzono obecność jednej bakterii grupy coli, np. pałeczki
okrężnicy - Escherichia coli, która żyje w jelicie cienkim człowieka, a gdy występuje
w wodzie, zawsze powoduje podejrzenie o jej zakażenie bakteriami chorobotwórczymi.
Według obowiązujących przepisów sanitarnych dla wody pitnej miano coli powinno
wynosić, co najmniej 100. Oznacza to, że dopuszcza się do picia taką wodę, w której w 100
cm
3
wykryto jedną bakterię grupy coli, (lecz ani jednej bakterii grupy coli typu kałowego!).
Stosuje się również określenie wskaźnika będącego odwrotnością miana coli - tzw.
indeksu coli
.
Zanieczyszczenia fizyczne
wody są to substancje stałe pochodzenia organicznego lub
nieorganicznego, nierozpuszczalne w wodzie, które występują w postaci zawiesin
o zróżnicowanej wielkości cząstek lub w postaci znacznie większych elementów pływających
czy porywanych przez wody płynące, głównie cząstki obumarłych zwierząt lub roślin, a także
składniki ścieków lub odpady (wody powierzchniowe), cząstki iłów, glin lub wtrąceń tlenków
żelaza (wody podziemne).
Zanieczyszczenia chemiczne
wody rozpoznawane są jako rozpuszczone w wodzie
substancje pogarszające jej jakość lub niebezpieczne dla środowiska.
Substancjami, nie wpływającymi szkodliwie na zdrowie przy przeciętnie występujących
stężeniach, są związki żelaza i manganu oraz wapnia i magnezu.
Podstawowe zagrożenia dla zdrowia człowieka stanowią metale ciężkie, cyjanki,
substancje powierzchniowo czynne, pestycydy i inne związki występujące w stężeniach
przekraczających dopuszczalne
.
Zanieczyszczenia izotopami
pierwiastków promieniotwórczych mogą wystąpić
w bardzo ograniczonych wypadkach. Stąd też przepisy dotyczące parametrów oceny jakości
wody do picia przewidują możliwość określenia odrębnymi przepisami wartości stężeń
substancji promieniotwórczych w wodzie.
Zalecenia Światowej Organizacji Zdrowia (WHO) wprowadzają dwojakie kryterium oceny:
− łączna dawka promieniowania jonizującego mniejsza od 0,1 mSv*/rok,
− globalna aktywność promieniotwórcza typu alfa mniejsza od 0,1 Bq**/dm³ oraz globalna
aktywność typu beta mniejsza od 0,1 Bq/dm³ (przy założeniu konsumpcji wody 2 l/24 h).
* 1 mSv (milisiwert) = 0,001 Sv (siwerta). W milisiwertach mierzy się dawkę równoważną
promieniowania, czyli wielkość będącą miarą skutków biologicznych wpływu
promieniowania jonizującego na człowieka.
** 1 Bq (bekerel) jest miarą aktywności substancji promieniotwórczych. Odpowiada on
aktywności substancji, w której jedna przemiana jądrowa (rozpad) zachodzi w ciągu jednej
sekundy.
W wodzie mogą znajdować się również mikrozanieczyszczenia dwojakiego rodzaju:
organiczne i nieorganiczne.
Organiczne
(pierwotne, w wodach naturalnych) - wielopierścieniowe węglowodory
aromatyczne (WWA), pestycydy, substancje powierzchniowo czynne (SPC), chlorowane
związki organiczne (ChZO), estry, alkohole, glikole, aminy alifatyczne i aromatyczne, fenole,
metabolity organizmów wodnych i inne.
Nieorganiczne
- przede wszystkim metale ciężkie i radionuklidy.
Do mikrozanieczyszczeń należałoby zaliczyć również te domieszki, które nie
charakteryzują się toksycznością, a cecha ta ujawnia się w wyniku interakcji z innymi
związkami obecnymi lub wprowadzonymi do wody podczas jej uzdatniania. Należą do nich
między innymi związki humusowe i inne prekursory ChZO oraz azotany.
Grupa mikrozanieczyszczeń wtórnych obejmuje wiele związków chloro- i bromo-
organicznych.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
55
4.11.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1) Jakie są źródła zanieczyszczeń wody i jak można je sklasyfikować według wybranego
kryterium?
2) Jaka jest klasyfikacja zanieczyszczenia wód z punktu widzenia zdrowia?
3) Jaka jest charakterystyka zanieczyszczeń bakteriologicznych i biologicznych?
4) Co to jest indeks coli?
5) Jakie znasz zanieczyszczenia fizyczne wody?
6) Jakie znasz zanieczyszczenia chemiczne wody?
7) Jak opisać zanieczyszczenia izotopami?
4.11.3. Ćwiczenia
Ćwiczenie 1
Określ źródła zanieczyszczeń wody.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) zaznaczyć na poniższym schemacie źródła zanieczyszczeń wody,
2) określić ich charakter.
OSIEDLE
S
x
O
Y
FABRYKA
TRASA
SZYBKIEGO
RUCHU
R Z E K A
kanał ściekowy
Schemat 1.
Źródła zanieczyszczeń wody
OCZYSZCZALNIA
ŚCIEKÓW
K
K

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
56
Wyposażenie stanowiska pracy
− karta pracy ze schematem,
− ołówek, gumka.
4.11.4. Sprawdzian postępów
Czy potrafisz?
TAK
NIE
1) zdefiniować mikrozanieczyszczenia?
2) zdefiniować
indeks
coli?
3) wymienić źródła zanieczyszczeń wody?
4) wymienić zanieczyszczenia fizyczne wody?
5) wymienić zanieczyszczenia chemiczne wody?
6) dokonać klasyfikacji zanieczyszczeń wód
według wybranego kryterium?
7) dokonać klasyfikacji zanieczyszczeń wód
z punktu widzenia zdrowia?
8) omówić zanieczyszczenia bakteriologiczne
i biologiczne?
9) scharakteryzować zanieczyszczenia izotopami?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
57
4.12. Ścieki – ich rodzaje i skład
4.12.1. Materiał nauczania
Ścieki
– to wody zużyte, zanieczyszczone, powstające w wyniku działalności życiowej
i produkcyjnej ludzi, a także wody z opadów atmosferycznych, odprowadzane do sieci
kanalizacyjnej.
Wody powierzchniowe mają właściwości samooczyszczania się czyli biodegradacji, ale
tylko do pewnej granicy. Olbrzymia ilość ścieków zrzucana do wód powierzchniowych
powoduje jej przekroczenie i zdolności wody do samooczyszczania maleją, a niekiedy nawet
skład tej wody niewiele się różni od składu ścieków.
Ścieki negatywnie wpływają na warunki życia flory i fauny wodnej, stanowią zagrożenie
epidemiologiczne, zmniejszają wykorzystanie wody do celów wodociągowych,
rekreacyjnych, rolniczych i hodowlanych, a także do celów przemysłowych.
Ścieki mają różnorodny skład fizykochemiczny. Są układem wielofazowym, składającym
się z substancji rozpuszczonych i osadów.
Skład fizykochemiczny i ilość ścieków zależą od wielu czynników:
− stopnia uprzemysłowienia osiedla,
− rodzaju produkcji,
− ilości zużywanej wody,
− pory roku,
− wyposażenia sanitarnego osiedla,
− urządzeń do oczyszczania ścieków.
Największe zagrożenie wód naturalnych, do których odprowadzane są ścieki stanowią
związki organiczne łatwo rozkładalne, tzn. szybko ulegające procesom biodegradacji.
Zużywany na te procesy tlen rozpuszczony w wodzie może doprowadzić do całkowitego
deficytu tlenowego i powstania warunków anaerobowych, czego skutkiem może być, np.
śnięcie ryb i nieprzyjemny zapach wody.
Substancje organiczne łatwo ulegające utlenianiu
, np siarczany(IV), azotany(III), jony
żelaza(II), które na procesy utleniania zużywają rozpuszczony w wodzie tlen.
Związki toksyczne
, np. jony metali ciężkich, pestycydy, fenole i inne, które hamują
naturalne procesy samooczyszczania wód, stanowią zagrożenie dla życia organizmów
wodnych ludzi i zwierząt.
Kwasy i zasady
, które wprowadzane do wód w dużych ilościach, powodują zmianę
odczynu i podobnie jak związki toksyczne wpływają ujemnie na biocenozę* wodną. Poza tym
kwasy powodują wydzielanie z wód siarkowodoru oraz działają korozyjnie.
Nadmierne zasolenie wód, działające szkodliwie na biocenozę wód i procesy
samooczyszczania.
Ścieki silnie zasolone powodują nieprzyjemny smak wody i utrudniają procesy jej
uzdatniania.
Sole wapnia i magnezu powodują wzrost twardości wody.
Oleje i tłuszcze, powodujące zmniejszenie napięcia powierzchniowego wody i przez
tworzenie na powierzchni cienkiej błonki, hamujące dyfuzję tlenu i powodujące
zanieczyszczanie powierzchni wody kurzem i pyłami przemysłowymi.
Mikroorganizmy chorobotwórcze dostające się do wód głównie ze ściekami bytowo-
gospodarczymi; mogą one być źródłem chorób zakaźnych przenoszonych za pośrednictwem
wody.
Substancje pożywkowe zawarte w ściekach, takie jak np. związki fosforu czy azotu,
powodujące eutrofizację i zmianę właściwości fizycznych wody.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
58
Substancje o intensywnym zapachu, np. halogenowe węglowodory alifatyczne (THM),
fenole, olejki eteryczne i inne, utrudniające procesy uzdatniania wody.
Substancje radioaktywne odprowadzane ze ściekami stanowiące duże zagrożenie dla
organizmów wodnych, ludzi i zwierząt.
Zawiesiny, które tworzą złogi osadów dennych, co powoduje spłycanie odbiorników.
Zmiana właściwości fizycznych (wzrost mętności i temperatury, barwa, nienaturalny
zapach, zmniejszenie napięcia powierzchniowego) wpływających ujemnie na odbiornik.
W celu ochrony wód przed nadmiernym zanieczyszczeniem, ścieki - przed
odprowadzeniem do wód naturalnych - należy zbadać i na podstawie otrzymanych
wyników określić ich charakter oraz ocenić, czy zgodnie z obowiązującymi przepisami
sanitarno - epidemiologicznymi można je odprowadzić do wód powierzchniowych.
W zależności od pochodzenia, ścieki można podzielić na pięć grup:
1. ścieki bytowo-gospodarcze - powstają z wód używanych przez ludność dla potrzeb
gospodarstwa, utrzymania higieny osobistej, spłukiwania urządzeń sanitarnych itp.
Ścieki bytowo-gospodarcze są w stanie świeżym mętne, mają szarożółte zabarwienie,
specyficzny zapach i odczyn lekko zasadowy. Zawierają około 60 % substancji
organicznych i 40 % substancji nieorganicznych w postaci rozpuszczonej i nie
rozpuszczonej. Bardzo często ścieki zawierają drobnoustroje chorobotwórcze, jak
bakterie, wirusy, jaja robaków pasożytniczych i inne patogenne organizmy.
Tego rodzaju ścieki, nie oczyszczone w dostatecznym stopniu, zrzucone do wód
powierzchniowych zasilających wodociągi, mogą wywoływać epidemie.
2. ścieki przemysłowe - powstają w trakcie procesów technologicznych w wielu rodzajach
zakładów przemysłowych. Skład tych ścieków jest bardzo zróżnicowany i dlatego nie
można sformułować ich ogólnej charakterystyki. Mogą zawierać związki organiczne
ulegające procesom biodegradacji, takie jak np. cukry, tłuszcze, białka, a także te
substancje, które nie ulegają przemianom biochemicznym w wodzie, np, niektóre
substancje powierzchniowo czynne, pestycydy, tworzywa sztuczne. Poza tym w ściekach
przemysłowych mogą znajdować się substancje toksyczne, takie jak np. cyjanki, sole
ołowiu, kadmu, rtęci, arsenu, chromu, miedzi. Obecność metali w wodzie wpływa między
innymi na odczyn wody, na ilość rozpuszczonego w niej tlenu i właściwości
organoleptyczne. Metale oddziałują niekorzystnie na pracę oczyszczalni biologicznych,
hamując lub nawet uniemożliwiając biochemiczny rozkład substancji organicznych
zawartych w ściekach oraz uniemożliwiają wykorzystanie osadów dennych dla celów
rolniczych czy też jako podkładów do kształtowania terenów. Niebezpieczne dla wód
powierzchniowych są również występujące w dużych stężeniach nietoksyczne składniki
ścieków, takie jak: kwasy mineralne, związki o odczynie zasadowym, azotany(III), azota-
ny (V), związki amonowe, fosforowe i inne.
Związki organiczne i nieorganiczne występujące w ściekach przemysłowych mogą
wpływać niekorzystnie na ich cechy fizyczne, takie jak: mętność, barwę, zapach czy ilość
zawiesin. Podwyższona temperatura ścieków jest uwarunkowana procesami
technologicznymi, natomiast pienienie się ścieków obecnością np. detergentów czy
mydeł.
3. ścieki miejskie (komunalne) - powstają w miastach i stanowią mieszaninę ścieków
bytowo -gospodarczych oraz przemysłowych. Skład i właściwości tych ścieków zależą od
wzajemnego stosunku, w jakim są zmieszane obydwa rodzaje ścieków.
4. ścieki opadowe - powstają z opadów atmosferycznych i ich skład zależy od
intensywności opadów, składu powietrza i gleby. Można do nich zaliczyć także ścieki
powstające w wyniku polewania ulic, zabudowań i zieleńców. Wody deszczowe zawierają
wiele substancji organicznych: np: wielopierścieniowe węglowodory aromatyczne
(WWA), polichlorowane bifenyle (PCB), pestycydy chloroorganiczne, chloropochodne

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
59
węglowodorów niskocząsteczkowych, rozpuszczalniki. Substancje te przechodzą do
atmosfery wskutek parowania oraz emisji z zakładów przemysłowych.
Obniżenie pH wód deszczowych (czysty deszcz ma pH około 5,7 z powodu reakcji
obecnego w atmosferze CO
2
z H
2
O) jest spowodowane wprowadzaniem do atmosfery SO
2
i tlenków azotu NO
x
, z których - pod wpływem wilgoci - powstają kwasy siarkowe
i azotowe. Przy spalaniu węgla i ropy naftowej mogą powstawać też inne kwasy, takie jak
HCl, HF, H
3
PO
4
.
Ilość zanieczyszczeń dostających się do ścieków opadowych zależy od:
− zanieczyszczenia atmosfery,
− rodzaju nawierzchni ulic, placów, chodników,
− rodzaju transportu kołowego i intensywności ruchu kołowego,
− sposobu walki z gołoledzią,
− ilości terenów zielonych.
5. ścieki radioaktywne - powstają w zakładach przeróbki rud radioaktywnych, zakładach
przeróbki materiałów rozszczepialnych, zakładach leczniczych i instytutach naukowych,
wykorzystujących radioizotopy, i innych. Najczęściej występują w ściekach takie
radioizotopy jak:
90
Sr,
131
I,
137
Cs,
60
Co,
32
P,
24
Na i
40
K. Niektóre pierwiastki
promieniotwórcze mogą wraz z pokarmem przedostawać się do organizmu ludzkiego
i stanowić dla niego ogromne zagrożenie. Działanie biologiczne radioizotopów wiąże się
ściśle z wielkością promieniowania przypadającą na dany organ u ludzi i zwierząt. Ścieki
radioaktywne nie mają żadnych cech zdradzających ich obecność w wodach, dlatego też
przy odprowadzaniu tego rodzaju ścieków do wód powierzchniowych obowiązuje
rygorystyczna, stała kontrola ich aktywności.
4.12.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1) Jakie czynniki są największym zagrożeniem dla wód naturalnych?
2) Jakie znasz rodzaje ścieków?
3) Jak można zapobiegać degradacji wód naturalnych?
4) Jakie mogą być konsekwencje zanieczyszczenia wód wyciekiem ropy naftowej
z tankowca?
5) Co zawierają ścieki bytowo-gospodarcze?
6) Dlaczego należy kontrolować aktywność ścieków radioaktywnych przy wprowadzaniu ich
do wód powierzchniowych?
4.12.3. Ćwiczenia
Ćwiczenie 1
Określ skalę zagrożeń kwaśnymi deszczami i podgrzanymi wodami poprodukcyjnymi
w środowisku lokalnym.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) pracować w grupie (dwie grupy). Zadaniem grup jest zebranie informacji o wybranych
zanieczyszczeniach wód.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
60
2) przewidzieć konsekwencje odprowadzania podgrzanych wód z zakładów
i elektrociepłowni (w danej okolicy) do zbiorników wodnych dla życia organizmów
wodnych - I grupa,
3) dokonać w najbliższej okolicy inwentaryzacji zanieczyszczeń powietrza powodujących
kwaśne deszcze na podstawie obserwacji i zdjęć środowiska wodnego wokół zakładów
przemysłowych - II grupa.
4) zredagować notatkę prasową o skali zagrożenia wraz z apelem do decydentów
o zwrócenie uwagi na przedstawiony problem i podjęcie stosownych decyzji.
Wyposażenie stanowiska pracy
− lornetka, lupa, mikroskop,
− mapa okolicy,
− spis zakładów pracy,
− ołówek, notes,
− aparat fotograficzny.
4.12.4. Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) zdefiniować ścieki?
2) wyjaśnić, co oznacza pojęcie degradacja?
3) wyjaśnić pojęcie
biodegradacja?
4) wymienić rodzaje ścieków?
5) wymienić substancje znajdujące się w ściekach
bytowo-gospodarczych?
6) wymienić sposoby zapobiegania degradacji wód?
7) scharakteryzować poszczególne rodzaje ścieków?
8) przewidzieć konsekwencje zanieczyszczenia wód
wyciekiem ropy naftowej z tankowca?
9) opisać wszystkie czynniki wpływające na
degradację wód?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
61
4.13. Badanie ścieków
4.13.1. Materiał nauczania
Badanie wody i ścieków jest jednym z niezbędnych środków ochrony źródeł wody przed
zanieczyszczeniem i degradacją środowiska. Badania fizyko-chemiczne ścieków wykonuje
się do różnych celów, a mianowicie:
− do wyboru odpowiedniego sposobu oczyszczania,
− do oceny efektywności oczyszczalni ścieków bytowo-gospodarczych na podstawie
analizy ścieków surowych i oczyszczonych,
− do kontroli oczyszczania ścieków przemysłowych przez poszczególne zakłady
przemysłowe,
− do oceny efektywności pracy oczyszczalni ścieków na poszczególnych etapach
oczyszczania,
− dla kontroli wód powierzchniowych, do których spuszczane są ścieki,
− dla zabezpieczenia urządzeń kanalizacyjnych przed ściekami o właściwościach
korozyjnych,
−
dla zabezpieczenia personelu pracującego przy remontach i czyszczeniu kanałów
ściekowych przed zatruciem
substancjami toksycznymi,
− do określenia wartości nawozowych i kontroli terenów rolniczego wykorzystania
ścieków.
Zakres badania ścieków bytowo-gospodarczych i miejskich można podzielić na analizę
skróconą, uproszczoną i pełną
.
Analiza skrócona ścieków bytowo-gospodarczych i miejskich
obejmuje następujące
oznaczenia: temperaturę, mętność, barwę, zapach, zawiesiny łatwo opadające, odczyn (pH),
zagniwalność utlenialność, BZT
5
.
Badania skrócone wyżej wymienionych rodzajów ścieków wykonuje się w celu
prowadzenia bieżącej kontroli składu fizyczno-chemicznego ścieków surowych oraz
oczyszczonych, dla kontroli efektu ich oczyszczania i ochrony odbiorników.
Uproszczone badania
tych ścieków obejmują oznaczenia objęte analizą skróconą oraz
dodatkowo azot: amonowy, azotynowy, azotanowy, chlorki, siarczany, suchą pozostałość,
pozostałość po prażeniu, stratę przy prażeniu, tlen rozpuszczony. Uproszczoną analizę
ścieków wykonuje się w celu orientacyjnej ich charakterystyki, np. w celu określenia wpływu
ścieków na jakość wody w odbiorniku, a także w celu kontroli efektu ich oczyszczania.
W zakres pełnych
badań ścieków bytowo-gospodarczych i miejskich wchodzą
oznaczenia objęte uproszczoną analizą oraz azot albuminowy, ogólny, ChZT, OWO,
substancje rozpuszczone mineralne i organiczne, fenole, detergenty, węglowodory, metale
ciężkie, radioaktywność, substancje specyficzne.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
62
Tabela 5. Zakres kontroli analitycznej dla wybranych ścieków przemysłowych.
Rodzaj przemysłu Wskaźniki zanieczyszczeń
Przemysł mięsny BZT
5
, N
(NO3)
, tłuszcze i oleje, fosfor, bakterie
Cukrownie Temperatura, zawiesiny, pH, BZT
5,
substancje
rozpuszczone
Przemysł cementowy
Temperatura, zawiesiny, pH, substancje
rozpuszczone
Zakłady tworzyw sztucznych
Zawiesiny, BZT
5
, ChZT, metale pH
Produkcja mydeł i detergentów
Zawiesiny, BZT
5
, ChZT, detergenty, tłuszcze i oleje
Przemysł nawozów azotowych
pH, N
og
, N
(no3),
N(
NH4
+
), C
og
Przemysł petrochemiczny
Całkowite i niepolarne substancje organiczne, S, fenole, BZT
5,
ChZT,
zasadowość, metale ciężkie
Garbarnie
Barwa, S, aminy, BZT
5
, ChZT, zasadowość, twardość, Cr, substancje
rozpuszczalne, tłuszcze i oleje
Huty szkła
Barwa, temperatura, mętność, pH
Przemysł gumowy
BZT
5
, ChZT, N
og
, detergenty, barwa, Cl, S, tłuszcze i oleje, fenole
Źródło: Lipkowska-Grabowska K., Faron-Lewandowska E.: Pracownia chemiczna. Analiza wody i ścieków.
WSiP, Warszawa 1988
Wybrane wskaźniki zanieczyszczenia ścieków:
− Temperatura ścieków ma wpływ na szybkość procesów biologicznych zachodzących
w czasie oczyszczania ścieków, a także odprowadzania ich do odbiornika. Temperatura
ścieków nie spada zazwyczaj poniżej 10°C, co jest bardzo korzystne dla przebiegu
stosowanych procesów oczyszczania. Temperatura ścieków bytowo-gospodarczych tylko
w niewielkim stopniu zależy od temperatury powietrza.
− Barwa jest wskaźnikiem świeżości ścieków. Wywołują ją związki organiczne
rozpuszczone i koloidalne oraz barwne związki nieorganiczne pochodzące najczęściej ze
ścieków przemysłowych. W ściekach odprowadzanych z gospodarstw domowych barwa
wynosi w skali kobaltowo-platynowej 40÷60 g Pt/m3. W stanie świeżym ścieki mają
barwę żółtoszarą lub białoszarą, a zagniłe — barwę czarnoszarą lub szarą.
− Zapach podobnie jak barwa, jest wskaźnikiem świeżości ścieków. Wywołują go przede
wszystkim występujące w ściekach substancje przeważnie organiczne, ale także wiele
związków nieorganicznych, np. siarkowodór, fosforowodór. Ścieki zgniłe (często ścieki
dowożone taborem asenizacyjnym) mają zapach gnilny, podobny do siarkowodoru. Przy
klasyfikacji zapachów rozróżnia się trzy zasadnicze grupy:
R
— roślinny (zapach ziemi, torfu),
G
— gnilny (zapach siarkowodoru),
S
— specyficzny (zapach chlorowy, fenolowy, naftowy).
Potencjał oksydacyjno-redukcyjny (zw. redoks lub redox) ma duże znaczenie
w procesach biochemicznego oczyszczania ścieków, a jego wartość w znacznym stopniu
zależy od natlenienia ścieków. Wartość potencjału redox wskazuje, czy procesy oczyszczania
ścieków zachodzą prawidłowo.
Potencjał redox wód naturalnych mieści się zazwyczaj w przedziale: –1000 ÷ +1000 mV.
Zmiany potencjału redox odzwierciedlają np. zmiany natlenienia wody. Niski potencjał redox
świadczy o małej zawartości tlenu lub jego braku. Pomiar potencjału redox jest bardzo istotny
przy prowadzeniu procesów nitryfikacji i denitryfikacji.
Przewodnictwo elektrolityczne (właściwe) oznacza się w celu określenia ogólnej
zawartości jonów rozpuszczonych w ściekach.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
63
− Opadające zawiesiny – takie, których średnica cząstek nie jest mniejsza od 0,1 µm.
W przeciętnych ściekach bytowo-gospodarczych lub o podobnych właściwościach
zawiesiny łatwo opadające stanowią 60÷65% ogólnej ilości zawiesin. Objętość ich
wynosi 2÷10 cm
3
osadu na 1 dm
3
ścieków. W czasie opadania zawiesin zachodzi
jednoczesne zagęszczanie opadłego osadu, co powoduje zmniejszenie jego objętości.
Najczęściej objętość opadłych zawiesin oznacza się po dwugodzinnym opadaniu.
Zawartość zawiesin ogólnych w badanej próbce (x
1
) można obliczyć w mg/dm
3
według
wzoru
x
1
=
V
m
m
1000
)
(
1
2
⋅
−
w przypadku wirowania próbki według wzoru
x
1
=
V
m
m
m
m
)
(
)
(
3
1
4
2
+
−
+
w których:
m
2
- masa naczynka wagowego z sączkiem i zawiesinami [mg],
m
1
- masa naczynka wagowego z sączkiem bez zawiesin [mg],
m
4
- masa tygla z zawiesinami [mg],
m
3
- masa wyprażonego tygla bez zawiesin [mg],
V - objętość próbki użytej do oznaczania [cm
3
].
Zanieczyszczenia chemiczne zawarte w ściekach dzieli się na substancje organiczne,
związki nieorganiczne oraz rozpuszczone gazy. Substancje organiczne w ściekach
odprowadzanych z gospodarstw domowych stanowią ok. 75% zawiesin oraz 40% związków
rozpuszczonych. Pierwiastki zawarte w zanieczyszczeniach organicznych — to przede
wszystkim: węgiel, wodór, tlen i azot, a także w mniejszej ilości żelazo, fosfor i inne
mikroelementy. Podstawowe grupy substancji organicznych w ściekach bytowo-
gospodarczych — to: białko — 40÷60%, węglowodany — 25÷50%, tłuszcze — ok. 10%.
Ścieki bytowo-gospodarcze charakteryzują się pH = 6,6÷8,0, co gwarantuje właściwy
przebieg biologicznego oczyszczania oraz pozwala na odprowadzanie ścieków do wód
płynących.
Zasadowość jest miarą zawartości wodorowęglanów wapnia Ca(HCO
3
)
2
i magnezu
Mg(HCO
3
)
2
. Związki te mają łącznie z fosforanami i węglanem sodu właściwości buforujące,
polegające na zobojętnianiu środowiska, co ma istotne znaczenie w realizacji biochemicznych
procesów oczyszczania ścieków.
Całkowitą ilość zanieczyszczeń zawartych w ściekach określa sucha pozostałość, tj. masa
substancji pozostałych po odparowaniu próbki ścieków i wysuszeniu jej do stałego ciężaru
w temperaturze 105°C. W skład suchej pozostałości wchodzą substancje mineralne oraz
organiczne, zarówno rozpuszczalne, jak i nierozpuszczone (zawiesina).
Proces całkowitego biochemicznego utleniania przebiega w dwóch fazach.
W pierwszej fazie trwającej ok. 20 dni utleniane są węglowodany, natomiast rozkład
związków azotowych następuje z opóźnieniem 3÷10 dni. Proces zużywania tlenu przebiega w
przybliżeniu według równania reakcji jednocząsteczkowej, tzn. w każdej jednostce czasu
rozkładowi ulega stały procent pozostałych substancji organicznych. Można to zapisać
równaniem
BZT
t
= BZT
ogólne
(1-10
-kt
)
gdzie:
BZT — biochemiczne zapotrzebowanie na tlen po czasie t [g/m
3
],
BZT
ogólne
— ogólne biochemiczne zapotrzebowanie na tlen [g/m
3
],
t — czas [s],
k— stała szybkości reakcji (orientacyjnie k = 0,15÷0,2 s
-1
)

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
64
Na przebieg biochemicznych procesów, których odzwierciedleniem jest BZT, wpływają
takie czynniki jak: budowa związków organicznych, obecność substancji odżywczych,
stężenie flory bakteryjnej, związki toksyczne i hamujące proces, mieszanie, temperatura,
odczyn (pH), jak też stężenie i stopień dyspersji substancji organicznych.
4.13.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1) Jakie znasz rodzaje analiz wody?
2) Na czym polega proces całkowitego biochemicznego utleniania?
3) Jakie są wskaźniki zanieczyszczenia wód?
4) Na czym polega analiza skrócona ścieków bytowo-gospodarczych i miejskich?
5) Jakie są cele badań fizyczno-chemicznych wody?
4.13.3. Ćwiczenia
Ćwiczenie 1
Oznacz zawiesiny ogólne metodą wagową.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) dokładnie wymieszaną i odmierzoną próbkę wody lub ścieków przesączyć przez sączek
przygotowany według zaleceń,
2) zawiesiny na sączku przemyć 50cm
3
wody destylowanej,
3) sączek z zawiesinami umieścić w naczynku wagowym i suszyć w suszarce przez
1 goidzinę w temperaturze 378K,
4) po ostudzeniu w eksykatorze w ciągu 30 minut, sączek w przykrytym naczynku
wagowym zważyć,
5) następnie naczynko z sączkiem ponownie zważyć. Różnica między ważeniami nie
powinna przekraczać 1 mg,
6) sączek z zawiesinami ogólnymi zachować do oznaczenia zawiesin mineralnych i lotnych,
7) w przypadku gdy zawartość zawiesin jest większa od 200 mg w próbce, a czas sączenia
dłuższy niż 50 cm
3
badanej wody lub ścieków należy umieścić w próbówce wirówkowej
i odwirować próbkę przez 5 minut przy 3000 obr/min,
8) następnie zdekantować płyn znad osadu i przesączyć go przez sączek,
9) osad w probówce przeprowadzić w stan zawiesinowy 50 cm
3
wody destylowanej przy
użyciu tryskawki i ponownie wirować przez 5 minut przy 3000 obr/min,
10) płyn znad osadu przesączyć przez ten sam sączek. Czynność powtórzyć jeszcze
dwukrotnie,
11) sączek z zawiesinami umieścić w naczynku wagowym. Zebrany z dna probówki osad
przenieść ilościowo przy użyciu tryskawki do uprzednio wyprażonego i zważonego tygla.
Zebrany w tyglu płyn z zawiesinami odparować na łaźni wodnej.
12) po odparowaniu stronę zewnętrzną tygla wytrzeć dokładnie bibułą zwilżoną 5–10%
kwasem solnym a następnie wodą destylowaną,
14) tygiel i naczynko wagowe z sączkiem suszyć w suszarce w ciągu 1 godziny
w temperaturze 378 K, następnie ostudzić w eksykatorze w ciągu 30 minut i zważyć.
Ponownie wstawić tygiel i naczynko do suszarki na pół godziny, ostudzić w eksykatorze
i zważyć. Różnica między ważeniami nie powinna być większa od 1 mg,
15) sączek z zawiesinami oraz tygiel z zawiesinami zachować do oznaczania zawiesin
mineralnych i lotnych.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
65
Wyposażenie stanowiska pracy
− naczynka wagowe o średnicy 3 – 3,5 cm
− wirówka laboratoryjna z probówkami, każdą o pojemności 50cm
3
− piec muflowy, elektryczny
− waga analityczna i suszarka labororatoryjna
− tygle porcelanowe o średnicy 3-3,5 cm wyprażone do stałej masy
− sączki ilościowe
− eksykator
4.13.4. Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1) wyjaśnić, co to jest zawiesina?
2) wymienić cele badań fizyczno-chemicznych wody?
3) wymienić
rodzaje
analiz
wody?
4) wymienić wskaźniki zanieczyszczenia wód?
5) określić na czym polega proces całkowitego
biochemicznego utleniania?
6) omówić wskaźniki zanieczyszczenia wód?
7) scharakteryzować analizę skróconą ścieków
bytowo-gospodarczych i miejskich?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
66
4.14. Metody opracowywania wyników badań
4.14.1. Materiał nauczania
Wykonana analiza wody powinna być sprawdzona pod względem poprawności uzyskanych
wyników w celu wyeliminowania błędów, które mogą powstać podczas poboru próbek,
wykonywania analizy lub obliczeń. Sprawdzenie poprawności można prowadzić
dwukierunkowo:
− sprawdzając korelacje między poszczególnymi składnikami (np. podwyższona zawartość
jonów wapnia i magnezu powinna wiązać się z podwyższoną twardością wody, wysoka
przewodność właściwa wiąże się z wysoką zawartością soli w wodzie (obecność tlenu
wyklucza obecność H
2
S, siarczynów i innych reduktorów),
− sprawdzając bilans kationów i anionów.
4.14.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1) Jakie są metody opracowywania wyników badań?
2) Na co należy zwracać uwagę, aby uniknąć błędu pomiaru?
3) Na czym polega sprawdzenie poprawności wyników badań?
4.14.3. Ćwiczenia
Ćwiczenie 1
Oceń poprawność prowadzenia analizy wody.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przeanalizować opis wyników badania: W badanej próbce wody stwierdzono dużą
zawartość jonów: wapnia, sodu, magnezu, węglanów, chlorków i siarczanów.
Jednocześnie woda ta miała niską przewodność właściwą.
2) odpowiedzieć na pytanie - czy analiza wody była przeprowadzona poprawnie?
Wyposażenie stanowiska pracy
− podręcznik ucznia
− notes, linijka, ołówek
Ćwiczenie 2
Oceń poprawność prowadzenia analizy wody.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) zanalizować tekst - Analityk badając próbkę wody wykrył w niej siarczyny SO
3
2-
, azotyny
NO
2
-, azotany NO
3
-
oraz tlen rozpuszczony i dwutlenek węgla.
2) odpowiedzieć na pytanie - czy popełnił błąd analityczny?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
67
Wyposażenie stanowiska pracy
− podręcznik ucznia
− notes, linijka, ołówek
4.14.4. Sprawdzian postępów
Czy potrafisz:
TAK NIE
1) wymienić metody opracowywania wyników badań?
2) wyjaśnić na co należy zwracać uwagę, aby uniknąć błędu pomiaru?
3) wyjaśnić na czym polega sprawdzenie poprawności wyników badań?
4) ocenić poprawność wykonania analizy?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
68
4.15. Przepisy bezpieczeństwa i higieny pracy obowiązujące
w laboratorium i w terenie podczas prowadzenia pomiarów
i badania wody
4.15.1. Materiał nauczania
Praca w laboratorium analitycznym wymaga zachowania daleko idących środków
ostrożności, porządku i systematyczności. Niejednokrotnie ma się tu do czynienia
z substancjami silnie
trującymi, żrącymi, łatwopalnymi oraz wybuchowymi i tylko
przestrzeganie prawidłowego wykonywania wszelkich operacji laboratoryjnych pracę tę
uczyni w pełni bezpieczną.
Dlatego też należy:
1. Utrzymywać w porządku i czystości miejsce pracy. Stół laboratoryjny powinien być
suchy. Rozlaną ciecz na stole laboratoryjnym należy niezwłocznie wytrzeć suchą ścierką,
stół wymyć wodą i następnie wytrzeć do sucha. Na stole powinien znajdować się tylko
potrzebny sprzęt laboratoryjny do wykonywanej analizy, podręcznik chemii z analizy
jakościowej oraz zeszyt laboratoryjny. Po ukończeniu zajęć sprzęt laboratoryjny powinien
być uprzątnięty i schowany do szafki.
2. Do zlewu nie wolno wrzucać osadów ani żadnych części stałych jak: sączków, bibuły,
korków, zbitego szkła, jak również wylewać stężonych roztworów kwasów, zasad oraz
związków rtęci. Do tego celu służą specjalne butle.
3. Odczynników ogólnych nie wolno zabierać z ich miejsc przeznaczenia i gromadzić na
stołach laboratoryjnych. Pobieranych chemikaliów nie należy wlewać lub wsypywać
z powrotem do butelek lub słoików.
4. Przed pobraniem odczynnika, ze względu na możliwość omyłki, należy sprawdzić napis
na etykiecie.
5. Ze względu na bezpieczeństwo własne jak i otoczenia należy pracować pod wyciągiem
w przypadkach:
− nalewania, odparowywania i rozcieńczania stężonych roztworów kwasów
− ogrzewania roztworów o odczynie zasadowym
− stapiania
− strącania i odsączania siarczków
− wykonywania wszelkich badań związanych z wydzielaniem się substancji
trujących, jak: H
2
S, HCN, CO, Cl
2
, Br
2
, tlenki azotu, lotne związki arsenu, rtęci
itp.
− wykonywania wszelkich prób na jon chloranowy(V).
6. W pobliżu palących się palników gazowych nie wolno gromadzić materiałów
łatwopalnych. Takie ciecze, jak alkohole, eter, benzen, powinny być po użyciu szczelnie
zamknięte, a korzystanie z nich jest dozwolone jedynie w znacznej odległości od źródła
ognia.
7. Ogrzewanie i odparowywanie cieczy łatwopalnych może być przeprowadzone tylko
w łaźni wodnej ogrzewanej parą, zamkniętej łaźni elektrycznej lub lampą grzejną.
8. Palnik gazowy należy zapalać zapałkami lub zapalniczką, obserwując, czy nie nastąpiło
przeskoczenie płomienia do wnętrza. W takim przypadku zamyka się natychmiast dopływ
gazu. Po upływie 2 — 3 minut zapala się palnik ponownie, uprzednio zmniejszając
dopływ powietrza.
9. Nie wolno wykonywać na własną rękę żadnych doświadczeń bez uzgodnienia
z prowadzącym zajęcia.
10. Ze względu na możliwość zatrucia nie należy pić wody z naczyń laboratoryjnych oraz

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
69
spożywać posiłków w pracowni.
11. Należy myć ręce przed opuszczeniem pracowni.
12. Wszystkich pracujących obowiązuje jak najdalej posunięta oszczędność w używaniu
odczynników, gazu, wody i prądu elektrycznego.
13. O wszelkich wypadkach należy natychmiast zawiadomić prowadzącego zajęcia.
Ze względu na bezpieczeństwo przeciwpożarowe laboratorium powinno być
zaopatrzone w gaśnice, skrzynie z piaskiem i koce azbestowe.
Niewielki pożar najłatwiej można ugasić przysypując źródło ognia piaskiem.
Do gaszenia większych pożarów należy używać gaśnic zawieszonych w miejscach
łatwo dostępnych.
W przypadku zapalenia się odzieży tłumi się ogień za pomocą koca azbestowego.
Można też w tym celu użyć natrysku z wodą, który powinien być zainstalowany
w każdym laboratorium.
14. W komplecie materiałów i przyrządów do przeprowadzania testów powinna się znaleźć
instrukcja zawierająca specyficzne informacje o pierwszej pomocy oraz informacje
chemiczne, na wypadek jeśli uczeń połknie jakiś odczynnik lub dotknie nim oka lub
skóry. Instrukcja taka powinna być powielona i zostawiona w dobrze widocznym miejscu.
15. Należy upewnić się, że uczniowie znają zasady zachowania bezpieczeństwa i od początku
zdają sobie sprawę z niebezpieczeństw zawiązanych z beztroskim traktowaniem
chemikaliów, bądź zagrożeń na jakie mogą narazić innych swoimi pomysłami.
16. Powinny być wykorzystywane okulary ochronne, zwłaszcza przy doświadczeniach
wymagających potrząsania i obracania mieszanki chemicznej – badanie zawartości
rozpuszczonego tlenu, , pH, zawartość azotanów i fosforu.
17. Po przeprowadzeniu każdego testu jakości wody należy umyć ręce w czystej wodzie.
Podczas monitorowania należy unikać dotykania oczu i ust.
18. Należy postępować zgodnie z ogólnymi zasadami obowiązującymi w regulaminie szkoły
i regulaminie prac laboratoryjnych.
19. Zużyte odczynniki chemiczne powinny być umieszczane w przeznaczonych do tego celu
pojemnikach.
20. Bezpieczne badania wody zapewnią:
a) okulary ochronne,
b) czysta miednica lub wiadro do mycia rąk,
c) dzban czystej wody do mycia rąk,
d) mydło (w miarę możliwości bakteriobójcze),
e) ręczniki,
f) pojemnik na odpadki do wrzucania pustych opakowań i osobny pojemnik na
płynne pozostałości chemikaliów (z wyjątkiem azotanu) – patrz punkt „j” poniżej,
g) rękawiczki ochronne,
h) butelka z kroplami do oczu,
i) apteczka pierwszej pomocy,
j) wyraźnie oznakowany pojemnik na niebezpieczne odpadki (np. płynne
pozostałości po badaniu azotanów) – UWAGA TOKSYNY! – opróżniany według
zasad obchodzenia się z niebezpiecznymi odpadami.
4.15.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczenia.
1) Gdzie należy składować zbite szkło, korki czy resztki stężonego kwasu?
2) Dlaczego etykietuje się odczynniki?
3) Jakie analizy wymagają pracy pod wyciągiem?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
70
4) W jakich warunkach można odparowywać i ogrzewać ciecze łatwopalne?
5) Na czym polega pierwsza pomoc w nagłych wypadkach?
4.15.3. Ćwiczenia
Ćwiczenie 1
Dokonaj analizy regulaminu pracowni analizy jakościowej wody.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) zapoznać się z regulaminem pracowni analizy jakościowej wody,
2) zastanowić się, jakie konsekwencje mogą wynikać z nie stosowania każdego z punktów
tego regulaminu,
3) zaprezentować w dowolnej formie wszystkie zagrożenia.
Wyposażenie stanowiska pracy
− regulamin pracowni
− notes, ołówek
4.15.4. Sprawdzian postępów
Czy potrafisz:
TAK
NIE
1)
zdefiniować pojęcie regulamin?
2) scharakteryzować wszystkie punkty regulaminu?
3) wymienić zagrożenia związane z nie przestrzeganiem
zasad bezpieczeństwa i higieny pracy?
4) udzielić pomocy w nagłych wypadkach?
5) określić warunki, w których należy odparowywać
i ogrzewać ciecze łatwopalne?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
71
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem pytań testowych.
4. Test zawiera 10 pytań o różnym stopniu trudności. Są to pytania: otwarte (krótkiej
odpowiedzi i z luką ) oraz zamknięte (wielokrotnego wyboru).
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi, stawiając w odpowiedniej
rubryce znak X lub wpisując prawidłową odpowiedź. W przypadku pomyłki należy
błędną odpowiedź zaznaczyć kółkiem, a następnie ponownie zakreślić odpowiedź
prawidłową.
6. Test składa się z dwóch części o różnym stopniu trudności: I część – poziom
podstawowy, II część - poziom ponadpodstawowy.
7. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci czas wolny.
9. Na rozwiązanie testu masz 40 min.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
72
ZESTAW ZADAŃ TESTOWYCH
I część
1. Skały ……………. powstają z zakrzepnięcia pierwotnej magmy podczas tworzenia się
skorupy ziemskiej.
2. Przewodność właściwa wód naturalnych świadczy o zanieczyszczeniu ich ……..
……………………..
3. Do której klasy czystości zaliczysz wody przeznaczone do chowu i hodowli zwierząt
gospodarskich?
4.
Czym zajmuje się hydrometria?
5.
Ścieki miejskie (komunalne) powstają:
a) w miastach i stanowią mieszaninę ścieków bytowo-gospodarczych oraz
przemysłowych,
b) powstają z opadów atmosferycznych i ich skład zależy od intensywności opadów,
składu powietrza i gleby,
c) powstają w trakcie procesów technologicznych w wielu rodzajach zakładów
przemysłowych,
d) powstają z wód używanych przez ludność dla potrzeb gospodarstwa, utrzymania
higieny osobistej, spłukiwania urządzeń sanitarnych.
II część
6. Przedstawione wskaźniki zanieczyszczeń: BZT
5
, N
(NO3)
, tłuszcze i oleje, fosfor, bakterie są
przedmiotem analizy wody przemysłu:
a) cementowego,
b) mięsnego,
c) mydeł i detergentów,
d) cukrowniczego.
7. Badania obejmujące oznaczenia: temperatura, mętność, barwa, zapach odczyn, twardość
ogólna i niewęglanowa, zasadowość, żelazo ogólne, mangan, chlorki, amoniak, azotany
(V), azotany (III), utlenialność to badanie:
a) skrócone,
b) specjalne,
c) rozszerzone,
d) pełne.
8. Jaki rodzaj próbki charakteryzuje poniższy opis?
Otrzymywana jest w wyniku pobrania odpowiedniej objętości, proporcjonalnej do
wielkości przepływu wody, ścieków w danej chwili w określonym punkcie. Próbka jest
charakterystyczna w określonym momencie czasu.
a) pierwotna,
b) złożona,
c) ogólna okresowa,
d) proporcjonalna.
9. Jakie konsekwencje dla życia organizmów wodnych niesie odprowadzanie podgrzanych
wód z zakładów i elektrociepłowni do zbiorników wodnych?
10. Wskaż sytuacje, w których, ze względu na bezpieczeństwo własne jak i otoczenia, należy
podczas analizy chemicznej próbek wody pracować pod wyciągiem.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
73
KARTA ODPOWIEDZI
Imię i nazwisko ……………………………………………………..
Badanie wody
Zakreśl poprawną odpowiedź, wpisz całe zdania lub brakujące części zdania. Pytania 3,
4, 9, 10 wymagają całych zdań.
Numer
pytania
ODPOWIEDŹ
Punktacja
1.
2.
3.
4.
5.
a b c d
6.
a b c d
7.
a b c d
8.
a b c d
9.
10.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
74
6. LITERATURA
1. Rozporządzenie Ministra Środowiska z dnia 11 lutego 2004 r. w sprawie klasyfikacji dla
prezentowania stanu wód powierzchniowych i podziemnych, sposobu prowadzenia
monitoringu oraz sposobu interpretacji wyników i prezentacji stanu tych wód (Dz. U.
Nr 32, poz. 284)
2. Chełmicki W.: Woda. Zasoby, degradacja, ochrona. Wydawnictwo Naukowe PWN,
Warszawa 2002
3. Dymaczewski Z., Oleszkiewicz J., Lozański M.: Poradnik eksploratora oczyszczalni
ścieków. Polskie Zrzeszenie Inżynierów i Techników Sanitarnych, Poznań 1997
4. Gajkowska-Stefańska L., Guberski S., Gutowski W., Mamak Z., Szperliński Z.:
Laboratoryjne badania wody, ścieków i osadów ściekowych. Oficyna Wydawnicza
Politechniki Warszawskiej, Warszawa 1994
5. Grochwicz E, Korytowski J.: Ochrona przyrody i wód. WSiP, Warszawa 1999
6. Heidrich Z.: Wodociągi i kanalizacja. WSiP, Warszawa 1999
7. Heidrich Z.: Urządzenia do uzdatniania wody. Arkady, Warszawa 1980
8. Radlicz-Rühlowa H., Szuster A.: Hydrologia i hydraulika z elementami hydrologii. WSiP
Warszawa 1997
9. Szpindor A.: Zaopatrzenie w wodę i kanalizację wsi. Arkady Warszawa 1992
10. Lipkowska-Grabowska K., Faron-Lewandowska E.: Pracownia chemiczna. Analiza wody
i ścieków. WSiP, Warszawa 1988
Wyszukiwarka
Podobne podstrony:
badanie wody
program badania wody, organizacja-pracy
20.Instrukcja badania wody, Haccp-Dokumentacja-przykład
DBW Druk Badania Wody ogólny
Badanie wody wyniki
badanie wody
Badanie wody w punktach
Badanie twardości wody
Badanie zależności temperatury wrzenia wody od ciśnienia, ćwiczenie14+, LABORATORIUM FIZYCZNE
BADANIA CHEMICZNE WODY, Studia, Polibuda Politechnika Warszawska, chemia środowiska
BADANIE WŁAŚCIWOŚCI WODY, PWR, chemia
Badanie twardości wody, Chemia, Sprawozdanie
Badanie czystości wody i powietrza, Mikrobiologia
Mikroskopowe badanie osadu czynnego, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technolog
Badanie hydrocyklonu, 1. ROLNICTWO, Technologia Wody i Ścieków
Badanie warunków napowietrzania złoża biologicznego, Technologia Wody i Ścieków
Mikroskopowe badanie osadu czynnego, Technologia Wody i Ścieków
6i8 Badanie podstawowych przemian termodynamicznych Wyznaczanie wielkości kappa Wyznaczanie ciepła p
I zajęcia Badania fizykochemiczne wody
więcej podobnych podstron