
j a k t o o d k r y l i
eureka!
P
rzes³anki do sformu³owania odpowiedzi na to pyta-
nie pochodzi³y z analizy wyników badañ nad rozpa-
dem promieniotwórczym uranu i toru. Nawiasem
mówi¹c, wyników, które wstrz¹sa³y podstawami ów-
czesnej chemii. Musimy pamiêtaæ, ¿e w XIX wieku che-
mia by³a potê¿n¹ dyscyplin¹ naukow¹, której podstaw¹
by³y niepodzielne atomy pierwiastków pouk³adane pre-
cyzyjnie w uk³adzie okresowym. W uk³adzie tym, ka¿dy
atom mia³ numer kolejny (lliicczzbbêê aattoom
mo
ow
w¹
¹
) i s¹siada
z lewej strony o ni¿szej, a z prawej o wy¿szej liczbie
atomowej. Chemia mia³a ju¿ wielkie sukcesy, szczegól-
nie w Niemczech cesarskich. Odkrycia w tej dziedzinie
i ich prze³o¿enie na rozwój przemys³owy nowoczesnej
metalurgii, chemii organicznej i nieorganicznej powo-
dowa³y, ¿e Niemcy by³y pierwszym krajem na œwie-
cie, który mia³ gospodarkê w znacznym stopniu
opart¹ na wiedzy, jak to mówimy dzisiaj. Przekonali
siê o tym ¿o³nierze w okopach pod Ypres a tak¿e mary-
narze brytyjscy w bitwie Jutlandzkiej.
W pierwszej dekadzie XX wieku w laborato-
riach fizyków i chemików we Francji, Niemczech i Wiel-
kiej Brytanii badano naturaln¹ promieniotwórczoœæ za-
równo nowoodkrytych pierwiastków radu i polonu,
a tak¿e znanych wczeœniej, uranu i toru. Szczególnie in-
tensywne badania by³y prowadzone przez Fredericka
Soddy’ego w laboratorium chemicznym Uniwersytetu
w Glasgow. Soddy, jak wielu innych badaczy w tym
czasie zauwa¿y³, ¿e emisja cz¹stek α i β, powoduje po-
jawienie siê w materiale emituj¹cym cz¹stki, pierwias-
tków, których tam wczeœniej nie by³o. Nie ulega³o w¹t-
pliwoœci, ¿e musi to byæ zwi¹zane z emisj¹ tych cz¹s-
tek. Soddy poprosi³ swojego kolegê zajmuj¹cego siê
analiz¹ chemiczn¹ o szczegó³owe zbadanie, co powsta-
je w wyniku tzw. rozpadu promieniotwórczego.
Okaza³o siê, ¿e w wyniku emisji cz¹stki α pow-
staje produkt przesuniêty w uk³adzie okresowym
o dwa miejsca w lewo, a w przypadku emisji cz¹stki β,
o jedno miejsce w prawo.
Dzia³y siê rzeczy napraw-
dê dziwne. I tak polon
o liczbie atomowej 218
emitowa³ cz¹stkê α i sta-
wa³ siê o³owiem-214, któ-
ry z kolei po emisji cz¹s-
tki β stawa³ siê bizmu-
tem-214, a ten z kolei po
emisji cz¹stki β stawa³ siê
wyjœciowym polonem ty-
le, ¿e o masie mniejszej
o cztery jednostki. Pier-
wiastek z tak¹ mas¹ nie
mia³ prawa pojawiæ siê
w tym miejscu uk³adu ok-
resowego! To by³o trudne
do zaakceptowania przez
chemików, którzy osi¹g-
nêli tak wiele w oparciu
o wieczny, niezmienny
i niepodzielny atom pierwiastka. Czêœæ z nich uwa¿a³a
z g³êbokim niesmakiem, ¿e znowu podjêto, zarzucone
jeszcze w XVII wieku, próby alchemików pozyskania
kamienia filozoficznego przemieniaj¹cego wszystkie
pierwiastki w z³oto. Faktów jednak przybywa³o i Soddy
móg³ sformu³owaæ swoj¹ regu³ê przesuniêæ
1)
opisuj¹c¹
zachowanie siê pierwiastków w tzw. szeregach pro-
mieniotwórczych, którego jeden fragment przedstawio-
no powy¿ej w historii o polonie. Atomy o ró¿nej masie
atomowej, które przecie¿ musia³y zajmowaæ to samo
miejsce w uk³adzie okresowym, Soddy nazwa³ izotopa-
mi, co po grecku oznacza to samo miejsce.
W tym samym czasie holenderski fizyk Antonius
van den Broek, postawi³ œmia³¹ hipotezê, ¿e numer ko-
lejny pierwiastka w uk³adzie okresowym - liczba ato-
mowa - oznacza iloœæ jednostek ³adunku elektrycznego
w j¹drze atomowym. Jednostkowym ³adunkiem musia³
byæ wiêc jon wodoru o ³adunku +1; zjonizowany hel
w postaci cz¹stki α mia³ ³adunek +2, a z³oto, na 79
miejscu w uk³adzie okresowym, ³adunek +79. Hipoteza
van den Broeka uporz¹dkowa³a wszystkie wyniki ob-
serwacji rozpadów promieniotwórczych. Atom X o licz-
bie masowej A i liczbie atomowej Z, kiedy emituje
cz¹stkê α o liczbie masowej 4 i liczbie atomowej 2, za-
mienia siê w atom X’ o liczbie masowej A-4 i liczbie
atomowej Z-2. Kiedy emituje cz¹stkê β zamienia siê
w atom X’’ o tej samej liczbie masowej, ale o liczbie
atomowej Z+1. Ca³y opis mo¿na wiec by³o sprowadziæ
do arytmetyki i zapisaæ w postaci:
X
X’ np.
Po
Pb
lub
X’
X’’ np.
Pb
Bi
Bezpoœredni dowód na to, ze van den Broek mia³
racjê uda³o siê znaleŸæ Ernestowi Rutherfordowi, kilka
lat póŸniej. Doœwiadczenia, o których mówimy, mia³y
miejsce tu¿ przed pierwsz¹ wojn¹ œwiatow¹, w której
losy wielu znakomitych uczonych potoczy³y siê bardzo
ró¿nymi drogami, o czym w dalszej czêœci tej opowieœ-
ci. W ka¿dym razie nikt nie mia³ ju¿ g³owy do zajmowa-
nia siê pierwiastkami promieniotwórczymi i Rutherford
214
83
→
β
214
82
A
1
Z
+
→
â
A
Z
214
82
→
α
218
84
4
A
2
Z
−
−
→
α
A
Z
W roku 1911, po publikacji przez Ernesta Rutherforda interpretacji wy-
ników badań Geigera i Marsdena nad rozpraszaniem cząstek αα na fo-
liach metalicznych nie było wątpliwości, co do istnienia jądra atomo-
wego, w którym zawarta jest prawie cała masa atomu i cały ładunek
dodatni. Naturalnie, pozostał problem jak ten ładunek związany jest
z masą jądra – czy przez analogię z elektronem w modelu plum pud-
ding Kelvina-Thomsona, ładunki dodatnie tkwią w materii jądra jak
izolowane byty, w ilości odpowiedniej dla zapewnienia elektroobojęt-
ności atomu jako całości?
M
Ł
ODY
TECHNIK
3/2005
5
54
4
TEKST TRUDNY
!!!
ODKRYCIE PROTONU
I NEUTRONU

tak¿e wzi¹³ udzia³ w wysi³ku wojennym (zaj¹³ siê po-
szukiwaniem metod wykrywania ³odzi podwodnych).
Do swoich badañ wróci³ dopiero po wojnie.
Rutherford postanowi³ w dalszym ci¹gu badaæ
oddzia³ywanie cz¹stek α, ale tym razem z lekkimi ato-
mami. W komorze pró¿niowej podzielonej na dwie
czêœci, cz¹stki α ze Ÿród³a radowego, przechodzi³y do
drugiej czêœci komory przez otwór przes³oniêty foli¹ ze
srebra i wywo³ywa³y rozb³yski œwietlne (scyntylacje)
na przeciwleg³ej œcianie komory, pokrytej siarczkiem
cynku. Po wprowadzeniu do tej czêœci komory azotu,
charakter scyntylacji zmieni³ siê – obok typowych roz-
b³ysków od czastek α, pojawi³y siê rozb³yski o innym
charakterze. Doœwiadczonemu obserwatorowi tych zja-
wisk, jakim niew¹tpliwie by³ Ernest Rutherford, przy-
pomina³y scyntylacje od zjonizowanych atomów wodo-
ru. Dalsze badania ca³kowicie potwierdzi³y to wra¿e-
nie. Nie mog³o byæ w¹tpliwoœci, ¿e wodór ten pochodzi
wy³¹cznie z oddzia³ywania cz¹stki α z atomem azotu.
A wiêc j¹dro azotu zawiera j¹dra wodoru skoro je emi-
tuje. A wiêc j¹dro wodoru o jednostkowej masie niesie
elementarny ³adunek dodatni tak poszukiwany. Ruther-
ford nazwa³ ten elementarny ³adunek dodatni p
prro
otto
o-
n
ne
em
m
(grecki protos, προτοσ, znaczy pierwszy). Kiedy
jeszcze w azocie bombardowanym cz¹stkami α wykry-
to tlen, mo¿na by³o opisaæ ca³¹ sytuacjê jako szczegól-
ny przypadek rozpadu promieniotwórczego o którym
mówiliœmy powy¿ej, z tym, ¿e zosta³ on wywo³any
sztucznie przez cz³owieka a nie dany przez Naturê. Sy-
tuacjê tê mo¿na by³o zapisaæ w postaci:
N +
α
F*
O + p + γ,
wynikaj¹cej z nieco póŸniejszej wiedzy o powstawaniu
wzbudzonego (st¹d gwiazdka) stanu poœredniego j¹dra
fluoru, które rozpada siê natychmiast na tlen i wodór
emituj¹c nadmiar energii w postaci promieniowania
gamma.
Proton, czyli j¹dro atomu wodoru, stanowi³ jed-
noczeœnie jednostkow¹ masê atomow¹, dlatego Rut-
herford uwa¿a³, ¿e wszystkie j¹dra zbudowane s¹
z protonów i elektronów. Np. j¹dro helu, musi byæ z³o-
¿one z czterech protonów i dwóch elektronów, aby ³a-
dunek wypadkowy wynosi³ +2. W tej sytuacji elektron
i proton mog¹, a mo¿e musz¹ tworzyæ stabilny uk³ad
neutralny elektrycznie. Uk³ad taki Rutherford nazwa³
hipotetycznie neutronem. Je¿eli ten uk³ad jest stabil-
ny, to mo¿e bombardowanie innych j¹der cz¹stkami α
mo¿e taki neutron wyrzuciæ na zewn¹trz, jak to obser-
wowano w przypadku protonu. Neutron o energii zbli-
¿onej do energii cz¹stek α powinien byæ bardzo prze-
nikliwy przez wszystkie materia³y (bêd¹c neutralnym
elektrycznie nie doznaje rozpraszania przez si³y kulom-
bowskie j¹der atomowych) i mieæ wiele innych niez-
wyk³ych w³aœciwoœci. Kilku studentów Rutherforda na-
tychmiast zabra³o siê ostro za poszukiwania neutronu.
Niestety nic nie znaleŸli.
Aby dojœæ do odkrywcy neutronu musimy siê
cofn¹æ do czasów przed pierwsza wojn¹ œwiatow¹.
W 1911 roku na uniwersytecie w Manchesterze student
James Chadwick zrobi³ dyplom z fizyki i zacz¹³ praco-
waæ u Rutherforda. Dwa lata póŸniej postanowi³ wyje-
chaæ do Niemiec, aby pracowaæ z Hansem Geigerem,
który w³aœnie wróci³ do kraju po bardzo owocnym po-
bycie w Manchesterze. Zdaje siê, ¿e obydwaj nie bar-
dzo interesowali siê polityk¹, bo wojna zaskoczy³a
Chadwicka w Niemczech. Jako obywatel wrogiego
pañstwa mia³ status cywilnego jeñca wojennego, ale to
by³y jeszcze ca³kowicie inne czasy – móg³ utrzymywaæ
kontakt ze swoimi niemieckimi kolegami i mieæ dostêp
do ksi¹¿ek - oczywiœcie nie móg³ prowadziæ doœwiad-
czeñ. Po wojnie wróci³ do Manchesteru do swojego
mistrza Ernesta Rutherforda, a kiedy ten przeniós³ siê
do Cavendish Laboratory w Cambridge pod¹¿y³ za nim.
Czym siê teraz zajmowa³? Oczywiœcie poszukiwaniem
neutronu. Nikt nie przypuszcza³, ¿e potrwa to a¿ 14 lat.
Tymczasem badania przybli¿aj¹ce odkrycie neut-
ronu prowadzone by³y intensywnie w Niemczech i we
Francji. W Niemczech, Walther Bothe i Herbert Becker
w roku 1930, tak¿e zajmowali siê oddzia³ywaniem
cz¹stek α z lekkimi atomami. Bombarduj¹c czwarty
pierwiastek w uk³adzie okresowym, beryl, zauwa¿yli,
¿e emituje on nies³ychanie przenikliwe promieniowa-
nie, przechodz¹ce nawet przez 20 cm œcianê z o³owiu.
Promieniami berylowymi, jak je nazwano, zaintereso-
wali siê Francuzi, Irena Joliot-Curie i jej m¹¿ Frederic
Joliot, którzy zaobserwowali, ¿e je¿eli na drodze tych
promieni umieœci siê blok parafiny, zaczyna on emito-
waæ strumieñ bardzo szybkich protonów. I Niemcy
i Francuzi przypisali ten efekt wysokoenergetycznym
promieniom gamma. Cz³owiekiem, który siê z nimi nie
zgodzi³, by³ w³aœnie James Chadwick. Natychmiast
podj¹³ w³asne eksperymenty i w oparciu o wyniki uzys-
kane zarówno przez siebie jak i swoich poprzedników
postawi³ hipotezê, któr¹ przedstawi³ w krótkim komu-
nikacie w „Nature” z 27 lutego 1932 roku (bodaj¿e mie-
si¹c po publikacji swoich obserwacji przez ma³¿onków
Joliot) zatytu³owanym ostro¿nie Possible existence of
a neutron
. Fragment tego komunikatu (w swobodnym
przek³adzie) wyjaœnia sposób jego rozumowania. ...Te
wyniki i inne, które uzyska³em w czasie realizacji pracy,
s¹ bardzo trudne do wyjaœnienia przy za³o¿eniu, ¿e pro-
mieniowanie pochodz¹ce z berylu jest promieniowaniem
elektromagnetycznym
(w oryginale is a quantum radia-
tion
), je¿eli energia i pêd maj¹ byæ zachowane w zde-
rzeniach. Trudnoœci znikaj¹ jednak¿e, je¿eli za³o¿y siê,
¿e promieniowanie sk³ada siê z cz¹stek o masie 1 i ³a-
dunku 0, czyli z neutronów. Przechwycenie cz¹stki
α
1
1
17
8
→
18
9
→
14
7
14
7
James Chadwick (1891-1974) –
fizyk angielski, specjalista z zakresu
fizyki jądrowej i zastosowania ener-
gii jądrowej. Kształcił się w rodzin-
nym Manchesterze i w Cambridge.
Od 1923 był zastępcą dyrektora do spraw badań w Labo-
ratorium Cavendisha. W 1932 został członkiem Royal So-
ciety. Od 1935 wykładał kolejno na uniwersytetach w Liver-
poolu, Manchesterze i Cambridge. Głównym osiągnięciem
naukowym Chadwicka było odkrycie w 1932 neutronu –
obojętnej elektrycznie cząstki wchodzącej, obok dodatnio
naładowanego protonu, w skład jąder atomowych. Możli-
wość istnienia takiej cząstki przewidział teoretycznie
w 1920 Ernest Rutherford, który też nadał jej nazwę. Okry-
cie neutronu przyniosło uczonemu w 1935 Nagrodę Nobla.
P r o t o n , n e u t r o n i e l e k t r o n – 3 c z ą s t k i t w o r z ą c a ł ą m a t e r i ę .
C z y ż t o n i e j e s t p i ę k n e ? A ż z a p i ę k n e !
dokończenie na str. 57
M
Ł
ODY
TECHNIK
3/2005
5
55
5
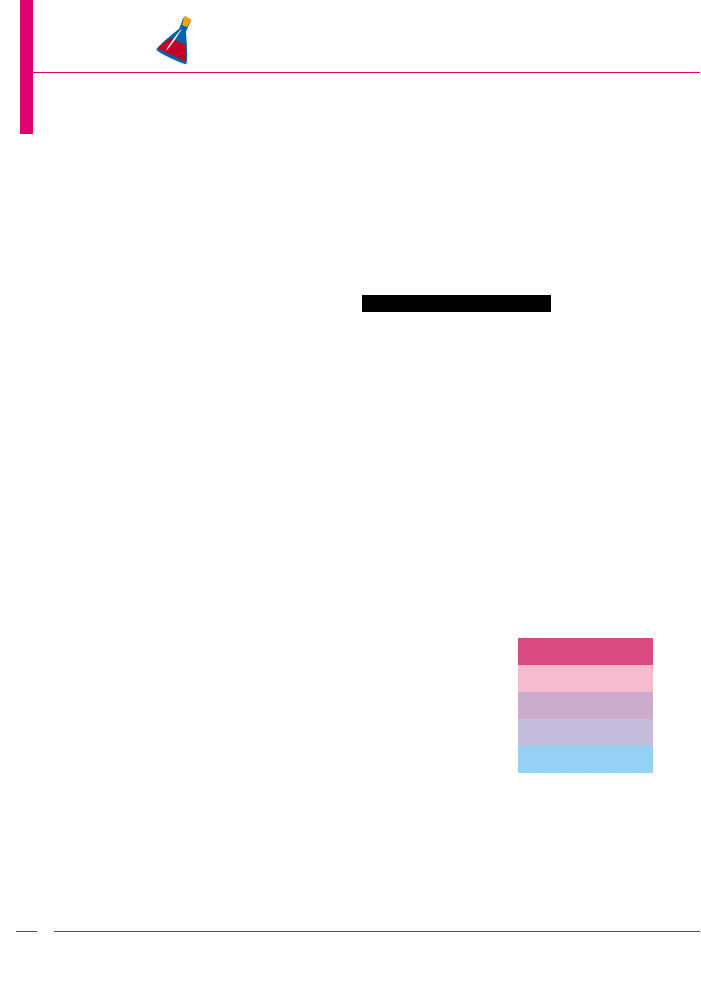
A
le my, chemicy, do budowy higrometru mo¿emy
z powodzeniem wykorzystaæ odpowiednie zwi¹zki
nieorganiczne. Nie jest przecie¿ dla nikogo tajemni-
c¹, ¿e s¹ zwi¹zki chemiczne zmieniaj¹ce sw¹ barwê
w zale¿noœci od stopnia uwodnienia cz¹steczek.
Najprostszym przyk³adem takiego zwi¹zku jest
siarczan miedzi (II). Otrzymany w zwyk³ych warunkach
poprzez krystalizacjê z wodnych roztworów tworzy
piêkne niebieskie kryszta³y o wzorze
CuSO
4
· 5H
2
O.
A wiêc na jedn¹ cz¹steczkê CuSO
4
przypada a¿
5 cz¹steczek H
2
O. Je¿eli jednak siarczan miedzi (II)
ogrzejemy do ok. 200°C, to z niebieskich kryszta³ów po-
wstanie bia³y proszek. Tworzy go bezwodny siarczan
miedzi (II) - CuSO
4
. I w³aœnie ten proszek pod wp³y-
wem wilgoci, zaczyna przybieraæ barwê niebiesk¹.
Przy budowie higrometru chemicznego wykorzy-
stamy jednak inne zwi¹zki, a mianowicie takie, jakie
w temperaturze otoczenia w sposób odwracalny zmie-
niaj¹ sw¹ barwê.
Pierwszym takim zwi¹zkiem jest chlorek miedzi
(II) CuCl
2
. Ten zwi¹zek tworzy zielonkawe kryszta³y,
w których na jedn¹ cz¹steczkê chlorku miedzi (II) przy-
pada jedna cz¹steczka wody -
CuCl
2
· 2H
2
O.
Zabarwienie tego zwi¹zku nie jest jednak inten-
sywne, bo pasek bibu³y czy papieru zanurzony w roz-
tworze po lekkim osuszeniu jest prawie bezbarwny.
Spróbujmy jednak taki pasek wysuszyæ dok³ad-
niej np. przy grzejniku. Wtedy pojawi siê wyraŸna bar-
wa ¿ó³ta. Jednak po lekkim nawil¿eniu w atmosferze
kuchni albo ³azienki barwa ¿ó³ta zniknie i pasek staje
siê znów bezbarwny.
I w tym przypadku mamy do czynienia ze zmia-
n¹ barwy wywo³an¹ ró¿n¹ zawartoœci¹ wody krysta-
licznej, bo kryszta³y
CuCl
2
· H
2
O
s¹ zielonkawe, a
CuCl
– ¿ó³te.
A teraz drugi kameleon chemiczny - intensyw-
nie czerwony chlorek kobaltu
CoCl
2
· H
2
O.
W miarê ogrzewania czy nawet przebywania w
suchej atmosferze chlorek kobaltu zaczyna traciæ jedn¹
po drugiej cz¹steczki wody krystalicznej, czerwieñ
przechodzi w ró¿, a¿ wreszcie w niebieski. W tym sta-
nie barwy wzór chlorku kobaltu jest taki - CoCl
2
·H
2
O.
Teraz przyst¹pimy do wykonania chemicznych
higrometrów. W 20 cm
3
wody rozpuszczamy 2 g po-
przednio namoczonej ¿elatyny i dodajemy 0,4g CoCl
2
.
Po wymieszaniu ca³oœci w roztworze takim zwil¿amy
paski bibu³y, bia³e papierowe kwiaty albo malujemy
pêdzelkiem na szkle pasy. Higrometr tego typu mo¿na
nazwaæ higrometrem granicznym, bo wyst¹pienie bar-
wy ¿ó³tej sygnalizuje bardzo ma³¹, skrajnie nisk¹ wil-
gotnoϾ powietrza. Takie powietrze spotykamy nieraz
w silnie ogrzewanych kaloryferami nieprzewietrzanych
pomieszczeniach. Jest ono dla naszego organizmu szko-
dliwe, powoduje pêkanie warg, suchoœæ w gardle i usz-
kodzenie œluzówek. St¹d wyst¹pienie ¿ó³tej barwy bê-
dzie sygna³em do nawil¿enia powietrza w takim wnêtrzu.
I teraz drugi przepis na wykonanie doskonal-
szego higrometru wskazuj¹cego nie tylko skrajne, ale
nawet i poœrednie stopnie wilgotnoœci powietrza.
Paski bibu³y moczy siê przez 10 minut w roztwo-
rze o takim sk³adzie:
woda
50 cm
3
chlorek kobaltu CoCl
2
·6H
2
O
7 g
chlorek sodu NaCl
5 g
chloran potasu KClO
3
2 g
dekstryna
2,5 g
W po³owie podanej iloœci zimnej wody rozrabia-
my dekstrynê, a w drugiej po³owie wody rozpuszczamy
pozosta³e sk³adniki. Oba roztwory zlewamy razem i do-
k³adnie mieszamy. Po namoczeniu pasków w tym roz-
tworze, rozwieszamy je tak ¿eby obciek³y i wysch³y. To
one sw¹ barw¹ bêd¹ nam sygnalizowa³y aktualn¹ wil-
gotnoϾ powietrza.
WilgotnoϾ powietrza
Barwa paska
bardzo du¿a (deszcz)
- ciemnoró¿owa
du¿a (przed i po deszczu)
- bladoró¿owa
œrednia (pogodnie)
- niebieskoró¿owa
ma³a (d³ugotrwa³a pogoda)
- niebieskolawendowa
bardzo ma³a
- b³êkitna
(susza, pomieszczenia zim¹)
Gotowy pasek bibu³y radzimy przypi¹æ pinezk¹
do korka, którym bêdzie zatkana krótka, ale szeroka
rurka szklana. Rurkê tak¹, otwart¹ od do³u, zawiesza-
my za oknem. Deszcze jej nie zaszkodz¹, a higrometr
bêdzie wskazywa³ aktualn¹ wilgotnoœæ atmosfery.
Przejdziemy teraz do chemicznego barometru
Zwyk³y barometr poprzez odkszta³cenie mem-
brany mierzy aktualne ciœnienie powietrza. Ale my mo-
¿emy tego dokonaæ poprzez reakcjê fizykochemiczn¹.
Higrometry, przyrządy służące do wskazywa-
nia wilgotności powietrza, są to proste urzą-
dzenia, w których czujnikiem, czyli elemen-
tem reagującym na zmiany wilgotności po-
wietrza, jest najczęściej włos koński albo
ludzki. Taki właśnie włos ludzki zmienia i to
znacznie, ale odwracalnie, swoją długość
w zależności od wilgotności powietrza.
TEKST
Ś
REDNIO TRUDNY
!!
!
c h e m i a p r a k t y c z n a
CHEMICZNE HIGROMETRY I BAROMETRY
S t e f a n S ę k o w s k i
M
Ł
ODY
TECHNIK
3/2005
5
56
6
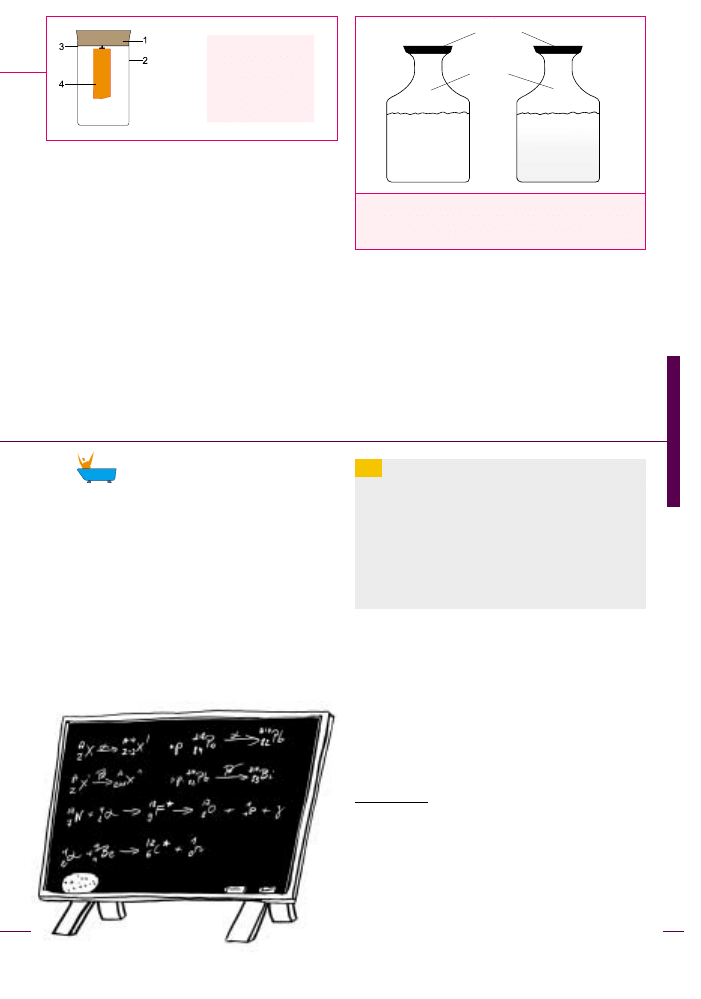
M
Ł
ODY
TECHNIK
3/2005
5
57
7
przez j¹dro Be
9
skutkuje utworzeniem j¹dra C
12
i emisj¹
neutronu
. W œwietle tej hipotezy, wszystko sta³o siê pro-
ste i to, co obserwowali Bothe i Becker a póŸniej ma³-
¿onkowie Joliot, mo¿na by³o zapisaæ w znanej postaci:
α + Be
C* + n .
Kilka miesiêcy póŸniej, Chadwick opublikowa³
w Proceedings of the Royal Society artyku³, którego ty-
tu³ The Existence of a Neutron nie pozostawia³ ju¿ ¿ad-
nych w¹tpliwoœci. Chadwick wyliczy³ masê neutronu
jako 1,0067 masy protonu. W przeprowadzonych doœ-
wiadczeniach w ¿aden sposób nie ujawnia³y siê pary
proton-elektron, których obecnoœæ w j¹drze zak³ada³
Rutherford. Elektrony by³y tylko na zewn¹trz j¹dra. Ne-
utron by³ wiêc trzeci¹, po elektronie i protonie, poszuki-
wan¹ cz¹stk¹ elementarn¹ odpowiedzialn¹ za masê
j¹dra atomowego. Nagle œwiat materialny sta³ siê pros-
ty i uporz¹dkowany jak uk³ad okresowy – wszystko by-
³o jasne – kolejnoœæ atomów i ich masy, z niewiado-
mych dotychczas powodów niebêd¹ce ca³kowitymi
wielokrotnoœciami masy jednostkowej. Liczba trzech
cz¹stek elementarnych, ujemnej, dodatniej i neutralnej
odpowiada³a estetycznej potrzebie prostoty i porz¹dku
w otaczaj¹cym œwiecie. Nad tym piêknym obrazem
unosi³o siê tylko niepokoj¹ce pytanie. Co, u licha trzy-
ma te protony i neutrony razem w j¹drze? Ale to ju¿
jest sprawa na inn¹ opowieœæ. !
1)
W polskiej literaturze naukowej znana jako reguła Soddego-Fajan-
sa. Kazimierz Fajans, urodził się w Warszawie w roku 1887. Studio-
wał chemię w Niemczech i Szwajcarii. W latach 1910-1911 praco-
wał u Rutherforda w Manchesterze nad szeregami promieniotwór-
czymi. Po powrocie do Niemiec, pracował dalej nad promieniot-
wórczością, najpierw jako asystent a później docent na Politechni-
ce w Karlsruhe aby w roku 1917 objąć Katedrę Chemii Fizycznej
Monachium. W 1935 roku opuścił Niemcy i wyjechał do Stanów
Zjednoczonych gdzie objął Katedrę Chemii w Uniwersytecie Stanu
Michigan w Ann Arbor. W Stanach pozostał do końca życia. Zmarł
w roku 1975. W roku 1924 był o krok od nagrody Nobla.
1
0
12
6
→
9
4
4
2
LEKSYKON
Ypres
– miasto w Belgii we Flandrii.
Okolice Ypres były miejscem trzech wielkich bitew podczas
I wojny światowej. Podczas pierwszej bitwy (31 październi-
ka - 22 listopada, 1914) Brytyjczycy przejęli miasto z rąk
Niemców. W drugiej bitwie (22 kwietnia - 22 maja, 1915)
Niemcy po raz pierwszy użyli gazów gazów bojowych na
froncie zachodnim. Podczas trzeciej bitwy (31 sierpnia -
10 października, 1917) po raz pierwszy użyto gazu musz-
tardowego, od nazwy miasta nazywanego iperytem.
j a k t o o d k r y l i
eureka!
Barometr chemiczny cieczowy to naczynie, np.
butelka, nape³niona 50% wodnoalkoholowym roztwo-
rem 6 g kamfory z dodatkiem 1 g azotanu potasu KNO
3
i 1,5 g chlorku amonu NH
4
Cl, zamkniête korkiem. Przy
wysokim ciœnieniu atmosferycznym, czyli zapowiedzi
dobrej pogody, ciecz w butelce jest przezroczysta.
W miarê spadku ciœnienia powietrza, ciecz w butelce
stopniowo mêtnieje.
Jak to dzia³a?
Podstawowym i jedynym czynnikiem zewnêtrz-
nym, jaki mo¿e i na pewno wywiera wp³yw na miesza-
ninê w butelce, jest ciœnienie powietrza.
Jak wiemy, zmiany ciœnienia powietrza nie tylko
towarzysz¹ ró¿nym zjawiskom atmosferycznym, jak np.
burza, deszcz, s³oneczna pogoda, ale bardzo czêsto te
zmiany poprzedzaj¹. Dla przyk³adu - spadek ciœnienia
nawet przy ³adnej, bezchmurnej pogodzie, zapowiada
zachmurzenie, deszcz albo burzê.
Zachodzi tu pytanie, czy zmiany ciœnienia powie-
trza mog¹ wywieraæ wp³yw poprzez korek na miesza-
ninê cieczy w butelce?
Oczywiœcie ¿e tak, ale pod warunkiem ¿e szyjkê
butelki zamkniemy nie korkiem gumowym czy z two-
rzywa sztucznego, ale z prawdziwego, naturalnego
korka. Taki korek jest na tyle porowaty, ¿e nie przepusz-
czaj¹c cieczy, przewodzi zmiany ciœnienia.
Zostaje jeszcze pytanie, co dzieje siê w butelce
pod wp³ywem zmian ciœnienia? - Zmienia siê rozpusz-
czalnoœæ poszczególnych zwi¹zków w wodzie. Zwróæ-
my uwagê, ¿e roztworem kamfory nie jest czysty alko-
hol etylowy, ale jego 50% wodny roztwór. W³aœnie roz-
puszczalnoϾ KNO
3
i NH
4
Cl zmienia siê razem z ciœnie-
niem, co powoduje wiêksze albo mniejsze mêtnienie al-
koholowego roztworu kamfory. !
Sposób instalacji
paska-higrometru
1 - korek naturalny
2 - rurka szklana
3 - pinezka
4 - pasek-higrometr
korek naturalny
naczynie szklane
Ciśnienie wysokie,
np. 1040 hPa,
ciecz w naczyniu przejrzysta
Ciśnienie niskie,
np. 950 hPa,
ciecz w naczyniu mętna
dokończenie ze str. 55
Wyszukiwarka
Podobne podstrony:
mitr protonowanie wody
Proton Manual
Protony spadają z powodu niebezpiecznej zawartości
6 proton
protonowanie wody
PROTON, FIZYKA
Brain Proton Magnetic Resonance Spectroscopy
Bose Proton amp
Protony spadają z powodu niebezpiecznej zawartości
Hadrony podobnie jak proton i neutron oddziałuja siłami wiążącymi jadra
NMR proton 2011
Inhibitory pompy protonowej, Pielęgniarstwo licencjat cm umk, III rok, Geriatria i pielęgniarstwo ge
jak kreci sie proton
3 T Proton MRS Investigation of Glutamate and Glutamine in Adolescents at High Genetic Risk for Schi
Chemia-atom-pojecia-ściągi, Liczba porz?dkowa-inaczej liczba atomowa, decyduje o ilo?ci proton?w w j
An in vivo Proton MRS study in schizohrenia patients
protony
mitr protonowanie wody
więcej podobnych podstron