
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 1064/2007
z dnia 17 wrze
śnia 2007 r.
zmieniaj
ące załącznik I do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego wspólnotową
procedur
ę dla określania maksymalnego limitu pozostałości weterynaryjnych produktów
leczniczych w
środkach spożywczych pochodzenia zwierzęcego w odniesieniu do awilamycyny
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzgl
ędniając Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę dla
okre
ślania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia
zwierz
ęcego (
1
), w szczególno
ści jego art. 2,
uwzgl
ędniając opinię Europejskiej Agencji Leków wydaną przez
Komitet ds. Weterynaryjnych Produktów Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje farmakologicznie czynne stosowane
we Wspólnocie w weterynaryjnych produktach leczni-
czych przeznaczonych do podawania zwierz
ętom, od
których lub z których pozyskuje si
ę żywność, powinny
by
ć oceniane zgodnie z rozporządzeniem (EWG)
nr 2377/90.
(2)
Do Europejskiej Agencji Leków zosta
ł złożony wniosek
o ustanowienie najwy
ższych dopuszczalnych poziomów
pozosta
łości dla awilamycyny, antybiotyku z grupy orto-
somycyn. Na podstawie zalecenia Komitetu ds. Wetery-
naryjnych Produktów Leczniczych substancj
ę tę należy
w
łączyć do załącznika I do rozporządzenia (EWG) nr
2377/90 w odniesieniu do trzody chlewnej (mi
ęśnie,
skóra i t
łuszcz, wątroba i nerki), królików (mięśnie,
t
łuszcz, wątroba i nerki) i drobiu (mięśnie, skóra
i t
łuszcz, wątroba i nerki), pod warunkiem że sustancja
ta nie jest stosowana u tych gatunków drobiu, których
jaja s
ą przeznaczone do spożycia przez ludzi.
(3)
W zwi
ązku z tym należy odpowiednio zmienić rozpo-
rz
ądzenie (EWG) nr 2377/90.
(4)
Nale
ży przewidzieć odpowiedni okres poprzedzający
stosowanie niniejszego rozporz
ądzenia, aby umożliwić
pa
ństwom członkowskim dostosowanie zezwoleń na
wprowadzenie do obrotu omawianych weterynaryjnych
produktów
leczniczych
udzielonych
zgodnie
z dyrektyw
ą 2001/82/WE Parlamentu Europejskiego
i Rady z dnia 6 listopada 2001 r. w sprawie wspólnoto-
wego kodeksu odnosz
ącego się do weterynaryjnych
produktów leczniczych (
2
), co mo
że okazać się konieczne
w
świetle niniejszego rozporządzenia.
(5)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artykuł 1
W za
łączniku I do rozporządzenia (EWG) nr 2377/90 wpro-
wadza si
ę zmiany zgodnie z załącznikiem do niniejszego rozpo-
rz
ądzenia.
Artykuł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po
jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporz
ądzenie stosuje się od dnia 18 listopada
2007 r.
PL
18.9.2007
Dziennik Urz
ędowy Unii Europejskiej
L 243/3
(
1
) Dz.U. L 224 z 18.8.1990, str. 1. Rozporz
ądzenie ostatnio zmie-
nione rozporz
ądzeniem Komisji (WE) nr 703/2007 (Dz.U. L 161
z 22.6.2007, str. 28).
(
2
) Dz.U. L 311 z 28.11.2001, str. 1. Dyrektywa ostatnio zmieniona
dyrektyw
ą 2004/28/WE (Dz.U. L 136 z 30.4.2004, str. 58).

Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
pa
ństwach członkowskich.
Sporz
ądzono w Brukseli, dnia 17 września 2007 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodniczący
PL
L 243/4
Dziennik Urz
ędowy Unii Europejskiej
18.9.2007
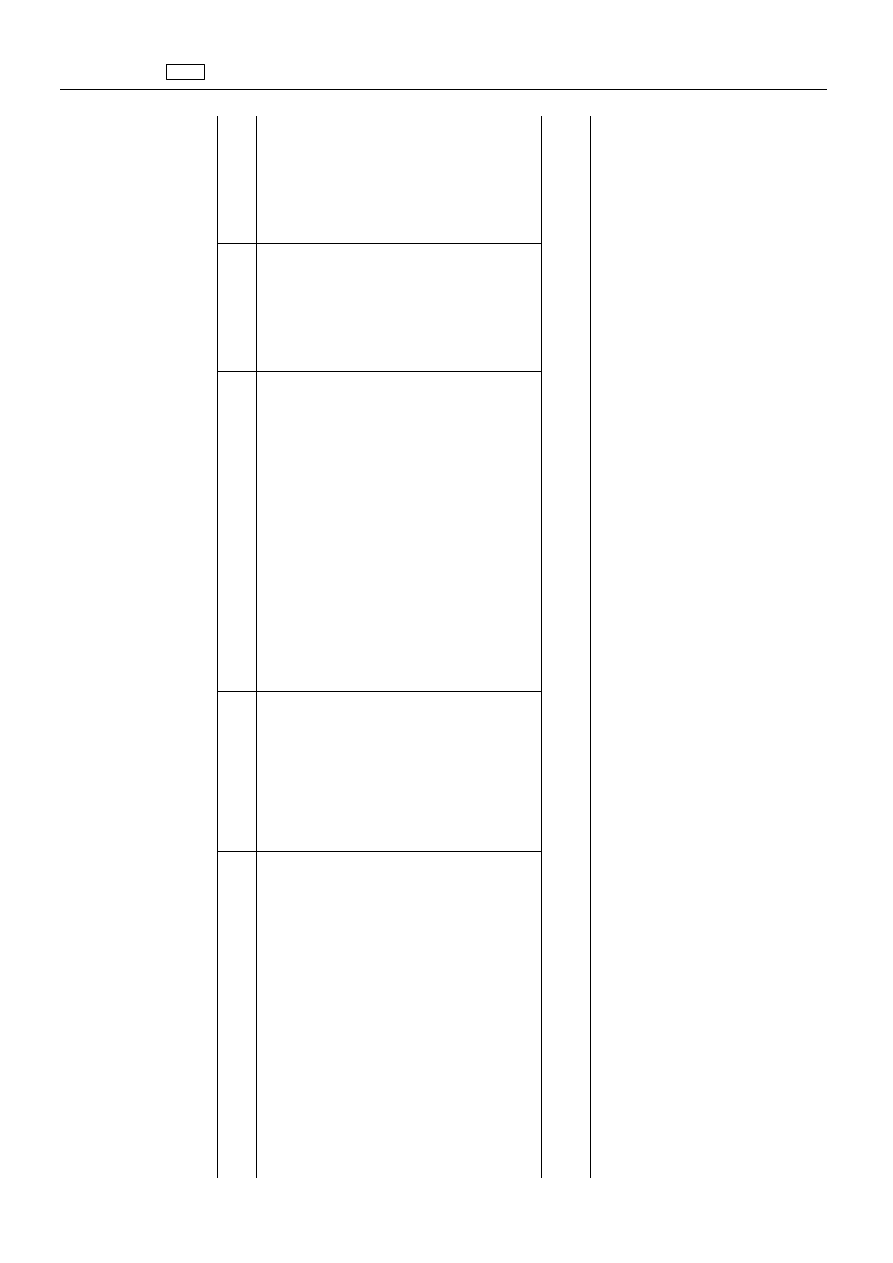
ZA
ŁĄ
CZNIK
Do
za
łą
cznika
I
do
rozporz
ądzenia
(EWG)
nr
2377/90
(Wykaz
substancji
farmakologicznie
czynnych,
dla
których
zosta
ły
ustalone
najwy
ższe
dopuszczalne
poziomy
pozosta
ło
ści)
dodaje
się
nast
ępuj
ąc
ą
substancj
ę:
1.
Środki
przeciwzaka
źne
1.2.
Antybiotyki
1.2.15.
Ortosomycyny
Substancja
farmakologicznie
czynna
Pozosta
ło
ść
znacznikowa
Gatunki
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
Awilamycyna
Kwas
dichloroizoewerni-
nowy
Trzoda
chlewna
50
μg/kg
Mi
ęś
nie
100
μg/kg
Tł
uszc
z
(
1
)
300
μg/kg
W
ątroba
200
μg/kg
Nerki
Króliki
50
μg/kg
Mi
ęś
nie
100
μg/kg
Tł
uszc
z
300
μg/kg
W
ątroba
200
μg/kg
Nerki
Drób
(
2
)5
0
μg/kg
Mi
ęś
nie
100
μg/kg
Tł
uszc
z
(
3
)
300
μg/kg
W
ątroba
200
μg/kg
Nerki
(
1
)
W
przypadku
trzody
chlewnej
i
drobiu
ten
najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
odnosi
si
ę
do
skóry
i
tł
uszczu,
w
naturalnych
proporcjach.
(
2
)
Nie
stosowa
ć
u
zwierz
ąt,
których
jaja
są
przeznaczone
do
spo
życia
przez
ludzi.
(
3
)
W
przypadku
trzody
chlewnej
i
drobiu
ten
najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
odnosi
si
ę
do
skóry
i
tł
uszczu,
w
naturalnych
proporcjach.
PL
18.9.2007
Dziennik Urz
ędowy Unii Europejskiej
L 243/5
Wyszukiwarka
Podobne podstrony:
(09) K 18 04 Pl omówienie
2002 09 18
pg 2005 09 18
12 09 18
09 (18)
09-18, sieci komputerowe
09-18, sieci komputerowe
SIMR-RR-EGZ-2012-09-18-rozw
SIMR-AN2-EGZ-2007-09-11b-rozw
elektro info projekt 2007 09 rys 1A dane slupa przelotowego
IPN 19 2007 09 07
E Maniewska, Prawo Wspólnotowe w orzecznic SN IP eps 2007 09 035
brzuch i miednica 2007 2008 18 01
elektro info 2007 09(1)(2)(1)
2002 09 18 Prezentac
więcej podobnych podstron