
WYTWARZANIE ENERGII W KOMÓRCE
Cechą organizmów żywych jest nieustanne przetwarzanie materii i energii, zwane metaboli-
zmem.
Równolegle funkcjonują dwa przeciwstawne procesy: katabolizm i anabolizm.
Wiele procesów zachodzących w organizmie, głównie tych anabolicznych, wymaga energii.
Organizmy autotroficzne mają zdolność przyswajania (asymilacji) światła i przetwarzania go
na inne formy energii - użyteczne w metabolizmie.
W organizmach heterotroficznych przebieg procesów zużywających energię jest możliwy
dzięki równocześnie zachodzącym procesom generującym energię.
Przekształcanie jednej formy energii w drugą zawsze odbywa się ze stratami.
Pewna jej część rozprasza się w postaci ciepła.
Zmiany energii swobodnej
Zawartość energii swobodnej w produktach reakcji jest niższa bądź wyższa od jej zawartości
w substratach reakcji.
Różnica ta nosi nazwę zmiany energii swobodnej (ΔG).
Wartość ta mierzona w standardowych warunkach (stężenie 1M, pH 7,0) nosi nazwę stan-
dardowej zmiany energii swobodnej i jest określona symbolem ΔG0.
Parametr ten jest wielkością teoretyczną, mierzoną przy bardzo wysokich, fizjologicznie nieo-
siągalnych stężeniach substratów.
Zmiana energii swobodnej (ΔG) układu reagującego zależy wyłącznie od jakości substratów i
produktów końcowych, a nie od drogi przebiegu reakcji.
Na przykład spalanie glukozy do CO2 i H2O in vitro, bez udziału enzymów, uwalnia tyle samo
energii, ile powstaje in vivo, w wyniku utleniania glukozy do tych samych produktów, zacho-
dzącego z udziałem wielu enzymów.
Jedyna różnica polega na tym, iż ten pierwszy proces przebiega gwałtownie, a całość wyzwo-
lonej energii rozprasza się w postaci ciepła.
Ten drugi natomiast, przebiega powoli, wieloetapowo, ze stopniowym wyzwalaniem energii,
której znaczna część (około 40%) jest magazynowana w postaci związków bogatych w energię,
a reszta rozprasza się w postaci ciepła.
Procesy kataboliczne przekształcają składniki tkanek do mniejszych, prostszych cząsteczek.
Sumaryczna wielkość ΔG tych procesów jest głęboko ujemna, chociaż niektóre etapy katabo-
lizmu mogą mieć ΔG0 o wartości dodatniej.
Zasadniczo jednak katabolizm jest procesem egzoergicznym, uwalniającym energię.
Procesy kataboliczne przekształcają różne złożone substraty w drobnocząsteczkowe produk-
ty, w wyniku czego uwalnia się energia.
Około 40% tej energii magazynuje się w postaci związków bogatych w energię, zwanych też
związkami makroergicznymi.
Tylko ta część energii jest użyteczna do celów metabolicznych. Pozostała (około 60%) rozpra-
sza się w postaci ciepła.
Procesy anaboliczne polegają na syntezie składników złożonych ze składników prostych z
wykorzystaniem energii uzyskanej w procesach katabolicznych.
Synteza zachodząca w układzie biologicznym nosi nazwę biosyntezy.
Sumaryczna wartość ΔG procesów anabolicznych jest wysoce dodatnia, jakkolwiek niektóre
reakcje składowe mogą wykazywać ΔG0 o wartości ujemnej.
Zasadniczo jednak anabolizm jest procesem endoergicznym, pochłaniającym energię.
Z pewnym uproszczeniem można przyjąć, iż źródłem energii dla organizmu ludzkiego jest
spalanie wodoru w tlenie.
Oczywiście substratem nie jest wodór atmosferyczny, lecz wysoko zredukowane substraty
energetyczne, które są dawcami atomów wodoru do reakcji utleniania.
Są nimi przede wszystkim: kwasy tłuszczowe (te cechują się najwyższym stopniem redukcji),
glukoza (i kilka innych cukrów prostych), glicerol, ciała ketonowe, a w znacznie mniejszym
stopniu szkielety węglowodorowe aminokwasów.
Poprzez szereg reakcji utleniania substraty te rozpadają się do CO2 i H2O.
Spalanie wodoru w tlenie zachodzące in vitro jest procesem gwałtownym i silnie egzoergicz-
nym.
Energia chemiczna zostaje zamieniona błyskawicznie i w całości na energię cieplną.
Spalanie wodoru w komórkach zachodzi powoli, wieloetapowo, a znacząca część uwalnianej
energii jest magazynowana w postaci energii chemicznej, której głównym nośnikiem staje się
bogaty w energię adenozynotrifosforan, wymieniany w literaturze i funkcjonujący w potocz-
nym nazewnictwie w formie skrótowej, jako ATP.
Substraty energetyczne lub pośrednie metabolity powstające w trakcie ich przemiany są
dawcami par atomów wodoru (2H+ + 2e–) dla specjalnych koenzymów, dinukleotydu nikoty-
noamidoadeninowego (NAD+) lub dinukleotydu flawinoadeninowego (FAD), tworząc ich zre-
dukowane formy: NADH+ + H+ i FADH2.
Te zredukowane koenzymy przekazują protony i elektrony na kolejne akceptory, a w końco-
wym etapie na atom tlenu, tworząc cząsteczkę H2O.
System przenośników protonów i elektronów z substratu energetycznego na tlen, prowadzący
do wytworzenia H2O, zlokalizowany w wewnętrznej błonie mitochondrialnej, nosi nazwę łań-
cucha oddechowego.
Elektrony, które przechodzą przez łańcuch oddechowy, tracą znaczną ilość ich wolnej energii.
Część tej energii jest przetwarzana w energię chemiczną i magazynowana w postaci ATP.
Proces powstawania ATP, sprzężony z funkcjonowaniem mitochondrialnego łańcucha odde-
chowego, nosi nazwę fosforylacji oksydacyjnej.
Przekazywanie energii
Energia zmagazynowana w postaci ATP jest zużytkowywana przede wszystkim:
-do skurczu mięśni szkieletowych,
-do skurczu mięśnia sercowego,
-do utrzymania gradientu stężeń jonów i metabolitów po obydwu stronach błon biologicznych,
dzielących wnętrze komórki na liczne przedziały,
-oraz na pokrycie potrzeb energetycznych procesów anabolicznych.
Biosynteza białka, kwasów tłuszczowych, triacylogliceroli, fosfolipidów, nukleotydów, ciał
ketonowych, cholesterolu, mocznika, glukozy, glikogenu, i innych składników tkankowych
wymaga energii pochodzącej z rozpadu ATP.
Także niektóre procesy kataboliczne potrzebują energii.
Na przykład włączenie glukozy do glikolizy wymaga na wstępie fosforylacji tego substratu
kosztem rozpadu ATP.
Podobna sytuacja dotyczy β-oksydacji kwasów tłuszczowych.
Każda cząsteczka tego substratu musi być najpierw poddana aktywacji poprzez przyłączenie
koenzymu A, co wymaga rozpadu cząsteczki ATP.
Sprzęganie procesów wytwarzających energią z procesami zużywającymi energię zachodzi
poprzez wspólne metabolity.
Jednym z nich jest ADP.
Jest on substratem zużywanym do syntezy ATP w procesach wytwarzających energię i pro-
duktem rozpadu ATP w procesach zużywających energię.
Rola wspólnych pośredników
Dwie reakcje chemiczne mają wspólne pośredniki, gdy produkt pierwszej reakcji jest substra-
tem w następnej reakcji:
A + B → C + D
D + X → Y + Z
D jest wspólnym pośrednikiem w tym ciągu reakcji i może służyć jako przenośnik energii
chemicznej pomiędzy dwiema reakcjami.
W wielu sprzężonych reakcjach funkcję takiego wspólnego pośrednika pełni ATP.
Jedne reakcje prowadzą do syntezy ATP poprzez przeniesienie reszty fosforanowej z bogatego
w energię pośrednika na ADP (fosforylacja substratowa), lub poprzez bezpośrednie wiązanie
fosforanu nieorganicznego z ADP kosztem energii wyzwalanej w trakcie transportu protonów i
elektronów przez mitochondrialny łańcuch oddechowy (fosforylacja oksydacyjna).
W innych reakcjach dochodzi do zużycia ATP.
Wykorzystanie energii zmagazynowanej w ATP zachodzi różnymi drogami.
W części przypadków dochodzi do rozpadu ATP z wytworzeniem ADP i fosforanu nieorganicz-
nego (Pi).
Natomiast w innych ATP rozpada się do adenozynomonofosforanu (AMP) i pirofosforanu nie-
organicznego (PPi).
W wielu sytuacjach energia zmagazynowana w ATP jest wykorzystywana poprzez przeniesie-
nie reszty fosforanowej z ATP na inną cząsteczkę, np. na glukozę, co aktywuje ten substrat i
umożliwia jego włączenie do różnych szlaków metabolicznych, jak glikoliza, szlak pentozo-
fosforanowy czy biosynteza glikogenu.
W niektórych przypadkach ATP (lub inny nukleotyd trifosforanowy) przekazuje energię w
sposób odmienny od wyżej opisanych.
Na przykład, aminokwas wchodzący jako substrat w proces biosyntezy białka jest wzbogaca-
ny w energię poprzez bezpośrednią interakcję z ATP.
Ten ostatni odłącza pirofosforan, a powstający AMP wiąże się z aminokwasem wiązaniem
bezwodnikowym, bogatym w energię.
Tak powstaje aminoacylo-AMP, który jest dawcą reszty aminokwasowej dla powstającego
łańcucha białkowego.
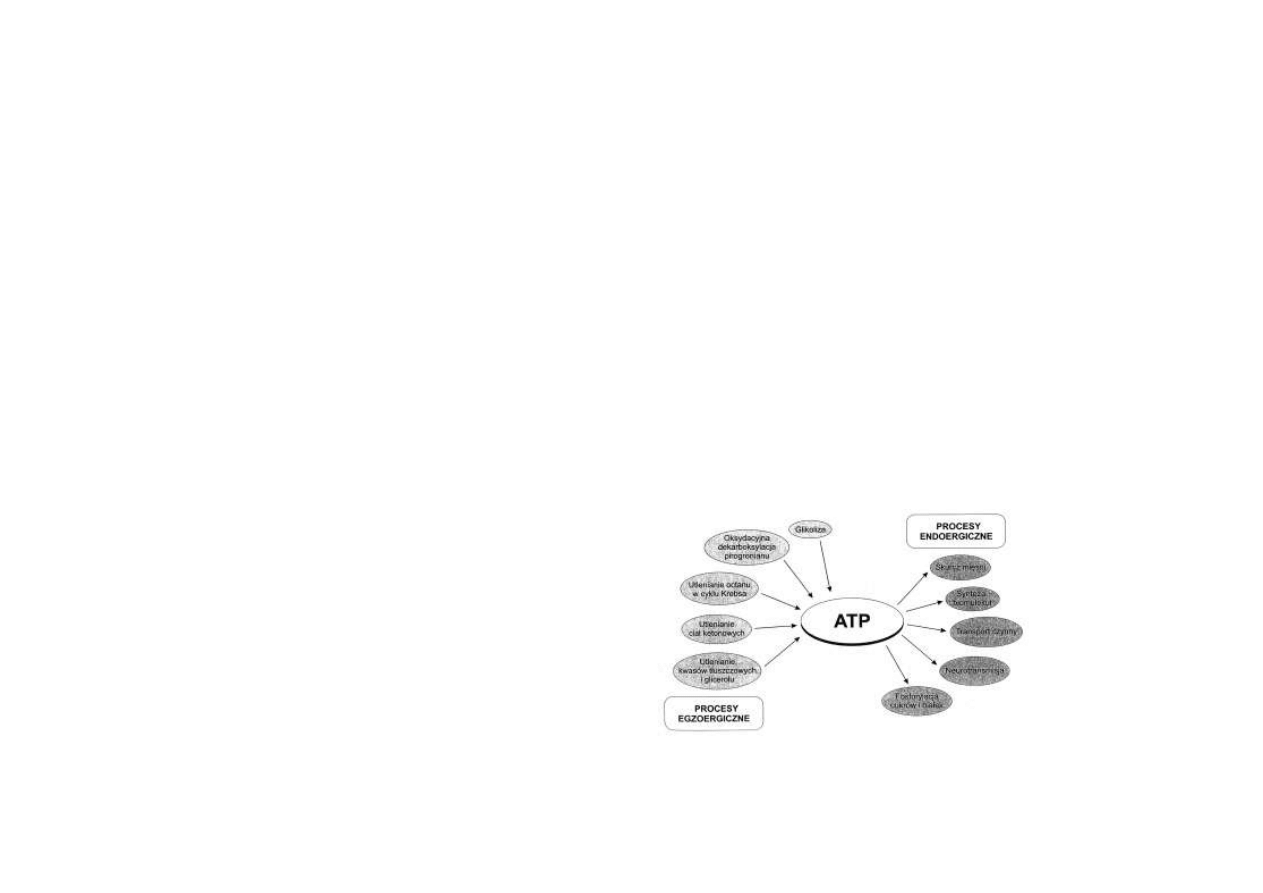
Szczególną rolę ATP w procesie integracji procesów egzoergicznych i endoergicznych przed-
stawia ryc. 4.1.
ATP jest produktem reakcji egzoergicznych i substratem zużywanym w procesach endoergicz-
nych.
W podobny sposób aktywują substraty inne nukleotydy trifosforanowe: urydynotrifosforan
(UTP) lub cytydynotrifosforan (CTP).
Rys. 4.1. ATP jako przenośnik energii między procesami egzoergicznymi a endoergicznymi.
Związki fosforanowe o wysokiej energii
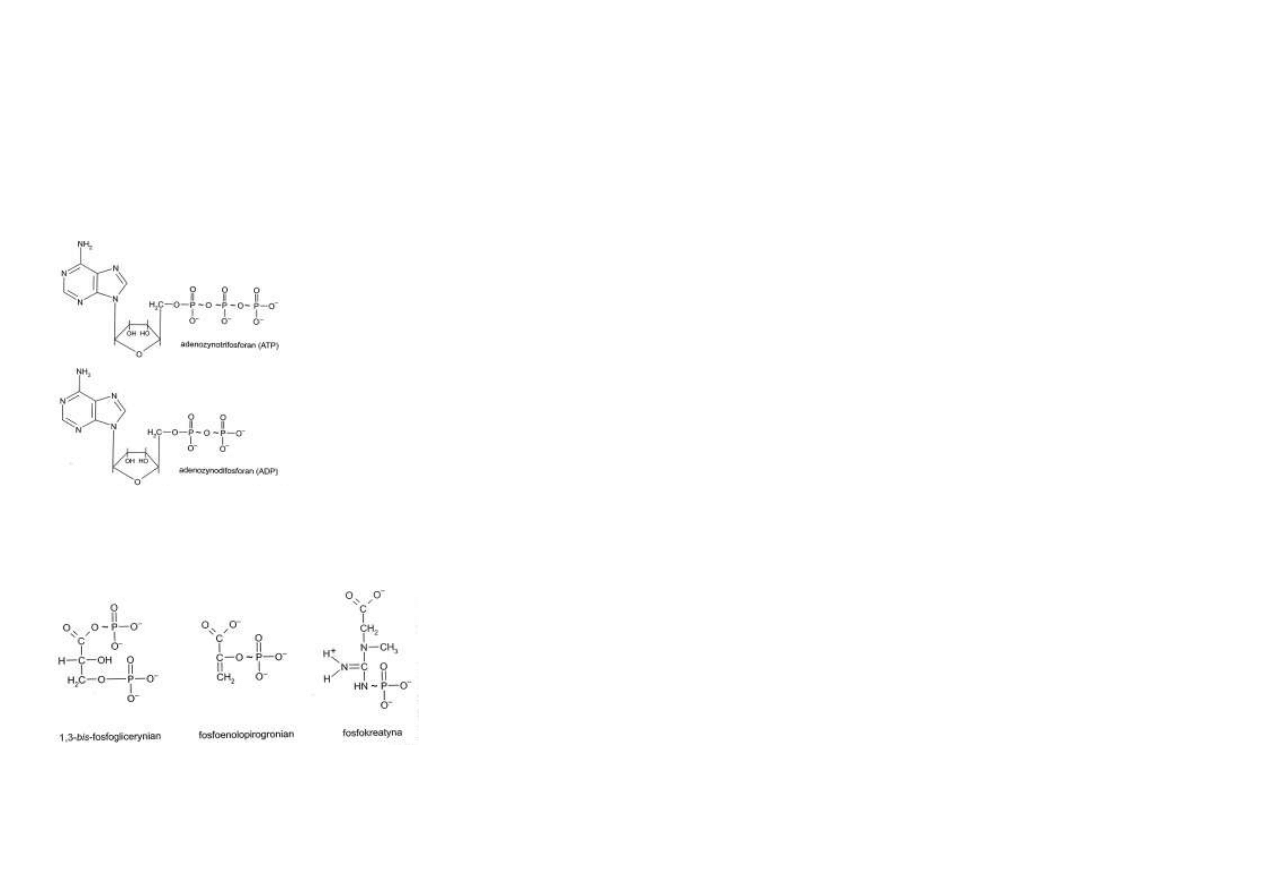
Głównymi nośnikami energii biologicznie użytecznej są ATP i inne nukleotydy trifosfora-
nowe, chociaż znaczenie tych ostatnich w bioenergetyce jest zdecydowanie mniejsze.
ATP jest nukleotydem trifosforanowym.
Składa się z adeniny, rybozy i trzech reszt kwasu ortofosforowego.
Jedna z nich jest połączona wiązaniem estrowym poprzez grupę -OH przy węglu 5’ rybozy a
wszystkie trzy pomiędzy sobą są zespolone wiązaniami bezwodnikowymi o wysokiej energii.
Cząsteczka ATP posiada dwa takie wiązania.
Jeżeli odłączy się jedna grupa fosforanowa, powstaje adenozynodifosforan (ADP), związek
posiadający jedno wiązanie bezwodnikowe, bogate w energię (ryc. 4.2).
Standardowa wolna energia ΔG° hydrolizy każdego
wiązania bezwodnikowego w ATP - wynosi około
30 kJ/mol.
Z powodu wysoko ujemnej wartości ΔG° tej reakcji,
ATP i ADP są nazywane związkami bogatymi w
energię.
Równolegle funkcjonują inne nazwy: związki „bo-
gatoenergetyczne”, „wysokoenergetyczne” lub
„makroergiczne”. ● Porównywalne wartości ΔG°
mają reakcje hydrolizy innych nukleotydów difos-
foranowych i trifosforanowych.
Rys. 4.2. Nukleotydy adeninowe (ATP i ADP) będące
nośnikami wiązań bogatych w energię.
Istnieją związki fosforanowe o zawartości energii
zadecydowanie wyższej niż w ATP.
Należą do nich: 1, 3-bisfosfoglicerynian, fosfoenolopirogronian i fosfokreatyna (ryc. 4.3).
Wartość ΔG° reakcji hydrolizy tych związków wynosi około 42 kJ/mol.
Nie mogą one jednak być bezpośrednimi dawcami energii dla reakcji endoergicznych.
Rys. 4.3. Związki fosforano-
we będące nośnikami energii
o wartości ΔGo wyższej niż
nukleotydy trifosforanowe.
Uczestniczą natomiast w
fosforylacji
substratowej,
czyli fosforylacji na poziomie
substratu.
Proces ten polega na tworze-
niu ATP kosztem rozpadu wspomnianych związków.
Nie jest związany z funkcjonowaniem łańcucha oddechowego.
Jest to drugi (obok fosforylacji oksydacyjnej) mechanizm tworzenia ATP, szczególnie ważny
dla komórek o metabolizmie beztlenowym.
Wśród związków tej grupy na szczególną uwagę zasługuje fosfokreatyna, która jest rezerwu-
arem energii potrzebnej do skurczu mięśnia.
Bezpośrednim dawcą energii dla tego procesu jest ATP, lecz jego zasoby w komórkach mię-
śniowych wystarczyłyby zaledwie na 1 do kilku sekund.
ATP musi więc być natychmiast odtwarzany.
Doraźny mechanizm szybkiego odtwarzania ATP polega na przenoszeniu reszty fosforanowej z
fosfokreatyny na ADP.
Reakcję tę katalizuje kinaza kreatynowa.
Fosfokreatyna + ADP ↔ ATP + kreatyna
Inne metabolity - zawierające grupy fosforanowe - cechują się niską zawartością energii.
Bezwzględna wartość ΔG° reakcji ich hydrolizy wynosi poniżej 17 kJ/mol.
Do nich należą przede wszystkim estry fosforanowe glicerolu, inozytolu, aminoalkoholi, cu-
krów prostych oraz wszystkie nukleotydy monofosforanowe.
Jak wynika z powyższych rozważań, ATP zajmuje pośrednią pozycję na skali bioenergetycznej
pomiędzy związkami fosforanowymi o bardzo wysokiej i niskiej energii.
ADP służy jako akceptor grup fosforanowych ze związków bardzo bogatych w energię.
Powstaje ATP, który jest dawcą grup fosforanowych dla innych składników komórek, tworząc
fosforany o niskiej energii.
Tak więc ATP pełni szczególną funkcję przekaźnika energii.
Nie ma bowiem w komórce innych mechanizmów, które mogłyby umożliwić przenoszenie grup
fosforanowych bezpośrednio z donorów o bardzo wysokiej energii na akceptory o niskiej ener-
gii, z pominięciem ATP.
Inne związki bogate w energię
Wiązania tioestrowe między siarką koenzymu A i grupą karboksylową kwasu organicznego
są także połączeniami bogatoenergetycznymi.
Niektóre z nich tworzą się kosztem rozpadu ATP do AMP i pirofosforanu (ryc. 4.4).
Kwasy tłuszczowe w formie aktywnej, jako acylo~S-CoA, mogą włączać się zarówno do proce-
su β-oksydacji, który jest szlakiem katabolicznym, jak i do biosyntezy estrów glicerolu lub
estrów cholesterolu, które to procesy są szlakami anabolicznymi.
Tak więc acylo~S-CoA jest kolejnym przykładem metabolitu sprzęgającego proces katabolicz-
ny z procesem anabolicznym.
Karbamoilofosforan (ryc. 4.4) jest produktem interakcji CO2 i NH3 w procesie biosyntezy
mocznika lub zasad pirymidynowych.
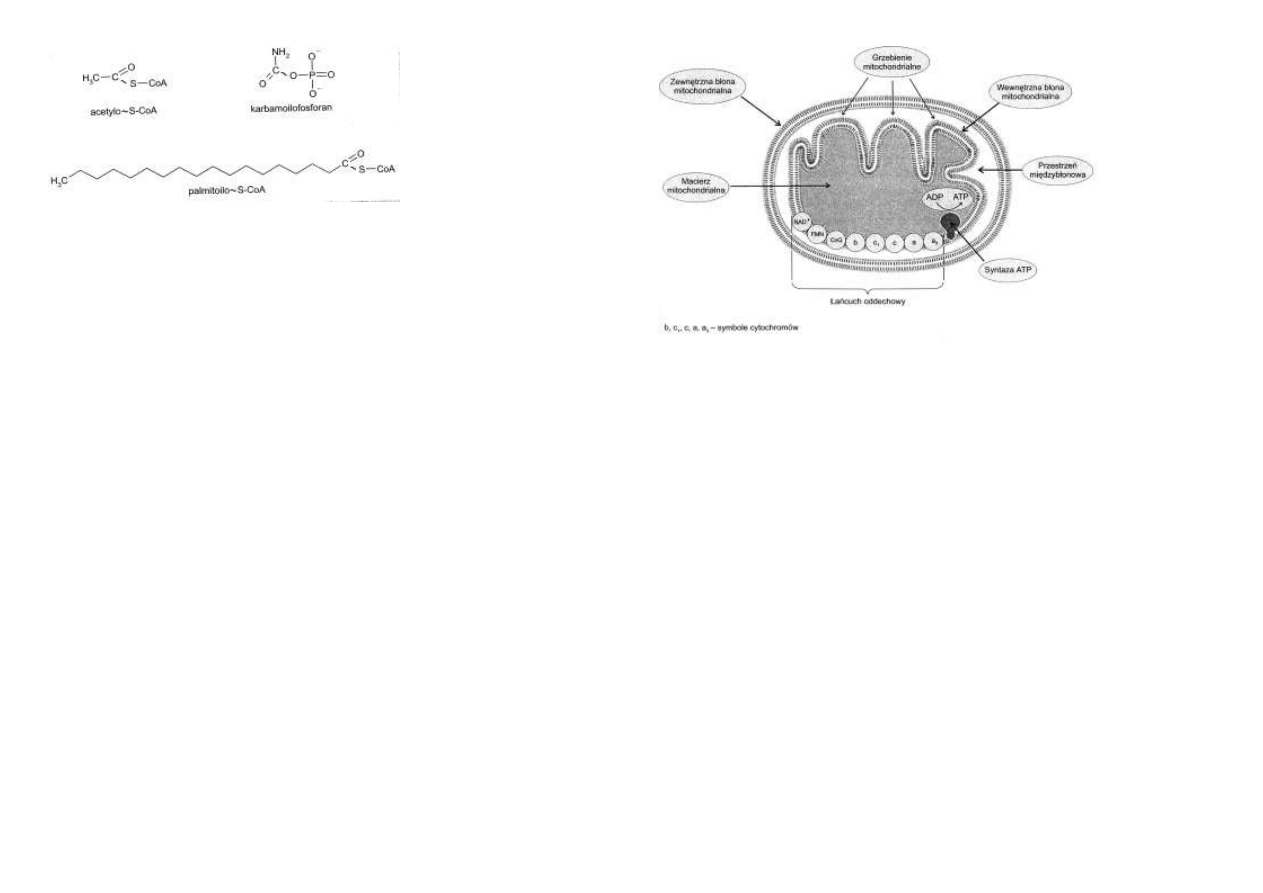
Jest on nośnikiem energii po-
chodzącej z rozpadu dwóch
cząsteczek ATP.
Rys. 4.4. Inne metabolity bogate
w energię.
Mitochondrium
Mitochondrium to organella komórkowa, pełniąca funkcję generatora energii.
Przetwarza energię chemiczną zawartą w substratach energetycznych w energię bezwodniko-
wych wiązań pirofosforanowych, zawartych w ATP.
Tylko ta postać energii jest użyteczna do napędzania reakcji endoergicznych w komórce.
Niektóre komórki, na przykład krwinki czerwone w ogóle nie posiadają mitochondriów.
Nie mają zdolności do utleniania substratów energetycznych do CO2 i H2O ani produkcji ATP
drogą fosforylacji oksydacyjnej.
Czerpią energię jedynie z beztlenowej przemiany glukozy zwanej glikolizą beztlenową, której
towarzyszy fosforylacja nieoksydacyjna, polegająca na tworzeniu ATP kosztem rozpadu
innych związków fosforanowych bogatych w energię: 1,3-bis-fosfoglicerynianu i fosfoenolopi-
rogronianu.
Mięsień sercowy, który potrzebuje dużo energii do utrzymania jego czynności skurczowej,
zawiera dużo mitochondriów.
Zajmują one około połowy objętości cytoplazmy.
Równie bogate w mitochondria są komórki wątrobowe, będące miejscem licznych procesów
biosyntezy, wymagających energii w postaci ATP.
Łańcuch transportu elektronów, zlokalizowany w wewnętrznej błonie mitochondrialnej, jest
wspólnym szlakiem, poprzez który elektrony pochodzące z różnych substratów energetycz-
nych przechodzą na tlen.
Transport elektronów i synteza ATP drogą fosforylacji oksydacyjnej zachodzi we wszystkich
komórkach zawierających mitochondria.
Błony mitochondrialne
Mitochondrium jest otoczone dwiema błonami: zewnętrzną i wewnętrzną.
Rozdziela je przestrzeń międzybłonowa.
Wnętrze mitochondrium wypełnia macierz mitochondrialna, obfitująca w liczne enzymy (ryc.
4.5).
Zewnętrzna błona mitochondrialna jest zbudowana z lipidów i białek występujących w
relacjach ilościowych 1:1.
Błona ta posia-
da liczne pory
pozwalające na
swobodne wni-
kanie do prze-
strzeni między-
błonowej więk-
szości jonów i
małych cząste-
czek.
Rys. 4.5. Sche-
mat
budowy
mitochondrium.
Wewnętrzna błona mitochondrialna jest nieprzepuszczalna dla większości jonów, np. H+,
Na+, K+ i małych cząsteczek, jak: ATP, ADP, pirogronian, kwasy tłuszczowe etc.
Istnieją wyspecjalizowane mechanizmy pozwalające na przemieszczanie wspomnianych
składników komórki w poprzek tej błony.
Zwraca uwagę fakt, iż wewnętrzna błona mitochondrialna jest szczególnie bogata w białka.
Stanowią one niemal 80% ich masy.
Połowa z nich uczestniczy w transporcie jonów H+, elektronów i w oksydacyjnej fosforylacji.
Znaczną ich część stanowią przenośniki transbłonowe.
Wśród białek enzymatycznych występują między innymi cytochromy: b, c, c1, a + a3, enzymy
utleniające, jak dehydrogenaza bursztynianowa, dehydrogenaza β-hydroksymaślanowa oraz
białka przenośnikowe.
Wewnętrzna błona mitochondrialna jest silnie pofałdowana.
Fałdy te noszą nazwę grzebieni mitochondrialnych.
Powodują one zwielokrotnienie powierzchni tej błony.
Po jej wewnętrznej stronie występują kuliste twory wystające w kierunku macierzy mitochon-
drialnej.
Taką postać przybiera syntaza ATP (ryc. 4.5).
Macierz mitochondrialna
Macierz mitochondrialna jest żelem wypełniającym wnętrze mitochondrium.
Jej dominującymi składnikami są białka, a wśród nich liczne enzymy uczestniczące w utle-
nianiu pirogronianu, aminokwasów, kwasów tłuszczowych i metabolitów cyklu kwasów tri-
karboksylowych oraz enzymy katalizujące niektóre reakcje biosyntezy mocznika i hemu.
Ponadto macierz zawiera NAD+ i FAD, które są akceptorami protonów i elektronów w reak-
cjach utleniania substratów energetycznych oraz ADP i fosforan nieorganiczny (Pi), potrzebne
do syntezy ATP.
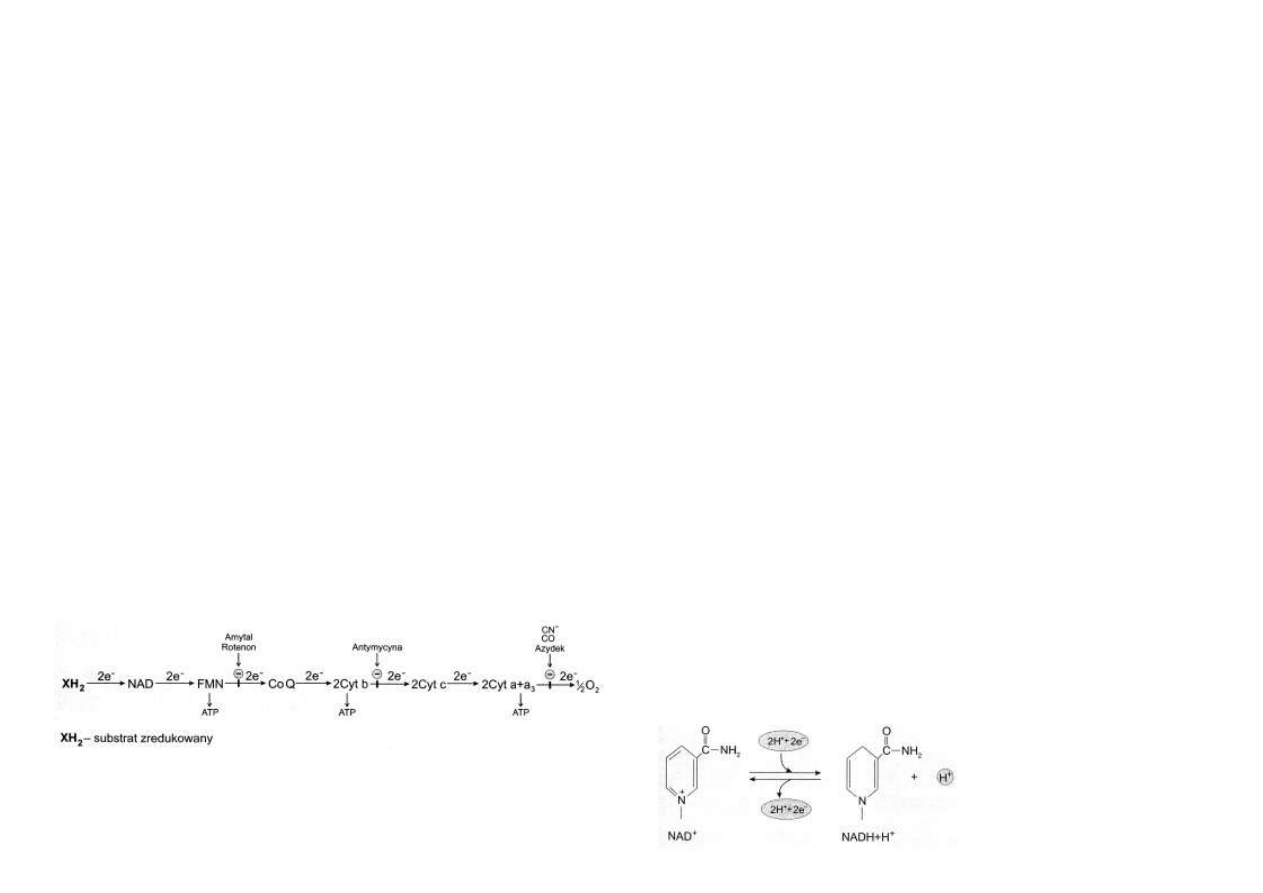
Organizacja łańcucha transportu protonów i elektronów
Transport protonów (H+) i elektronów (e–) z substratu energetycznego na tlen atmosferyczny
dostarczany do tkanek przez hemoglobinę jest procesem wieloetapowym i zachodzi z udziałem
szeregu ogniw pośrednich.
Pierwszym akceptorem atomów wodoru odłączanych od substratu jest najczęściej NAD+,
kolejnym FMN, następnym koenzym Q.
Do tego etapu transport protonów i elektronów przebiega wspólnie.
Począwszy od tego ostatniego dalsze przemieszczanie elektronów zachodzi niezależnie od
protonów.
Elektrony przechodzą poprzez cytochrom b, cytochrom c1, cytochrom c oraz cytochrom a
+ a3 na tlen.
Powstaje anion tlenkowy O2–, który wiąże się z dwoma protonami, tworząc cząsteczkę wody
(ryc. 4.6).
Mitochondrialny łańcuch oddechowy jest sprzężony w trzech miejscach z reakcjami fosforyla-
cji oksydacyjnej, w których ADP wiąże Pi, tworząc ATP.
Dlatego transport jednej pary atomów wodoru z substratu na tlen przy udziale NAD+ dostar-
cza trzech cząsteczek ATP.
Niektóre substraty energetyczne, jak bursztynian czy acylo~S-CoA, są utleniane przez dehy-
drogenazy zależne od FAD.
Pierścienie dimetyloizoalloksazyny wiążą dwa atomy wodoru, przekształcając FAD w FADH2.
Są one przekazywane z FADH2 bezpośrednio na koenzym Q, z pominięciem NAD+ i FMN, a
także miejsca pierwszej fosforylacji.
Z tego powodu reakcje utleniania substratów energetycznych, zachodzące z udziałem FAD,
dostarczają jedynie dwóch cząsteczek ATP w przeliczeniu na parę atomów wodoru (ryc. 4.6).
Rys. 4.6. Uproszczony schemat łańcucha oddechowego. Wskazano ogniwa tego łańcucha
sprzężone z fosforylacją oksydacyjną oraz miejsca działania inhibitorów transportu elektro-
nów.
Elementy składowe łańcucha transportu elektronów
Wszystkie elementy składowe łańcucha oddechowego, z wyjątkiem koenzymu Q, są białkami.
Niektóre z nich są enzymami, np. dehydrogenazy, cytochromy, inne są białkami nieenzyma-
tycznymi, zawierającymi centra żelazowo-siarkowe.
Te ostatnie są kompleksami żelaza i siarki o różnych relacjach ilościowych i o różnej struktu-
rze przestrzennej.
Jon Fe2+/3+, zawarty w centrach żelazowo-siarkowych, pośredniczy w przekazywaniu elek-
tronów między FMN a koenzymem Q oraz między cytochromem b a cytochromem c.
Każdy cytochrom zawiera cząsteczkę hemu z jonem Fe2+/3+, a cytochrom a+a3 zawiera
dodatkowo jon Cu+/2+.
NAD+. Liczne dehydrogenazy współdziałają z NAD+.
Utleniają substraty, odłączając od nich pary atomów wodoru i dzieląc je równocześnie w
bardzo szczególny sposób.
Jeden z atomów wodoru jest w całości wiązany przez pierścień kwasu nikotynowego, zawarte-
go w NAD+.
Następuje zanik jednego z podwójnych wiązań.
Natomiast drugi atom wodoru dysocjuje na elektron i proton.
Elektron wiąże się z atomem azotu w pierścieniu kwasu nikotynowego, zobojętnia jego ładu-
nek dodatni, natomiast powstały proton jest uwalniany do środowiska reakcji (ryc.4.7).
Dlatego przebieg procesu utleniania uwodornionego substratu (XH2) przez NAD+ przyjęto
zapisywać w sposób następujący:
XH2 + NAD+ → X + NADH + H+
W wielu przypadkach reakcji oksydoredukcji zachodzących z udziałem NAD+ w ogóle nie
wymienia się H+ jako uczestnika reakcji, traktując jego obecność jako rzecz oczywistą.
Taką uproszczoną formę zapisu stosują także liczne podręczniki biochemii.
XH2 + NAD+ → X + NADH
Skutek sumaryczny reakcji jest taki, iż pierścień kwasu nikotynowego wiąże jeden proton i
dwa elektrony (H+ + 2e–), zamieniając NAD+ w NADH.
To tak, jakby NAD+ związał anion wodorkowy (H–), czyli (H+ + 2e–).
Ryc. 4.7 przedstawia przekształcenia zachodzące w pierścieniu kwasu nikotynowego w wyni-
ku redukcji NAD+ do NADH.
Para elektronów (2e–) związana z NADH i przekazywana na kolejne ogniwa łańcucha odde-
chowego nosi nazwę równoważnika
redukcyjnego.
Rys. 4.7. Zmiany w strukturze pierście-
nia nikotynowego w następstwie reduk-
cji NAD+ do NADH.
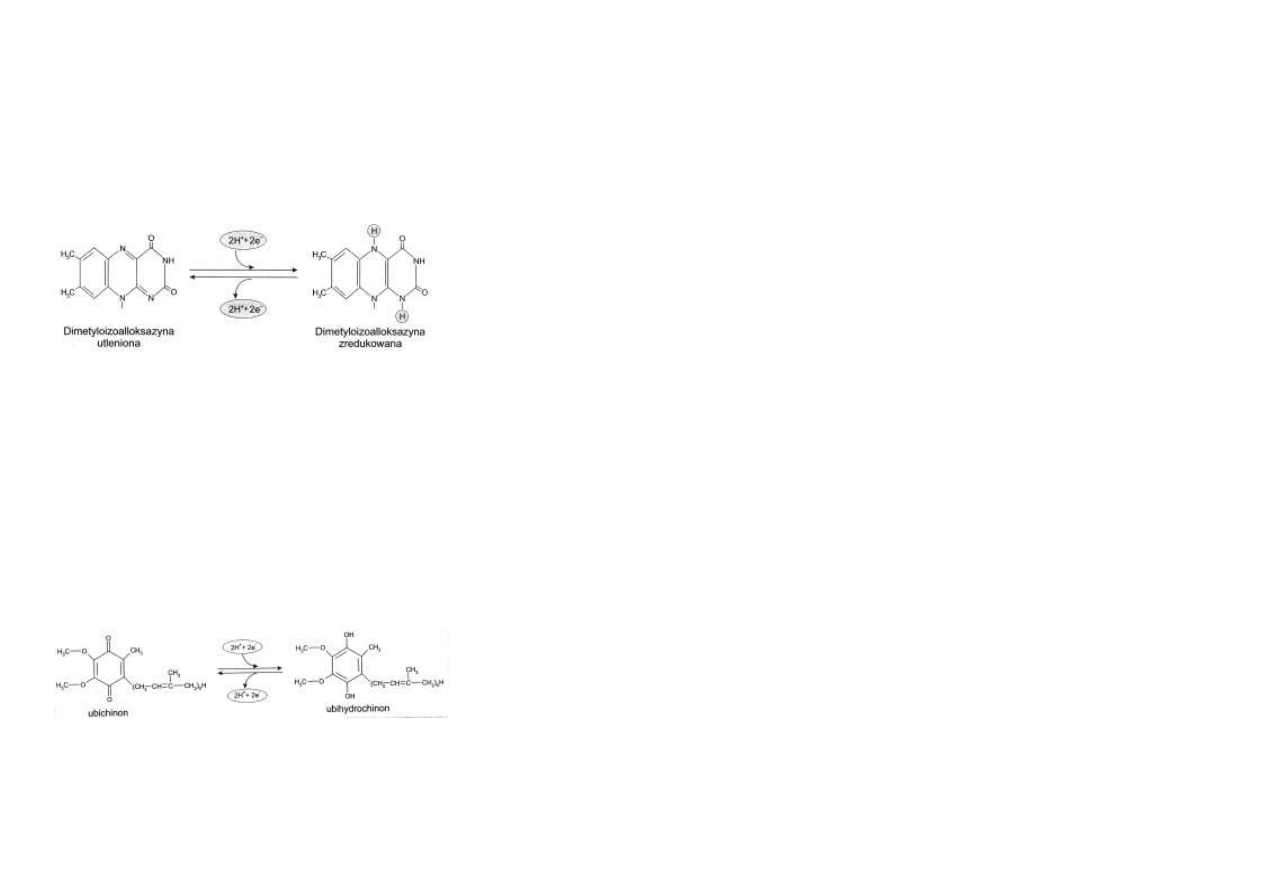
FMN. Wolny proton (H+) oraz jon wodorkowy (H+ + 2e–) zawarty w NADH, są przenoszone na
kolejny akceptor, którym jest FMN.
Koenzym ten jest składnikiem dehydrogenazy NADH - kompleksu enzymatycznego zawartego
w wewnętrznej błonie mitochondrialnej.
Enzym ten pobiera 2 protony i 2 elektrony z NADH+H+, przekształcając FMN w FMNH2.
Ryc.4.8 przedstawia przekształcenia zachodzące w dwóch pierścieniach dimetyloizoalloksazy-
ny w wyniku redukcji FMN do FMNH2.
W kolejnym etapie ten sam enzym przekazuje 2H+ i 2e– z FMNH2 na koenzym Q.
Rys. 4.8. Zmiany w struk-
turze pierścienia dimetylo-
izoalloksazyny w następ-
stwie redukcji FMN do
FMNH2 lub FAD do
FADH2.
Koenzym Q, czyli ubi-
chinon, jest związkiem zawierającym pierścień chinonowy, połączony z długim łańcuchem
izoprenoidowym.
W skład tego łańcucha wchodzi od 6 do 10 jednostek izoprenowych (ryc. 4.9).
Właściwym przenośnikiem pary protonów i elektronów (2H+ +2e–) jest pierścień chininowy.
Długi hydrofobowy łańcuch izoprenoidowy umożliwia zakotwiczenie koenzymu Q w lipido-
wych składnikach wewnętrznej błony mitochondrialnej.
Koenzym Q może przejmować atomy wodoru zarówno z FMNH2 jak i z FADH2.
Przyłączenie pary atomów wodoru sprawia, iż ubichinon przechodzi w ubihydrochinon, ina-
czej ubichinol.
Na etapie koenzymu Q kończy się wspólny szlak transportu protonów i elektronów.
W dalszych etapach następuje przemieszczanie pojedynczych elektronów pomiędzy kolejnymi
ogniwami łańcucha oddechowego.
Rys. 4.9. Zmiany w
strukturze koenzymu Q
(ubichinonu) w następ-
stwie jego redukcji do
ubihydrochinonu.
Cytochromy są biał-
kami o niewielkiej masie cząsteczkowej, od 13 do 22 kDa.
Każdy z nich wiąże cząsteczkę hemu, zawierającą jon Fe2+/3+.
W przeciwieństwie do hemu zawartego w hemoglobinie lub w mioglobinie żelazo cytochromo-
we jest łatwo i odwracalnie utleniane i redukowane: z Fe2+ do Fe3+ i odwrotnie.
Dzięki tej właściwości cytochromy stają się na przemian dawcami i akceptorami elektronów w
łańcuchu oddechowym.
Funkcjonują w następującym porządku:
KoQ → 2cyt b → 2 cyt. c1 → 2 cyt c → 2 cyt a + a3 → ½ O2
Bardzo dobrze poznano strukturę cytochromu c.
Enzym ten składa się ze 103 reszt aminokwasowych i zawiera grupę prostetyczną w postaci
hemu C, powiązanego z białkiem dwoma wiązaniami kowalencyjnymi.
W przeciwieństwie do innych cytochromów jest dobrze rozpuszczalny w wodzie i łatwo poddaje
się procedurom stosowanym w izolacji i oczyszczaniu białek.
Pozostałe cytochromy są trwale wbudowane w strukturę wewnętrznej błony mitochondrialnej.
Trudno je wyizolować i oczyścić.
Cytochrom a + a3 jest końcowym ogniwem w łańcuchu transportu elektronów, który prze-
kazuje je na tlen.
W tym miejscu elektrony, atom tlenu i wolne protony wiążą się, wytwarzając cząsteczkę H2O.
Składa się z 6 podjednostek.
Wśród nich występują 2 podjednostki a i 4 podjednostki a3.
Każda z nich wiąże cząsteczkę hemu A, różniącą się od hemu C występującego w hemoglobi-
nie, mioglobinie i cytochromie c.
Hem A (w odróżnieniu od hemu C) nie tworzy wiązań kowalencyjnych z białkiem enzymatycz-
nym.
Wiąże się zarówno z podjednostkami a, jak i z podjednostkami a3, jedynie poprzez wiązania
koordynacyjne.
Cytochrom a i cytochrom a3 są właściwie identycznymi białkami, a różnią się jedynie lokali-
zacją w wewnętrznej błonie mitochondrialnej.
To sprawia, iż podjednostki te funkcjonują w nieco innym mikrośrodowisku, stąd różnią się
właściwościami katalitycznymi.
Kompleksy oddechowe
Elementy składowe łańcucha oddechowego, zawarte w wewnętrznej błonie mitochondrialnej,
są zgrupowane w pięć kompleksów, zwanych kompleksami oddechowymi.
Są one oznaczane cyframi rzymskimi od I do V.
Kompleksy od I do IV zawierają fragmenty łańcucha oddechowego, natomiast kompleks V jest
układem syntetyzującym ATP.
Kompleks I - oksydoreduktaza NADH : ubichinon, zwany także dehydrogenazą NADH,
zawiera białka Fe:S.
Funkcję przenośnika dwóch atomów wodoru (2H++2e–) pełni trwale związana cząsteczka
FMN.
Pobiera ona 2H+ + 2e– z NADH + H+, przechodząc w FMNH2 i przekazując je następnie na
ubichinon.
Proces ten jest sprzężony z reakcją fosforylacji ADP i powstaniem pierwszej cząsteczki ATP.
Kompleks II - oksydoreduktaza bursztynian : ubichinon, uczestniczy w utlenianiu bursz-
tynianu.
Jest kompleksem białka enzymatycznego: dehydrogenazy bursztynianowej (zawierającej FAD
oraz białek Fe:S).
Przekształca ubichinon w ubichinol.
Kompleks III - oksydoreduktaza ubichinol : utleniony cytochrom c.
Zawiera cytochrom b, białka Fe:S oraz cytochrom c1.
Przenosi elektrony z ubichinolu, poprzez cytochrom b na cytochrom c.
Proces ten jest sprzężony z reakcją fosforylacji ADP i powstaniem drugiej cząsteczki ATP.
Kompleks IV - oksydoreduktaza zredukowany cytochrom c : tlen.
Zwany jest także oksydazą cytochromową.
Zawiera cytochromy a i a3.
Przekazuje elektrony ze zredukowanego cytochromu c, poprzez cytochrom a + a3 na tlen.
Proces ten jest sprzężony z reakcją fosforylacji ADP i powstaniem trzeciej cząsteczki ATP.
Kompleks V - syntaza ATP.
Jest to kompleks enzymatyczny, przekształcający energię wyzwalaną przez łańcuch oddecho-
wy w energię wiązań pirofosforanowych.
Wiąże ADP z fosforanem nieorganicznym (Pi), tworząc ATP.
Jak przedstawiono na ryc. 4.6 transport jednej pary atomów wodoru z substratu przez dehy-
drogenazę zależną od NAD+ i kolejne ogniwa łańcucha oddechowego na atom tlenu wiąże się
z powstaniem 3 cząsteczek ATP, przy zużyciu 3 cząsteczek nieorganicznego fosforanu.
Stosunek molowy zużytego fosforanu do zużytego tlenu (stosunek P:O) wynosi 3.
Utlenienie substratu przez dehydrogenazę zależną od FAD i kolejne ogniwa łańcucha odde-
chowego pomija miejsce pierwszej fosforylacjii i dostarcza jedynie 2 cząsteczek ATP.
W tej sytuacji stosunek P : O wynosi 2.
Fosforylacja oksydacyjna
Transport elektronów poprzez łańcuch oddechowy jest procesem energetycznie korzystnym,
ponieważ NADH jest „hojnym” dawcą, a tlen cząsteczkowy jest „chciwym” biorcą elektronów.
Jednak przepływ elektronów z NADH na tlen nie prowadzi bezpośrednio do syntezy ATP.
Mechanizm sprzężenia transportu elektronów przez łańcuch oddechowy z syntezą ATP, za-
chodzącą drogą wiązania nieorganicznego fosforanu przez ADP, jest przedmiotem kilku hipo-
tez.
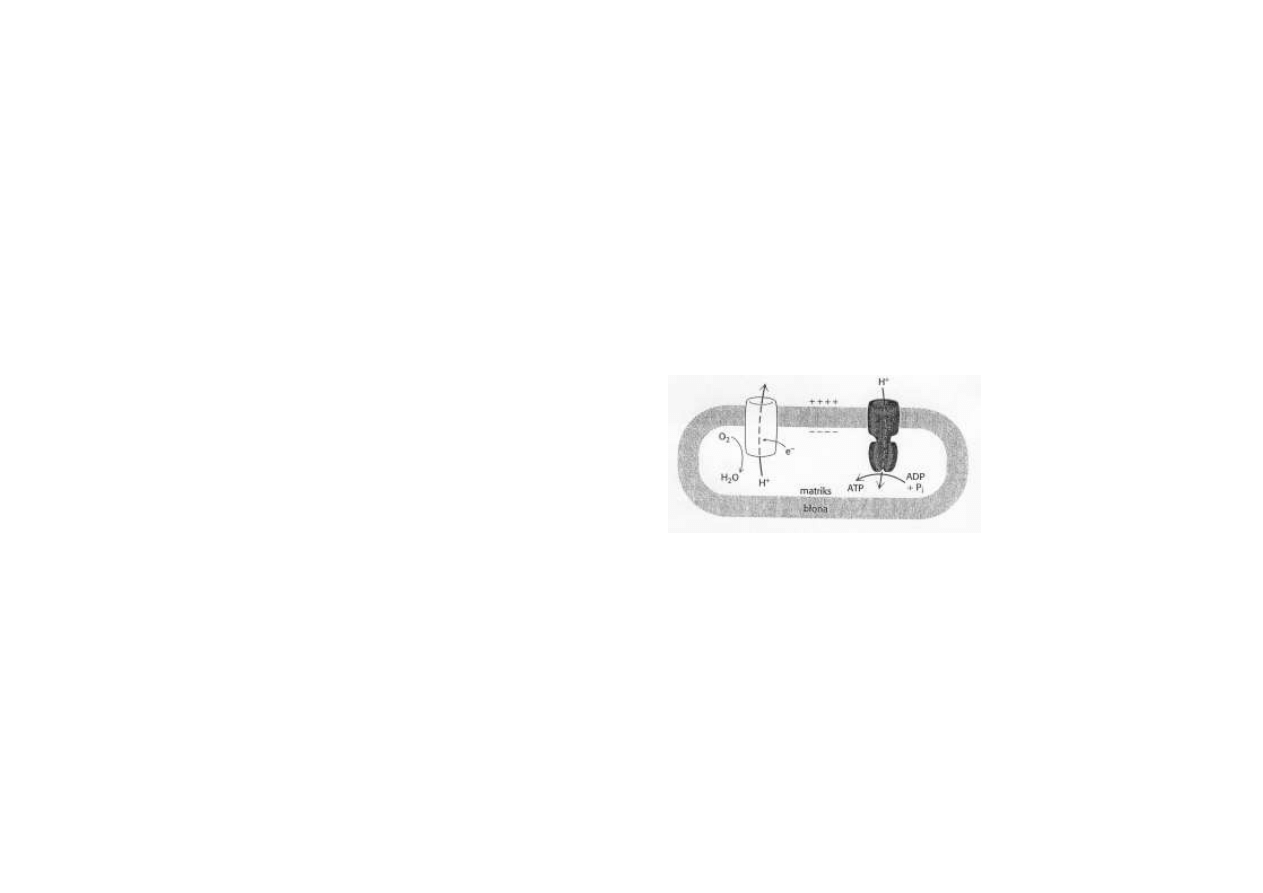
Najbardziej przekonywającą wydaje się niżej przedstawiona teoria chemioosmotyczna (Peter
Mitchell 1969).
Teoria ta zakłada, iż kompleksy oddechowe: I, III i IV pełnią funkcję pompy protonowej.
Funkcjonowanie wspomnianej pompy sprawia, iż transport elektronów przez łańcuch odde-
chowy jest sprzężony z równoczesnym przemieszczaniem protonów (H+) w poprzek wewnętrz-
nej błony mitochondrialnej, od strony macierzy w kierunku przestrzeni międzybłonowej.
Zakłada się, iż transportowi jednej pary elektronów z NADH na atom tlenu towarzyszy prze-
mieszczenie 3 par protonów na zewnętrzną powierzchnię wewnętrznej błony mitochondrial-
nej.
Proces ten wytwarza gradient elektryczny i gradient pH po obydwu stronach tej błony.
Strona zewnętrzna staje się naładowana bardziej dodatnio, niż strona wewnętrzna, a wartość
pH po stronie zewnętrznej staje się niższa, niż po stronie wewnętrznej.
Teoria chemiosmotyczna zakłada, że protony przeniesione na zewnętrzną powierzchnię
wewnętrznej błony mitochondrialnej wracają do macierzy mitochondrialnej poprzez kanał w
cząsteczce syntazy ATP.
Rozładowuje to gradient elektryczny i gradient pH po obydwu stronach wewnętrznej błony
mitochondrialnej, co wyzwala ener-
gię pozwalającą na wytworzenie
wiązania bezwodnikowego między
ADP i Pi z wytworzeniem ATP.
Rys. Istota fosforylacji oksydacyjnej.
Utlenianie jest sprzężone z syntezą
ATP przez transbłonowy przepływ
protonów.
Na korzyść tej teorii przemawiają
następujące fakty.
Oligomycyna (jeden z antybiotyków) wiąże się z syntazą ATP, zamykając kanał protonowy i
zapobiegając powrotowi protonów do macierzy mitochondrialnej.
Gradient elektryczny i gradient pH, wywołane przez transport protonów nie mogą być rozła-
dowane, a pompa protonowa nie może go powiększać poza pewne granice.
Ponieważ funkcjonowanie łańcucha oddechowego i pompy protonowej są ze sobą sprzężone,
zahamowanie tej drugiej zatrzymuje transport elektronów.
Jednocześnie ustaje synteza ATP.
Dodanie kwasu (źródła protonów) do zawiesiny mitochondriów prowadzi do wytwarzania w
nich ATP.
Oznacza to, iż warunkiem fosforylacji oksydacyjnej jest obecność protonów na zewnątrz mito-
chondrium.
Fosforylacja oksydacyjna nie zachodzi w układzie rozpuszczalnym, który nie daje możliwości
wytwarzania gradientu elektrycznego i gradientu pH.
Transport elektronów i fosforylacja oksydacyjna są ze sobą sprzężone.

Jeżeli zostanie zahamowane funkcjonowanie łańcucha oddechowego, ustaje fosforylacja ok-
sydacyjna.
Możliwe jest jednak zahamowanie fosforylacji przy zachowaniu transportu elektronów przez
łańcuch oddechowy.
Takie zjawisko nosi nazwę rozprzężenia fosforylacji oksydacyjnej.
Wywołują je substancje, które zwiększają przepuszczalność wewnętrznej błony mitochon-
drialnej dla protonów i uniemożliwiają wytworzenie gradientu H+ po obydwu jej stronach.
Takie właściwości mają przede wszystkim słabe kwasy aromatyczne, na przykład 2,4-
dinitrofenol - substancja o dużym powinowactwie do lipidów błonowych.
Łatwo wbudowuje się w strukturę wewnętrznej błony mitochondrialnej, prowadząc do na-
tychmiastowego rozładowania gradientu protonów po obydwu jej stronach.
W tej sytuacji transport elektronów zachodzi prawidłowo, lecz nie prowadzi to do powstania
gradientu protonów po obydwu stronach tej błony.
Energia uwalniana przez transport elektronów nie może napędzać syntezy ATP, lecz rozprasza
się w postaci ciepła.
Podobny efekt wywierają dikumarol, wysokie stężenia tyroksyny lub duże dawki salicylanów,
np. aspiryny.
Rozprzężenie fosforylacji oksydacyjnej sprawia, iż substraty energetyczne podlegają utlenia-
niu, lecz nie towarzyszy temu powstawanie ATP.
Postępującemu zużyciu ATP przez komórkę nie towarzyszy jego odtwarzanie.
Maleje ilość ATP, rośnie zaś ADP.
Zmniejsza się stosunek ATP/ADP, co jest sygnałem regulacyjnym do nasilenia utleniania
substratów energetycznych.
Wzmożonemu utlenianiu nie towarzyszy „oczekiwany” efekt w postaci wzrostu zawartości ATP
w komórce.
Dochodzi do bezproduktywnego utleniania substratów energetycznych i rozpraszania energii
w postaci ciepła.
Reaktywne formy tlenu
Funkcjonowanie łańcucha oddechowego i procesów utleniania od niego niezależnych wiąże
się z powstawaniem reaktywnych form tlenu, w skrócie RFT, zwanych także wolnymi rod-
nikami tlenowymi.
Przypisuje się im liczne aktywności biologiczne, na ogół uszkadzające strukturę i czynność
tkanek.
Wolnymi rodnikami nazwano atomy lub cząsteczki posiadające niesparowany elektron.
W przyrodzie nieożywionej wolne rodniki powstają w wyniku procesów zwiększających energię
cząsteczek, jak wysoka temperatura, promieniowanie jonizujące czy wyładowania atmosfe-
ryczne, które prowadzą do rozrywania wiązań chemicznych.
Powstawanie wolnych rodników tlenowych jest związane z procesami utleniania zachodzący-
mi w tkankach.
Niektóre z nich powstają jako produkty uboczne, w wieloetapowym transporcie elektronów
przez mitochondrialny łańcuch oddechowy na tlen.
Inne natomiast powstają bez udziału łańcucha oddechowego.
Do reaktywnych form tlenu należy zaliczyć przede wszystkim anionorodnik ponadtlenkowy
O•2, rodnik wodoronadlenkowy HO•2 i rodnik wodorotlenowy •OH, a także tlenek azotu NO•
i dwutlenek azotu NO•2.
Wśród różnych postaci RTF wymienia się także tlen singletowy – 1O2.
Chociaż nie odpowiada on definicji wolnego rodnika tlenowego, jest szczególnie reaktywną
formą tego pierwiastka.
Właściwość ta wynika ze swoistego rozmieszczenia elektronów na poszczególnych orbitalach.
Łańcuch oddechowy – źródłem rft
Mitochondria są głównym konsumentem tlenu.
Ponieważ cząsteczka tego pierwiastka składa się z dwóch atomów, jej całkowita redukcja
wymaga przyłączenia 4 elektronów i 4 protonów, prowadząc do powstania 2 cząsteczek wody.
Każdy z dwóch atomów zawartych w cząsteczce tlenu jest bowiem zdolny do przyjęcia dwóch
elektronów z utlenianych substratów.
Elektrony wędrują z substratu na tlen poprzez wyżej omówione przenośniki, uszeregowane w
kolejności odpowiadającej rosnącym wartościom ich standardowych potencjałów redukcyj-
nych (E0).
Zredukowana oksydaza cytochromowa redukuje tlen cząsteczkowy, dostarczając czterech
elektronów do każdej cząsteczki; po dwa na każdy atom tlenu.
Mitochondrialny łańcuch oddechowy nie jest jednak tworem na tyle doskonałym, aby zapew-
nić 100% przepływ elektronów z substratów energetycznych na tlen cząsteczkowy.
„Kanały”, przez które przepływają elektrony nie są dostatecznie szczelne.
Pewna część elektronów pomija pośrednie ogniwa ich transportu i wchodzi w bezpośrednią
reakcję z tlenem cząsteczkowym (O2), redukując go na drodze procesu jednoelektronowego.
W wyniku takiej redukcji powstaje anionorodnik ponadtlenkowy.
Jest to główne źródło anionorodnika ponadtlenkowego (O•2) w większości komórek o metabo-
lizmie tlenowym.
Ocenia się, iż około 1 - 4% tlenu zużywanego przez mitochondria ulega jednoelektronowej
redukcji, tworząc anionorodnik ponadtlenkowy.
Biologiczne efekty działania rft
Reaktywne formy tlenu wywierają wiele efektów toksycznych.

Uszkadzają zarówno komórki, jak i macierz pozakomórkową.
Utleniają, a w konsekwencji pozbawiają aktywności różne związki biologicznie ważne, jak:
glutation, askorbinian, hemoglobina i mioglobina.
Inaktywują enzymy, przenośniki błonowe i niektóre koenzymy.
Degradują białka (np. kolagen) i glikozoaminoglikany (np. kwas hialuronowy).
Uszkadzają lipidy błon biologicznych.
Wywołują różnorodne uszkodzenia DNA, np. przerwania ciągłości nici polinukleotydowych,
uszkodzenia zasad lub składników cukrowych, mutacji genów - prowadzących niekiedy do
transformacji nowotworowej komórek.
Hamują fosforylację oksydacyjną, a w krańcowych sytuacjach powodują śmierć komórki.
Szczególnie dobrze poznano wpływ RFT na lipidy.
Powodują one degradację nienasyconych kwasów tłuszczowych do krótkich fragmentów.
Głównym produktem końcowym tego procesu jest dialdehyd malonowy (HCO-CH2-CHO),
który może być wykryty w tkankach za pomocą swoistej reakcji barwnej.
Reaktywne formy tlenu są bardzo nietrwałe, a komórka dysponuje mechanizmami pozwalają-
cymi na ich unieczynnienie.
Temu celowi służą odpowiednie enzymy oksydoredukcyjne i reduktory nieenzymatyczne.
Enzymy: katalaza i peroksydaza rozkładają nadtlenek wodoru, uniemożliwiając powstawanie
rodników wodorotlenowych.
Dysmutaza ponadtlenkowa przekształca dwa anionorodniki ponadtlenkowe w nadtlenek
wodoru, a ten jest rozkładany przez katalazę lub peroksydazę:
Liczne antyoksydanty nieenzymatyczne, a przede wszystkim:
witamina E (tokoferol),
witamina C (askorbinian),
witamina A (retinol),
karoteny także unieczynnianiają („zmiatają”) wolne rodniki tlenowe.
Wyszukiwarka
Podobne podstrony:
Wpływ procesów wytwarzania energii na środowisko przyrodnicze
11 Wytwarzanie specjalnych wyro Nieznany (2)
IMIR przyklady praca energia id Nieznany
12 Wytwarzanie zakladek, podnos Nieznany (3)
Pomiary jakosci energii Konfere Nieznany
16 Wytwarzanie podstawowych pol Nieznany (2)
metabolizm, Metabolizm ogół procesów fizycznych i chemicznych związanych z wytwarzaniem energii:
Ściągi z fizyki-2003 r, Wpływ produkcji wytwarzania energii na środowisko naturalne
21 Wytwarzanie odziezy miarowej Nieznany (2)
35 Wytwarzanie amoniaku, kwasu Nieznany (2)
33 Wytwarzanie kwasu siarkowego Nieznany (2)
28 Wytwarzanie styrenu z etylob Nieznany
4 Straty energii w przeplywie Nieznany
PORÓWNANIE TECHNOLOGII WYTWARZANIA ENERGII
(wytwarzanie materialow nanokry Nieznany (2)
Pomiar jakosci energii elektryc Nieznany
Ekonomiczne aspekty wytwarzania energii, Studia, ekologia
36 Wytwarzanie sody kalcynowane Nieznany (2)
więcej podobnych podstron