
1
CZYNNIKI WPŁYWAJ
Ą
CE NA
CZYNNIKI WPŁYWAJ
Ą
CE NA
WŁASNO
Ś
CI MATERIAŁÓW
WŁASNO
Ś
CI MATERIAŁÓW
-
-
STRUKTURA ATOMU
STRUKTURA ATOMU
-
-
WYST
Ę
PUJ
Ą
CY RODZAJ WI
Ą
ZANIA
WYST
Ę
PUJ
Ą
CY RODZAJ WI
Ą
ZANIA
CZ
Ą
STECZKOWEGO
CZ
Ą
STECZKOWEGO
-
-
STAN SKUPIENIA
STAN SKUPIENIA
-
-
RODZAJE STRUKTUR ATOMOWYCH
RODZAJE STRUKTUR ATOMOWYCH
STRUKTURA ATOMU
STRUKTURA ATOMU
Atom, to najmniejsza cz
ą
stka materii zdolna do
samoistnego wyst
ę
powania w przyrodzie
i zachowuj
ą
ca indywidualne cechy pierwiastka.
BUDOWA ATOMÓW
2
MODELE ATOMU
MODELE ATOMU
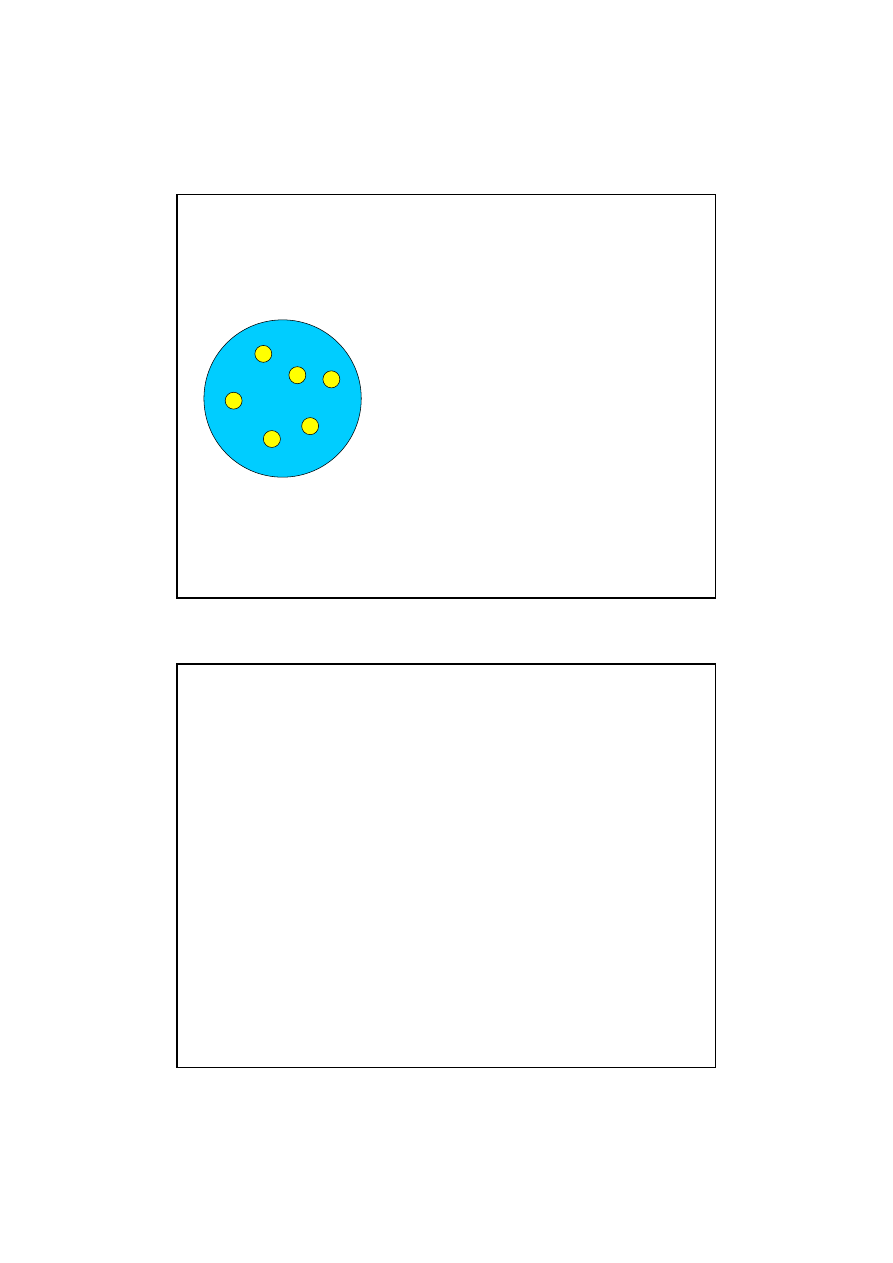
Model J.J. Thomsona
+
-
-
-
-
-
-
+
+
+
+
+
+
W 1903 r. J.J. Thomson
zaproponował nast
ę
puj
ą
cy
model atomu. Atom ma posta
ć
kuli równomiernie wypełnionej
elektrycznym ładunkiem
dodatnim, wewn
ą
trz której
znajduj
ą
si
ę
elektrony.
Sumaryczny ładunek dodatni
kuli równy jest ładunkowi
elektronu, tak wi
ę
c atom jako
cało
ść
jest oboj
ę
tny
elektrycznie.
Model Ernesta
Model Ernesta
Rutherforda
Rutherforda
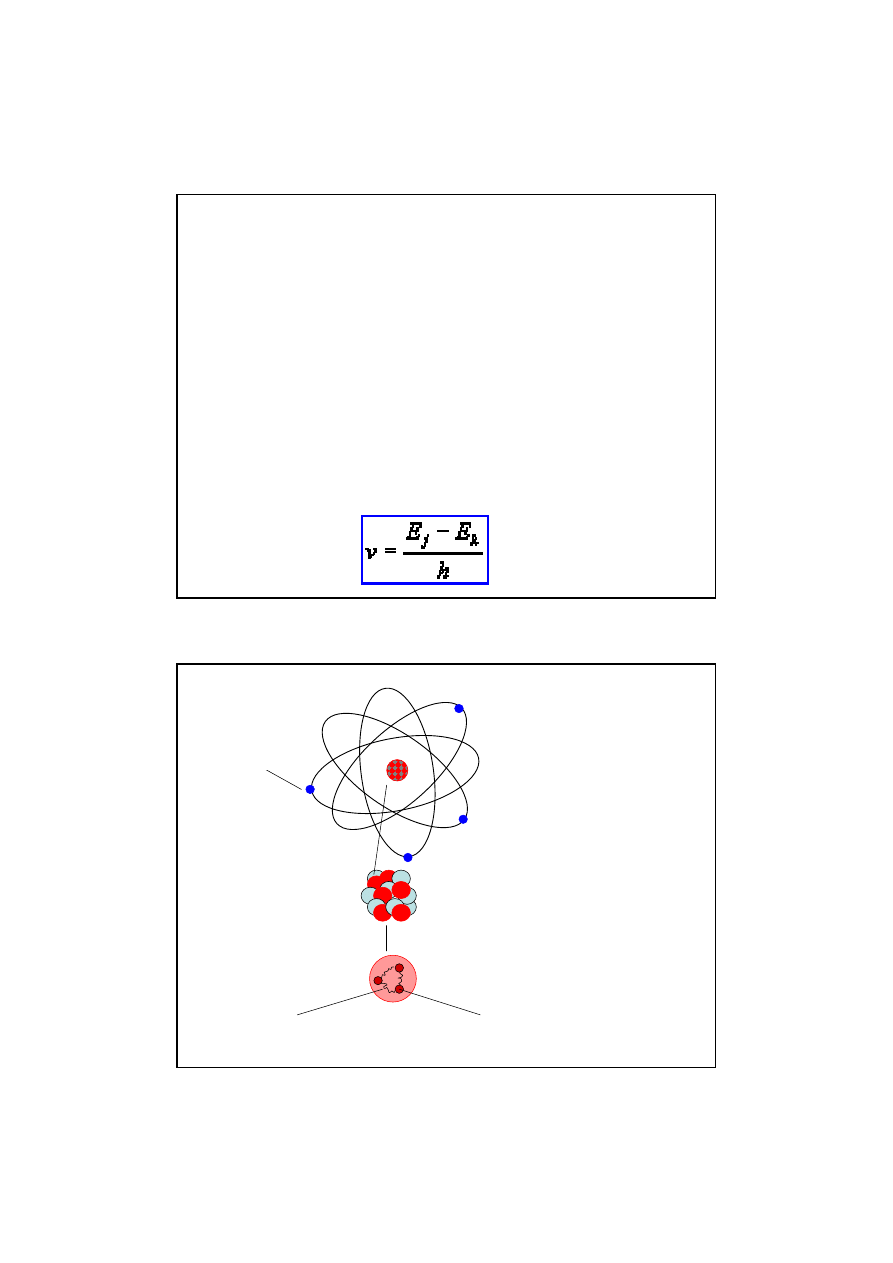
Model Ernesta Rutherforda - model "planetarny"
(elektrony obiegaj
ą
j
ą
dro podobnie jak planety
obiegaj
ą
Sło
ń
ce). Zgodnie z klasyczn
ą
mechanik
ą
poruszaj
ą
cy si
ę
dookoła j
ą
dra
elektron powinien emitowa
ć
fal
ę
elektromagnetyczn
ą
. Emisja taka jest zwi
ą
zana
z ucieczk
ą
pewnej energii z układu elektron-
j
ą
dro. Elektron zmniejszaj
ą
c swoj
ą
energi
ę
zmniejsza jednocze
ś
nie odległo
ść
od j
ą
dra.
Powinien on wi
ę
c porusza
ć
si
ę
nie po okr
ę
gu
lecz po spirali i ostatecznie zderzy
ć
si
ę
z
j
ą
drem. Takiego zjawiska jednak nie
obserwowano.
3
Model
Model
Bohra
Bohra
Postulaty
Postulaty
Bohra
Bohra
:
:
1. Elektron mo
ż
e porusza
ć
si
ę
tylko po pewnych dozwolonych
orbitach.
2. Pomimo,
ż
e elektron doznaje przyspieszenia (poruszaj
ą
c si
ę
po
takiej orbicie), to jednak nie wypromieniowuje energii. A zatem jego
całkowita energia pozostaje stała.
3. Promieniowanie elektromagnetyczne zostaje wysłane tylko gdy
elektron poruszaj
ą
cy si
ę
po orbicie o całkowitej energii E
j
, zmienia
swój ruch skokowo, tak
ż
e porusza si
ę
nast
ę
pnie po orbicie o energii
E
k
. Cz
ę
stotliwo
ść
emitowanego promieniowania jest równa:
typowe wymiary
atom 10
-10
m
gluon
proton lub neutron 10
-15
m
kwark 10
-16
m lub mniej
j
ą
dro atomowe 10
-14
m
nukleony:
protony
m
p
=1,6
·
10
-24
g
q
p
=+1,602
·
10
-19
C
neutrony
m
n
=1,6
·
10
-24
g
q
p
=0
elektron
m
e
=9,1
·
10
-28
g
q
e
=-1,602
·
10
-19
C

4
Atomy pierwiastków chemicznych ró
ż
ni
ą
si
ę
mi
ę
dzy sob
ą
liczb
ą
zawartych w ich j
ą
drze
protonów
protonów
, która nosi nazw
ę
liczby atomowej
liczby atomowej
.
Liczba zawartych w j
ą
drze atomu
neutronów
neutronów
mo
ż
e by
ć
ró
ż
na dla danego pierwiastka – ma to miejsce w przypadku
izotopów
izotopów
.
.
Izotopy maj
ą
takie same własno
ś
ci chemiczne ale ró
ż
ne
własno
ś
ci fizyczne.
Liczba masowa
Liczba masowa
pierwiastka to liczba zawartych w j
ą
drze
nukleonów (protonów i neutronów).
nukleonów (protonów i neutronów).
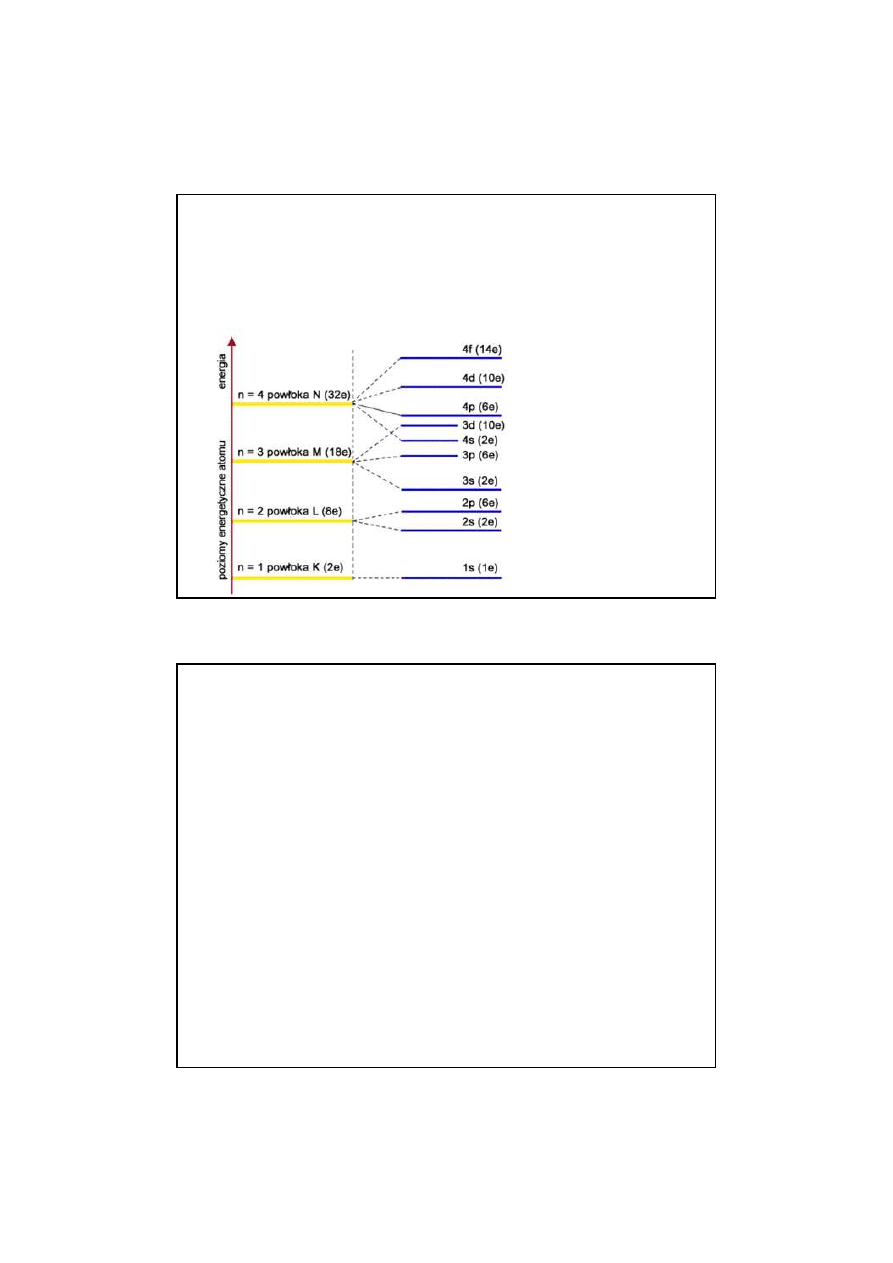
STANY KWANTOWE
STANY KWANTOWE
Wokół j
ą
dra kr
ążą
elektrony, które s
ą
rozmieszczone na odpowiednich powłokach
elektronowych. Poło
ż
enie elektronów na
powłokach jest
ś
ci
ś
le okre
ś
lone za pomoc
ą
tzw.
„liczb kwantowych”.
„liczb kwantowych”.
W odosobnionym atomie pierwiastka istnieje
zasada zwana
zakazem
zakazem
Pauliego
Pauliego, według której
ż
aden atom nie mo
ż
e mie
ć
elektronów opisanych
przez cztery identyczne liczby kwantowe.
5
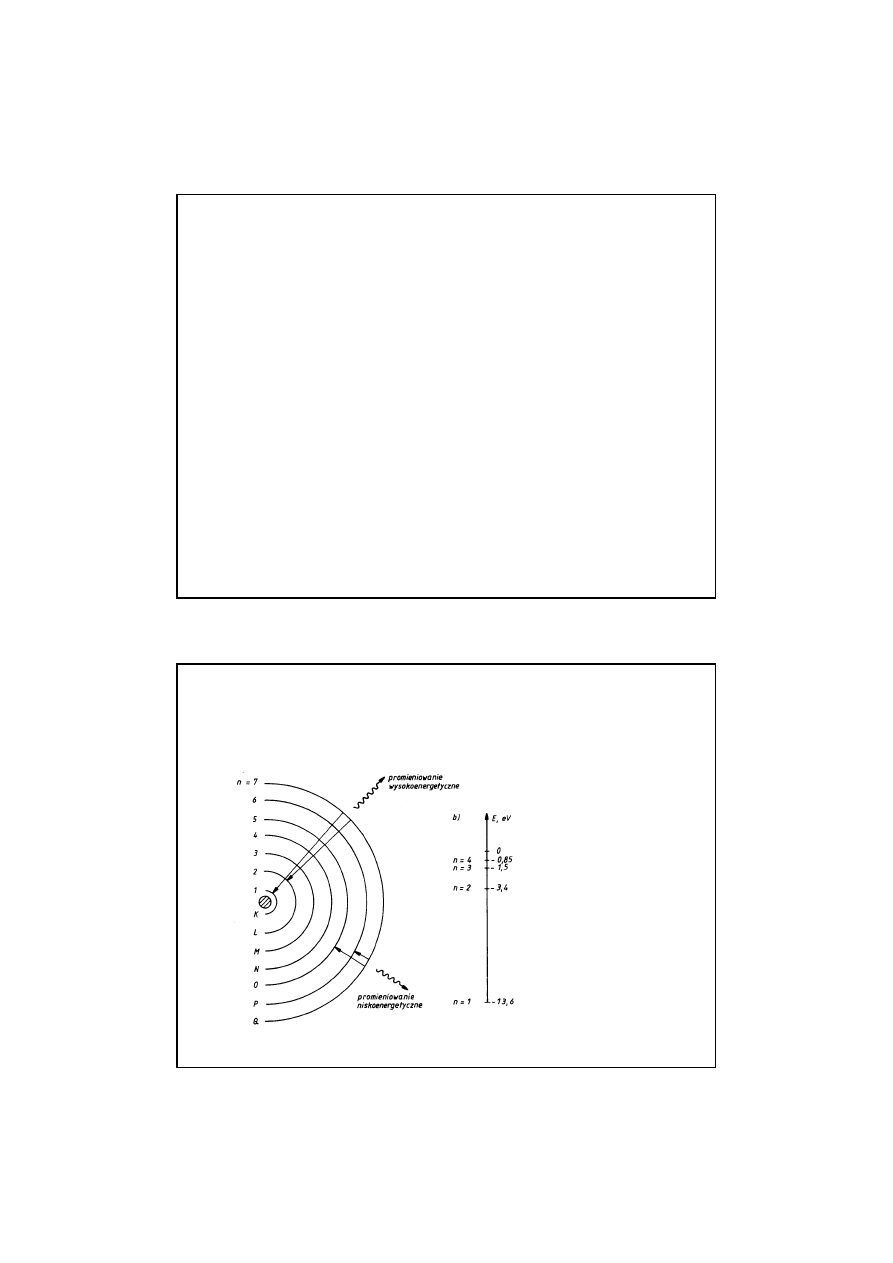
LICZBY KWANTOWE
LICZBY KWANTOWE :
GŁÓWNA LICZBA KWANTOWA n
GŁÓWNA LICZBA KWANTOWA n – przybiera warto
ś
ci
kolejnych liczb naturalnych
1,2,3,4,…n
1,2,3,4,…n.
Okre
ś
la ona numer porz
ą
dkowy powłoki elektronowej atomu.
Powłoki s
ą
oznaczane kolejno literami:
K,L,M,N,O,P,Q
K,L,M,N,O,P,Q.
Poszczególnym
powłokom odpowiadaj
ą
powłokom odpowiadaj
ą
okre
ś
lone,
coraz to wy
ż
sze
poziomy energetyczne
poziomy energetyczne.
Przej
ś
ciu elektronu z orbity na orbit
ę
towarzyszy
wchłoni
ę
cie
wchłoni
ę
cie,
lub
wypromieniowanie
wypromieniowanie
ś
ci
ś
le okre
ś
lonej porcji energii
zwanej kwantem energii.
Wchłoni
ę
cie energii powoduje przej
ś
cie elektronu na orbit
ę
bardziej oddalon
ą
od j
ą
dra.
Powrót elektronu na orbit
ę
bli
ż
sz
ą
j
ą
dra wi
ąż
e si
ę
z wypromieniowaniem kwantu energii.
Kwant energii E mo
ż
na okre
ś
li
ć
za pomoc
ą
nast
ę
puj
ą
cego wzoru:
E=h·
νννν
=h
·
c/
λλλλ
gdzie: h-stała Plancka, c-pr
ę
dko
ść ś
wiatła w pró
ż
ni.
Powłoki elektronowe
atomu oraz poziomy
energetyczne atomu
wodoru
Graficzna prezentacja tego modelu jest pokazana stronie
applet:http://www.colorado.edu/physics/2000/
6
-
-
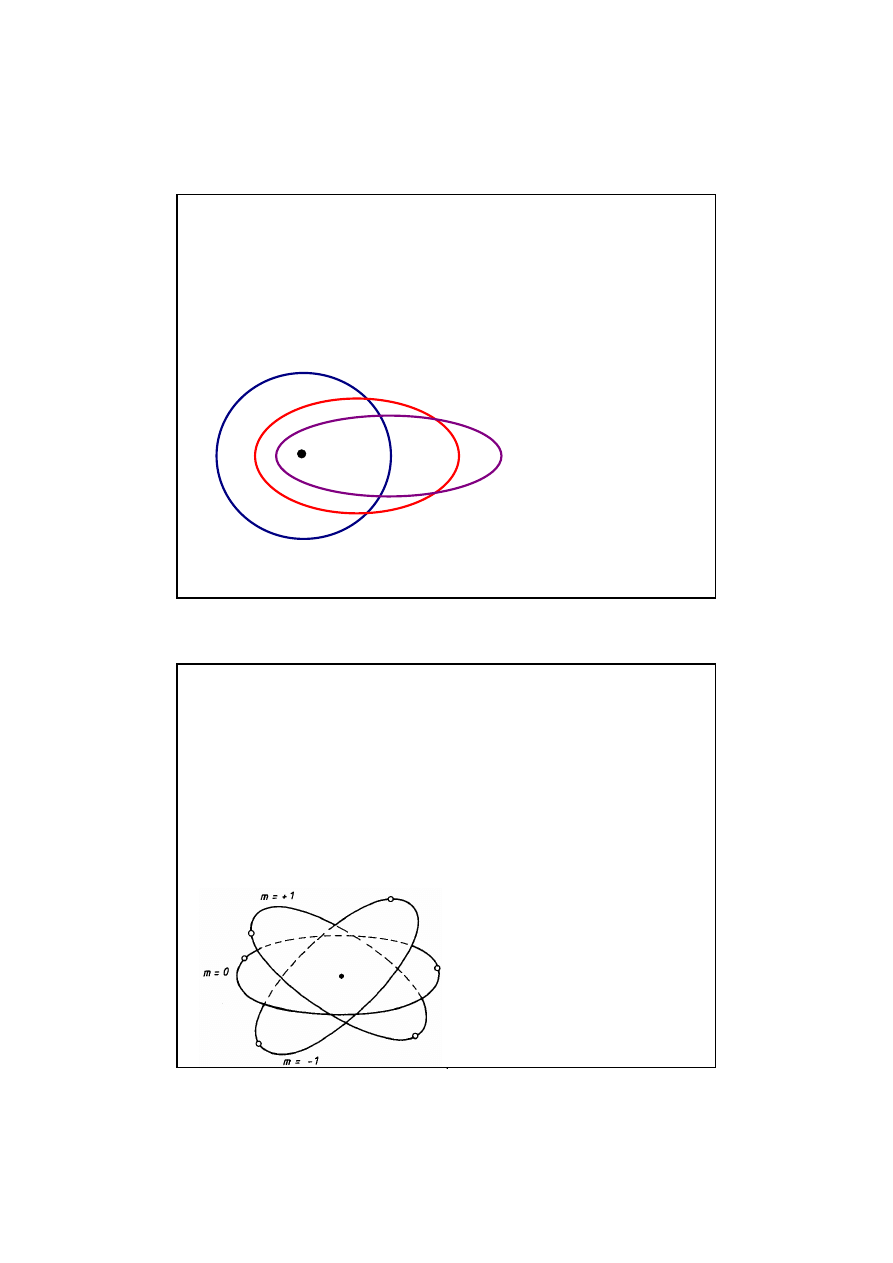
POBOCZNA (ORBITALNA) LICZBA KWANTOWA l
POBOCZNA (ORBITALNA) LICZBA KWANTOWA l - okre
ś
la
istnienie w powłokach warstw orbit (podpowłok). Mo
ż
e
przybiera
ć
n warto
ś
ci całkowitych od
0 do n
0 do n
-
-
1
1. Warstwy orbit
odpowiadaj
ą
ce kolejnym warto
ś
ciom
l
l oznaczane s
ą
literami:
s, p, d, f, g, h, i.
s, p, d, f, g, h, i. Orbity maj
ą
kształt kołowy dla l=0 (orbita s)
oraz eliptyczny dla l=1,2..
Warstwy orbit w powłoce
M (n=3)
orbita s
l=0
orbita p
l=1
orbita d
l=2
-
-
MAGNETYCZNA LICZBA KWANTOWA m
MAGNETYCZNA LICZBA KWANTOWA m – okre
ś
la
orientacj
ę
przestrzenn
ą
orbity. Płaszczyzny orbit w poszcze-
gólnych warstwach mog
ą
ustawia
ć
si
ę
wzgl
ę
dem pewnego
wyró
ż
nionego kierunku pod
ś
ci
ś
le okre
ś
lonymi k
ą
tami,
okre
ś
lonymi przez magnetyczn
ą
liczb
ę
kwantow
ą
. Liczba
m
m mo
ż
e przybiera
ć
(2l+1) warto
ś
ci
(2l+1) warto
ś
ci, zawieraj
ą
cych
si
ę
mi
ę
dzy
–
–
l i +l (m=0,
l i +l (m=0,
±
±
1,
1,
±
±
2..
2..
±
±
l).
l). W ten sposób wyznacza
si
ę
maksymaln
ą
liczb
ę
orbit, które mog
ą
wyst
ę
powa
ć
w danej warstwie.
Usytuowanie przestrzenne
orbit w warstwie 3p
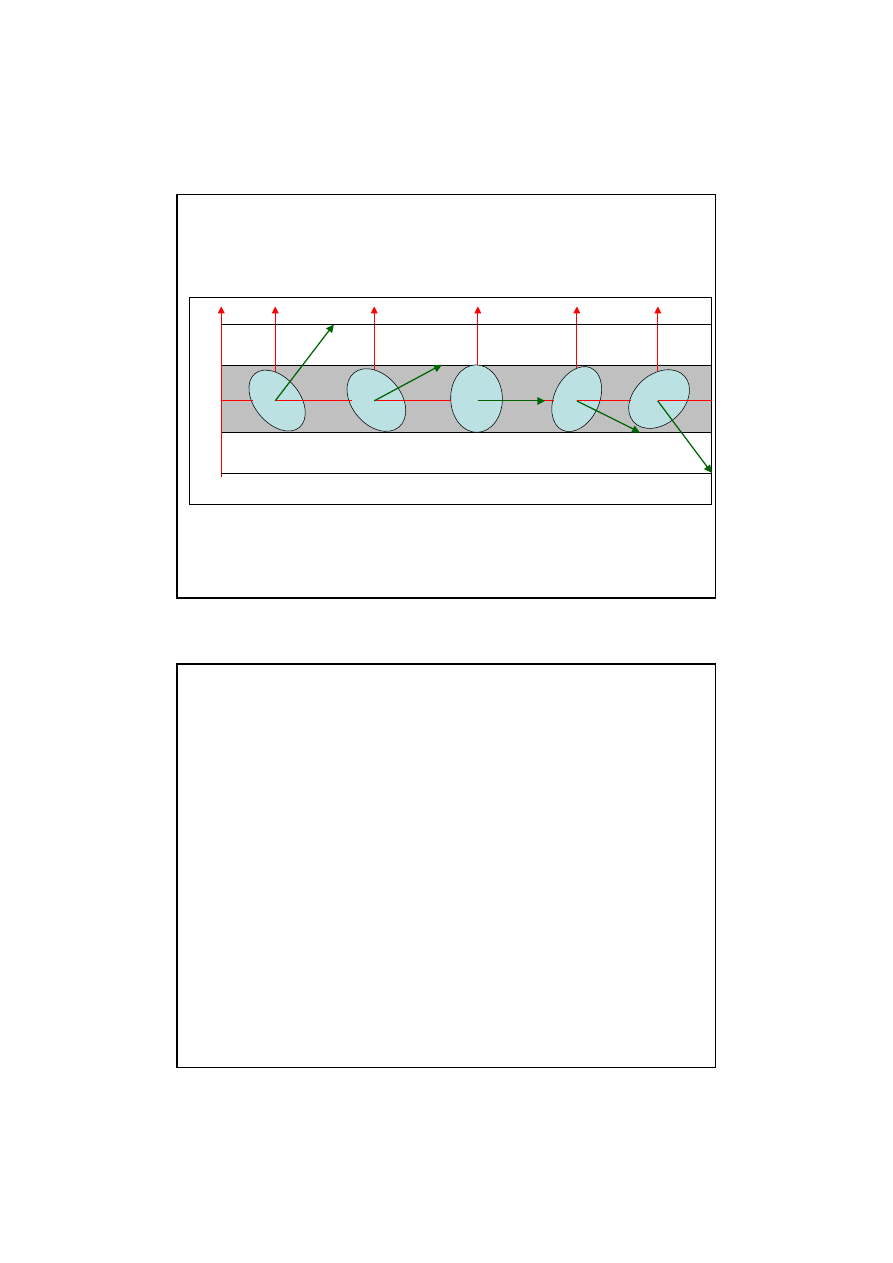
7
Wektor orbitalnego momentu p
ę
du nie mo
ż
e ustawi
ć
si
ę
pod
Wektor orbitalnego momentu p
ę
du nie mo
ż
e ustawi
ć
si
ę
pod
dowolnym k
ą
tem do linii sił przyło
ż
onego pola magnetycznego
dowolnym k
ą
tem do linii sił przyło
ż
onego pola magnetycznego
a tylko w dozwolonych wybranych kierunkach co pokazano na
a tylko w dozwolonych wybranych kierunkach co pokazano na
rys. i dla l = 2.
rys. i dla l = 2.
Rys.
Rys.
Wektor orbitalnego momentu L jest
Wektor orbitalnego momentu L jest
skwantowany
skwantowany
w przestrzeni.
w przestrzeni.
Wzgl
ę
dem danego kierunku z dozwolone s
ą
jedynie pewne ustawienia
Wzgl
ę
dem danego kierunku z dozwolone s
ą
jedynie pewne ustawienia
wektora L. Gdy l = 2, kwantyzacja przestrzenna wektora orbitalne
wektora L. Gdy l = 2, kwantyzacja przestrzenna wektora orbitalne
go
go
momentu
momentu
pedu
pedu
daje składowe
daje składowe
Lz
Lz
= 0h, +/
= 0h, +/
-
-
1h, +/
1h, +/
-
-
2h.
2h.
z z z z z z
2h
2h
1h
1h
0h
L
L
L
L
L
a b c d
e
m=2
m=1
m=0
m=-1
m=-2
W znaczeniu fizycznym magnetyczna liczba kwantowa m
W znaczeniu fizycznym magnetyczna liczba kwantowa m
okre
ś
la niewielkie ró
ż
nice energetyczne pomi
ę
dzy
okre
ś
la niewielkie ró
ż
nice energetyczne pomi
ę
dzy
elektronami o tej samej liczbie kwantowej n i l oraz
elektronami o tej samej liczbie kwantowej n i l oraz
wzajemne ustawienie si
ę
wzajemne ustawienie si
ę
orbitali
orbitali
w przestrzeni pod
w przestrzeni pod
wpływem zewn
ę
trznego pola magnetycznego.
wpływem zewn
ę
trznego pola magnetycznego.
Przy braku zewn
ę
trznego pola magnetycznego
Przy braku zewn
ę
trznego pola magnetycznego
orbitale
orbitale
nie
nie
maj
ą
okre
ś
lonego kierunku w przestrzeni i nie ró
ż
ni
ą
si
ę
maj
ą
okre
ś
lonego kierunku w przestrzeni i nie ró
ż
ni
ą
si
ę
energi
ą
, s
ą
zatem zdegenerowane. Degeneracja oznacza
energi
ą
, s
ą
zatem zdegenerowane. Degeneracja oznacza
istnienie dwóch lub wi
ę
cej ró
ż
nych stanów o tej samej
istnienie dwóch lub wi
ę
cej ró
ż
nych stanów o tej samej
energii. Stany p s
ą
trzykrotne, stany d
energii. Stany p s
ą
trzykrotne, stany d
-
-
pi
ę
ciokrotne, a
pi
ę
ciokrotne, a
stany f
stany f
-
-
siedmiokrotnie zdegenerowane.
siedmiokrotnie zdegenerowane.
Liczba m mo
ż
e przyjmowa
ć
(2l + 1) warto
ś
ci.
Liczba m mo
ż
e przyjmowa
ć
(2l + 1) warto
ś
ci.
m =
m =
-
-
l,
l,
-
-
(l
(l
-
-
1), ......
1), ......
-
-
1, 0, +1, .......,+(l
1, 0, +1, .......,+(l
-
-
1) +l
1) +l
8
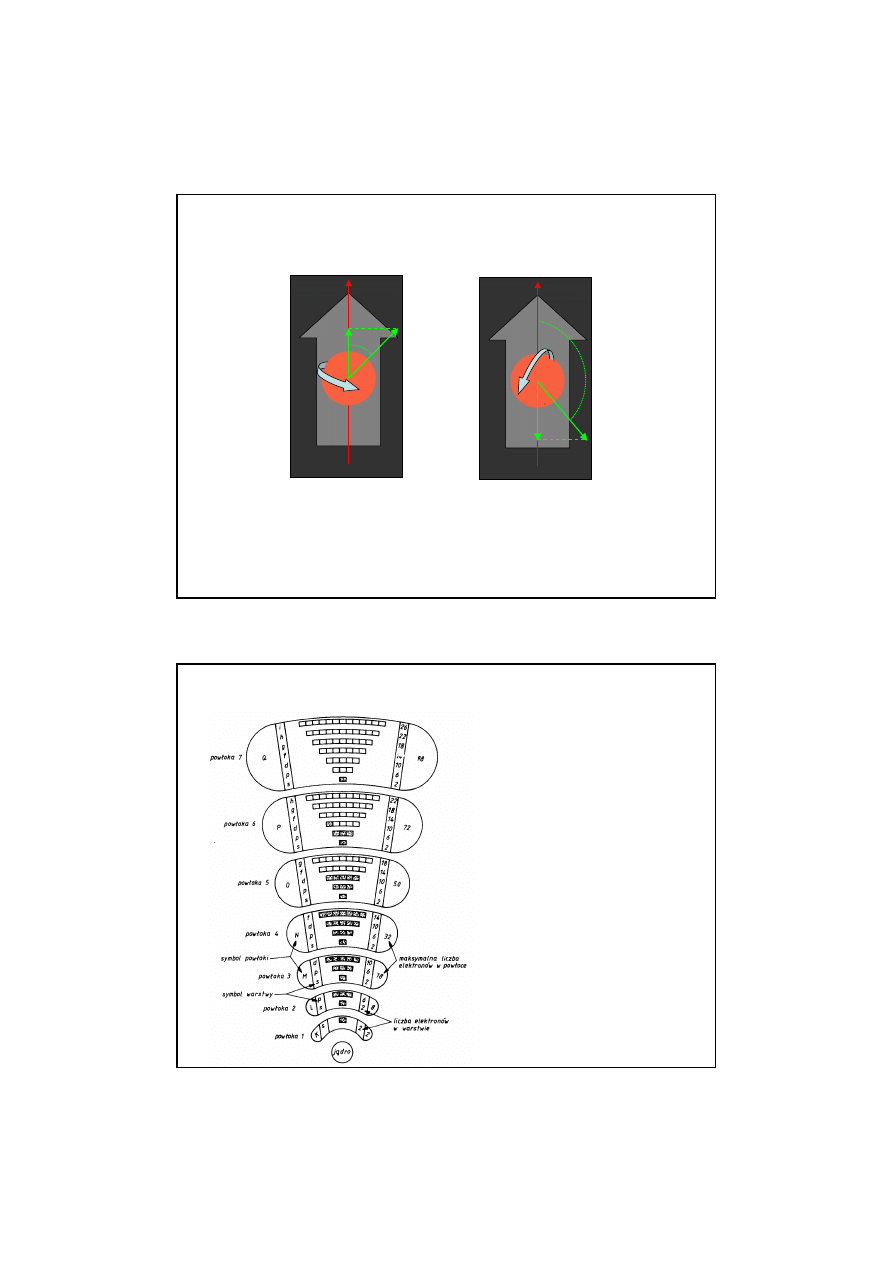
SPINOWA LICZBA KWANTOWA
SPINOWA LICZBA KWANTOWA s –okre
ś
la kierunek wirowania
elektronu wokół własnej osi. Mo
ż
e przyjmowa
ć
tylko dwie
warto
ś
ci
±
±
1/2
1/2.
Rys.
Rys.
Spinowy moment p
ę
du elektronu przestrzennie
Spinowy moment p
ę
du elektronu przestrzennie
skwantowany
skwantowany
,
,
-
-
wzgl
ę
dem pola magnetycznego B ma tylko dwa
wzgl
ę
dem pola magnetycznego B ma tylko dwa
dozwolone ustawienia.
dozwolone ustawienia.
ϕ
z
B
+1/2 h
Spin skierowany w gór
ę
ϕ
z
B
-1/2 h
Spin skierowany w dół
Stany kwantowe w atomie
Stany kwantowe w atomie
wieloelektronowym
wieloelektronowym
9
STRUKTURA ELEKTRONOWA ATOMÓW
Ka
ż
dy z pierwiastków ma charakteryzuj
ą
c
ą
go liczb
ę
elektronów. Elektrony
wypełniaj
ą
struktur
ę
atomu według rosn
ą
cego poziomu
energetycznego poszczególnych warstw i powłok elektronowych.
Najpierw zapełniaj
ą
si
ę
warstwy o najni
ż
szych poziomach energetycznych.
Poziomy
energetyczne
elektronów
nale
żą
cych do
kolejnych powłok i
warstw
elektronowych
atomów.
O własno
ś
ciach chemicznych pierwiastków decyduj
ą
przede
wszystkim
elektrony walencyjne (warto
ś
ciowo
ś
ci
elektrony walencyjne (warto
ś
ciowo
ś
ci
)
) znajduj
ą
ce si
ę
w warstwach
s i p
s i p
.
.
Elektrony te bior
ą
udział w tworzeniu cz
ą
steczek.
Pierwiastki mo
ż
na podzieli
ć
na
-
-
elektrododatnie
elektrododatnie -ich atomy maj
ą
mniej ni
ż
cztery elektrony
walencyjne,w pewnych warunkach mog
ą
traci
ć
elektrony staj
ą
c
si
ę
jonami dodatnimi. Nale
żą
do nich głównie metale.
-
-
elektroujemne
elektroujemne - ich atomy maj
ą
wi
ę
cej ni
ż
cztery elektrony
walencyjne, w pewnych warunkach mog
ą
przył
ą
cza
ć
elektrony
staj
ą
c si
ę
jonami ujemnymi. Nale
żą
do nich głównie dielektryki.
Bardzo trwałymi układami, nie oddaj
ą
cymi i nie przył
ą
czaj
ą
cymi
elektronów s
ą
atomy pierwiastków, w których warstwy s i p
Zewn
ę
trznych powłok s
ą
całkowicie zapełnione. Elektrony w tych
warstwach tworz
ą
tzw.
oktet elektronowy (2+6=8 elektronów).
oktet elektronowy (2+6=8 elektronów).
Tak
ą
struktur
ą
charakteryzuj
ą
si
ę
gazy szlachetne,
które s
ą
nieaktywne chemicznie.
Wyszukiwarka
Podobne podstrony:
chemia, BUDOWA ATOMÓW, WIĄZANIA
budowa atomow i czasteczek , Budowa atomów i cząsteczek
budowa atomów i cząsteczek sprawdzian, VIII L.O
budownictwo, wewnetrzna budowa atomow, 1
budowa atomów i cząsteczek sprawdzian VIII L O
Budowa atomów i cząsteczek, LICEUM różne, CHEMIA
Budowa atomów i prawa chemiczne SPRAWDZIAN, do wykorzystania w szkole
budowa atomów i czasteczek sprawdzian
budowa atomów i cząsteczek
Budowa i promieniowanie atomow
BUDOWA JĄDRA ATOMOWEGO, PROMIENIOTWÓRCZOŚĆ xp
więcej podobnych podstron